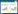文章信息
- 冯玲玲, 杜鑫, 葛瑜, 杨凡, 黄荣, 张丽萍
- FENG Lingling, DU Xin, GE Yu, YANG Fan, HUANG Rong, ZHANG Liping
- 葶苈子水提液通过调控HMGB1/TLR4/NF-κB信号通路对LPS吸入性肺损伤新生大鼠的影响
- Effect of Semen Lepidii aqueous extract on neonatal rats with LPS inhalation lung injury by regulating HMGB1/TLR4/NF-κB signaling pathway
- 天津中医药大学学报, 2022, 41(3): 342-347
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(3): 342-347
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.03.15
-
文章历史
收稿日期: 2022-03-11
2. 武汉科技大学附属医院儿科, 武汉 430000
2. Department of Pediatrics, Affiliated Hospital of Wuhan University of Science and Technology, Wuhan 430000, China
急性肺损伤(ALI)/急性呼吸窘迫综合征(ARDS)是肺部重度炎症,可导致弥漫性肺泡损伤、低氧血症、肺水肿和呼吸衰竭[1]。世界范围内儿童ALI的发生率很高,常见病因是由于呼吸道感染革兰氏阴性杆菌,病死率大于35%[2]。脂多糖(LPS)是革兰氏阴性细菌细胞壁的主要生物活性成分,已被广泛用于通过触发过多的炎症介质来诱导与人的ALI病理特征相似的ALI模型[3]。由于目前ALI的病理机制尚未完全阐明,临床上以对症治疗为主,治疗效果较差,导致ALI患者的病死率较高。因此,寻找有效的方法和探索分子机制是十分必要的。
葶苈子为十字花科芝麻菜属植物芝麻菜或播娘蒿的种子,具有止咳平喘、强心利尿、抗肿瘤等作用[4]。已有研究表明葶苈子水提液通过改善水通道蛋白5的含量或活性,对LPS致ALI大鼠的肺淤血、肺水肿及动脉血气的改变具有调节作用[5]。但葶苈子对LPS诱导ALI的具体作用机制仍不清楚,本文探究葶苈子水提液对LPS吸入性肺炎新生大鼠病理损伤、氧化应激、炎性因子及高迁移率族蛋白1(HMGB1)/Toll样受体4(TLR4)/核转录因子-κB(NF-κB)信号通路的影响。
1 材料和方法 1.1 实验动物60只雄性3 d龄新生SPF级SD大鼠购自华中科技大学动物实验中心,体质量(7±2)g,许可证号:SCXK(鄂)2016—0009。于SPF级别动物饲养房饲养,每周更换灭菌垫料,按时添加裸鼠饲料及饮水。本实验所有动物实验流程经仙桃市第一人民医院动物伦理委员会批准同意。
1.2 实验药物和主要试剂葶苈子(批号:3010523)购自上元堂大药房;地塞米松(批号:SD9530)购自北京索莱宝科技有限公司;苏木素-伊红(HE)染液(批号:D006-1-1)、超氧化物歧化酶(SOD)测定试剂盒(批号:A001-3-2)、丙二醛(MDA)测定试剂盒(批号:A003-1)、谷胱甘肽(GSH)测定试剂盒(批号:A005-1-2)、白细胞介素-6(IL-6)测定测试盒(批号:H007)、白细胞介素-1β(IL-1β)测定试剂盒(批号:H002)和肿瘤坏死因子-α(TNF-α)测定试剂盒(批号:H052)购自南京建成生物工程研究所;二喹啉甲酸(BCA)蛋白浓度测定试剂盒(批号:P0012S)、辣根过氧化物酶标记山羊抗兔免疫球蛋白G(IgG)(批号:A0208)购自上海碧云天生物技术研究所;兔抗单克隆抗体HMGB1(批号:ab18256)、TLR4(批号:ab13556)、NF-κB p65(批号:ab16502)购自英国Abcam公司。
1.3 葶苈子水提液的制备取葶苈子200 g,8倍量水煎煮3次,将其制备为含生药2 g/mL的水提液,即合并3次滤液浓缩至100 mL,实验时用生理盐水配成所需浓度[6]。
1.4 动物模型建立及分组将大鼠随机分为6组:对照组、模型组、葶苈子水提液低、中、高剂量组和地塞米松组,每组10只大鼠。葶苈子水提液低、中、高剂量组分别灌胃葶苈子水提液5、10、20 g/kg[7],地塞米松组灌胃地塞米松0.002 g/kg[8],对照组和模型组灌胃等量生理盐水,每日1次,连续7 d。于第7日灌胃后,除对照组外的其余大鼠用左手大拇指和食指固定新生大鼠头部,均于鼻内单次滴注LPS 5 mg/kg复制吸入性肺损伤模型[9]。
1.5 干湿法采用干湿法检测肺干湿质量比值,处死各组大鼠后,取肺组织称取质量,记为湿质量,置于烤箱中烘烤至质量不变,记为干质量。肺干湿质量比值=干质量/湿质量×100%。
1.6 HE染色取各组大鼠肺组织用10%甲醛固定48 h,石蜡包埋制作成切片,厚度5 mm。然后用HE染液进行染色,在200倍荧光显微镜下观察肺组织损伤情况。
1.7 氧化应激按照试剂盒说明书,采用酶标仪测定SOD含量,采用可见分光光度计测定MDA、GSH含量。SOD在450 nm处测A值,MDA在532 nm处测A值,GSH在412 nm处测A值。
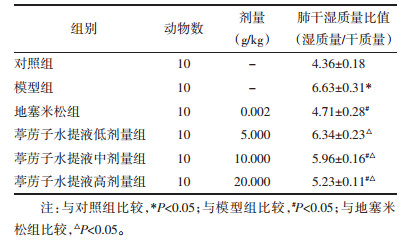
1.8 ELISA将各组大鼠肺组织置于含蛋白酶抑制剂的裂解液的玻璃匀浆器中匀浆,12 000 r/min离心15 min(离心半径10 cm),收集上清液,按照ELISA试剂盒说明书检测炎症因子IL-6、IL-1β、TNF-α水平。
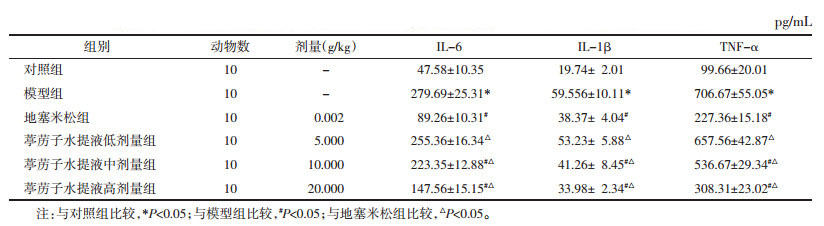
1.9 Western Blot取各组大鼠肺组织,加入含蛋白酶抑制剂的细胞裂解液提取总蛋白,并用BCA试剂盒测定蛋白质含量。取等质量蛋白质样品,100 ℃变性5 min后用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)法分离并转移至聚偏二氟乙烯膜(PVDF),在4 ℃条件下加入HMGB1、TLR4和NF-κB p65一抗并孵育过夜,清洗,然后在4 ℃下加入辣根过氧化物酶标记山羊抗兔IgG,孵育2 h,最后加入电化学发光(ECL)发光液,曝光处理。Image J软件统计灰度值,以目的条带灰度值/GAPDH灰度值表示蛋白表达水平。
1.10 统计学分析使用GraphPad Prism 5进行统计分析,计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD法。P<0.05为差异有统计学意义。
2 结果 2.1 葶苈子水提液降低吸入性肺损伤新生大鼠模型肺干湿质量比值通过干湿法检测各组新生大鼠肺干湿质量比值,结果显示与对照组比较,模型组肺干湿质量比值升高,差异有统计学意义(P<0.05)。与模型组比较,葶苈子水提液中、高剂量组和地塞米松组肺干湿质量比值降低,差异有统计学意义(P<0.05)。与地塞米松组比较,葶苈子水提液各剂量组肺干湿质量比值升高,差异有统计学意义(P<0.05)。见表 1。
通过HE染色检测各组新生大鼠肺组织病理损伤,提示对照组肺组织结构完整,肺泡腔清晰,无明显水肿及炎性细胞浸润。模型组肺泡组织结构紊乱、水肿、间质增厚、出血和大量炎性细胞浸润。与模型组比较,葶苈子水提液中、高剂量组和地塞米松组病理损伤程度明显减轻,炎性细胞浸润减少。见图 1。
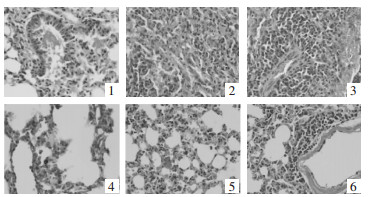
|
| 注:1.对照组;2.模型组;3.葶苈子水提液低剂量组;4.葶苈子水提液中剂量组;5.葶苈子水提液高剂量组;6.地塞米松组。 图 1 葶苈子水提液对吸入性肺损伤新生大鼠模型肺组织病理损伤的影响(×200) |
通过ELISA法检测各组新生大鼠SOD、MDA和GSH含量,结果显示与对照组比较,模型组大鼠SOD、GSH含量降低,MDA含量升高,差异有统计学意义(P<0.05)。与模型组比较,葶苈子水提液中、高剂量组和地塞米松组SOD、GSH含量升高,MDA含量降低,差异有统计学意义(P<0.05)。与地塞米松组比较,葶苈子水提液各剂量组SOD、GSH含量降低,MDA含量升高,差异有统计学意义(P<0.05)。见表 2。
通过ELISA法检测各组新生大鼠IL-6、IL-1β和TNF-α水平,结果显示与对照组比较,模型组IL-6、IL-1β和TNF-α水平升高,差异有统计学意义(P<0.05)。与模型组比较,葶苈子水提液中、高剂量组和地塞米松组IL-6、IL-1β和TNF-α水平降低,差异有统计学意义(P<0.05)。与地塞米松组比较,葶苈子水提液各剂量组IL-6、IL-1β和TNF-α水平升高,差异有统计学意义(P<0.05)。见表 3。
通过Western Blot法检测新生大鼠肺组织中HMGB1、TLR4和p-NF-κB p65蛋白表达水平,结果显示与对照组比较,模型组HMGB1、TLR4蛋白表达水平及p-NF-κB p65与NF-κB p65比值升高,差异有统计学意义(P<0.05)。与模型组比较,葶苈子水提液中、高剂量组和地塞米松组HMGB1、TLR4蛋白表达水平及p-NF-κB p65与NF-κB p65比值降低,差异有统计学意义(P<0.05)。与地塞米松组比较,葶苈子水提液各剂量组HMGB1、TLR4蛋白表达水平及p-NF-κB p65与NF-κB p65比值升高,差异有统计学意义(P<0.05)。见图 2、表 4。
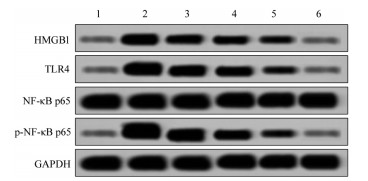
|
| 注:1.对照组;2.模型组;3.葶苈子水提液低剂量组;4.葶苈子水提液中剂量组;5.葶苈子水提液高剂量组;6.地塞米松组。 图 2 HMGB1、TLR4和p-NF-κB p65蛋白表达水平 |
由于肺泡发育不成熟,自生免疫功能低下,新生儿发生ALI的概率极高[10]。临床治疗方式主要为抗感染、氧疗和机械辅助通气,但效果不佳。本研究通过鼻内滴注LPS 5 mg/kg的方法建立了吸入性肺损伤大鼠模型,研究发现葶苈子水提液具有降低模型大鼠肺干湿质量比值及改善肺组织病理损伤程度的作用。
由于呼吸道和肺组织承担着机体所需氧气的供给及交换,肺组织容易受到氧自由基的攻击,相关研究表明,过度的氧化应激是导致ALI的重要原因[11]。GSH、SOD是体内最重要的抗氧化物酶,可清除细胞中ROS,具有保护细胞免受氧化损伤的作用[12]。MDA是脂质过氧化反应的最终产物,并在一定程度上反映了氧化应激水平[13]。陈小兰等[14]研究发现葶苈子提取液可降低心肌缺血/再灌注损伤大鼠MDA含量,提高SOD活力从而减轻心肌损伤。本研究发现葶苈子水提液能够升高吸入性肺损伤大鼠模型SOD、GSH含量,降低MDA含量,提示葶苈子水提液具有改善吸入性肺损伤新生大鼠模型氧化应激状态的作用。
肺组织中炎性细胞浸润是LPS诱发ALI的主要病理生理变化之一[15]。IL-6是评估和检测ALI的常用指标,其水平高低与ALI呈正相关。IL-1β和TNF-α是由单核细胞和巨噬细胞产生的具有致炎作用的细胞因子[16],IL-1β通过激活相关炎症通路进一步刺激炎症介质的释放,TNF-α可通过激活血管内皮细胞产生大量细胞黏附因子,使炎症细胞在炎症部位得到表达[17]。张桐茂等[18]研究发现葶苈子提取物可减轻慢性阻塞性肺疾病大鼠炎症反应。本研究发现,葶苈子水提液具有降低吸入性肺损伤大鼠模型IL-6、IL-1β和TNF-α水平的作用,提示葶苈子水提液通过抑制炎症因子的释放对吸入性肺损伤新生大鼠模型具有保护作用。
LPS诱发的ALI与HMGB1/TLR4/NF-κB信号通路的激活密切相关,HMGB1是真核细胞广泛表达的一种高度保守的细胞核非组蛋白,当细胞坏死或被激活时可释放大量HMGB1,可促进炎症因子的释放[19]。TLR4作为HMGB1的重要配体,参与晚期炎性信号的传导,使NF-κB p65磷酸化,诱导IL-6、IL-1β和TNF-α等炎症因子的释放[20]。NF-κB是炎症反应中重要的转录调节因子,磷酸化激活后可转移到细胞核内,结合并启动促炎基因表达,导致炎症损伤[21]。因此,抑制NF-κB信号活化是治疗炎症性疾病的重要方式[22]。本研究发现,葶苈子水提液具有降低吸入性肺损伤大鼠模型HMGB1、TLR4蛋白表达水平及p-NF-κB p65与NF-κB p65比值的作用,提示葶苈子水提液通过抑制HMGB1/TLR4/NF-κB信号通路活化,减轻肺组织病理损伤、炎性反应及氧化应激,对LPS诱发ALI的新生大鼠产生保护作用。
综上所述,葶苈子水提液可改善吸入性肺损伤大鼠模型肺组织病理损伤,抑制氧化应激、炎症因子的释放,其机制可能是通过抑制HMGB1/TLR4/NF-κB信号通路活化实现的。本研究为葶苈子临床治疗新生儿吸入性肺损伤提供了一定理论依据。
| [1] |
DONG Z W, YUAN Y F. Juglanin suppresses fibrosis and inflammation response caused by LPS in acute lung injury[J]. International Journal of Molecular Medicine, 2018, 41(6): 3353-3365. |
| [2] |
MENG Y X, CAI X H, WANG L P. Potential genes and pathways of neonatal sepsis based on functional gene set enrichment analyses[J]. Computational and Mathematical Methods in Medicine, 2018, 20(18): 670-675. |
| [3] |
JU M J, LIU B F, HE H Y, et al. microRNA-27a alleviates LPS-induced acute lung injury in mice via inhibiting inflammation and apoptosis through modulating TLR4/MyD88/NF-κB pathway[J]. Cell Cycle (Georgetown, Tex), 2018, 17(16): 2001-2018. DOI:10.1080/15384101.2018.1509635 |
| [4] |
孟祥凤. 葶苈子化学成分及药理作用的研究进展[J]. 黑龙江科技信息, 2013, 17(34): 63, 71. MENG X F. Research progress on chemical constituents and pharmacological action of Semen lepidii[J]. Heilongjiang Science and Technology Information, 2013, 17(34): 63, 71. |
| [5] |
张朝晖, 徐小云, 瞿星光, 等. 葶苈子水提液对内毒素致急性肺损伤大鼠肺泡Ⅱ型上皮细胞水通道蛋白5表达的影响[J]. 中国中医急症, 2016, 25(4): 606-608, 622. ZHANG Z H, XU X Y, QU X G, et al. Effects of semen lepidii on the expression of aquaporin-5 of alveolar cells type Ⅱin rats with endotoxin induced acute lung injury[J]. Journal of Emergency in Traditional Chinese Medicine, 2016, 25(4): 606-608, 622. DOI:10.3969/j.issn.1004-745X.2016.04.012 |
| [6] |
郭娟, 陈长勋, 沈云辉. 葶苈子水提液对动物实验性心室重构的影响[J]. 中草药, 2007, 38(10): 1519-1523. GUO J, CHEN C X, SHEN Y H. Effect of aqueous extract from Semen Lepidii seu Descurainiae on ventricular remodeling in experimental animals[J]. Chinese Traditional and Herbal Drugs, 2007, 38(10): 1519-1523. DOI:10.3321/j.issn:0253-2670.2007.10.029 |
| [7] |
张晓丹, 范春兰, 余迎梅, 等. 葶苈子水提液对CHF大鼠利尿作用的影响[J]. 中国现代应用药学, 2010, 27(3): 210-213. ZHANG X D, FAN C L, YU Y M, et al. Diuretic effect of aqueous extract of Tinglizi on CHF rats[J]. Chinese Journal of Modern Applied Pharmacy, 2010, 27(3): 210-213. |
| [8] |
由淑萍, 汪波, 赵军, 等. 肉苁蓉苯乙醇总苷对脂多糖致大鼠急性肺损伤的抑制作用[J]. 中国药理学与毒理学杂志, 2019, 33(5): 347-353. YOU S P, WANG B, ZHAO J, et al. Inhibitory effect of cistanches phenylethanol glycosides on lipopolysasccharide-induced acute lung injury in rats[J]. Chinese Journal of Pharmacology and Toxicology, 2019, 33(5): 347-353. DOI:10.3867/j.issn.1000-3002.2019.05.005 |
| [9] |
杨世勇, 何毅, 宋大强, 等. 基于TLR4/NF-κB途径的白藜芦醇减轻LPS致小鼠急性肺损伤的机制研究[J]. 中国药房, 2020, 31(9): 1034-1039. YANG S Y, HE Y, SONG D Q, et al. Study on the mechanism of resveratrol attenuating LPS-induced acute lung injury in mice based on TLR4/NF-κB pathway[J]. China Pharmacy, 2020, 31(9): 1034-1039. |
| [10] |
LI Y, WANG Q, CHEN H, et al. Epidemiological features and risk factor analysis of children with acute lung injury[J]. World Journal of Pediatrics, 2012, 8(1): 43-46. DOI:10.1007/s12519-012-0334-8 |
| [11] |
CARNESECCHI S, PACHE J C, BARAZZONE-ARGIROFFO C. NOX enzymes: potential target for the treatment of acute lung injury[J]. Cellular and Molecular Life Sciences: CMLS, 2012, 69(14): 2373-2385. DOI:10.1007/s00018-012-1013-6 |
| [12] |
BAVUNOGLU I, GENC H, KONUKOGLU D, et al. Oxidative stress parameters and inflammatory and immune mediators as markers of the severity of sepsis[J]. Journal of Infection in Developing Countries, 2016, 10(10): 1045-1052. DOI:10.3855/jidc.7585 |
| [13] |
ZHANG H X, LIU S J, TANG X L, et al. H2S attenuates LPS-induced acute lung injury by reducing oxidative/nitrative stress and inflammation[J]. Cellular Physiology and Biochemistry, 2016, 40(6): 1603-1612. DOI:10.1159/000453210 |
| [14] |
陈小兰, 郑道国, 徐群威, 等. 南葶苈子提取液对心肌缺血/再灌注大鼠心肌自噬及MAPK/ERK1/2通路的影响[J]. 中国中医急症, 2019, 28(8): 1349-1353. CHEN X L, ZHENG D G, XU Q W, et al. Effects of south Semen Lepidii extraction solution on myocardial autophagy and MAPK/ERK1/2 pathway in rats with myocardial ischemia/reperfusion[J]. Journal of Emergency in Traditional Chinese Medicine, 2019, 28(8): 1349-1353. DOI:10.3969/j.issn.1004-745X.2019.08.009 |
| [15] |
COSTA E L, AMATO M B. The new definition for acute lung injury and acute respiratory distress syndrome: is there room for improvement?[J]. Current Opinion in Critical Care, 2013, 19(1): 16-23. DOI:10.1097/MCC.0b013e32835c50b1 |
| [16] |
王军媛, 赵建红, 刘颖, 等. 芪明颗粒对早期糖尿病肾病炎症因子及尿微量白蛋白的影响[J]. 天津中医药大学学报, 2017, 36(2): 113-116. WANG J Y, ZHAO J H, LIU Y, et al. Effect of Qiming Granule on inflammatory factors and urinary micro albumin in early diabetic nephropathy[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2017, 36(2): 113-116. |
| [17] |
MANTOVANI A, DINARELLO C A, MOLGORA M, et al. Interleukin-1 and related cytokines in the regulation of inflammation and immunity[J]. Immunity, 2019, 50(4): 778-795. DOI:10.1016/j.immuni.2019.03.012 |
| [18] |
张桐茂, 刘炜, 孔德颖. 南葶苈子中的指标成分槲皮素-3-O-β-D-葡萄糖基-7-O-β-D-龙胆双糖苷对慢性阻塞性肺疾病大鼠肺部免疫功能调节机制研究[J]. 中草药, 2019, 50(4): 910-917. ZHANG T M, LIU W, KONG D Y. Machanism of QGG from Descurainia sophia on airway inflammation and remodeling in COPD rats[J]. Chinese Traditional and Herbal Drugs, 2019, 50(4): 910-917. |
| [19] |
樊菲菲, 谢建刚, 赵丹珲, 等. 雾化吸入高渗盐水对脓毒症大鼠肺损伤的影响[J]. 解放军医药杂志, 2020, 32(11): 1-5. FAN F F, XIE J G, ZHAO D H, et al. Effect of inhalation of nebulized hypertonic saline on lung injury in septic rats[J]. Medical & Pharmaceutical Journal of Chinese PLA, 2020, 32(11): 1-5. DOI:10.3969/j.issn.2095-140X.2020.11.001 |
| [20] |
SUBRAMANI T, RATHNAVELU V, ALITHEEN N B, et al. Cellular crosstalk mechanism of Toll-like receptors in gingival overgrowth (review)[J]. International Journal of Molecular Medicine, 2015, 35(5): 1151-1158. DOI:10.3892/ijmm.2015.2144 |
| [21] |
夏娟, 张书春, 代紫阳, 等. 姜黄素通过抑制NF-κB信号通路减轻高糖致H9C2心肌细胞损伤的实验研究[J]. 天津中医药大学学报, 2021, 40(6): 778-782. XIA J, ZHANG S C, DAI Z Y, et al. Circumin attenuates high glucose-induced H9C2 cardiomyocyte injury via NF-κB signaling pathway[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2021, 40(6): 778-782. |
| [22] |
SUN Y N, LI W, YAN X T, et al. Phenolic components from the stem of Acanthopanax koreanum and their inhibitory effects on NF-κB[J]. Bioscience, Biotechnology, and Biochemistry, 2014, 78(3): 374-377. DOI:10.1080/09168451.2014.890036 |
 2022, Vol. 41
2022, Vol. 41