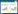文章信息
- 刘云, 郭洁, 张曼玲, 时昭红
- LIU Yun, GUO Jie, ZHANG Manling, SHI Zhaohong
- 基于网络药理学的葱白提取物治疗非酒精性脂肪性肝病的机制研究和验证
- Mechanism and verification of Allii Fistulost Bulbus extract against nonalcoholic fatty liver disease based on network pharmacology
- 天津中医药大学学报, 2022, 41(3): 348-354
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(3): 348-354
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.03.16
-
文章历史
收稿日期: 2022-01-11
2. 湖北中医药大学附属武汉市第一医院, 武汉 430000
2. Wuhan First Hospital Affiliated to Hubei University of Traditional Chinese Medicine, Wuhan 430000, China
非酒精性脂肪性肝病(NAFLD)是一种与胰岛素抵抗(IR)和遗传易感密切相关的代谢应激性肝脏损伤,以弥漫性肝细胞大泡性脂肪变为主要特征,包括单纯性脂肪肝以及由其演变的脂肪性肝炎(NASH)和肝硬化[1]。NAFLD除直接或间接通过促进并存的其他肝病进展,导致肝脏衰竭和肝细胞癌(HCC)外,还参与2型糖尿病及动脉硬化的发病,是导致慢性肝病的重要原因之一[2]。
本课题组在近10年的临床诊疗中,借张仲景“旋覆花汤”(方药组成:旋覆花、葱白、茜草)治疗肝着通阳通络之意,大剂量运用具有通阳作用的葱白汁对NAFLD进行治疗,疗效显著。同时课题组进一步与湖北中医药大学药学院共同研发出葱白提取物(葱白有效部位的主要成分为二烯丙基硫醚、儿茶素等)[3],进行长期大样本临床研究[4],结果表明葱白提取物对脂肪肝患者疗效显著,且葱白提取物疗效优于脂必妥。基于此,本研究运用网络药理学方法对葱白进行进一步的挖掘与数据分析,筛选并预测出治疗NAFLD相关性最强的化合物及分子靶点,进而运用小分子RNA干扰(RNAi)技术在动物实验中进行验证。
1 材料 1.1 动物及细胞系SPF级SD雄性大鼠48只,6~8周龄,体质量(200±20)g,由湖北省疾病控制中心提供,合格证编号:SCXK(鄂)2008-0005。293T细胞系,购于赛默飞公司。
1.2 药物与试剂葱白提取物来自于华夏小葱根茎,由武汉市第一医院药剂研究室提取,为褐色粉末状,批号:20110902,以适量植物油调配成悬混液,控制浓度为5 g/L;大鼠高脂饲料组成为:72.1%标准大鼠饲料,2%胆固醇(采购于国药集团化学试剂有限公司),10%猪油,5%蔗糖,0.5%脱氧胆酸钠(采购于国药集团化学试剂有限公司),0.2%甲硫氧嘧啶(50 mg/片,采购于北京燕京药业有限公司);由武汉巴菲尔生物有限公司提供空载腺病毒及过氧化物酶体增生物激活受体γ共激活因子-1α(PGC-1α)RNAi腺病毒,滴度为109 pfu/mL。
1.3 主要仪器Sigma30高速低温离心机(法国,Sigma公司),HITACHI7160全自动生化检测仪(日本,HITACHI公司),微量移液器(Eppendorf公司),电泳仪电源(型号:DYY-7C,北京六一仪器厂),垂直电泳槽(型号:DYCZ-24DN,北京六一仪器厂),电转仪(型号:DYCZ-40,北京六一仪器厂),水平摇床(型号:TS-1,江苏海门其林贝尔仪器制造有限公司),pH计(型号:LP115,德国Metter-Toledo GmbH公司),电子天平(型号:CPA,北京赛多利斯仪器系统有限公司);P4000高效液相色谱仪(美国TSP公司),二极管陈列检测器(型号:UV6000,美国TSP公司),实时定量-聚合酶链反应(RT-PCR)仪(型号:ABI7500,美国Thermo公司)。
2 方法 2.1 葱白有效化学成分筛选利用中药系统药理学分析平台(TCMSP)检索“葱白”所含全部化合物,同时以口服生物利用度(OD)≥30%、类药性(DL)≥0.18为阈值进行筛选。
2.2 葱白有效成分相关基因靶点预测利用TCMSP网络数据库,下载葱白所含化合物相关基因靶点,利用Perl语言软件(5.28版)进行葱白有效化学成分相关靶点筛选。
2.3 NAFLD基因靶点获取登录GeneCards网络数据库,检索“NAFLD”疾病基因并下载。
2.4 葱白与NAFLD的共同基因靶点获取通过R语言软件(4.0.0版)将“葱白有效成分相关基因靶点”与“NAFLD基因靶点”进行映射,得到药物与疾病相互作用的共同靶点并通过Venn图表现。
2.5 “活性成分-靶点-疾病”网络图及蛋白互作图构建将上述步骤所得到的数据输入Cytoscape软件(3.8.0版)构建“活性成分-靶点-疾病”网络图,同时将共同靶基因上传至String网络数据平台,构建出蛋白互作(PPI)网络图。
2.6 生物功能与通路富集分析通过R语言软件对葱白治疗NAFLD疾病的预测靶点进行GO功能富集分析及KEGG通路富集分析。
2.7 采用动物实验验证网络药理学结果将48只SD雄性大鼠分为6组,即空白组、模型组、葱白组、空转组、转染组、转染加葱白组,除空白组外,其余5组大鼠均采用高脂饲料喂养法造模,喂养12周后造模成功,继续给予高脂饲料喂养,自由进食饮水。空白组及模型组腹腔注射生理盐水1 mL及生理盐水灌胃,每日1次;葱白组腹腔注射生理盐水1 mL及葱白灌胃,每日1次;转染组腹腔注射PGC-1α RNAi腺病毒1 mL及生理盐水灌胃,每日1次;空转组腹腔注射空载体病毒1 mL及生理盐水灌胃,每日1次;转染葱白组腹腔注射PGC-1α RNAi腺病毒1 mL及葱白灌胃,每日1次。各组操作时间固定于每日下午,共持续4周。药物处理4周后处死大鼠,取出肝脏,进行苏木精-伊红(HE)及油红O染色,蛋白免疫印迹(Western Blot)法检测肝脏组织过氧化物酶体增殖物受体γ(PPARG)、PPARG辅助活化因子A(PPARGC1A)蛋白表达,RT-PCR法检测肝脏组织PPARGC1A mRNA表达。
2.8 统计学分析使用SPSS 22.0软件对所有数据进行统计分析,计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD法。P<0.05为差异有统计学意义。
3 结果 3.1 葱白和NAFLD的网络药理学研究 3.1.1 葱白的有效成分及作用靶点通过TCMSP网络数据平台,以OB>30%、DL>0.18为筛选标准,共筛选出化合物7个。见表 1。
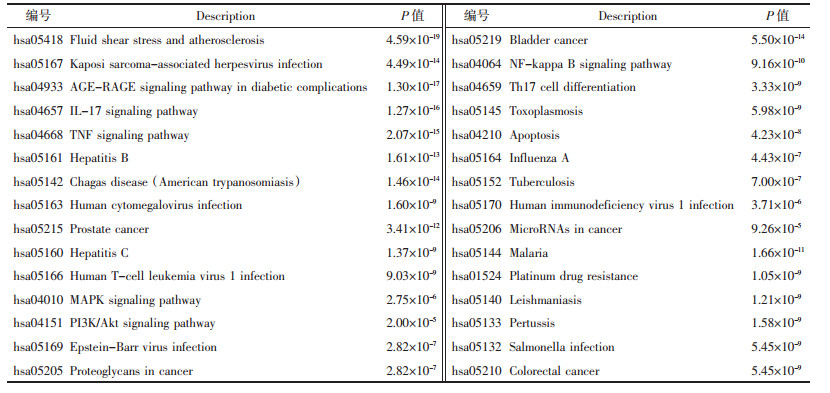
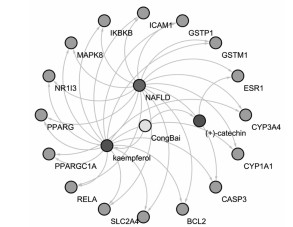
通过GeenCards数据库得到NAFLD相关靶点1 024个,通过R语言软件得到葱白有效成分对应基因靶点36个,并通过R语言软件绘制Venn图,得到共同靶点16个,见图 1。将上述16个共同靶点通过Cytoscape 3.8.0软件构建葱白药物治疗NAFLD的“活性成分-靶点-疾病”可视化网络图,见图 2。
|
| 图 1 葱白与NAFLD的共同作用靶点Venn图 |
|
| 图 2 “活性成分-靶点-疾病”可视化网络图 |
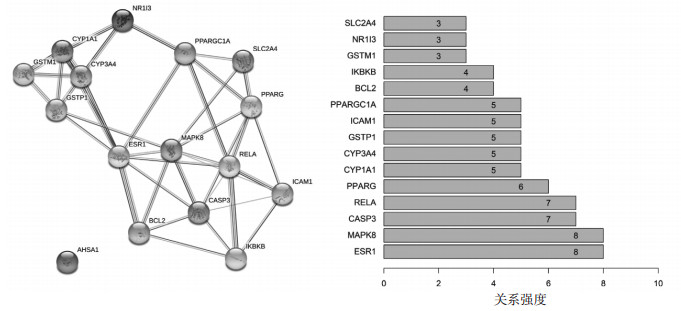
将葱白及NAFLD的16个共同蛋白靶点上传至String网络数据平台,设置置信度>0.4,所得结果中存在1个游离靶点蛋白,另外15个靶点蛋白可形成PPI网络图,其中每个节点代表蛋白靶点,连接线代表蛋白之间的作用关系。同时运用R语言软件,对各个靶点间的相关性进行统计,见图 3。
|
| 图 3 葱白治疗NAFLD相关靶点PPI网络图及计数统计 |
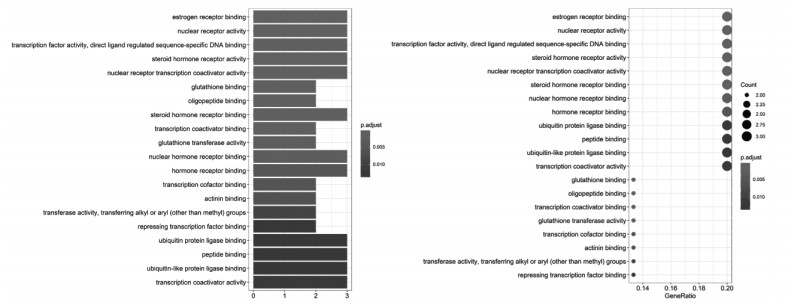
通过R语言软件对16个靶点蛋白进行GO分析,设置P值为0.05,共得到67个功能分析条目,见图 4,图中展示了前20位功能调控条目,涉及较多的为雌激素受体结合、核受体活性、转录因子活性及特异性DNA结合直接配体调控序列、类固醇激素受体、核受体转录共激活活性、谷胱甘肽及寡肽结合等。
|
| 图 4 GO富集分析柱状图及点状图 |
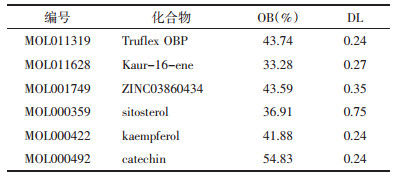
通过R语言软件对16个靶点蛋白进行KEGG通路富集分析,共得到114条通路,见表 2,表中列举了前30位信号通路名称,其中涉及NAFLD的相关信号通路包括流体剪切应力和动脉粥样硬化、糖尿病并发症的AGE-RAGE信号通路、白细胞介素-17(IL-17)信号通路、肿瘤坏死因子(TNF)信号通路、丝裂原活化蛋白激酶(MAPK)信号通路、磷脂酰肌醇-3激酶(PI3K)/蛋白激酶B(Akt)信号通路、核转录因子-κB(NF-κB)信号通路、细胞凋亡等。
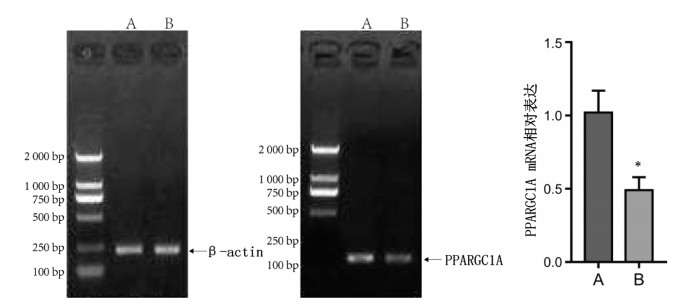
为验证PPPARGC1A RNAi腺病毒构建成功,预先在正常大鼠中进行腺病毒转染验证。应用线性化的pBSilence1.1质粒表达载体构建干扰质粒,对干扰质粒进行有效性筛选后亚克隆,在293T细胞系中扩增,浓缩病毒滴度值至109 pfu/mL备用。应用RT-PCR法验证病毒可以knock-down大鼠转录因子PPARGC1A表达,与空白组相比,空白加转染组大鼠PPARGC1A mRNA的表达降低(P<0.01)。见图 5。
|
| 注:A.空白组;B.空白加转染组;与空白组比较,*P<0.01。 图 5 PPARGC1A RNAi腺病毒对正常大鼠肝脏PPARGC1A mRNA表达的影响(x±s,n=8) |
随后在实验各组大鼠中进行PGC-1α RNAi腺病毒转染验证,与空转组比较,转染组PPARGC1A mRNA的表达水平降低(P<0.01),证实转染成功。与空白组比较,模型组PGC-1α mRNA的表达水平降低(P<0.01),证实NAFLD的发生发展过程与PPARGC1A失活相关。与模型组比较,葱白组PPARGC1A mRNA的表达水平增加(P<0.01),转染加葱白组差异无统计学意义。见图 6。
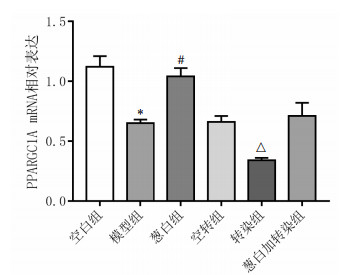
|
| 注:与空白组比较,*P < 0.01;与模型组比较,#P < 0.01;与空转组比较,△P < 0.01。 图 6 PPARGC1A RNAi腺病毒实验各组大鼠肝脏PPARGC1A mRNA表达的影响(x±s,n=8) |
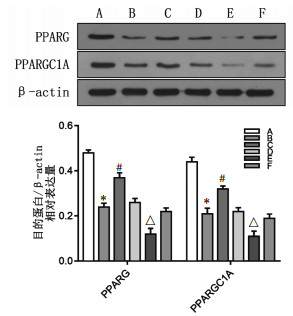
|
| 注:A.空白组;B.模型组;C.葱白组;D.空转组;E.转染组;F.转染加葱白组;与空白组比较,*P < 0.01;与模型组比较,#P < 0.01;与空转组比较,△P < 0.01。 图 7 大鼠肝脏PPARG、PPARGC1A蛋白的表达水平条带图及灰度统计图(x±s,n=8) |
与空白组比较,模型组大鼠肝脏的PPARG、PPARGC1A蛋白表达降低(P<0.01);与模型组比较,葱白组大鼠肝脏的PPARG、PPARGC1A蛋白表达升高(P<0.01);与空转组比较,转染组大鼠PPARG、PPARGC1A蛋白表达降低(P<0.01)。见图 7。
3.2.3 葱白提取物对NAFLD大鼠肝脏组织病理学影响从肝脏外观来看,空白组大鼠肝脏色泽鲜红,表面光滑,边缘锐利;葱白组接近空白组,无明显油腻状,指压有弹性,体积大小接近空白组;其余4组大鼠肝脏肉眼观察可见体积增大,颜色浅黄,质软,边缘变钝,表面有油腻感。
从HE染色结果来看,空白组细胞基本无异常变化,未见明显脂滴空泡;模型组、空转组、转染组及转染加葱白组细胞胞浆内充满大小不等的脂滴空泡,部分肝细胞核被挤到一边,细胞肿胀;葱白组细胞内脂滴少于模型组。
从油红O染色结果来看,空白组肝细胞边缘清晰,细胞核大,细胞内未见红色脂滴聚集;模型组、空转组及转染组肝细胞边缘欠清晰,细胞间结合欠紧密,细胞胞浆内充满大小不等的红色脂滴,细胞发生明显肿胀;葱白组肝细胞内橘红色脂滴数量少于模型组,转染加葱白组肝细胞内红色脂滴数量介于模型组和葱白组之间。
通过肝细胞气球样变、小叶内炎症及肝细胞脂肪变3个方面进行NAS评分,结果显示与空白组大鼠相比,高脂饮食造成的模型组大鼠的NAS评分升高(P<0.01);与模型组相比,经葱白提取物处理后的葱白组大鼠肝脏NAS评分有所改善(P<0.01);空转组、转染组、转染加葱白组未见统计学差异。见图 8、图 9。
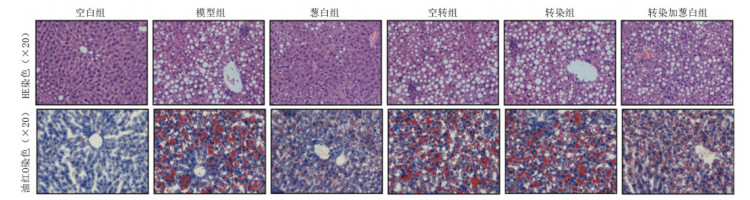
|
| 图 8 各组大鼠肝脏组织HE及油红O染色结果 |
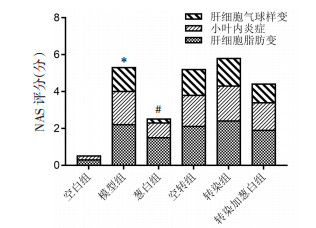
|
| 注:与空白组比较,*P < 0.01;与模型组比较,#P < 0.01。 图 9 各组大鼠肝脏NAS评分(x±s,n=8) |
中医药治疗NAFLD从整体出发,根据患者体质结合疾病发病原因与规律,全面调节患者气血阴阳失衡状态。无论辨证论治、专法专方治疗,以及名医经验、中西医结合疗法、中医多途径、多方法治疗等,在控制病因、降脂、降糖、促进肝内脂肪消退、减少肝细胞坏死、炎症和纤维化等方面均取得了独特的疗效优势。但中医治疗NAFLD多针对其痰、瘀、浊的证候辨证施治,对病机的研究多偏重于痰湿瘀血阻滞,而对阳气不通的病机认识不够,故仍有部分NAFLD患者临床疗效欠佳。对于这部分患者,课题组大剂量运用具有通阳作用的葱白汁进行治疗,疗效显著。
网络药理学信息技术是近几年兴起的新型数据分析技术,本研究应用此项技术,运用数据挖掘的方法并结合动物实验,证明葱白提取物治疗NAFLD的科学性与可行性。本研究筛选得到葱白治疗NAFLD的两个有效成分,山奈酚(kaempferol)与15个基因靶点对应,儿茶素(catechin)与1个基因靶点对应。其中kaempferol是葱白发挥治疗作用的主要有效成分之一,研究证实kaempferol可改善肥胖大鼠糖脂代谢,降低肥胖大鼠血糖及血脂水平[5]。
同时,GO功能富集分析显示,葱白治疗NAFLD主要涉及雌激素受体结合、核受体活性、转录因子活性、特异性DNA结合直接配体调控序列及核受体转录共激活活性等生物过程。核受体包含48个转录因子家族[6],其中过氧化物酶体增殖物受体(PPARs)是核受体超家族之一,在调节肝脏糖脂代谢方面起着重要的调控作用。PPARG是PPARs中的一员,在脂肪组织中高度表达,可加速脂肪酸的氧化和分解,并能增加胰岛素敏感性,降低血糖、血脂水平[7]。目前,PPARG受体激活剂罗格列酮在临床上运用广泛,实验证明PPARG上调可改善肝脏脂肪性病变[8]。通过KEGG通路富集分析,显示炎性因子通路在NAFLD疾病发展过程中占有重要地位。同时在肝脏中PPARG可诱导M1型巨噬细胞向M2型巨噬细胞转化,发挥免疫抑制型巨噬细胞作用,减少炎性细胞因子分泌,改善肝脏免疫炎性反应[9]。
通过PPI网络图发现PPARGC1A与PPARG存在密切联系,PPARGC1A是一种可介导能量代谢的核受体辅助激活因子,通过停靠转录因子,如细胞核呼吸因子-1(NRF-1)、肝细胞核因子-4α(HNF-4α)以及大多数核受体超家族成员,以不同的方式与其发生分子对接,进而调控其下游一系列基因表达,在机体的线粒体生物合成、肝糖异生、脂肪酸β氧化及氧化应激等一系列能量代谢过程中发挥重要作用,PPARGC1A基因失活使PPARG无法激活,减少脂肪酸β氧化酶的转录活性[10]。同时,下调肉毒碱棕榈酰基转移酶(CPT)、核呼吸因子(NRF)、线粒体转录因子A(mtTFA)的转录活性,减少线粒体β氧化,降低线粒体对葡萄糖的转化,导致脂肪酸在肝细胞堆积[11]。KEGG通路富集分析显示PI3K/Akt信号通路在NAFLD糖脂代谢紊乱中具有重要作用,病理情况下Akt磷酸化异常,导致肝细胞胰岛素抵抗,不能有效抑制肝糖原输出,PPARGC1A表达上调可维持Akt正常酪氨酸磷酸化,增加肝脏对胰岛素的敏感性[12]。
本次实验证实了PPARGC1A与PPARG的相关性以及葱白提取物治疗NAFLD的可行性。因此,通过运用网络药理学的分析方法,可以预测“活性成分-靶点-疾病”的相互作用关系,为探索具有复杂成分的中药治疗NAFLD的作用机制提供新的研究方法。
| [1] |
YOUNOSSI Z M, KOENIG A B, ABDELATIF D, et al. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes[J]. Hepatology (Baltimore, Md), 2016, 64(1): 73-84. DOI:10.1002/hep.28431 |
| [2] |
LI Z Z, XUE J, CHEN P, et al. Prevalence of nonalcoholic fatty liver disease in mainland of China: a meta-analysis of published studies[J]. Journal of Gastroenterology and Hepatology, 2014, 29(1): 42-51. DOI:10.1111/jgh.12428 |
| [3] |
程明, 温荣, 张长弓. 葱白超临界二氧化碳萃取工艺考察[J]. 医药导报, 2008, 27(2): 213-215. CHENG M, WEN R, ZHANG C G. Study on supercritical carbon dioxide extraction technology of Allii Fistulost Bulbus extract[J]. Herald of Medicine, 2008, 27(2): 213-215. DOI:10.3870/j.issn.1004-0781.2008.02.039 |
| [4] |
王进益, 张介眉, 雷健, 等. 搏心通胶囊对冠心病心绞痛患者脂质过氧化损伤的保护作用[J]. 湖北中医学院学报, 2007, 9(1): 30-32. WANG J Y, ZHANG J M, LEI J, et al. Protection of boxintong capsule against lipid peroxide injury in the patients with angina pectoris of coronary atherosclerotic cardiopathy[J]. Journal of Hubei College of Traditional Chinese Medicine, 2007, 9(1): 30-32. DOI:10.3969/j.issn.1008-987X.2007.01.016 |
| [5] |
刘贵波, 刘跃光, 孙成, 等. 山奈酚对2型糖尿病大鼠糖脂代谢及胰岛素抵抗的影响[J]. 实用临床医药杂志, 2012, 16(9): 1-3. LIU G B, LIU Y G, SUN C, et al. Effects of kaempferol on glycolipid metabolism and insulin resistance in rats with type 2 diabetes[J]. Journal of Clinical Medicine in Practice, 2012, 16(9): 1-3. DOI:10.3969/j.issn.1672-2353.2012.09.001 |
| [6] |
苑博, 王宇晖, 曹后康, 等. 核受体在非酒精性脂肪肝中的研究进展[J]. 中南药学, 2018, 16(5): 674-678. YUAN B, WANG Y H, CAO H K, et al. Progress of nuclear receptor in nonalcoholic fatty liver disease[J]. Central South Pharmacy, 2018, 16(5): 674-678. |
| [7] |
LEHRKE M, LAZAR M A. The many faces of PPARgamma[J]. Cell, 2005, 123(6): 993-999. DOI:10.1016/j.cell.2005.11.026 |
| [8] |
李秀丽, 王晓晖. PPAR激动剂在治疗非酒精性脂肪性肝病中的应用前景[J]. 中国医院药学杂志, 2015, 35(23): 2153-2156. LI X L, WANG X H. Application prospect of peroxisome proliferator-activated receptor agonists against non-alcoholic fatty liver diseases[J]. Chinese Journal of Hospital Pharmacy, 2015, 35(23): 2153-2156. |
| [9] |
CHAWLA A. Control of macrophage activation and function by PPARs[J]. Circulation Research, 2010, 106(10): 1559-1569. DOI:10.1161/CIRCRESAHA.110.216523 |
| [10] |
VEGA R B, HUSS J M, KELLY D P. The coactivator PGC-1 cooperates with peroxisome proliferator-activated receptor α in transcriptional control of nuclear genes encoding mitochondrial fatty acid oxidation enzymes[J]. Molecular and Cellular Biology, 2000, 20(5): 1868-1876. DOI:10.1128/MCB.20.5.1868-1876.2000 |
| [11] |
SRIVASTAVA S, DIAZ F, IOMMARINI L, et al. PGC-1α/β induced expression partially compensates for respiratory chain defects in cells from patients with mitochondrial disorders[J]. Human Molecular Genetics, 2009, 18(10): 1805-1812. DOI:10.1093/hmg/ddp093 |
| [12] |
BESSE-PATIN A, JEROMSON S, LEVESQUE-DAMPHOUSSE P, et al. PGC1A regulates the IRS1:IRS2 ratio during fasting to influence hepatic metabolism downstream of insulin[J]. Proceedings of the National Academy of Sciences of the United States of America, 2019, 116(10): 4285-4290. DOI:10.1073/pnas.1815150116 |
 2022, Vol. 41
2022, Vol. 41