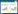文章信息
- 杨敏, 张锋, 付姣, 皮志杰, 何丽
- YANG Min, ZHANG Feng, FU Jiao, PI Zhijie, HE Li
- 圣草酚对高脂饮食诱导的糖尿病大鼠肝损伤的保护作用及机制探讨
- The protective effect and mechanism of eriodictyol on the liver injury in diabetic rats induced by high-fat diet
- 天津中医药大学学报, 2022, 41(3): 355-360
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(3): 355-360
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.03.17
-
文章历史
收稿日期: 2022-01-11
2. 武汉科技大学附属医院儿科, 武汉 430064
2. Department of Pediatrics, Affiliated Hospital of Wuhan University of Science and Technology, Wuhan 430064, China
糖尿病是一种多因素代谢性疾病,具有高血糖、高发病率、高致残率等特征[1]。胰岛素是机体唯一具有降低血糖作用的激素,当胰岛素分泌不足时,机体长期处于高血糖的状态,氧化应激及炎症反应相应增强,导致器官功能性障碍[2]。其中,肝是调节血糖的主要场所,血糖水平异常,患者易发展成肝损伤、肝炎、肝硬化甚至肝癌[3],严重威胁患者生命。
据研究,中药活性成分在治疗糖尿病肝损伤方面具有良好效果,比如人参皂苷Rg1[4]、槲皮素[5]、白藜芦醇[6]、黄芪和葛根[7]等。圣草酚是一种天然黄烷酮亚类的类黄酮,广泛存在于具有潜在健康重要性的多种药用植物中,如柑橘类水果和蔬菜[8]。药理活性广泛,具有抗氧化、抗炎、抗肿瘤[9]等作用。此外,圣草酚对多种肝脏疾病有良好的治疗效果,比如减弱乙酰氨基酚诱导的肝毒性、缓解饮食诱导的小鼠肝脏脂肪变性[10]。据报道,圣草酚对糖尿病及其并发症具有一定的治疗作用[11],但未见对糖尿病肝损伤的相关报道。因此,本研究通过建立相关实验模型,探讨圣草酚对高脂饮食诱导的糖尿病大鼠肝损伤、氧化应激及胰岛素抵抗的影响,以期为糖尿病肝损伤的临床治疗提供新思路。
1 材料 1.1 实验动物SPF级SD雄性大鼠60只,5周龄,体质量200~230 g,购自北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2016-0011,使用许可证号:SYXK(京)2017-0033。实验经十堰市太和医院动物管理伦理委员会讨论通过,伦理编号:IACUC2020-045。
1.2 药物与试剂圣草酚(纯度≥98%)购自成都普菲德生物技术有限公司(货号为CAS:552-58-9);链脲佐菌素(STZ)购自上海如吉生物科技公司(货号为CAS:18883-66-4);天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)试剂盒购自上海纪宁生物科技有限公司(货号分别为D-5001、D-2001、H-5011、H-2031);超氧化物歧化酶(SOD)、丙二醛(MDA)试剂盒购自上海晶抗生物工程有限公司(货号为QS-071、QS-051);原位末端标记技术(TUNEL)试剂盒购自武汉默沙克生物科技有限公司(货号为K374-104);二喹啉甲酸(BCA)蛋白定量检测试剂盒购自上海碧云天生物技术有限公司(货号为QPBCA-1KT);B淋巴细胞瘤-2(Bcl-2,ab182858,1∶2 000)、Bcl-2相关X蛋白(Bax,ab32503,1∶1 000)、肿瘤坏死因子-α(TNF-α,ab183218,1∶1 000)相关抗体购自英国Abcam公司;TBST缓冲液、4%多聚甲醛购自北京华越洋生物科技有限公司(货号为C1067-002、C1042-014);RIPA裂解液购自北京普利莱基因技术有限公司(货号为C1053-100);苏木精-伊红(HE)染色液、3,3’-二氨基联苯胺(DAB)染色液、苏木素染色液购自北京博蕾德生物科技有限公司(货号分别为DH0006、DH0032、DH0058)。
1.3 主要仪器SpectraMax iD5多功能酶标仪购自美国Molecular Devices仪器公司;HGM-114血糖仪购自苏州尔达医疗设备有限公司;XSP-SG-63X光学显微镜购自上海光学仪器一厂;Avanti JXN-30/26智能型高效离心机购自美国Beckman Coulter公司。
2 方法 2.1 动物分组与造模参考文献方法[12-13],将50只雄性SD大鼠适应性饲养1周后,10只作为正常组,喂养正常饲料,剩余40只大鼠喂养高脂饲料,4周后腹腔注射STZ 30 mg/kg建立高脂饮食联合低剂量STZ诱导的糖尿病模型,1周后检测大鼠空腹血糖(FBG),高于7.0 mmol/L提示造模成功,淘汰未成模大鼠后随机分为4组:模型组、低剂量组(圣草酚2.5 mg/kg)、中剂量组(圣草酚5 mg/kg)、高剂量组(圣草酚10 mg/kg),每组10只大鼠。各给药组分别腹腔注射2.5、5、10 mg/kg圣草酚,正常组及模型组给予等体积生理盐水,每日1次,共8周。末次给药后,各组大鼠禁食不禁水12 h,麻醉处理,腹主动脉取血后处死,迅速解剖取出肝脏,用预冷的生理盐水清洗。取部分用4%多聚甲醛固定,剩余组织匀浆处理。
2.2 评估胰岛素抵抗相关指标给药结束后,各组大鼠禁食12 h后,使用血糖仪检测空腹血糖(FBG),采用酶联免疫吸附(ELISA)法测定空腹胰岛素(FINS),并根据胰岛素抵抗指数(HOMA-IR)公式计算,HOMA-IR=(FBG×FINS)/22.5。
2.3 试剂盒检测肝功能生化指标水平检测AST、ALT、LDL、HDL水平,按照相关试剂盒说明书操作,采用酶标仪进行检测。
2.4 HE染色观察肝组织病理形态取固定处理的肝脏组织,进行脱水、包埋、制片、HE染色,并在光学显微镜下观察、拍摄。
2.5 试剂盒检测氧化应激标志物水平根据SOD、MDA试剂盒说明进行检测。
2.6 TUNEL观察肝细胞凋亡情况根据TUNEL试剂盒说明进行操作,并在光学显微镜下观察、拍摄。
2.7 蛋白免疫印迹(Western Blot)法检测凋亡相关蛋白表达取制备的肝组织匀浆液,加入RIPA裂解液,用BCA试剂盒测定蛋白浓度,煮沸变性后获取上样样本,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离、转膜、封闭后,采用Bax、Bcl-2相关抗体孵育,TBST冲洗后,采用电化学发光(ECL)进行显影,分析相应灰度值。
2.8 免疫组化法检测TNF-α水平取固定处理的肝脏组织,进行切片、二甲基脱蜡、水化、热修复处理后,在正常的山羊血清工作液中封闭10 min;磷酸缓冲盐溶液(PBS)清洗后,滴加TNF-α相关一抗孵育1 h;继续用PBS清洗,滴加二抗孵育20 min;PBS清洗,加入DAB染色及苏木素复染,经乙醇脱水至透明后,中性树胶封片。
2.9 统计学方法应用SPSS 19.0统计软件对结果进行分析,计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析,两两比较采用LSD法。P<0.05为差异有统计学意义。
3 结果 3.1 圣草酚对糖尿病大鼠一般行为学的影响正常组大鼠状态良好,皮毛光泽,活动、进食、排便正常;模型组大鼠皮毛杂乱,有糖尿病“三多一少”的症状出现,进食量、排便量增加,活动量减少,慵懒,精神不佳;与模型组相比,各给药组大鼠状态有一定改善。
3.2 圣草酚对糖尿病大鼠胰岛素抵抗相关指标的影响与正常组相比,模型组大鼠FBG、FINS、HOMA-IR均升高(P < 0.05);与模型组相比,除圣草酚低剂量组差异不具有统计学意义外(P > 0.05),其余两组胰岛素抵抗相关指标均有不同程度的降低(P < 0.05),提示圣草酚能够降低糖尿病大鼠的胰岛素抵抗,延缓病情进展。见图 1。
|
| 注:A.正常组;B.模型组;C.圣草酚低剂量组;D.圣草酚中剂量组;E.圣草酚高剂量组;与正常组比较,*P < 0.05;与模型组比较,#P < 0.05。 图 1 圣草酚对糖尿病大鼠胰岛素抵抗相关指标的影响(x±s,n=10) |
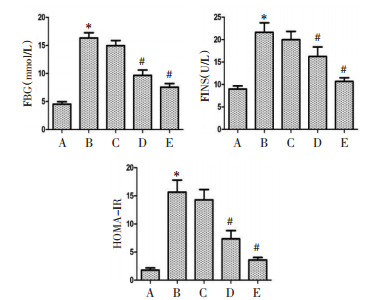
与正常组相比,模型组大鼠AST、ALT、LDL水平升高,HDL水平降低(P < 0.05);与模型组相比,除圣草酚低剂量组差异不具有统计学意义外(P > 0.05),其余两组AST、ALT、LDL水平降低,HDL水平升高(P < 0.05),提示圣草酚能够调节转氨酶及脂质水平,缓解糖尿病大鼠肝损伤程度。见图 2。
|
| 注:A.正常组;B.模型组;C.圣草酚低剂量组;D.圣草酚中剂量组;E.圣草酚高剂量组;与正常组比较,*P < 0.05;与模型组比较,#P < 0.05。 图 2 圣草酚对糖尿病大鼠肝功能指标的影响(x±s,n=10) |
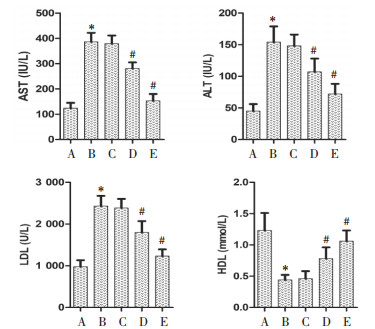
正常组大鼠肝脏组织结构完整,肝细胞未见水肿,形态正常;模型组大鼠肝脏组织结构紊乱,排列不规则,部分可见坏死或空泡样变性,多见炎症灶浸润,肝组织损伤明显;与模型组相比,3个给药组大鼠肝脏组织病理形态有一定的改善,其中圣草酚高剂量组大鼠的肝组织结构与肝细胞形态趋于正常,提示圣草酚能够减轻糖尿病大鼠肝组织的病理形态,缓解肝脏损伤程度。见图 3。
|
| 注:A.正常组;B.模型组;C.圣草酚低剂量组;D.圣草酚中剂量组;E.圣草酚高剂量组。 图 3 圣草酚对糖尿病大鼠肝组织病理形态的影响(×400) |
与正常组相比,模型组大鼠SOD活性降低,MDA含量升高(P < 0.05);与模型组相比,除圣草酚低剂量组差异不具有统计学意义外(P > 0.05),其余两组SOD活性升高,MDA含量降低(P < 0.05),提示圣草酚能够提高抗氧化酶活性,减少过氧化反应,缓解糖尿病大鼠氧化应激程度。见图 4。
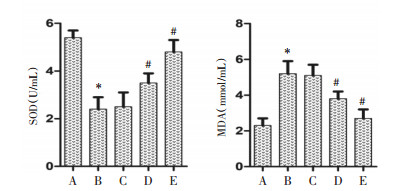
|
| 注:A.正常组;B.模型组;C.圣草酚低剂量组;D.圣草酚中剂量组;E.圣草酚高剂量组;与正常组比较,*P < 0.05;与模型组比较,#P < 0.05。 图 4 圣草酚对糖尿病大鼠肝组织氧化应激指标的影响(x±s,n=10) |
TUNEL染色后,正常细胞的细胞核不着染,而凋亡细胞的细胞核被着染为黄色或棕黄色,并且具有细胞变小、细胞核固缩的改变。正常组大鼠肝细胞正常排列,少见凋亡细胞;模型组大鼠阳性凋亡细胞数目增多,细胞核固缩程度较严重;与模型组相比,3个给药组大鼠肝细胞凋亡状态有一定程度的缓解,提示圣草酚能够缓解糖尿病大鼠肝细胞凋亡。见图 5。
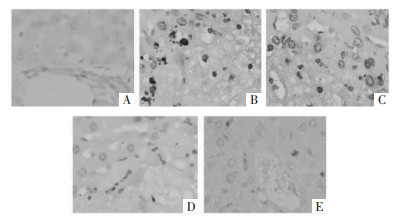
|
| 注:A.正常组;B.模型组;C.圣草酚低剂量组;D.圣草酚中剂量组;E.圣草酚高剂量组。 图 5 圣草酚对糖尿病大鼠肝细胞凋亡的影响(×400) |
与正常组相比,模型组大鼠Bax/Bcl-2比值升高;与模型组相比,除圣草酚低剂量组差异不具有统计学意义外(P > 0.05),其余两组Bax/Bcl-2比值降低(P < 0.05),提示圣草酚能够缓解糖尿病大鼠肝细胞凋亡状态,保护肝细胞,与“3.6”项结果吻合。见图 6。
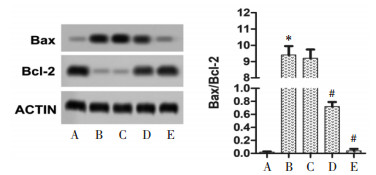
|
| 注:A.正常组;B.模型组;C.圣草酚低剂量组;D.圣草酚中剂量组;E.圣草酚高剂量组;与正常组比较,*P < 0.05;与模型组比较,#P < 0.05。 图 6 圣草酚对糖尿病大鼠肝细胞凋亡相关蛋白表达量的影响(x±s,n=10) |
TNF-α的表达部位定位在细胞核、细胞质,阳性物质呈棕黄色,阴性无染色。免疫组化染色显示,模型组的染色程度较大,而各给药组的染色程度均有一定程度减轻,其中圣草酚高剂量组趋向于正常组,提示圣草酚能够缓解糖尿病大鼠炎症反应,缓解肝损伤。见图 7。
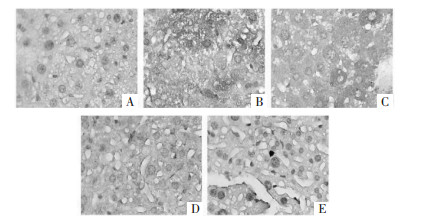
|
| 注:A.正常组;B.模型组;C.圣草酚低剂量组;D.圣草酚中剂量组;E.圣草酚高剂量组。 图 7 圣草酚对糖尿病大鼠肝组织TNF-α阳性表达的影响(×400) |
据统计,糖尿病已经成为全球第七大死亡原因,其发病率逐年上升,并呈年轻化趋势,预计到2035年全世界糖尿病患者将达到5.92亿,已成为严重威胁人类健康的全球性公共卫生问题[14]。目前,糖尿病的治疗已取得良好进展,但其毒副作用也不容忽视,常引起潴留、肥胖、视网膜病变、抑郁等症状[15-16]。圣草酚是一种天然黄酮类化合物,药理活性广泛,本研究探讨其对高脂饮食诱导的糖尿病大鼠肝损伤、氧化应激及胰岛素抵抗的影响。
当肝脏、脂肪等靶组织对胰岛素的敏感性下降时会出现胰岛素抵抗,导致血糖代谢紊乱,促使机体处于氧化应激状态,产生过量自由基,导致肝细胞损伤。AST、ALT被释放入血,其含量间接反映肝细胞损伤程度[17]。此外,氧自由基与脂质发生过氧化反应生成MDA,促进脂质代谢,而机体中的SOD具有较强的抗氧化能力,可抑制氧自由基的生成,减轻对肝细胞的损害,并且降低MDA的生成[18]。人体血浆内包括胆固醇、三酰甘油等,胆固醇和脂蛋白结合后才能被运送到体内各个部位,LDL将胆固醇从肝脏运送至全身组织,HDL将各组织的胆固醇运回肝脏代谢。因此,LDL、HDL水平是反映机体脂质代谢的重要指标[19]。Yang等[20]研究显示,降糖颗粒通过减轻糖脂代谢紊乱和氧化应激发挥对糖尿病所致肝损伤的保护作用。本实验中圣草酚可以降低FBG、FINS、HOMA-IR,同时能够降低AST、ALT、LDL水平,升高HDL水平,增强SOD活性,减少MDA含量,提示圣草酚可以抑制胰岛素抵抗,降低转氨酶活性,促进脂质代谢,提高抗氧化能力,缓解氧化应激反应,发挥对糖尿病肝损伤的保护作用。
肝损伤疾病的重要特征是细胞凋亡,促凋亡蛋白Bax与抗凋亡蛋白Bcl-2的比例能够反映细胞凋亡趋势。TNF-α是一种促炎及促凋亡的细胞因子,在诱导糖尿病发生的过程中起重要作用[21]。Safhi等[22]研究显示马尾藻通过抑制细胞因子及凋亡途径发挥对糖尿病大鼠肝脏损伤的保护作用,本实验中圣草酚可以降低凋亡率及Bax/Bcl-2比值,降低TNF-α表达,减轻细胞凋亡,提示圣草酚能够抑制肝细胞凋亡,发挥保护肝脏的作用。
综上所述,圣草酚对高脂饮食诱导的糖尿病大鼠肝损伤具有保护作用,其机制可能与抑制胰岛素抵抗、降低转氨酶水平、促进脂质代谢、提高抗氧化能力、缓解氧化应激、调控细胞因子表达、抑制组织炎症及肝细胞凋亡等有关。圣草酚对糖尿病肝损伤的治疗效果显著,具有深入研究的潜在价值及现实意义。
| [1] |
MENDES-BRAZ M, MARTINS J O. Diabetes mellitus and liver surgery: the effect of diabetes on oxidative stress and inflammation[J]. Mediators of Inflammation, 2018, 201(5): 245-265. |
| [2] |
ZACCARDI F, WEBB D R, YATES T, et al. Pathophysiology of type 1 and type 2 diabetes mellitus: a 90-year perspective[J]. Postgraduate Medical Journal, 2016, 92(1084): 63-69. DOI:10.1136/postgradmedj-2015-133281 |
| [3] |
MANTOVANI A, PERNIGO M, BERGAMINI C, et al. Nonalcoholic fatty liver disease is independently associated with early left ventricular diastolic dysfunction in patients with type 2 diabetes[J]. PLoS One, 2015, 10(8): e0135329. DOI:10.1371/journal.pone.0135329 |
| [4] |
TIAN W, CHEN L, ZHANG L, et al. Effects of ginsenoside Rg1 on glucose metabolism and liver injury in streptozotocin-induced type 2 diabetic rats[J]. Genetics and Molecular Research, 2017, 16(1): 19-25. |
| [5] |
SENYIGIT A, DURMUS S, MIRZATAS E B, et al. Effects of quercetin on lipid and protein damage in the liver of streptozotocin-induced experimental diabetic rats[J]. Journal of Medicinal Food, 2019, 22(1): 52-56. DOI:10.1089/jmf.2018.0030 |
| [6] |
HAMADI N, MANSOUR A, HASSAN M H, et al. Ameliorative effects of resveratrol on liver injury in streptozotocin-induced diabetic rats[J]. Journal of Biochemical and Molecular Toxicology, 2012, 26(10): 384-392. DOI:10.1002/jbt.21432 |
| [7] |
丛金凤, 范颖, 李新, 等. 基于析因设计探讨黄芪葛根汤有效组分对糖尿病大鼠肝脏PI3K/Akt信号转导通路的影响[J]. 中医学报, 2020, 35(4): 815-820. CONG J, FAN Y, LI X, et al. Effect of effective components of Huangqi Gegen Decoction on PI3K/Akt signal transduction pathway in diabetic rats with factorial design[J]. Acta Chinese Medicine, 2020, 35(4): 815-820. |
| [8] |
ISLAM A, ISLAM M S, RAHMAN M K, et al. The pharmacological and biological roles of eriodictyol[J]. Archives of Pharmacal Research, 2020, 43(6): 582-592. DOI:10.1007/s12272-020-01243-0 |
| [9] |
吕凤, 杜倩, 奚鑫, 等. 圣草酚药理作用研究进展[J]. 中草药, 2019, 50(23): 5907-5912. LYU F, DU Q, XI X, et al. Advances in studies on pharmacological effects of eriodictyol[J]. Chinese Traditional and Herbal Drugs, 2019, 50(23): 5907-5912. DOI:10.7501/j.issn.0253-2670.2019.23.036 |
| [10] |
WANG Z Y, LAN Y, CHEN M H, et al. Eriodictyol, not its glucuronide metabolites, attenuates acetaminophen-induced hepatotoxicity[J]. Molecular Pharmaceutics, 2017, 14(9): 2937-2951. DOI:10.1021/acs.molpharmaceut.7b00345 |
| [11] |
HAMEED A, HAFIZUR R M, HUSSAIN N, et al. Eriodictyol stimulates insulin secretion through cAMP/PKA signaling pathway in mice islets[J]. European Journal of Pharmacology, 2018, 820(3): 245-255. |
| [12] |
RODRÍGUEZ V, PLAVNIK L, TOLOSA DE TALAMONI N. Naringin attenuates liver damage in streptozotocin: induced diabetic rats[J]. Biomedicine & Pharmacotherapy, 2018, 105(2): 95-102. |
| [13] |
ACIKGOZ E, AKTUG H, YIGITTURK G, et al. Repression of the Notch pathway prevents liver damage in streptozotocin-induced diabetic mice[J]. Folia Histochemica et Cytobiologica, 2017, 55(3): 140-148. DOI:10.5603/FHC.a2017.0014 |
| [14] |
DOWNS C A, FAULKNER M S. Toxic stress, inflammation and symptomatology of chronic complications in diabetes[J]. World Journal of Diabetes, 2015, 6(4): 554-565. DOI:10.4239/wjd.v6.i4.554 |
| [15] |
王雅宁, 崔立业, 宋亚玲. 糖尿病视网膜病变患者的血糖和糖化血红蛋白水平及其与视力损伤程度的相关性[J]. 解放军医药杂志, 2019, 31(12): 73-76. WANG Y N, CUI L Y, SONG Y L. Levels of blood sugar and glycosylated hemoglobin and their correlations with degree of visual impairment in patients with diabetic retinopathy[J]. Medical & Pharmaceutical Journal of Chinese PLA, 2019, 31(12): 73-76. DOI:10.3969/j.issn.2095-140X.2019.12.016 |
| [16] |
高兴, 刘海燕, 陈丽萍, 等. 老年2型糖尿病患者合并焦虑和抑郁的相关影响因素分析[J]. 解放军医药杂志, 2019, 31(12): 77-80. GAO X, LIU H Y, CHEN L P, et al. Analysis of related influencing factors of anxiety and depression in elderly patients with type 2 diabetes mellitus[J]. Medical & Pharmaceutical Journal of Chinese PLA, 2019, 31(12): 77-80. DOI:10.3969/j.issn.2095-140X.2019.12.017 |
| [17] |
OYENIHI O R, BROOKS N L, OGUNTIBEJU O O. Effects of kolaviron on hepatic oxidative stress in streptozotocin induced diabetes[J]. BMC Complementary and Alternative Medicine, 2015, 15(7): 236. |
| [18] |
李鑫. 人参皂苷Rg1对2型糖尿病大鼠肝损伤保护作用[J]. 中国公共卫生, 2015, 31(5): 612-614. LI X. Protective effect of ginsenoside Rg1 on liver injury in rats with type 2 diabetes[J]. Chinese Journal of Public Health, 2015, 31(5): 612-614. |
| [19] |
陈红武. 低密度脂蛋白胆固醇检查的标准及意义[J]. 家庭医学, 2017, 33(1): 8-9. CHEN H W. Criteria and significance of low density lipoprotein cholesterol[J]. Family Medicine, 2017, 33(1): 8-9. |
| [20] |
YANG X S, ZHANG P J, ZHANG F X, et al. Protective effect of hypoglycemic granule against diabetes-induced liver injury by alleviating glycolipid metabolic disorder and oxidative stress[J]. Journal of Cellular Biochemistry, 2020, 121(5): 3221-3234. |
| [21] |
张丽华, 李爱伏. 血清降钙素原、白细胞介素6、肿瘤坏死因子α在糖尿病合并感染患者中的变化及临床意义[J]. 临床误诊误治, 2020, 33(1): 53-56. ZHANG L H, LI A F. Changes and clinical significance of serum procalcitonin, interleukin-6 and tumor necrosis factor-α in patients with diabetes mellitus complicated with infection[J]. Clinical Misdiagnosis & Mistherapy, 2020, 33(1): 53-56. DOI:10.3969/j.issn.1002-3429.2020.01.013 |
| [22] |
SAFHI M M, ALAM M F, SIVAKUMAR S M, et al. Hepatoprotective potential of Sargassum muticum against STZ-induced diabetic liver damage in wistar rats by inhibiting cytokines and the apoptosis pathway[J]. Analytical Cellular Pathology(Amsterdam), 2019, 20(19): 795-801. |
 2022, Vol. 41
2022, Vol. 41