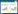文章信息
- 张练, 王茂娟, 周荣, 江帆
- ZHANG Lian, WANG Maojuan, ZHOU Rong, JIANG Fan
- 木犀草素通过调控HMGB1改善脓毒症小鼠模型的认知功能障碍
- Luteolin can improve cognitive dysfunction in septic mice by regulating HMGB1
- 天津中医药大学学报, 2022, 41(3): 368-374
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(3): 368-374
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.03.19
-
文章历史
收稿日期: 2022-02-22
2. 四川省德阳市人民医院中医科, 德阳 618000
2. Department of Traditional Chinese Medicine, Deyang People's Hospital of Sichuan Province, Deyang 618000, China
脓毒症是极为常见、致命和治疗代价昂贵的疾病之一,其为由细菌、病毒或真菌感染引起,导致全身性炎性反应综合征及器官功能障碍甚至死亡[1]。脓毒症经常导致弥漫性脑功能障碍,即脓毒症性脑病(SAE)。越来越多的证据表明,脓毒症患者的长期认知障碍与病死率增加之间存在关联[2]。脓毒症的病理生理机制仍未能完全阐述清楚,提示需要探寻更加具体有效的治疗脓毒症的方法。
木犀草素属于天然黄酮类化合物,主要存在于水果、蔬菜和多种中草药中[3]。临床研究表明,木犀草素具有多种生物学和药理活性,如抗肿瘤、抗肝脏毒性、抗过敏和抗氧化作用[4-5]。已有研究表明,木犀草可以通过抗炎和抗氧化作用改善脓毒症诱导的急性肺损伤[6]。高迁移率族蛋白B1(HMGB1)是一种常见的炎性因子,在脓毒症的发生发展过程中起到关键作用[7],它在脓毒症患者中表达升高。
目前关于木犀草素对脓毒症的具体作用机制未见报道,故本研究拟建立SAE小鼠模型,探究木犀草素通过调控HMGB1对SAE小鼠模型认知功能障碍的影响。
1 材料与方法 1.1 实验动物SPF级雄性C57BL/6小鼠120只,8周龄,体质量(22±2)g,购自杭州子源实验动物科技有限公司[许可证号:SCXK(浙)2019-0004]。小鼠饲养于四川省医学科学院动物房中[许可证号:SYXK(川)2018-058],室温(20±2)℃,12 h光照/12 h黑暗循环,自由饮水和进食。本动物实验经德阳市人民医院伦理委员会审查通过。
1.2 实验药物和主要试剂木犀草素(批号:111520-202006)购自中国食品药品检定研究院,化学式:C15H10O6,相对分子量:286.24,纯度≥94.4%;甘草酸(批号:1295888)购自美国Sigma-Aldrich公司;白细胞介素-6(IL-6)酶联免疫吸附(ELISA)检测试剂盒(批号:JLC6422)、肿瘤坏死因子-α(TNF-α)ELISA检测试剂盒(批号:JLC7047)、白细胞介素-1β(IL-1β)ELISA检测试剂盒(批号:JLC6382)购自上海晶抗生物工程有限公司;二喹啉甲酸(BCA)蛋白浓度测定试剂盒(批号:QN1075)购自北京百奥莱博科技有限公司;原位末端标记技术(TUNEL)细胞凋亡检测试剂盒(批号:C1091)购自上海碧云天生物技术研究所;苏木素-伊红(HE)染液(批号:SY2022)、超氧化物歧化酶(SOD)检测试剂盒(批号:SY6458)、谷胱甘肽过氧化物酶(GSH)检测试剂盒(批号:SY6452)、丙二醛(MDA)检测试剂盒(批号:SY6486)购自北京伊塔生物科技有限公司;兔抗HMGB1(批号:ab18256)、Actin(批号:ab8227)均购自英国Abcam公司。
1.3 动物模型的建立及分组将小鼠随机分为6组:假手术(Sham)组、模型(Model)组、木犀草素低剂量(Lut 50 mg/kg)组、木犀草素中剂量(Lut 100 mg/kg)组、木犀草素高剂量(Lut 200 mg/kg)组和地塞米松(Dex 1 mg/kg)组(作为阳性对照),每组12只。参照Lima等[8]方法采用盲肠结扎穿刺(CLP)建立脓毒症小鼠模型:腹腔注射2.5%戊巴比妥钠麻醉小鼠,仰卧位固定,消毒后腹中线切口开腹,游离肠系膜和盲肠,除Sham组外其余各组用丝线在回盲瓣以下环形结扎,针头在结扎部位远端进行贯通穿口,挤出少量粪便,缝合切口。模型建立成功后,Lut 50、100、200 mg/kg组分别灌胃给予50、100、200 mg/kg的木犀草素[9],Dex 1 mg/kg组腹腔注射地塞米松1 mg/kg[10],Sham组和Model组灌胃等量生理盐水,连续4 d,每日1次。模型建立后每隔12 h检测小鼠存活情况,连续96 h,进行生存分析。
1.4 旷场实验采用旷场反应箱收集各组小鼠10 min运动距离和中央区域停留时间。实验在安静环境下进行,将小鼠放入箱底部中央,同时进行摄像与计时,每只小鼠单独进行实验。
1.5 Morris水迷宫实验检测小鼠逃避潜伏期、目标象限时间和穿越区域次数Morris水迷宫装置由高60 cm、直径150 cm的黑色圆形池组成,分为4个视觉象限,池中注满水。将直径10 cm的圆形平台放置在第三象限中心、水面下方2 cm处。连续4 d,将小鼠放入面向池壁的池中,每只小鼠依次从4个象限进入,并以相同的顺序进入水中。在60 s内未能找到平台的小鼠被引导并允许在平台上停留10 s。将小鼠用于寻找平台的时间记录为潜伏期。第5天,在没有平台的情况下,记录在目标象限中花费的时间以及小鼠越过目标象限的次数。
1.6 标本采集于末次给药12 h后,将各组小鼠于冰台断头,取海马组织,部分10%甲醛固定,常规梯度乙醇脱水,蜡块包埋,切片厚度为5 mm。部分海马组织4 ℃加入生理盐水制成1∶9匀浆液。
1.7 HE染色观察小鼠大脑海马区组织病理损伤采用HE染液,取各组大鼠海马组织切片,进行脱水、包埋、制片、HE染色,在光学显微镜下观察并拍摄。
1.8 TUNEL染色检测细胞凋亡按照TUNEL细胞凋亡试剂盒提供的方法,对切片进行染色封片,光学显微镜观察组织细胞凋亡状况。细胞凋亡率=凋亡细胞数/总细胞数×100%。
1.9 ELISA法检测海马组织中IL-6、IL-1β、TNF-α水平取“1.6”项收集的各组大鼠海马组织匀浆液,按照ELISA试剂盒说明书检测海马组织中炎症因子IL-6、IL-1β、TNF-α水平。
1.10 试剂盒检测海马组织中SOD、MDA、GSH含量按照试剂盒说明书,采用酶标仪测定SOD含量,采用可见分光光度计测定MDA、GSH含量。SOD在450 nm处检测A值,MDA在532 nm处测A值,GSH在412 nm处测A值。
1.11 Western Blot法检测HMGB1蛋白表达水平取各组小鼠脑组织加入含蛋白酶抑制剂的细胞裂解液,进行总蛋白提取,BCA试剂盒测定蛋白质含量。提取等量蛋白质样品,100 ℃变性5 min,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离并转移至PVDF膜,5%的牛血清白蛋白(BSA)室温封闭2 h后加入HMGB1一抗,4 ℃过夜孵育,次日TBST清洗后加入辣根过氧物酶(HRP)-免疫球蛋白G(IgG)室温孵育1 h,清洗后加入发光液,于凝胶成像仪进行曝光拍照,并用Image J软件统计灰度值计算相对表达量。
1.12 考察加入HMGB1抑制剂对脓毒症小鼠模型的影响将48只小鼠随机分为4组:Model组、木犀草素(Lut 200 mg/kg)组、甘草酸(GL)组、木犀草素+甘草酸(Lut 200 mg/kg+GL)组,参照“1.3”建立脓毒症小鼠模型,Lut 200 mg/kg组灌胃给予200 mg/kg木犀草素,GL组腹腔内注射25.9 mL/kg(0.5 mL生理盐水中溶解10 mg甘草酸)甘草酸[11],Lut 200 mg/kg+GL组同时灌胃木犀草素和腹腔注射甘草酸。检测各组小鼠HMGB1蛋白表达水平、活动探索及学习认知能力、神经细胞凋亡、氧化应激指标(SOD、GSH、MDA)水平和炎性因子(IL-6、IL-1β、TNF-α)水平。
1.13 统计学分析本研究所有数据采用SPSS 18.0软件进行统计学分析。数据以均数±标准差(x±s)表示,组间比较采用单因素方差分析,两两比较采用LSD法。P < 0.05为差异有统计学意义。
2 结果 2.1 木犀草素升高SAE小鼠存活率与Sham组比较,Model组小鼠存活率降低(P < 0.05)。与Model组比较,Lut 100、200 mg/kg组和Dex 1 mg/kg组小鼠存活率升高(P < 0.05)。见图 1。
|
| 注:与Sham组比较,*P < 0.05;与Model组比较,#P < 0.05。 图 1 木犀草素对SAE小鼠存活率的影响(n=12) |
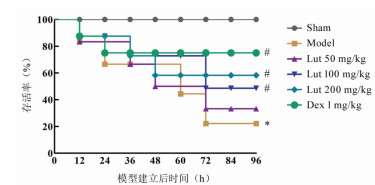
通过旷场实验检测各组小鼠10 min内总行驶距离和中央区域停留时间,结果显示与Sham组比较,Model组总行驶距离和中央区域停留时间缩短(P < 0.05);与Model组比较,Lut 100、200 mg/kg组和Dex 1 mg/kg组总行驶距离和中央区域停留时间提高(P < 0.05)。通过Morris水迷宫实验检测各组小鼠逃避潜伏期、目标象限时间、穿越区域次数,结果显示与Sham组比较,Model组逃避潜伏期时间升高(P < 0.05),目标象限时间、穿越区域次数降低(P < 0.05)。与Model组比较,Lut 100、200 mg/kg组和Dex 1 mg/kg组逃避潜伏期时间降低(P < 0.05),目标象限时间以及穿越区域次数升高(P < 0.05)。见图 2。
|
| 注:A.10 min总行驶距离;B.中央区域停留时间;C.逃避潜伏期;D.目标象限时间;E.穿越区域次数;与Sham组比较,*P < 0.05;与Model组比较,#P < 0.05。 图 2 木犀草素对SAE小鼠认知障碍的影响(x±s,n=12) |
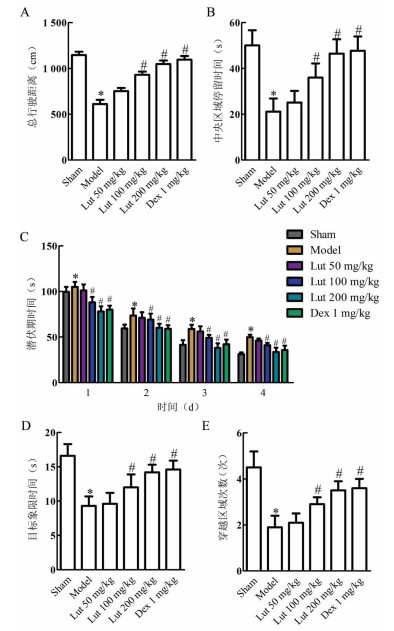
通过HE染色检测各组小鼠大脑海马区组织病理损伤,结果显示Sham组小鼠海马区神经细胞形态结构完整,排列规整,细胞质均匀,细胞核清晰。Model组海马区神经细胞体积变小,排列紊乱,炎性因子浸润。Lut 100、200 mg/kg组和Dex 1 mg/kg组较Model组病理损伤程度改善,细胞排列较规整,炎性因子浸润减少。见图 3。
|
| 图 3 木犀草素对SAE小鼠脑损伤的影响(HE,×200,n=12) |
TUNEL染色检测各组小鼠神经细胞凋亡,结果显示与Sham组比较,Model组小鼠神经细胞凋亡率升高(P < 0.05)。与Model组比较,Lut 100、200 mg/kg组和Dex 1 mg/kg组小鼠神经细胞凋亡率降低(P < 0.05)。见图 4。

|
| 注:与Sham组比较,*P < 0.05;与Model组比较,#P < 0.05。 图 4 木犀草素对SAE小鼠神经细胞凋亡的影响(x±s,n=12) |
通过ELISA法检测各组小鼠海马组织中IL-6、IL-1β、TNF-α水平,结果显示与Sham组比较,Model组IL-6、IL-1β、TNF-α水平升高(P < 0.05)。与Model组比较,Lut 100、200 mg/kg组和Dex 1 mg/kg组IL-6、IL-1β、TNF-α水平降低(P < 0.05)。见图 5。
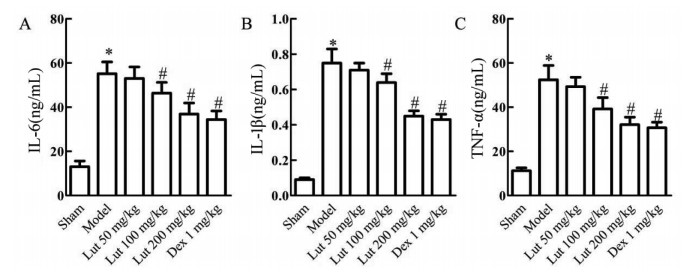
|
| 注:A.IL-6水平;B.IL-1β水平;C.TNF-α水平;与Sham组比较,*P < 0.05;与Model组比较,#P < 0.05。 图 5 木犀草素对SAE小鼠IL-6、IL-1β、TNF-α水平的影响(x±s,n=12) |
通过试剂盒检测各组小鼠海马组织中SOD、MDA、GSH含量,结果显示与Sham组比较,Model组SOD、GSH含量降低(P < 0.05),MDA含量升高(P < 0.05)。与Model组比较,Lut 100、200 mg/kg组和Dex 1 mg/kg组SOD、GSH含量升高(P < 0.05),MDA含量降低(P < 0.05)。见图 6。
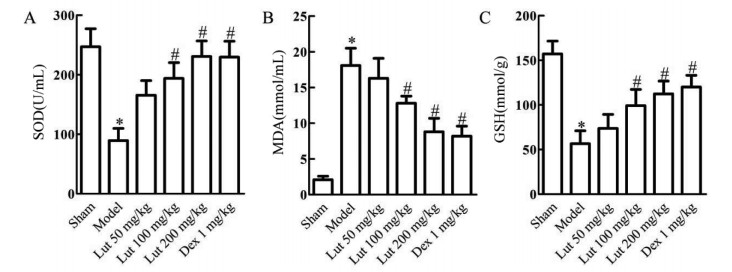
|
| 注:A.SOD含量;B.MDA含量;C.GSH含量;与Sham组比较,*P < 0.05;与Model组比较,#P < 0.05。 图 6 木犀草素对SAE小鼠SOD、MDA、GSH含量的影响(x±s,n=12) |
通过Western Blot法检测各组小鼠HMGB1蛋白表达水平,结果显示与Sham组比较,Model组小鼠HMGB1蛋白水平升高(P < 0.05)。与Model组比较,Lut 100、200 mg/kg组和Dex 1 mg/kg组小鼠HMGB1蛋白水平降低(P < 0.05)。见图 7。

|
| 注:A.Western Blot检测HMGB1蛋白表达;B.HMGB1蛋白表达;与Sham组比较,*P < 0.05;与Model组比较,#P < 0.05。 图 7 木犀草素对SAE小鼠HMGB1蛋白表达水平的影响(x±s,n=12) |
通过Western Blot法检测各组小鼠HMGB1蛋白表达水平,结果显示与Model组比较,Lut 200 mg/kg组HMGB1蛋白水平降低(P < 0.05),GL组HMGB1蛋白水平升高(P < 0.05);与GL组比较,Lut 200 mg/kg+GL组HMGB1蛋白水平降低(P < 0.05)。通过旷场实验考察各组小鼠10 min内总行驶距离和中央区域停留时间,结果显示与Model组比较,Lut 200 mg/kg组总行驶距离和中央区域停留时间升高(P < 0.05),GL组总行驶距离和中央区域停留时间降低(P < 0.05);与GL组比较,Lut 200 mg/kg+GL组总行驶距离和中央区域停留时间升高(P < 0.05)。通过Morris水迷宫实验检测各组小鼠逃避潜伏期、目标象限时间、穿越区域次数,结果显示与Model组比较,Lut 200 mg/kg组逃避潜伏期时间降低(P < 0.05),目标象限时间、穿越区域次数升高(P < 0.05),GL组逃避潜伏期时间升高(P < 0.05),目标象限时间、穿越区域次数降低(P < 0.05);与GL组比较,Lut 200 mg/kg+GL组逃避潜伏期时间降低(P < 0.05),目标象限时间、穿越区域次数升高(P < 0.05)。见开放科学(资源服务)标识码(OSID)。
2.9 木犀草素通过调控HMGB1对SAE小鼠模型神经细胞凋亡、氧化应激和炎症的影响通过TUNEL染色检测各组小鼠神经细胞凋亡,结果显示与Model组比较,Lut 200 mg/kg组细胞凋亡率降低(P < 0.05),GL组细胞凋亡率升高(P < 0.05);与GL组比较,Lut 200 mg/kg+GL组细胞凋亡率降低(P < 0.05)。通过ELISA法检测各组小鼠海马组织中IL-6、IL-1β、TNF-α水平,结果显示与Model组比较,Lut 200 mg/kg组IL-6、IL-1β、TNF-α水平降低(P < 0.05),GL组IL-6、IL-1β、TNF-α水平升高(P < 0.05);与GL组比较,Lut 200 mg/kg+GL组IL-6、IL-1β、TNF-α水平降低(P < 0.05)。通过试剂盒检测各组小鼠海马组织中SOD、MDA、GSH含量,结果显示与Model组比较,Lut 200 mg/kg组SOD、GSH含量升高(P < 0.05),MDA含量降低(P < 0.05),GL组SOD、GSH含量降低(P < 0.05),MDA含量升高(P < 0.05);与GL组比较,Lut 200 mg/kg+GL组SOD、GSH含量升高(P < 0.05),MDA含量降低(P < 0.05)。见OSID。
3 讨论脓毒症患者常存在睡眠与觉醒周期紊乱、意识受损、认知障碍、明显的精神错乱和昏迷等大脑局灶性或弥漫性功能障碍,早期应用抗感染药物、多器官功能保护、抑制氧化应激、减轻全身炎性反应、对意识状态改变的早期识别等均有助于延缓脓毒症的发生发展[12-13]。本研究通过旷场实验发现,经木犀草素处理后,SAE小鼠的活动和探索能力增强。Morris水迷宫实验可以反映小鼠的学习和认知能力,实验发现脓毒症小鼠的学习和认知能力减弱,木犀草素能够改善小鼠的学习和认知能力,提示木犀草素对SAE小鼠的认知功能障碍具有改善作用。
失控性全身炎性反应和免疫功能障碍是脓毒症发生的主要病理生理过程[14]。IL-6是评估和检测脓毒症的常用指标,其水平高低与脓毒症呈正相关。研究表明,高水平的促炎细胞因子IL-1β和TNF-α与术后认知障碍有关[15-16]。余洁等[17]研究发现木犀草素可以抑制哮喘患儿外周血单个核细胞(PBMCs)促炎性细胞因子TNF-α、IL-6的分泌。本研究发现,木犀草素具有降低SAE小鼠IL-6、IL-1β、TNF-α水平的作用,提示木犀草素抑制了SAE小鼠模型炎性因子的释放。
本研究发现,经木犀草素处理后,SAE小鼠SOD、GSH含量升高,MDA含量降低。在脓毒症患者发病的过程中,其脑部可以产生大量氧化应激因子及炎性细胞因子并导致脑损伤,特别是在海马和皮质区域容易出现早期氧化应激反应[18]。氧化应激是脓毒症多系统损伤的根本机制,抗氧化治疗可能成为脓毒症治疗的新策略[19]。MDA是细胞膜脂质被活性氧氧化的副产物,是氧化应激损伤的生物标志物。SOD是细胞中主要的抗氧化酶,是清除氧自由基的主要物质,能够抵抗氧自由基对细胞的损害[20]。李娜[21]研究发现木犀草素可以缓解糖尿病脑梗死大鼠氧化应激反应,提示木犀草素通过抗氧化应激对SAE小鼠模型起到脑组织保护作用。
HMGB1是真核细胞广泛表达的一种高度保守的细胞核非组蛋白,当细胞坏死或被激活时可释放大量HMGB1,可促进炎性因子的释放,进而促进脓毒症进展和器官损伤[22]。HMGB1与脓毒症的病情严重程度及预后相关,相关研究表明血浆、血清HMGB1浓度与病情严重程度呈正相关[23]。本研究发现,木犀草素具有降低SAE小鼠HMGB1蛋白表达水平的作用,加入HMGB1抑制剂甘草酸后,逆转了木犀草素对SAE小鼠模型认知障碍、炎症因子、神经细胞凋亡和氧化应激的影响,提示木犀草素能够通过调控HMGB1改善SAE小鼠模型的认知功能障碍。
综上所述,木犀草素能够通过调控HMGB1升高SAE小鼠模型存活率,增强脓毒症小鼠模型活动探索能力和学习认知能力,降低神经细胞凋亡率,减轻炎性反应和氧化应激水平。本研究为木犀草素临床治疗脓毒症提供了参考。
| [1] |
WU X L, YANG J H, YU L, et al. Plasma miRNA-223 correlates with risk, inflammatory markers as well as prognosis in sepsis patients[J]. Medicine, 2018, 97(27): e11352. DOI:10.1097/MD.0000000000011352 |
| [2] |
WANG X R, XU X L, GUO Y H, et al. Qiang Xin 1 formula suppresses excessive pro-inflammatory cytokine responses and microglia activation to prevent cognitive impairment and emotional dysfunctions in experimental sepsis[J]. Frontiers in Pharmacology, 2020, 11(12): 579. |
| [3] |
WEI B, LIN Q, JI Y G, et al. Luteolin ameliorates rat myocardial ischaemia-reperfusion injury through activation of peroxiredoxin Ⅱ[J]. British Journal of Pharmacology, 2018, 175(16): 3315-3332. DOI:10.1111/bph.14367 |
| [4] |
KWON E Y, JUNG U J, PARK T, et al. Luteolin attenuates hepatic steatosis and insulin resistance through the interplay between the liver and adipose tissue in mice with diet-induced obesity[J]. Diabetes, 2015, 64(5): 1658-1669. DOI:10.2337/db14-0631 |
| [5] |
NABAVI S F, BRAIDY N, GORTZI O, et al. Luteolin as an anti-inflammatory and neuroprotective agent: a brief review[J]. Brain Research Bulletin, 2015, 119(Pt A): 1-11. |
| [6] |
孙力超, 陈旭, 姚尧, 等. 木犀草素对脓毒症小鼠急性肺损伤的保护作用[J]. 中华急诊医学杂志, 2019, 28(6): 717-723. SUN L C, CHEN X, YAO Y, et al. Protective effect of luteolin on acute lung injury in sepsis mice[J]. Chinese Journal of Emergency Medicine, 2019, 28(6): 717-723. DOI:10.3760/cma.j.issn.1671-0282.2019.06.012 |
| [7] |
LEE K, CHANG Y J, SONG K, et al. Associations between single nucleotide polymorphisms of high mobility group box 1 protein and clinical outcomes in Korean Sepsis patients[J]. Yonsei Medical Journal, 2016, 57(1): 111-117. DOI:10.3349/ymj.2016.57.1.111 |
| [8] |
LIMA G C, VASCONCELOS Y A G, DE SANTANA SOUZA M T, et al. Hepatoprotective effect of essential oils from Hyptis crenata in sepsis-induced liver dysfunction[J]. Journal of Medicinal Food, 2018, 21(7): 709-715. DOI:10.1089/jmf.2017.0125 |
| [9] |
戴丽, 端莉梅, 姚志清. 木犀草素对脂多糖诱导下小鼠急性肺损伤的保护作用及其机制研究[J]. 河北医药, 2015, 37(3): 339-342. DAI L, DUAN L M, YAO Z Q. Study on protective effects and its imechanism of luteolin on acute lung injury induced by lipopolysaccharide in mice[J]. Hebei Medical Journal, 2015, 37(3): 339-342. |
| [10] |
SHALMANI A A, GHAHREMANI M H, JEIVAD F, et al. Monomethyl fumarate alleviates sepsis-induced hepatic dysfunction by regulating TLR-4/NF-κB signalling pathway[J]. Life Sciences, 2018, 215: 152-158. DOI:10.1016/j.lfs.2018.11.010 |
| [11] |
叶菁菁. 甘草酸对脓毒症小鼠模型肾脏的保护作用[J]. 中国医学创新, 2017, 14(25): 16-19. YE J J. The protective effect of glycyrrhizin on the kidney of septic mice[J]. Medical Innovation of China, 2017, 14(25): 16-19. DOI:10.3969/j.issn.1674-4985.2017.25.004 |
| [12] |
徐革, 于洋, 杨曼, 等. 氢气对野生型及Nrf2基因敲除型脓毒症小鼠血脑屏障损伤和认知功能障碍的影响[J]. 中国中西医结合外科杂志, 2020, 26(3): 409-415. XU G, YU Y, YANG M, et al. Effects of hydrogen gas on blood-brain barrier damage and cognitive dysfunction in wild type and Nrf2-knock out mice with sepsis[J]. Chinese Journal of Surgery of Integrated Traditional and Western Medicine, 2020, 26(3): 409-415. DOI:10.3969/j.issn.1007-6948.2020.03.003 |
| [13] |
刘玲玲. 氢气对脓毒症小鼠脑损伤的保护作用及其相关机制[D]. 天津: 天津医科大学, 2015. LIU L L. The protective effects and mechanisms of hydrogen gas on brain injury in septic mice[D]. Tianjin: Tianjin Medical University, 2015. |
| [14] |
COHEN J, VINCENT J L, ADHIKARI N K, et al. Sepsis: a roadmap for future research[J]. The Lancet Infectious Diseases, 2015, 15(5): 581-614. DOI:10.1016/S1473-3099(15)70112-X |
| [15] |
CIBELLI M, FIDALGO A R, TERRANDO N, et al. Role of interleukin-1beta in postoperative cognitive dysfunction[J]. Annals of Neurology, 2010, 68(3): 360-368. DOI:10.1002/ana.22082 |
| [16] |
TERRANDO N, MONACO C, MA D Q, et al. Tumor necrosis factor-alpha triggers a cytokine cascade yielding postoperative cognitive decline[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(47): 20518-20522. DOI:10.1073/pnas.1014557107 |
| [17] |
余洁, 彭哲, 谢婷, 等. 木犀草素对哮喘患儿外周血单核细胞TNF-α和IL-6分泌的影响及机制研究[J]. 中国免疫学杂志, 2019, 35(13): 1580-1583, 1589. YU J, PENG Z, XIE T, et al. Effects of Luteolin on secretion of TNF-α and IL-6 in peripheral blood mononuclear cells of asthmatic children and its mechanism of action[J]. Chinese Journal of Immunology, 2019, 35(13): 1580-1583, 1589. DOI:10.3969/j.issn.1000-484X.2019.13.009 |
| [18] |
于明懂, 李佩, 于泳浩, 等. 吸入氢气对脓毒症小鼠海马组织DNA甲基化的影响[J]. 天津医药, 2020, 48(3): 177-181. YU M D, LI P, YU Y H, et al. Effects of inhaled hydrogen gas on the DNA methylation in hippocampus of septic mice[J]. Tianjin Medical Journal, 2020, 48(3): 177-181. |
| [19] |
曹佳, 杨华英, 何艺, 等. 姜黄素通过激活SIRT1调节脓毒症小鼠模型的认知功能障碍研究[J]. 陕西中医, 2020, 41(3): 301-307. CAO J, YANG H Y, HE Y, et al. Curcumin regulates cognitive dysfunction in sepsis mice by activating SIRT1[J]. Shaanxi Journal of Traditional Chinese Medicine, 2020, 41(3): 301-307. DOI:10.3969/j.issn.1000-7369.2020.03.009 |
| [20] |
BAVUNOGLU I, GENC H, KONUKOGLU D, et al. Oxidative stress parameters and inflammatory and immune mediators as markers of the severity of sepsis[J]. Journal of Infection in Developing Countries, 2016, 10(10): 1045-1052. DOI:10.3855/jidc.7585 |
| [21] |
李娜. 木犀草素对糖尿病脑梗死大鼠SOD、MDA及NO的影响[J]. 医学动物防制, 2015, 31(2): 148-151. LI N. Effects of luteolin on SOD, MDA and NO in diabetic cerebral infarction rats[J]. Journal of Medical Pest Control, 2015, 31(2): 148-151. |
| [22] |
SUNDEN-CULLBERG J, NORRBY-TEGLUND A, TREUTIGER C J. The role of high mobility group box-1 protein in severe sepsis[J]. Current Opinion in Infectious Diseases, 2006, 19(3): 231-236. DOI:10.1097/01.qco.0000224816.96986.67 |
| [23] |
LEE S A, KWAK M S, KIM S, et al. The role of high mobility group box 1 in innate immunity[J]. Yonsei Medical Journal, 2014, 55(5): 1165-1176. DOI:10.3349/ymj.2014.55.5.1165 |
 2022, Vol. 41
2022, Vol. 41