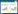文章信息
- 于瑞丽, 周雅婷, 张玥, 于英莉, 周昆
- YU Ruili, ZHOU Yating, ZHANG Yue, YU Yingli, ZHOU Kun
- 补骨脂素、异补骨脂素和补骨脂酚急性毒性的性别差异研究
- An acute toxicity study of psoralen, isopsoralen and bakuchiol in different gender
- 天津中医药大学学报, 2022, 41(3): 375-379
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(3): 375-379
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.03.20
-
文章历史
收稿日期: 2022-02-27
2. 天津市中药药理学重点实验室, 天津 301617
2. Tianjin Key Laboratory of Traditional Chinese Medicine and Pharmacology, Tianjin 301617, China
补骨脂是豆科植物补骨脂(Psoralea corylifolia L.)的干燥成熟果实,为临床常用中药,其味辛、苦、性温,具有补肾助阳、消风祛斑及温脾止泻等功效[1]。补骨脂被应用于许多中成药中,如二神丸、壮骨关节丸、仙灵骨葆等方中均含有补骨脂。然而如果补骨脂在临床中用药不当、过量或长期用药也会引起肝毒性[2]、光毒性[3]、肾毒性[4]等危害。性别差异是导致药物有效性、安全性出现个体差异的重要因素之一[5]。目前虽然有关于补骨脂毒性的研究报道,但对补骨脂毒性的性别差异研究还未见报道。因此,本研究对补骨脂的3种主要成分(补骨脂素、异补骨脂素、补骨脂酚)对雌雄小鼠的急性毒性作用进行比较,探讨其可能存在的性别差异。
1 材料 1.1 药物与仪器补骨脂素和异补骨脂素(纯度>98%,批号201502)购于天津市月牙湖科技有限公司,补骨脂酚(纯度>98%,批号2018041103)购于成都普菲德生物技术有限公司。JA1003电子分析天平购于上海恒平科技仪器有限公司,LT1000B电子天平购于常熟市天量仪器有限责任公司。
1.2 动物SPF级ICR小鼠,雌雄各半,4~6周龄,体质量18~20 g,购于北京华阜康生物科技有限公司,实验动物生产许可证号:SCXK(京)2014-0004。动物饲养于天津中医药大学动物实验中心,环境温度20~25 ℃,湿度40%~60%,自由摄食和饮水,光暗周期为12 h。实验前12 h禁食,自由饮水。
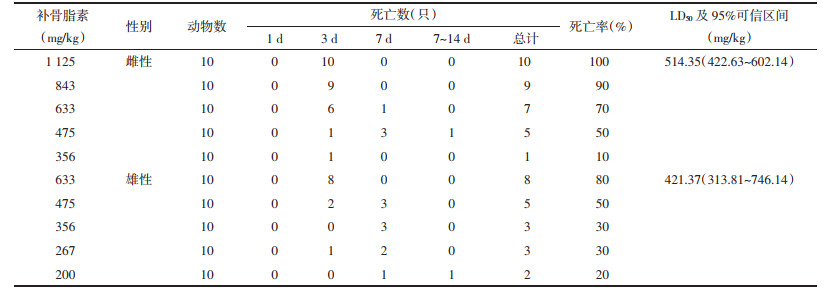
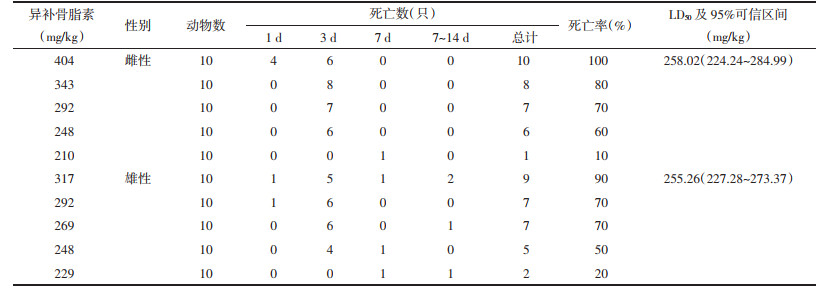
2 方法 2.1 急性毒性实验方法前期研究发现,补骨脂素剂量为633 mg/kg时死亡的雄性小鼠较多,并且预实验中雄性小鼠剂量为633 mg/kg时3只小鼠全部死亡[6]。最终,本研究中各受试药剂量设置为:补骨脂素组雌性组(1 125、843、633、475、356 mg/kg)、雄性组(633、475、356、267、200 mg/kg),异补骨脂素组雌性组(404、343、292、248、210 mg/kg)、雄性组(317、292、269、248、229 mg/kg),补骨脂酚组雌性组和雄性组(2 000、1 765、1 500、1 200、1 020 mg/kg)。280只ICR小鼠根据体质量随机分组,除补骨脂酚2 000、1 020 mg/kg剂量组为雌雄各5只,其他剂量组及对照组均为雌雄各10只。给药前,小鼠禁食不禁水12 h。对小鼠进行0.4 mL/10 g体积灌胃给药处理,一次性给药。连续观察给药后2周小鼠毒性反应和死亡情况,并于给药后的第1、3、7、14天测量存活小鼠体质量。
2.2 统计分析方法应用SPSS 11.5统计学软件,采用Probit回归法计算半数致死量(LD50)、最小中毒量(LD5)数值和95%可信区间,采用GraphPad Prism 5软件生成生存曲线。
3 结果 3.1 补骨脂素、异补骨脂素及补骨脂酚给药期间小鼠的行为和体质量变化对照组小鼠在给药后2周内均活动自如,无异常,无死亡;补骨脂素、异补骨脂素及补骨脂酚给药组小鼠偶有出现四肢强直、抽搐、口眼周有分泌物、心率减慢乃至死亡的现象。与对照组比较,补骨脂素组的雌性小鼠在给药3 d后,体质量均出现下降,并于给药14 d后体质量略有回升。雄性小鼠除了低剂量组外,体质量均呈上升趋势,低剂量组给药14 d后体质量下降。异补骨脂素组中,雌雄小鼠的体质量与对照组比较均降低,并于14 d后出现回升,其中雌性小鼠剂量为248 mg/kg组的体质量维持在较低水平且未见回升,而雄性各给药组小鼠体质量升高至正常水平。与对照组比较,补骨脂酚各给药剂量对雌雄小鼠体质量并无显著影响。见图 1。
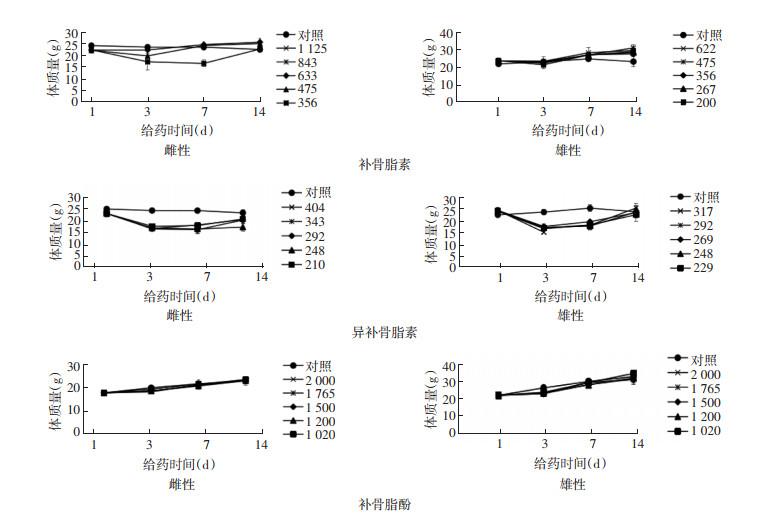
|
| 图 1 补骨脂素、异补骨脂素和补骨脂酚给药14 d小鼠体质量 |
补骨脂素对小鼠的急性毒性在雄性表现更明显,其中356 mg/kg时雌性小鼠的死亡率为10%,而雄性小鼠的死亡率达30%。补骨脂素雌性小鼠LD50为514.35 mg/kg,95%可信区间为422.63~602.14 mg/kg;雄性小鼠LD50为421.37 mg/kg,95%可信区间为313.81~746.14 mg/kg。见表 1。
异补骨脂素对雌雄小鼠的急性毒性并无明显性别差异,异补骨脂素雌性小鼠LD50为258.02 mg/kg,95%可信区间为224.24~284.99 mg/kg;雄性小鼠LD50为255.26 mg/kg,95%可信区间为227.28~273.37 mg/kg。见表 2。
补骨脂酚对雌性和雄性小鼠急性毒性也有较大差异,在2 000 mg/kg剂量下死亡率分别为40%、100%。补骨脂酚雌性小鼠LD50大于2 000 mg/kg,雄性小鼠LD50为1 679.40 mg/kg,95%可信区间为1 480.00~2 189.29 mg/kg。见表 3。
以对数剂量为横坐标,给药后小鼠响应概率为纵坐标,分别作出补骨脂素、异补骨脂素以及补骨脂酚的Probit回归曲线。其中补骨脂素雌性小鼠的曲线方程为Y=-17.9+2.86X,R2=0.967,雄性小鼠的曲线方程为Y=-8.14+1.35X,R2=0.866;异补骨脂素组中雌性小鼠的曲线方程为Y=-22.7+4.07X,R2=0.834,雄性小鼠的曲线方程Y=-32.47+5.86X,R2=0.924;补骨脂酚组雌性小鼠的曲线方程为Y=-16.86+2.2X,R2=0.942,雄性小鼠的曲线方程为Y=-11.61+1.52X,R2=0.998。根据公式可外推出,补骨脂素的雌性小鼠LD5为294.02 mg/kg,95%可信区间为157.44~373.55 mg/kg,而雄性小鼠LD5仅为124.04 mg/kg,95%可信区间为9.25~203.4 mg/kg。但由于置信区间较宽,两者之间差异并无统计学意义,从补骨脂酚2 000 mg/kg剂量时雌雄小鼠的生存曲线也可以看出雌雄小鼠的毒性反应存在一定差异。见图 2。
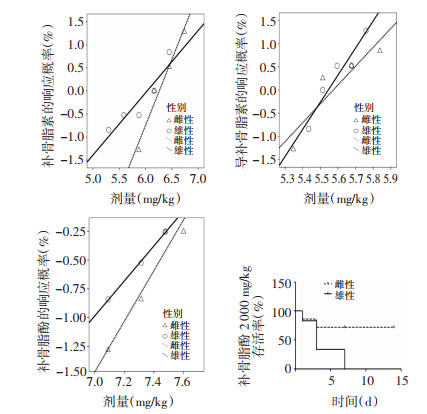
|
| 图 2 补骨脂素、异补骨脂素和补骨脂酚的Probit回归曲线及补骨脂酚的生存曲线 |
在实验中对补骨脂素、异补骨脂素和补骨脂酚的给药毒性进行分析,发现雌雄小鼠的毒性表现极为相似,提示不同性别动物对药物的毒性反应机制可能无明显差别。另外,无论雌性还是雄性小鼠,异补骨脂素的急性毒性都明显强于补骨脂素和补骨脂酚,LD50和LD5远低于后两者。
从3条Probit回归曲线可发现,受试药在不同性别动物的曲线斜率不同。补骨脂素和异补骨脂素,高剂量组和低剂量组具有相反的性别差异,补骨脂素在低剂量时,雌性的耐受性强于雄性,而高剂量时雄性的耐受性相比于雌性略强;异补骨脂素在低剂量时,雄性的耐受性略强于雌性,而高剂量时雌性的耐受性强于雄性;补骨脂酚在高、中、低剂量中都表现为雌性的耐受性强于雄性。根据Probit回归曲线可以计算补骨脂素给药的LD5,并作为其最小致死量进行比较,结果发现,尽管补骨脂素的雌性小鼠LD50值仅高出雄性小鼠22%,但由于毒性-剂量曲线斜率差异较大,根据公式可推算雌性小鼠LD5为294.02 mg/kg,而雄性小鼠LD5仅为124.04 mg/kg,补骨脂素雌性小鼠LD5值高出雄性小鼠137%。尽管这种根据回归曲线推算的方式不够准确,但其结果也有一定的提示作用,该计算结果表明,雌雄动物口服补骨脂素出现毒性的最小剂量差异较大,在临床使用中应予以充分注意。
随着临床医学进入精准医疗时代,性别差异在药物研究中越来越被关注。研究表明激素水平可以影响生理状态,从而导致药物在吸收、蛋白结合率、分布容积及代谢方面出现女性与男性不同的情况[5]。雌激素与各种酶或受体的相互作用还可能减弱或增强配伍药物的作用,甚至是毒副作用[7]。肝药酶在药物代谢过程中发挥重要作用,而有研究发现,妇女在肝脏中有更多的肝药酶[8]。因此合理判断性别差异对药物疗效、安全性的影响是至关重要的。补骨脂素、异补脂素和补骨脂酚是补骨脂药材的重要活性成分[9],这3个成分在补骨脂的药效和毒性中有重要作用。本实验比较补骨脂素、异补骨脂素以及补骨脂酚急性毒性的性别差异发现,补骨脂素在较低剂量下的毒性存在较为明显的性别差异,而补骨脂酚大剂量时也表现出一定性别差异。本研究仅研究了补骨脂急性毒性时期的性别差异,尚需进一步研究和探讨其长期用药毒性的性别差异,才可能更好地为临床上不同性别人群合理选择药物剂量、减少药物不良反应提供研究基础,为提高用药水平提供实验依据。
5 结论补骨脂素对雌性小鼠的LD5值高出雄性小鼠137%,尽管差异并无统计学意义,但仍提示补骨脂素在雄性的最小毒性剂量低于雌性,其毒性具有潜在的性别差异可能。
| [1] |
刘自力, 施静. 补骨脂临床研究进展[J]. 中国民族民间医药, 2009, 18(5): 101-102. LIU Z L, SHI J. Clinical research progress in psoralin[J]. Chinese Journal of Ethnomedicine and Ethnopharmacy, 2009, 18(5): 101-102. |
| [2] |
宋蕾, 毕亚男, 袁晓美, 等. 异补骨脂素腹腔注射9 d所致的C57小鼠肝损害[J]. 毒理学杂志, 2018, 32(1): 21-24. SONG L, BI Y N, YUAN X M, et al. Study on the influence of isopsoralen on C57 mice liver injury after intraperitoneal injection for 9 days[J]. Journal of Toxicology, 2018, 32(1): 21-24. |
| [3] |
姚凤玲, 陈洪, 马铁牛, 等. 补骨脂引起急性光毒性接触性皮炎12例报告(附光斑贴试验)[J]. 中国皮肤性病学杂志, 2000, 14(6): 410-411. YAO F L, CHEN H, MA T N, et al. Report of 12 cases of acute phototoxic contact dermatitis caused by psoralin (attached patch test)[J]. The Chinese Journal of Dermatovenereology, 2000, 14(6): 410-411. DOI:10.3969/j.issn.1001-7089.2000.06.030 |
| [4] |
张玉顺, 刘玉琦, 吴子伦, 等. 补骨脂酚对小鼠肾脏毒害作用的研究[J]. 中药通报, 1981, 6(3): 30-32. ZHANG Y S, LIU Y Q, WU Z L, et al. Study on the toxic effects of psoralol in mouse kidney[J]. Traditional Chinese medicine bulletin, 1981, 6(3): 30-32. |
| [5] |
魏敏吉, 赵德恒, 王水强, 等. 新药临床开发过程中性别差异影响的考虑和研究策略[J]. 中国新药杂志, 2017, 26(3): 309-313. WEI M J, ZHAO D H, WANG S Q, et al. Considerations and research strategies on the assessment of gender difference in the clinical development of new drugs[J]. Chinese Journal of New Drugs, 2017, 26(3): 309-313. |
| [6] |
白茹玉, 张盼阳, 毕亚男, 等. 补骨脂素和异补骨脂素的急性毒性和相互作用[J]. 药物评价研究, 2018, 41(6): 1068-1072. BAI R Y, ZHANG P Y, BI Y N, et al. Acute toxicity and drug interaction of psoralen and isopsoralen[J]. Drug Evaluation Research, 2018, 41(6): 1068-1072. |
| [7] |
PARKINSON A, MUDRA D R, JOHNSON C, et al. The effects of gender, age, ethnicity, and liver cirrhosis on cytochrome P450 enzyme activity in human liver microsomes and inducibility in cultured human hepatocytes[J]. Toxicology and Applied Pharmacology, 2004, 199(3): 193-209. DOI:10.1016/j.taap.2004.01.010 |
| [8] |
石宁江, 熊方武. 性别对药代动力学和药效学的影响[J]. 国外医学, 1999, 26(5): 296-299. SHI N J, XIONG F W. Effect of sex on pharmacokinetic and pharmacodynamics[J]. Foreign Medical Sciences Section, 1999, 26(5): 296-299. |
| [9] |
李建梅, 周凡, 希尔艾力·吐尔逊, 等. 反相高效液相色谱法在补骨脂提取物3种主要成分含量测定中的应用[J]. 中国医药导报, 2017, 14(27): 12-15. LI J M, ZHOU F, TURSUN X. Application of RP-HPLC in determination of the three main kinds of components in the extract of Psoralea corylifolia[J]. China Medical Herald, 2017, 14(27): 12-15. |
 2022, Vol. 41
2022, Vol. 41