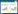文章信息
- 蒋宇航, 苗家燕, 刘雨涵, 韩晨, 罗赣, 高晓燕
- JIANG Yuhang, MIAO Jiayan, LIU Yuhan, HAN Chen, LUO Gan, GAO Xiaoyan
- 经典名方当归四逆汤物质基准的关键质量属性传递规律分析
- Analysis on transfer law of critical quality attributes of Danggui Sini Decoction material benchmarks
- 天津中医药大学学报, 2022, 41(3): 380-389
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(3): 380-389
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.03.21
-
文章历史
收稿日期: 2022-03-02
《古代经典名方中药复方制剂物质基准的申报资料要求(征求意见稿)》[1]明确提出,在整个经典名方研究过程中,应以浸出物、含量测定、指纹图谱等指标,全面考察药材-饮片-中间体-对应实物的相关性,关注对应实物制备过程中关键质量属性(CQAs)的量质传递。《人用药物注册技术要求国际协调委员会药物研发指导原则》(ICHQ8)[2]中提出,药品CQAs是在适当的限度、范围或分布之内的物理、化学、生物或微生物性质或特征,用以确保所需的产品质量。从药材-饮片-传统汤剂-物质基准-复方制剂,CQAs贯穿于经典名方研究的整个过程。为此,进行CQAs传递规律研究,有助于从可量化、可传递、可追溯3个角度来构建从药材到饮片、物质基准、制剂全过程的质量控制体系。
经典名方历经数千年临床检验,是中医药宝库的精华。为了推动经典名方的开发研究,国家药品监督管理局发布《古代经典名方目录(第一批)》[3],当归四逆汤(DSD)被收录其中。DSD出自张仲景的《伤寒论·辨厥阴病脉证并治》[4],原文:“手足厥寒,脉细微欲绝者,当归四逆汤主之。”全方由当归、桂枝(去皮)、白芍、细辛、通草、炙甘草、大枣7味药物组成,治疗血虚寒厥证症见阳虚欲脱、四肢厥逆、冷汗自出和脉微欲绝[5-7]。现代临床将DSD加减化裁后用于治疗雷诺氏病[8]、痛经[9-10]、关节炎[11]、冠状动脉粥样硬化性心脏病[12]和糖尿病伴随周围神经病变[13]等疾病,可见DSD具有广泛的临床应用基础,开发价值极大。本研究制备15批药材、饮片、水煎液和对应的DSD物质基准对应实物,进行CQAs传递规律研究,以构建DSD全过程质量控制体系,为经典名方DSD复方制剂后续开发研究提供科学理论依据。
1 材料 1.1 仪器Waters 2695高效液相色谱仪,购自美国Waters公司;XP-6型精密天平,购自梅特勒-托利多仪器(上海)有限公司;KQ5200DA超声波清洗器,购自昆山市超声仪器有限公司;Milli-Q超纯水系统,购自美国Millipore公司;Sorvall ST 8R高速冷冻离心机,购自赛默飞世尔科技有限公司;LC-E013S电陶炉,购自广东顺德忠臣电器有限公司;SHB-Ⅲ循环水式多用真空泵,购自郑州长城科工贸有限公司;FD-2A型真空冷冻干燥机,购自北京博医康实验仪器有限公司。
1.2 试药与试剂对照品芍药苷(批号DST191024-070)、藁本内酯(批号DST200610-007)、细辛脂素(批号DST190528-014)、甘草酸铵(批号DST190702-008)、肉桂酸(批号DST200614-045)购自成都德思特生物技术有限公司;对照品桂皮醛(批号110710-201418)购于中国食品药品检定研究院,上述对照品纯度均>98%。色谱纯乙腈,购自赛默飞世尔科技有限公司;分析纯甲醇、磷酸,购自国药集团化学试剂有限公司;水为实验室自制超纯水。
DSD中各药材产地信息见开放科学(资源服务)标识码(OSID),经前期研究确定各药材的炮制方法,由北京康仁堂药业有限公司提供各批次药材和饮片。方中各味药材经北京中医药大学杨瑶珺教授鉴定分别为伞形科植物当归[Angelica sinensis(Oliv.)Diels]的干燥根、樟科植物肉桂(Cinnamomumcassia Presl)的干燥嫩枝、毛茛科植物芍药(Paeonia lactiflora Pall)的干燥根、马兜铃科植物北细辛[Asarum heterotropoidesFr.Schmidtvar.mandshuricum(Maxim.)Kitag]的干燥根和根茎、木通科植物三叶木通[Akebia trifoliata(Thunb.)Koidz]的干燥藤茎、豆科植物甘草(Glycyrrhiza uralensis Fisch)的干燥根和根茎、鼠李科植物枣(Ziziphus jujuba Mill)的干燥成熟果实。
2 方法与结果经典名方物质基准CQAs包括特征图谱、指标性成分含量和干膏率,针对以上3个方面,本研究探索了CQAs在DSD物质基准制备过程中药材-饮片-水煎液-物质基准的传递规律。
2.1 15批DSD物质基准各药味饮片批次随机组合方法采用随机数字表法对各药味饮片批次进行随机组合及排序,15批DSD物质基准的药材混批结果见OSID。
2.2 样品制备 2.2.1 DSD物质基准对应实物制备称取15批DSD处方量的当归、白芍、桂枝、细辛、木通、炙甘草、大枣(破开去核)各饮片,置于3 L陶瓷锅内,加1 600 mL去离子水,置电陶炉上武火(8档)加热至煮沸后转文火(5档)煎煮60 min,趁热滤过,放冷,定容至500 mL,取上述水煎液适量于4 ℃、11 410×g条件下离心20 min,精密移取100 mL上清液,-20 ℃预冻后冷冻干燥72 h即得DSD物质基准对应实物。
2.2.2 DSD物质基准供试品溶液制备供试品溶液1:取DSD冻干粉0.45 g,精密称定后置于5 mL容量瓶中,加入1倍量的30%甲醇,超声10 min完全溶解后定容,混匀,取适量于1.5 mL离心管中,16 060×g、4 ℃离心20 min,取上清液用于芍药苷、甘草酸、桂皮醛、藁本内酯和肉桂酸的含量测定以及特征图谱研究。
供试品溶液2:取冻干粉0.90 g,精密称定,去离子水溶解后超声10 min,定容至10 mL容量瓶,混匀后倒入50 mL分液漏斗中,以等量乙酸乙酯萃取2次,合并2次萃取后的乙酸乙酯层溶液,80 ℃水浴挥干溶剂,甲醇定容至2 mL,取适量在16 060×g、4 ℃条件下离心20 min,后取上清液用于细辛脂素的含量测定。
2.2.3 单味药样品及阴性样品溶液制备分别称取处方量的各饮片,按“2.2.1”项方法,分别制备各单味药样品溶液和缺各单味药的阴性样品溶液,用于特征图谱研究。
2.3 DSD物质基准制备过程中指标成分含量传递规律研究 2.3.1 DSD处方中药材、饮片、水煎液和物质基准中各指标成分的含量测定方法DSD水煎液和物质基准中各指标成分含量测定的方法前期已完成[14]。
DSD处方中药材、饮片中芍药苷、细辛脂素、甘草酸铵、桂皮醛的含量测定方法依据《中华人民共和国药典》(2020年版)[15],但未规定当归中指标性成分藁本内酯和桂枝中指标性成分肉桂酸的含量测定方法,故本研究在此建立如下方法。
2.3.1.1 当归药材及饮片中藁本内酯含量测定方法供试品溶液制备:分别取15批当归药材和饮片粉末(过3号筛)1.0 g,精密称定,置50 mL具塞锥形瓶中,精密加入100%甲醇20 mL,密塞,称定总质量,超声40 min,放冷,再次称定质量,100%甲醇补质量,摇匀,取适量在4 ℃下、16 060×g条件下离心20 min,取上清液用于藁本内酯的含量测定。
色谱条件:Phenomenex Luna® C18色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈(A)-水(B),梯度洗脱:0~5 min,50%A;5~17 min,50%~100%A;17~20 min,100%A。柱温30 ℃,体积流量1 mL/min,检测波长290 nm,进样量5 μL。此色谱条件用于藁本内酯含量测定。
2.3.1.2 桂枝药材及饮片中肉桂酸含量测定方法供试品溶液制备:分别取15批桂枝药材粉末(过4号筛)0.5 g,精密称定,置50 mL具塞锥形瓶中,精密加入70%甲醇25 mL,称定总质量,超声30 min,放冷,再次称定质量,用100%甲醇补质量,摇匀,0.45 μm微孔滤膜滤过,精密量取续滤液1 mL,100%甲醇定容至25 mL容量瓶,摇匀后取上清液用于桂皮醛的含量测定。
色谱条件:ThermoSyncronis C18色谱柱(4.6 mm× 250 mm,5 μm),流动相为乙腈(A)-0.1%磷酸溶液(B),梯度洗脱:0~10 min,20~29%A;10~30 min,29%A;30~32 min,29%~32%A;32~40 min,32%A;柱温25 ℃,检测波长275 nm,体积流量1 mL/min,进样量10 μL。此色谱条件用于肉桂酸含量测定。
2.3.2 方法学考察因当归中的藁本内酯和桂枝中的肉桂酸为新增定量成分,《中华人民共和国药典》(2020年版)未规定其检测方法,故优化前处理方法后进行方法学考察。
2.3.2.1 线性关系考察取藁本内酯、肉桂酸对照品适量,精密称定,分别加纯甲醇定容至5 mL,得到4.90 mg/mL藁本内酯和0.49 mg/mL肉桂酸母液,稀释系列浓度梯度进样后以对照品溶液浓度作为横坐标(X),以不同浓度对照品进样所得峰面积为纵坐标(Y)绘制标准曲线,得到各指标成分线性回归方程为:藁本内酯,Y=8 024.7X+163 583(r=0.999 9);肉桂酸Y=1.348X+6.247 3(r=0.999 5),结果表明,两个成分依次在153.190~2 451.000、0.984~492.000 μg/mL范围内线性关系良好。
2.3.2.2 精密度实验分别取当归和桂枝药材,按“2.3.1”项方法制备用于藁本内酯和肉桂酸含量测定的供试品溶液,并按照对应成分的色谱条件连续进样6次。结果显示藁本内酯和肉桂酸峰面积RSD均小于0.41%,表明仪器精密度良好。
2.3.2.3 稳定性实验分别取当归和桂枝药材,按“2.3.1”项方法制备用于藁本内酯和肉桂酸含量测定的供试品溶液,并按照对应成分的色谱条件进样,分别于样品制备后0、2、4、8、12、24 h进样检测。结果显示藁本内酯和肉桂酸峰面积RSD均小于1.14%,表明供试品溶液在48 h内稳定性良好。
2.3.2.4 重复性实验分别取同一批次当归和桂枝药材6份,按“2.3.1”项方法制备用于藁本内酯和肉桂酸含量测定的供试品溶液,并按照对应成分的色谱条件进样。结果显示藁本内酯和肉桂酸含量的RSD均小于2.12%,表明该方法重复性良好。
2.3.2.5 加样回收率实验按《中华人民共和国药典》(2020年版)规定,分别以指标成分含量的50%、100%、150%加入藁本内酯和肉桂酸对照品各3份,按“2.3.1”项方法制备供试品溶液,上述各供试品溶液按照对应成分的色谱条件进样。结果显示藁本内酯和肉桂酸的平均加样回收率分别为97.54%、96.41%,RSD分别为3.98%、2.75%,表明该方法准确可靠。
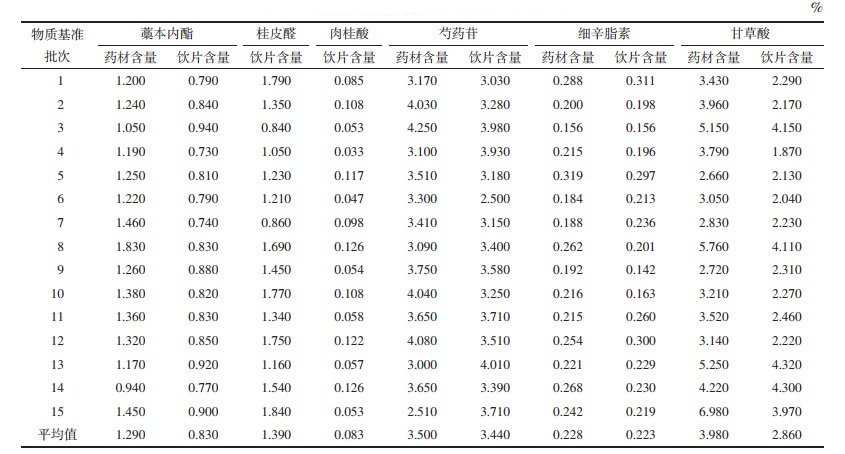
2.3.3 DSD处方药味各指标成分在药材、饮片、水煎液和物质基准中的含量测定结果以随行对照品溶液为对照,测定15批DSD中6个指标成分的含量,结果见表 1和表 2。
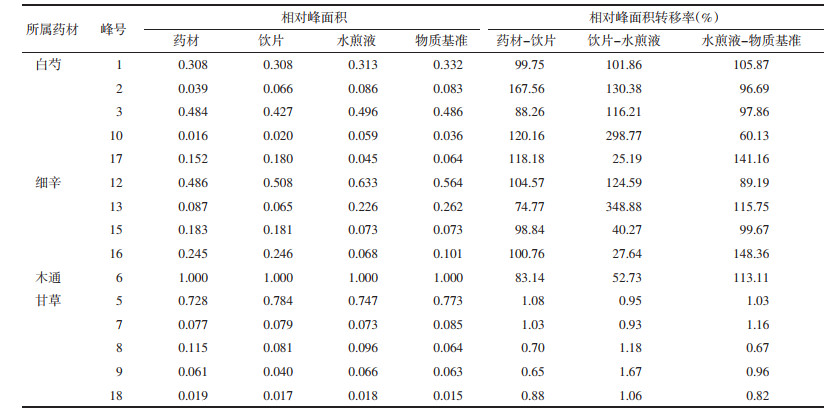
计算药材-饮片-水煎液-物质基准中指标成分含量的转移率,考察其传递规律,结果见表 3和图 1。转移率=(w×m×5)/(W×M)×100%(w:取100 mL水煎液冻干所得DSD物质基准中有效成分的质量分数;m:DSD物质基准的质量;W:饮片中有效成分的质量分数;M:处方中饮片的质量)。
|
| 图 1 15批物质基准中指标性成分平均转移率(x±s) |
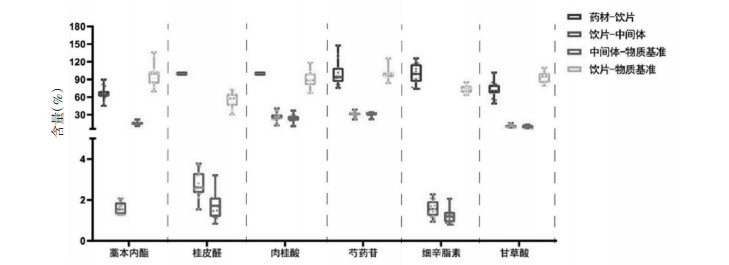
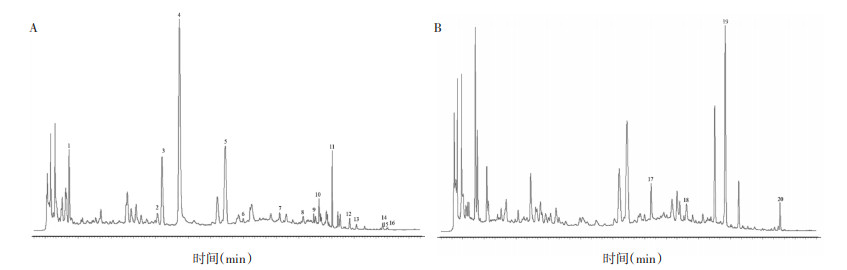
本研究前期已建立了DSD物质基准特征图谱[14]。色谱条件:Phenomenex Luna®C18色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈(A)-0.05%磷酸水溶液(B),洗脱条件:0~8 min,5%~10%A;8~15 min,10%~13%A;15~24 min,13%~15%A;24~30 min,15%~17%A;30~34 min,17%~20%A;34~45 min,20%~30%A;45~50 min,30%~45%A;50~65 min,45%~80%A;65~67 min,80%~95%A;67~70 min,95%A。柱温30 ℃,体积流量1 mL/min,检测波长230 nm和290 nm,进样量10 μL。特征图谱见图 2。
|
| 注:A.230 nm;B.290 nm;4.芍药苷;5.甘草苷;11.甘草酸铵;14.细辛脂素;19.桂皮醛;20.藁本内酯。 图 2 DSD物质基准特征图谱 |
对DSD物质基准特征图谱进行特征峰归属分析,共归属20个特征峰。峰1、2、3、4、10、17归属白芍,峰12、13、14、15、16归属细辛,峰6归属木通,峰5、7、8、9、11、18归属甘草,峰19归属桂枝,峰20归属当归。经与对照品比对共指认6个特征成分,分别是4号峰芍药苷、5号峰甘草苷、11号峰甘草酸铵、14号峰细辛脂素、19号峰桂皮醛、20号峰藁本内酯。大枣在此条件下没有色谱信息,后续将进行进一步研究。
2.4.2 精密度考察精密度:取同一供试品溶液,按“2.4.1”项色谱条件,连续进样6次。以芍药苷(230 nm)和桂皮醛(290 nm)为参照峰,各特征峰相对保留时间和相对峰面积的RSD均小于3.0%,表明仪器精密度良好。
2.4.3 重复性考察重复性:平行制备同一批冻干粉(S3)供试品溶液6份,按“2.4.1”项色谱条件进样。以芍药苷(230 nm)和桂皮醛(290 nm)为参照峰,各特征峰相对保留时间和相对峰面积的RSD均小于3.0%,表明方法重复性良好。
2.4.4 稳定性考察取同一供试品溶液,按“2.4.1”项色谱条件,分别于制样后0、2、4、8、12、24 h进样。以芍药苷(230 nm)和桂皮醛(290 nm)为参照峰,各特征峰在24 h内相对保留时间和相对峰面积的RSD均小于3.0%,表明供试品溶液在24 h内稳定性良好。
2.4.5 DSD物质基准特征图谱的测定按“2.2.2”项方法制备供试品溶液,按“2.4.1”项色谱条件进行测定。将15批物质基准样品特征图谱导入《中药色谱指纹图谱相似度评价系统》(2012年版),以S1为参照图谱,时间窗宽度为0.1,采用中位数法,进行全谱峰匹配,计算相似度。
15批DSD物质基准特征图谱叠加图见OSID。直观分析15批基准样品特征图谱,批次间色谱峰的数量及响应值差异较小;15批物质基准特征图谱与对照图谱R的相似度均大于0.90。
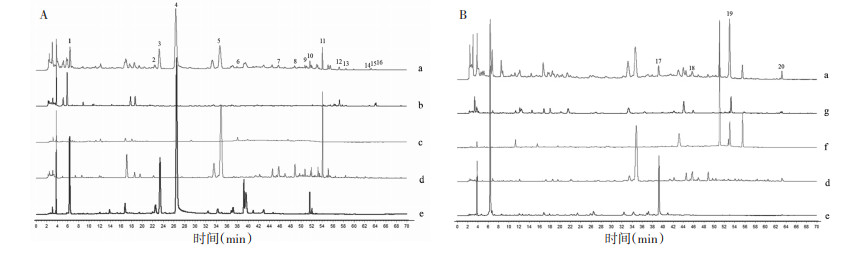
2.5 DSD特征图谱物质群量质传递规律研究 2.5.1 特征峰个数的传递规律研究分别将15批当归药材、桂枝药材、白芍药材、细辛药材、木通药材、甘草药材、大枣药材、DSD基准样品的特征图谱拟合出1张对照图谱,通过将单味药材的对照图谱与基准样品的对照图谱进行比对,发现单味药的特征峰均可传递到全方基准样品的对照谱图中,见图 3。白芍传递了6个特征峰,细辛传递了5个特征峰,木通传递了1个特征峰,甘草传递了6个特征峰,桂枝传递了1个特征峰,当归传递了1个特征峰,大枣在此条件下没有色谱信息。表明从药材到物质基准特征图谱的传递在特征峰个数方面是稳定的。
|
| 注:A.230 nm;B.290 nm;a.DSD物质基准;b.细辛;c.木通;d.甘草;e.白芍;f.桂枝;g.当归。 图 3 DSD物质基准和药材特征图谱中20个特征峰及其归属 |
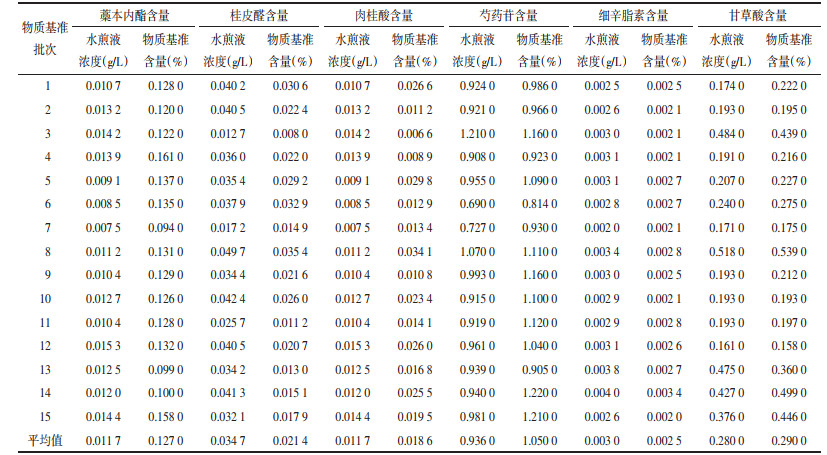
利用1~20号特征峰在单味药材、饮片、水煎液和基准样品特征图谱中的保留时间,按公式计算特征峰在药材-饮片-水煎液-物质基准特征图谱传递中保留时间的相对偏移量,结果见表 4。由结果可知,保留时间靠后的特征峰,其相对偏移量较小,最大偏移量为0.008,在药材-饮片-水煎液-物质基准特征图谱传递中,20个特征峰的保留时间相对偏移量平均值较小,表明特征图谱的传递在特征峰的保留时间方面是稳定的。以药材(Tb)、饮片(Ta)为例,保留时间的相对偏移量=|Ta-Tb|/Tb。
对15批DSD处方中的药材、饮片、水煎液和物质基准中各特征峰进行测定,以每个特征峰峰面积与该峰所属药味特征峰的总面积(指标性成分除外)的比值作为每个特征峰的相对峰面积。计算各药味中特征峰的相对峰面积在药材-饮片-水煎液-物质基准的传递过程中的转移率,结果见表 5。由结果可知,特征峰相对峰面积的传递率大部分在平均值±30%波动,表明特征图谱能够在药材-饮片-水煎液-物质基准过程中稳定传递。其中,20个特征峰中4(芍药苷)、11(甘草酸铵)、14(细辛脂素)、19(桂皮醛)、20(藁本内酯)号峰为指标性成分,已对其单独进行了含量的转移率研究。
按“2.2”项方法制备15批物质基准样品,测定其干膏率,了解饮片-物质基准传递过程中干膏率的变化规律,根据各饮片投药量在全方投药量的占比以及各饮片的干膏率计算全方中各单味药折算加和后的理论干膏率。理论干膏率(%)=∑单味药干膏率×单味药生药量/全方生药量×100%。对比理论干膏率与实际干膏率,计算传递率:传递率(%)=实际干膏率/理论干膏率×100%。
15批DSD物质基准实际干膏率为13.37%~16.64%,且各批次干膏率未出现平均值±30%范围之外的离散值。物质基准的实际干膏率均低于理论干膏率,可能是各成分间的相互作用导致的,传递率平均值为55.16%,RSD为6.1%,表明各批次物质基准干膏率传递稳定。见表 6、图 4。
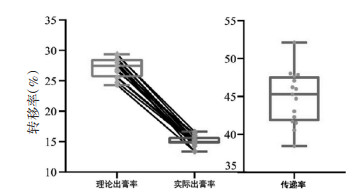
|
| 图 4 DSD物质基准干膏率传递规律分析(x±s) |
经典名方物质基准作为后续复方制剂生产及质量控制的参照,在研究过程中具有核心地位[16],因此对DSD从药材到物质基准的量质传递过程进行分析,明确其质量控制指标及范围具有重要意义。本研究以指标性成分含量、特征图谱和干膏率3个方面作为CQAs[17],考察其在不同工艺单元中的传递,从点到面地阐明经典名方CQAs从药材、饮片炮制到水煎煮再到浓缩冻干的长流程制备过程中的传递规律,以实现对DSD物质基准质量控制,为构建全过程质量控制体系提供数据支撑,为其复方制剂的开发提供科学依据。
3.1 指标性成分含量传递规律分析在DSD指标性成分传递规律研究中,发现各成分在“饮片-水煎液”过程中转移率较低,可能是由于提取方法不同所致,药材饮片采用《中华人民共和国药典》方法,多为醇超声提取,而水煎液和物质基准为水煎提取,由于温度过高、提取溶剂为水,易造成挥发性成分损失、醇溶性成分提取不完全。芍药苷含量在药材、饮片、水煎液和物质基准之间的转移率稳定,药材-饮片有2个批次的转移率高于平均值的130%,可能是药材取样随机性较差,导致药材中的含量低于饮片中含量。第5、11、14批桂皮醛在“水煎液-物质基准”传递率波动较大,可能是桂皮醛本身稳定性差,煎煮工艺参数的微小波动导致水煎液中桂皮醛含量发生了变化。本实验中甘草指标性成分甘草酸在DSD水煎液和物质基准中含量波动较大,而对比“水煎液-物质基准”转移率均在平均值±30%,调查文献发现[18],甘草因产地、生长时间、采收时间、取样部位不同都会导致成分含量的较大差异,例如根木质部的甘草酸含量普遍低于根皮部。因此考虑甘草较为复杂,不同部位成分差异大,建议在今后进行含有甘草方剂物质基准的制备时将甘草混批投料,并严格将饮片按部位及大小分等,以确保物质基准质量的稳定。藁本内酯在“药材-饮片”过程中含量降低,平均转移率为65.76%,可能与饮片的炮制工艺和饮片贮存有关,与已有文献的研究结果一致[19],当归饮片中藁本内酯含量与同批次药材相比显著降低,而新鲜切制的当归饮片中藁本内酯的含量与药材相比变化并不明显。通过以上分析可以得出,取样的随机性、原料药质量的均一性以及对制备工艺参数的严格控制均是保证指标性成分稳定传递的基础和保障。
3.2 物质基准特征图谱传递规律分析对于无法进行含量测定的特征峰,以相对峰面积转移率为考察指标,进行了其在药材-饮片-水煎液-物质基准中特征图谱传递规律的研究。结果显示从药材到饮片一些特征峰的相对峰面积转移率较大,推测为净制去除了非药用部位。从饮片到水煎液,9、10和13号特征峰峰面积转移率较大,同时注意到归属到各自药材的15、16、17号特征峰转移率较低,可能是因复方中多成分间的相互作用促进成分在水煎液中溶出或转移;水煎液-物质基准之间各特征峰相对峰面积的转移率变化浮动较小,说明冻干工艺对复方中各成分影响微小。
4 结论本实验制备了15批次DSD冻干粉作为物质基准,从特征图谱物质群量质传递、指标性成分含量转移率和干膏率转移率3个方面对DSD物质基准进行CQAs传递规律研究。结果表明,DSD物质基准的特征图谱、指标性成分含量和干膏率可在药材-饮片-水煎液-物质基准中稳定传递。本研究初步构建了DSD全过程质量控制体系,为DSD全过程质量控制提供数据支撑,为其复方制剂的开发提供科学依据。
| [1] |
国家药品监督管理局. 国家药监局综合司公开征求古代经典名方中药复方制剂及其物质基准申报资料要求(征求意见)意见[EB/OL]. (2021-03-27)[2022-01-09]. https://www.nmpa.gov.cn/xxgk/zhqyj/zhqyjyp/20190327150101694.html. National Medical Products Administration(NMPA). The Comprehensive Department of SFDA publicly solicits opinions on the application data requirements of ancient classical Chinese herbal compound preparations and their material reference[EB/OL]. (2021-03-27)[2022-01-09]. https://www.nmpa.gov.cn/xxgk/zhqyj/zhqyjyp/20190327150101694.html. |
| [2] |
ICH. Pharmaceutical Development[EB/OL]. (2009-08-01)[2022-01-09]. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/q8r2-pharmaceutical-development.
|
| [3] |
国家中医药管理局. 国家中医药管理局关于发布《古代经典名方目录(第一批)》的通知[EB/OL]. (2018-04-16)[2022-01-09]. http://kjs.satcm.gov.cn/zhengcewenjian/2018-04-16/7107.html. National Administration of Traditional Chinese Medicine. Circular of the national administration of traditional Chinese medicine on issuing catalogue of ancient classic famous prescriptions (the first batch)[EB/OL]. (2018-04-16)[2022-01-09]. http://kjs.satcm.gov.cn/zhengcewenjian/2018-04-16/7107.html. |
| [4] |
张仲景, 柳长华. 伤寒论(明赵开美本)[M]. 北京: 科学技术出版社, 2016: 46-47. ZHANG Z J, LIU C H. Treatise on febrile diseases (Ming: ZHAO Kaimei edtion)[M]. Beijing: Science and Technology Press, 2016: 46-47. |
| [5] |
管天护, 谷松. 论当归四逆汤证[J]. 辽宁中医药大学学报, 2021, 23(4): 145-148. GUAN T H, GU S. Brief analysis of syndrome of Danggui Sini Decoction[J]. Journal of Liaoning University of Traditional Chinese Medicine, 2021, 23(4): 145-148. |
| [6] |
黄克冬. 研究当归四逆汤的现代药理及疗效[J]. 中西医结合心血管病电子杂志, 2014, 2(18): 4, 6. HUANG K D. Modern pharmacology and efficacy of Danggui Sini Decoction[J]. Cardiovascular Disease Journal of Integrated Traditional Chinese and Western Medicine, 2014, 2(18): 4, 6. |
| [7] |
彭霞. 当归四逆汤方证研究[D]. 广州: 暨南大学, 2013. PENG X. The research on prescription and syndrome of Danggui Sini Decoction[D]. Guangzhou: Jinan University, 2013. |
| [8] |
关新亚, 周小垒. 浅谈当归四逆汤加味治疗雷诺氏病[J]. 中国卫生产业, 2012, 9(17): 161-162. GUAN X Y, ZHOU X L. A brief discussion of modified Danggui Sini Decoction on treating Raynaud's Disease[J]. China Health Industry, 2012, 9(17): 161-162. |
| [9] |
卻丹华, 陈王焕, 姜飞鹏, 等. 基于网络药理学和分子对接研究当归四逆汤治疗原发性痛经的机制[J]. 中国中药杂志, 2021, 46(4): 855-864. QUE D H, CHEN W H, JIANG F P, et al. Mechanism of Danggui Sini Decoction in treatment of primary dysmenorrhea based on network pharmacology and molecular docking[J]. China Journal of Chinese Materia Medica, 2021, 46(4): 855-864. |
| [10] |
郭李燕, 朱东芳, 林丽仪. 温针灸配合四逆汤加味对寒凝血瘀型原发性痛经的疗效分析[J]. 检验医学与临床, 2019, 16(17): 2527-2529. GUO L Y, ZHU D F, LIN L Y. Efficacy of modified Danggui Sini Decoction combined with warm acupuncture in treating primary dysmenorrhea of the Hanning Xueyu type[J]. Laboratory Medicine and Clinic, 2019, 16(17): 2527-2529. DOI:10.3969/j.issn.1672-9455.2019.17.033 |
| [11] |
周帅琪, 梁龙, 于杰, 等. 当归四逆汤在骨伤科中的应用[J]. 辽宁中医药大学学报, 2019, 21(12): 165-168. ZHOU S Q, LIANG L, YU J, et al. Application of Danggui Sini Decoction in orthopedics[J]. Journal of Liaoning University of Traditional Chinese Medicine, 2019, 21(12): 165-168. |
| [12] |
贾晓雅. 加味当归四逆汤治疗冠心病稳定型心绞痛阴寒凝滞证的临床观察[D]. 长沙: 湖南中医药大学, 2020. JIA X Y. The clinical effect of Jiawei Danggui Sini Decoction in treating coronary heart disease with stable angina pectoris and yin cold stagnation syndrome[D]. Changsha: Hunan University of Chinese Medicine, 2020. |
| [13] |
施岚尔, 聂课朝, 张文婧, 等. 基于网络药理学探讨当归四逆汤治疗2型糖尿病的作用机制[J]. 中华中医药学刊, 2020, 38(11): 149-153, 278. SHI L E, NIE K C, ZHANG W J, et al. Study on mechanism of Danggui Sini Decoction in treatment of type 2 diabetes mellitus based on network pharmacology[J]. Chinese Archives of Traditional Chinese Medicine, 2020, 38(11): 149-153, 278. |
| [14] |
苗家燕, 罗赣, 高晓燕, 等. 经典名方当归四逆汤物质基准的关键质量属性研究[J]. 分析测试学报, 2021, 40(5): 740-746. MIAO J Y, LUO G, GAO X Y, et al. Research on critical quality attributes of substance benchmarks for classical prescription Danggui sini decoction[J]. Journal of Instrumental Analysis, 2021, 40(5): 740-746. DOI:10.3969/j.issn.1004-4957.2021.05.017 |
| [15] |
国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2015. The National Pharmacopoeia Commission. Pharmacopoeia of People's Republic of China[M]. Beijing: China Medical Science and Technology Press, 2015. |
| [16] |
代云桃, 靳如娜, 吴治丽, 等. 基于标准汤剂(物质基准)的经典名方制备工艺和质量标准研究[J]. 中国实验方剂学杂志, 2020, 26(2): 164-174. DAI Y T, JIN R N, WU Z L, et al. Research strategies for quality standards of famous classical formula based on standard decoction(material reference)[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2020, 26(2): 164-174. |
| [17] |
关雅戈, 罗赣, 高晓燕, 等. 经典名方桃核承气汤物质基准关键质量属性研究[J]. 中草药, 2021, 52(8): 2267-2275. GUAN Y G, LUO G, GAO X Y, et al. Study on critical quality attributes of classical prescription substance benchmarks of Taohe Chengqi Decoction[J]. Chinese Traditional and Herbal Drugs, 2021, 52(8): 2267-2275. |
| [18] |
王汉卿, 雍婧姣, 肖东, 等. 宁夏产甘草不同组织部位成分差异比较[J]. 中华中医药杂志, 2019, 34(6): 2672-2675. WANG H Q, YONG J J, XIAO D, et al. Comparative study of components differences among different tissues of Radix Glycyrrhizae from Ningxia[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2019, 34(6): 2672-2675. |
| [19] |
卢晨娜, 叶潇, 刘晓谦, 等. 当归药材与饮片中7种成分含量测定及其物质传递规律研究[J]. 中国中药杂志, 2021, 46(23): 6196-6203. LU C N, YE X, LIU X Q, et al. Content determination and transferring rules of seven components in Angelicae Sinensis Radix and its processed products[J]. China Journal of Chinese Materia Medica, 2021, 46(23): 6196-6203. |
 2022, Vol. 41
2022, Vol. 41