文章信息
- 吴惠梅, 陈永, 肖长虹, Kutty Selva Nandakumar
- WU Huimei, CHEN Yong, XIAO Changhong, NANDAKUMAR Kutty Selva
- 甘草养阴汤在改善小鼠银屑病样皮损和调节炎症反应中的作用
- Effect of Gancao Yangyin Decoctionon improving psoriasis-like skin lesions and regulating inflammation in mice
- 天津中医药大学学报, 2022, 41(4): 457-464
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(4): 457-464
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.04.12
-
文章历史
收稿日期: 2022-02-18
2. 深圳市人民医院(暨南大学第二临床医学院、南方科技大学第一附属医院)风湿免疫科,深圳 518020;
3. 南方医科大学中西医结合医院风湿科,广州 510315
2. Department of Rheumatology and Immunology, Shenzhen People's Hospital, The Second Clinical Medical College of Jinan University, The First Affiliated Hospital of Southern University of Science and Technology, Shenzhen 518020, China;
3. Department of Rheumatology, Integrated Hospital of Traditional Chinese Medicine, Southern Medical University, Guangzhou 510315, China
银屑病是由遗传和环境因素共同导致的一种免疫介导的慢性、炎症性、全身性疾病[1]。银屑病患病率高且容易复发;欧洲和北美的患病率约为2%[1],在丹麦为7.9%[2]。除了全身皮肤病变表现外,银屑病患者罹患心血管疾病、代谢综合征和银屑病关节炎的风险也增加[3]。尽管目前临床运用多种免疫抑制剂或者生物制剂,但疗效仍不尽人意,并且当前治疗方式多会带来一系列不良反应,极大影响患者的生活质量[4]。
银屑病在中医被称为“白疕”,而中药用于银屑病患者的治疗具有悠久的历史渊源[5]。根据中医理论:“血热生风”是常见的银屑病的辨证类型。中医上选择了具有阴、凉性质的药物来治疗银屑病。尽管现代科学技术能够提取中草药的一些有效成分,但在临床实践中,以中药复方是中医临床处方的基本原则[6]。基于中药配方及中草药成分的功效,结合中医配伍原则,设计出包含甘草、人参、干姜、蒲公英、罗汉果、玉竹、大枣7种中药成分(专利申请号:201910843519.9)的滋阴中药,并将其命名为“甘草养阴汤(GNY)”。该配方的中草药提取物的抗炎功能有大量研究报道。例如,甘草中的二氢磺基苯甲酸酯能够稳定自由基的产生、并通过减少人类全血样本中的血栓烷B2(TXB2)和前列腺素E2(PGE2)的释放而显示出抗氧化和抗炎活性[7]。甘草的提取物甘草酸苷可用于治疗寻常型银屑病且能够调节Th17细胞(Th17)及其相关细胞因子的表达[8]。人参多糖提取物能够抑制白细胞介素-8(IL-8)的分泌和Th1细胞的分化等[9]。人参皂苷可以调节小鼠脾脏中树突状细胞(DC)的不同亚群而缓解小鼠的类风湿性关节炎[10]。人参皂苷可抑制树突细胞成熟迁移和归巢,减少T细胞的活化[11]。针对该配方,前期在自身免疫性疾病类风湿关节炎及溃疡性结肠炎的基础研究及临床病例中显示治疗价值[12-13]。
在本研究中,用咪喹莫特(IMQ)诱导了银屑病小鼠模型,通过研究GNY对炎症细胞和细胞因子影响,探索其治疗银屑病及其他自身免疫性疾病的的潜在作用机制,为GNY用于银屑病等自身免疫性疾病患者的临床试验奠定理论基础。
1 材料与方法 1.1 动物实验采用8周龄的BALB/c雌性近交小鼠。购自南方医科大学实验动物中心(批准号:CUMS-2018-0062-03)。SPF级环境饲养,自由摄取水和食物。
1.2 IMQ诱发银屑病小鼠模型将小鼠分为4组[对照组(CTRL)、模型组(IMQ)和不同浓度药物治疗组包括GNY-2.5 g/kg和GNY-5 g/kg组],每组8只。除对照组外,所有组的每只小鼠在背部的剃毛区局部给药每日30 mg,连续5日的IMQ以诱导银屑病[14]。使用IMQ的所有小鼠均出能现银屑病样皮肤炎症,显示模型建立成功。
1.3 GNY的制备GNY的成分如下:甘草、人参、罗汉果、蒲公英、玉竹、干姜、大枣,按照比例12∶9∶12∶6∶9∶6∶18。将中药饮片煮沸两次,持续1 h,然后用双蒸馏水(ddH2O)稀释到2.5 g/kg和5 g/kg浓度的药液。
1.4 干预措施和症状评估GNY-2.5 g/kg和GNY-5 g/kg组的小鼠在饮用水中加入相应浓度的GNY。在第10天,当所有组中的银屑病样病变炎症消退时,第二次应用IMQ,连续5天(如图 1A所示)。使用银屑病面积和严重程度指数(PASI)来检测银屑病症状,该评分包括:红斑(0-4)、鳞片(0-4),皮肤厚度(0-4),总计12分。使用电子游标卡尺在特定受损皮肤区域测量皮肤厚度。
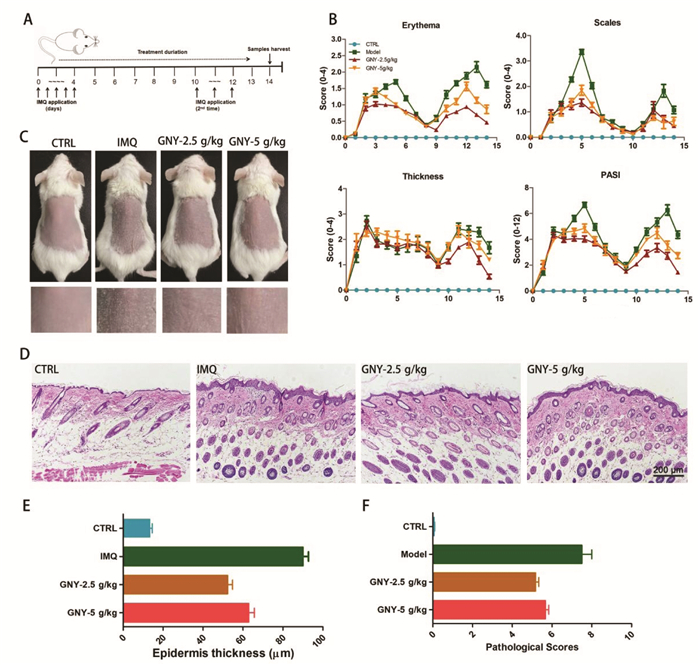
|
| 注:A.实验方案流程图。B.对照组,模型组(IMQ造模),实验组(GNY-2.5 g/kg和GNY-5 g/kg)的红斑,鳞屑,浸润程度和PASI评分。C.第14天小鼠背部皮肤示意图。GNY组分别采用2.5 g/kg和5 g/kg浓度的GNY处理小鼠。GNY组表现出较低的红斑、鳞屑和PASI评分。在第二次IMQ刺激后,观察到GNY再次体现治疗效果。D. HE染色结果表明模型组出现表皮增厚、棘层肥厚和角化不全,是银屑病样皮损的典型病理特征(放大倍数:4×5)。E.统计学结果表明GNY治疗改善上皮的增厚程度。F.病理学评分结果(Baker’s评分)表明改善以上的皮肤病变的病理特征。与模型组相比,*P<0.05;***P<0.001。 图 1 GNY改善小鼠IMQ诱导的银屑病症状 |
在银屑病造模期结束时(第14天),通过肌肉内注射Zoletil 50(Virbac,France,20 mg/kg)使小鼠麻醉,并通过断颈法处死。收集皮肤样品用于组织病理学分析。通过常规步骤进行HE染色,光学显微镜下观察。使用×10放大倍数从每只小鼠的皮肤切片中选择10个随机区域来测量表皮厚度、使用Baker评分[9]来判断银屑病的病理学损害程度。
1.6 免疫组织化学和免疫荧光染色在银屑病末期(第14天)收获皮肤样品,每组5只小鼠。用生物素抗小鼠Gr-1(Ly6C/6G)、CD11c(Biolegend,美国)对炎症细胞进行常规免疫组化染色。然后在显微镜下观察。免疫荧光染色:皮肤样品常规包埋并切片,然后将切片在冰上用丙酮固定10 min,然后浸入PBS中15 min。用含2%BSA的PBST(Biofroxx,德国)封闭45 min。用兔单克隆抗体转化生长因子β(TGF-β,Affinity Biosciences,中国)和维甲酸受体相关的孤儿受体γt(RORγt,Abcam,英国)在室温下孵育组织1 h。然后加入荧光标记的抗兔二抗,并在室温下孵育60 min(碧云天,中国),4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)(碧云天)溶液用于细胞核染色。使用共聚焦显微镜(Cannon,日本)拍摄照片。
1.7 流式细胞分析为了探索每组小鼠中Th17和调节性T细胞(Treg)的水平,在处死小鼠后收集脾细胞。通过研磨制备单细胞悬液,并在避光环境下与抗特定细胞表面标记的抗体在冰上孵育30 min。Th17细胞用CD4+-APC和IL-17A+-PE抗体进行标记。Treg细胞用CD4+-PE,CD25+-APC,和叉头框蛋白P3(Forkhead box protein P3,Foxp3)+ -BV570标记。以上抗体均购置于BD Biosciences公司。使用LSRⅡ(BD Biosciences)流式细胞仪进行细胞分析,并使用Flow Jo软件v 7.6(Tree Star,美国)进行结果分析。
1.8 实时荧光定量聚合酶链反应(qRT-PCR)使用Trizol(Invitrogen,美国)从皮肤中提取出总RNA,并溶解在无RNAse的RQ-DNAse水(Promega,美国)。使用PrimeScript RT试剂盒(Thermo Scientific,英国)对mRNA样本进行反转录。qRT-PCR反应使用SYBR Premix Ex Taq Ⅱ TliRNaseH Plus(Takara biotech,日本)体系,使用LightCycler 96(Roche,瑞典)热循环仪进行PCR扩增。采用β-肌动蛋白(β-actin)作为内参,用于计算转录本相对表达量,并使用2-ΔΔCt算法计算相对表达水平。重复实验三遍以确认结果。
qRT-PCR目标基因的引物序列如下所列:β-actin(ACCGTGAAAAGATGACCCAG,GTACGACCAGAGGCATACAG);TNF-α(ACGCTCTTCTGTCTACTGAACT,ATCTGAGTGTGAGGGTCTGG);IL-6(GAGAAAAGAGTTGTGCAATGGC,CCAGTTTGGTAGCATCCATCAT);IL-10(CTGCTAACCGACTCCTTAATGC,GCTCCACTGCCTTGCTCTTAT);TGF-β(ATCTCGATTTTTACCCTGGTGGT,CTCCCAAGGAAAGGTAGGTGATAGT);AMPK-ɑ1(TGTGGCTGGGTGTGTAAA,GGCTGTGTGTGGCATTC);IL-17A(CCCCTAAGAAACCCCCACG,TAAAGTCCACAGAAAAACAAACACG);IL-17E(ACAGGGACTTGAATCGGGTC,TGGTAAAGTGGGACGGAGTTG);IL-17F(GTCAGGAAGACAGCACCA,AGCCAACTTTTAGGAGCA);IL-22(CATGCAGGAGGTGGTACCTT,CAGACGCAAGCATTTCTCAG);IL-23(AGCAACTTCACACCTCCCTAC,ACTGCTGACTAGAACTCAGGC)。
1.9 统计分析使用GraphPad Prism 8软件分析数据,结果表示为均值±标准差(x±s)。两组之间使用Student t检验进行比较,使用Bonferroni或Newman-Keuls校正进行单向方差分析作多次比较。P<0.05为差异具有统计学意义。
2 结果 2.1 GNY改善小鼠银屑病的临床症状、减轻角质细胞过度增厚实验方案如图 1A所示。在对BALB/c小鼠用IMQ诱导5 d后(图 1A),皮肤出现典型的红斑、鳞屑和厚度增加,且总PASI高达7分,表明咪喹莫特诱导银屑病模型成功建立。GNY能够在4,5,6 d及IMQ二次免疫后显著降低红斑评分。GNY-2.5 g/kg和GNY-5 g/kg组能够在第4~6天,第14天显著降低鳞屑评分(P<0.05)。GNY-2.5 g/kg组在第10、11、13、14天降低皮肤厚度(P<0.05)。即GNY能够在第1次IMQ诱导的银屑病高峰期(第4~6天)及IMQ二次免疫后显著性的降低银屑病评分,且在第2次IMQ诱导后,GNY的治疗效果更加明显,且GNY-2.5 g/kg组治疗效果优于GNY-5 g/kg组(图 1B)。IMQ二次免疫后第14天的小鼠背部皮肤图片证明以上特点(图 1C)。
在两个治疗组(GNY-2.5 g/kg和GNY-5 g/kg)中,皮肤病变的HE染色显示表皮增厚、棘皮症、角化不全比模型组低(图 1D)。同时,GNY汤治疗组能够显著性降低上皮的浸润程度厚度(图 1E)和组织的病理评分(图 1F)。
2.2 GNY降低皮肤中Gr-1,CD11c和RORγ t阳性细胞的表达粒细胞受体-1(Gr-1)是一种髓样分化抗原,在粒细胞和巨噬细胞上表达的糖基磷脂酰肌醇(GPI)相关蛋白[15],参与自身免疫性疾病的发病机制[16]。CD11c在单核细胞和巨噬细胞上与CD1c(BDCA-1)共表达。真皮髓样CD11c+DC可激活CD4+ T细胞并进一步诱发银屑病的炎症反应[17]。在本研究中,观察到银屑病模型小鼠比对照组小鼠表达更高水平的Gr-1和CD11c,而GNY以剂量依赖性方式降低了它们的表达(图 2A和B)。研究显示在银屑病中Th17细胞产生IL-17A细胞因子,这可以通过RORγt进行特异性标记[17]。在银屑病模型小鼠的真皮中,观察到RORγt阳性细胞的存在(1~3个细胞/切片),而在对照和GNY药物处理的小鼠中均未见RORγt阳性细胞(图 2C)。TGF-β可促进Th17细胞发育[18]。本研究显示与健康小鼠相比,银屑病模型小鼠表达更高数量的TGF-β+细胞。在GNY作用下降低了TGF-β+细胞的表达(图 2C)。
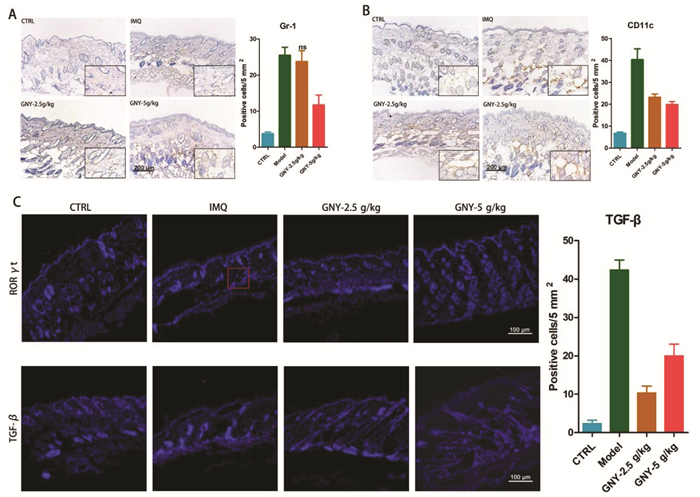
|
|
注:A-B.银屑病小鼠表达的Gr-1和CD11c阳性细胞水平高于对照组小鼠,而GNY以剂量依赖性方式降低其表达(动物数=8/组)。C.通过免疫荧光在银屑病小鼠的真皮中观察到RORγt阳性细胞(1~3个细胞/切片),而在对照和GNY处理的小鼠中,它们的水平可以忽略不计。与健康对照小鼠相比,银屑病小鼠表达的TGF-β+细胞数量更多。两种浓度的GNY均降低了TGF-β的表达(动物数=8/组)。与模型组相比, *P<0.05;**P<0.01;***P<0.001。 图 2 GNY抑制IMQ诱导银屑病小鼠模型中的非特异性和特异性免疫细胞 |
脾脏T细胞亚群的结果表明,模型小鼠CD4+ IL-17+ Th17细胞百分比增加,而CD25+ Foxp3+ Treg细胞减少。Th17细胞是自身免疫和炎症的促进剂,而Treg细胞则可以抑制这些现象并保持免疫稳态[19]。在两种浓度的GNY中,分化的CD4+ IL-17+ Th17细胞均显着降低(图 3A),而脾脏中的CD25+ Foxp3+ Treg细胞在GNY干预后增加(图 3B)。
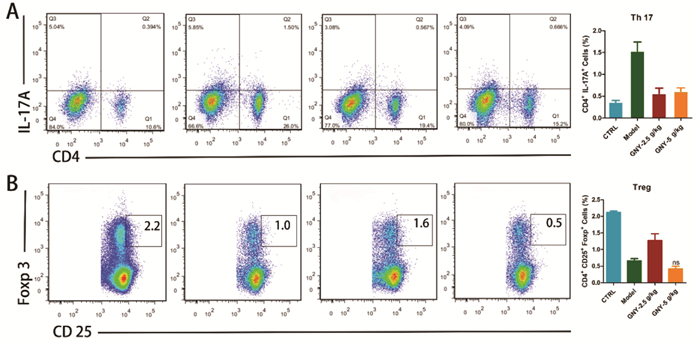
|
| 注:A:在两种浓度的GNY作用下,脾脏中分化的CD4+ IL-17+的Th17细胞均减少。B:Treg(CD4+CD25+ Foxp3+)在GNY处理后会增加。与模型组相比,*P<0.05;**P<0.01;***P<0.001。 图 3 GNY调节脾脏Treg/Th17细胞 |
银屑病患者血清中细胞因子,细胞因子受体及其信号转导途径的复杂网络升高[20]。本研究通过qPCR实验对皮肤样品中IL-6、IL-10、IL-17A、IL-22、IL-23、TNF-α、TGF-β和腺苷酸活化蛋A激酶(AMPactivatedproteinkinase,AMPK-ɑ1)的相对mRNA表达水平进行了半定量分析。发现,除IL-10外,模型小鼠的血清中所有这些mRNA均升高,而GNY治疗后可显著降低炎症因子及AMPK-ɑ1表达(图 4)。
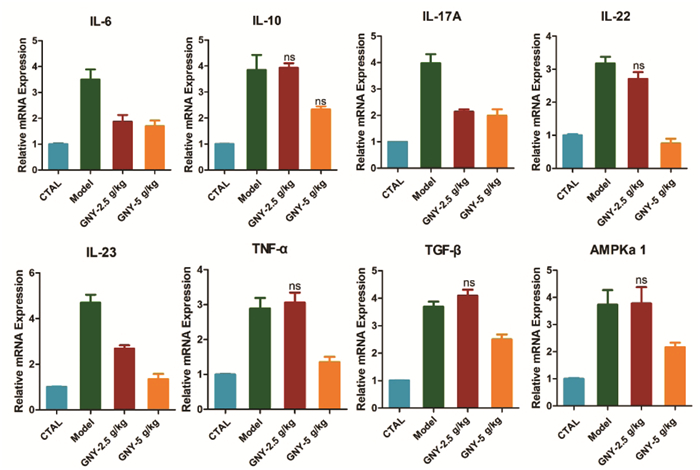
|
| 注:与模型组相比,*P<0.05;**P<0.01;***P<0.001。 图 4 GNY降低牛皮癣小鼠模型真皮中的炎症细胞因子水平 |
自拟方GNY,是根据中医理论、药物的性味、归经,结合多位中医学专家意见进行讨论拟定的针对自身免疫性疾病的中药复方。方中甘草益气补中,清热解毒为君药;人参补气、生津,玉竹养阴润燥,协调甘草作用,并消除其水钠潴留的副作用,为臣药。蒲公英、罗汉果清热解毒,干姜温中散寒,回阳通脉,属于佐药;大枣养血安神、缓和药性为使药。整个配方阴阳调和、滋阴为主,阴中求阳;对机体的阴阳失调形成了“缓冲液”样作用。
根据GNY所含成分的功效,主要是滋阴。“阳亢”在中医诊断中可表现为“上火”,即过多的阳气或心火旺盛与自身免疫反应或炎性症状相关。IMQ诱导的银屑病小鼠是研究自身免疫和炎性疾病的代表性动物模型,在一定程度上可以看作是上火、阴虚阳亢的模型。在本研究中,GNY该模型临床表现和角质形成、细胞增殖有明显改善作用。非特异性和特异性免疫反应在银屑病发病机理中起到重要作用[23-24],所以本研究初步探索了GNY的治疗机制,涉及非特异性和特异性免疫反应。结果证实,治疗组在用药后炎症反应减轻,Gr-1、CD11c和RORγt阳性细胞降低。Gr-1是在粒细胞和巨噬细胞上表达的特异性标记。CD11c主要在非特异性免疫细胞如单核细胞、DC、粒细胞、NK细胞以及T细胞和B细胞的亚群上表达,它是用于鉴定皮肤髓样DC的最显著的表面抗原[26]。研究显示银屑病皮肤真皮中CD11c+髓样DC的数量增加,在银屑病的发病机理中具有重要作用[27]。RORγt在Th17细胞的分化、维持和功能中起关键作用,并且是治疗IL-17介导的自身免疫性疾病的重要靶标[28]。在本研究中,观察到仅在模型组的真皮中存在RORγt阳性细胞,而在健康对照组和GNY治疗组中未能发现RORγt阳性细胞。
银屑病患者中存在TGF-β信号的失调[29],TGF-β促进Th17细胞的发育[27]。本研究发现GNY可降低IMQ诱导的银屑病小鼠皮肤中TGF-β的表达。据此推测Th17细胞可能是GNY治疗银屑病的作用机制的靶细胞之一。通过流式细胞仪分析了Th17细胞的百分比,结果显示在用GNY治疗后,该群细胞显著减少。CD4+CD25+ Foxp3+ Treg细胞对银屑病炎症发挥调控作用[30]。在本研究中,模型组中的CD25+ Foxp3+ Treg细胞减少,GNY给药组显著增加。
本研究还观察了IL-17A和IL-6、IL-10、IL-22、IL-23、TGF-β和TNF-α等mRNA基因的表达变化。这些靶点均与IL-17形成密切的通路关系[31-32]。除IL-10外,研究证实GNY可以下调此类炎症因子水平。此外,还测试了AMPK/IL-17信号通路,AMPKɑ1在自身免疫反应中会增加,并通过调节代谢水平发挥一直炎症的作用,并且在炎症反应控制后趋于正常水平。在本实验中,银屑病小鼠模型中GNY治疗后AMPK-ɑ1的mRNA的升高水平显著降低,这说明炎症水平得到了较好的控制。
本研究使用IMQ诱导的银屑病小鼠模型,分析了自拟方GNY的治疗效果。研究结果显示PASI分数的降低,证实GNY汤的有效性。免疫组化、免疫荧光、流式细胞技术和qPCR分析进一步揭示了其效率和作用机理。因此,本研究显示了GNY对动物模型的出色疗效,证实了抗炎反应。这些结果将成为使用GNY汤治疗银屑病设计未来临床试验基础。
| [1] |
BOEHNCKE W H, SCHÖN M P. Psoriasis[J]. Lancet (London, England), 2015, 386(9997): 983-994. DOI:10.1016/S0140-6736(14)61909-7 |
| [2] |
EGEBERG A, ANDERSEN Y M F, THYSSEN J P. Prevalence and characteristics of psoriasis in Denmark: findings from the Danish skin cohort[J]. BMJ Open, 2019, 9(3): e028116. DOI:10.1136/bmjopen-2018-028116 |
| [3] |
GRAYSON M. Psoriasis[J]. Nature, 2012, 492(7429): S49. DOI:10.1038/492S49a |
| [4] |
FLOREK A G, WANG C J, ARMSTRONG A W. Treatment preferences and treatment satisfaction among psoriasis patients: a systematic review[J]. Archives of Dermatological Research, 2018, 310(4): 271-319. DOI:10.1007/s00403-018-1808-x |
| [5] |
WENG S W, CHEN B C, WANG Y C, et al. Traditional Chinese medicine use among patients with psoriasis in Taiwan: a nationwide population-based study[J]. Evidence-Based Complementary and Alternative Medicine: ECAM, 2016, 2016: 3164105. |
| [6] |
YANG P W. Application of "monarch, minister, assistant and envoy" principle to rheumatoid arthritis management[J]. Journal of Rheumatology and Arthritic Diseases, 2017, 2(3): 1-4. |
| [7] |
TROMBETTA D, GIOFRÈ S V, TOMAINO A, et al. Selective COX-2 inhibitory properties of dihydrostilbenes from liquorice leaves: in vitro assays and structure/activity relationship study[J]. Natural Product Communications, 2014, 9(12): 1761-1764. |
| [8] |
吴文中, 张福仁, 王福喜, 等. 复方甘草酸苷治疗寻常型银屑病疗效评价及对Th17细胞因子的影响[J]. 中国麻风皮肤病杂志, 2015, 31(12): 716-719. WU W Z, ZHANG F R, WANG F X, et al. Assessment of the therapeutic efficacy of compound glycyrrhizin in the treatment of the patients with psoriasis vulgaris and the effects on Th17 cell and related cytokines expression[J]. China Journal of Leprosy and Skin Diseases, 2015, 31(12): 716-719. |
| [9] |
WANG C Z, HOU L F, WAN J Y, et al. Ginseng berry polysaccharides on inflammation-associated colon cancer: inhibiting T-cell differentiation, promoting apoptosis, and enhancing the effects of 5-fluorouracil[J]. Journal of Ginseng Research, 2020, 44(2): 282-290. DOI:10.1016/j.jgr.2018.12.010 |
| [10] |
雒宏, 陈雁飞, 钱军. 人参皂苷对胶原诱导类风湿关节炎小鼠脾脏树突状细胞亚群的影响[J]. 临床和实验医学杂志, 2021, 20(10): 1021-1025. LUO H, CHEN Y F, QIAN J. Effects of ginsenosides on the subpopulations of dendritic cells in the spleen of mice with collagen-induced rheumatoid arthritis[J]. Journal of Clinical and Experimental Medicine, 2021, 20(10): 1021-1025. DOI:10.3969/j.issn.1671-4695.2021.10.004 |
| [11] |
陈镜宇. 人参皂苷CK对实验性关节炎的治疗作用及其抗炎免疫调节机制[D]. 合肥: 安徽医科大学, 2014. CHEN J Y. Antiinflammatory and immunoregulatory effects of ginsenoside metabolite compound K in treatment of experiitiemtal arthritis[D]. Hefei: Anhui Medical University, 2014. |
| [12] |
陈永, 邱富娟, 陈艳娟, 等. 甘草养阴汤对类风湿关节炎滑膜成纤维细胞增殖和凋亡的影响[J]. 中医学报, 2021, 36(8): 1734-1738. CHEN Y, QIU F J, CHEN Y J, et al. Influences of Gancao Yangyin Decoction on proliferation and apoptosis of rheumatoid arthritis synovial fibroblast[J]. Acta Chinese Medicine, 2021, 36(8): 1734-1738. |
| [13] |
高海军, 陈艳娟, 娄国梁, 等. 甘草养阴汤治疗溃疡性结肠炎1例[J]. 中国民间疗法, 2020, 28(4): 81-83. GAO H J, CHEN Y J, LOU G L, et al. One case with ulcerative colitis treated by Gancao Yangyin Decoction[J]. China's Naturopathy, 2020, 28(4): 81-83. |
| [14] |
SWINDELL W R, MICHAELS K A, SUTTER A J, et al. Imiquimod has strain-dependent effects in mice and does not uniquely model human psoriasis[J]. Genome Medicine, 2017, 9(1): 24. DOI:10.1186/s13073-017-0415-3 |
| [15] |
JACKSON A R, HEGDE V L, NAGARKATTI P S, et al. Characterization of endocannabinoid-mediated induction of myeloid-derived suppressor cells involving mast cells and MCP-1[J]. Journal of Leukocyte Biology, 2014, 95(4): 609-619. DOI:10.1189/jlb.0613350 |
| [16] |
IWATA Y, FURUICHI K, KITAGAWA K, et al. Involvement of CD11b+ GR-1 low cells in autoimmune disorder in MRL-Fas lpr mouse[J]. Clinical and Experimental Nephrology, 2010, 14(5): 411-417. DOI:10.1007/s10157-010-0309-9 |
| [17] |
KIM T G, KIM D S, KIM H P, et al. The pathophysiological role of dendritic cell subsets in psoriasis[J]. BMB Reports, 2014, 47(2): 60-68. DOI:10.5483/BMBRep.2014.47.2.014 |
| [18] |
QIN H W, WANG L F, FENG T, et al. TGF-beta promotes Th17 cell development through inhibition of SOCS3[J]. Journal of Immunology (Baltimore, Md: 1950), 2009, 183(1): 97-105. DOI:10.4049/jimmunol.0801986 |
| [19] |
LEE G R. The balance of Th17 versus treg cells in autoimmunity[J]. International Journal of Molecular Sciences, 2018, 19(3): 730. DOI:10.3390/ijms19030730 |
| [20] |
BALIWAG J, BARNES D H, JOHNSTON A. Cytokines in psoriasis[J]. Cytokine, 2015, 73(2): 342-350. DOI:10.1016/j.cyto.2014.12.014 |
| [21] |
TEAGUE H L, VARGHESE N J, TSOI L C, et al. Neutrophil subsets, platelets, and vascular disease in psoriasis[J]. JACC Basic to Translational Science, 2019, 4(1): 1-14. DOI:10.1016/j.jacbts.2018.10.008 |
| [22] |
RENDON A, SCHÄKEL K. Psoriasis pathogenesis and treatment[J]. International Journal of Molecular Sciences, 2019, 20(6): 1475. DOI:10.3390/ijms20061475 |
| [23] |
KARNELL J L, KUMAR V, WANG J Y, et al. Role of CD11c+ T-bet+ B cells in human health and disease[J]. Cellular Immunology, 2017, 321: 40-45. DOI:10.1016/j.cellimm.2017.05.008 |
| [24] |
LOWES M A, CHAMIAN F, ABELLO M V, et al. Increase in TNF-alpha and inducible nitric oxide synthase-expressing dendritic cells in psoriasis and reduction with efalizumab (anti-CD11a)[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(52): 19057-19062. DOI:10.1073/pnas.0509736102 |
| [25] |
IMURA C, UEYAMA A, SASAKI Y, et al. A novel RORγt inhibitor is a potential therapeutic agent for the topical treatment of psoriasis with low risk of thymic aberrations[J]. Journal of Dermatological Science, 2019, 93(3): 176-185. DOI:10.1016/j.jdermsci.2019.03.002 |
| [26] |
HAN G W, WILLIAMS C A, SALTER K, et al. A role for TGF beta signaling in the pathogenesis of psoriasis[J]. The Journal of Investigative Dermatology, 2010, 130(2): 371-377. DOI:10.1038/jid.2009.252 |
| [27] |
OWCZARCZYK-SACZONEK A, CZERWIŃSKA J, PLACEK W. The role of regulatory T cells and anti-inflammatory cytokines in psoriasis[J]. Acta Dermatovenerologica Alpina, Pannonica, et Adriatica, 2018, 27(1): 17-23. |
| [28] |
MA X Y, REYNOLDS S L, BAKER B J, et al. IL-17 enhancement of the IL-6 signaling cascade in astrocytes[J]. Journal of Immunology, 2010, 184(9): 4898-4906. DOI:10.4049/jimmunol.1000142 |
| [29] |
EKMAN A K, BIVIK EDING C, RUNDQUIST I, et al. IL-17 and IL-22 promote keratinocyte stemness in the germinative compartment in psoriasis[J]. The Journal of Investigative Dermatology, 2019, 139(7): 1564-1573. DOI:10.1016/j.jid.2019.01.014 |
| [30] |
FURUE K, ITO T, TSUJI G, et al. Psoriasis and the TNF/IL23/IL17 axis[J]. Giornale Italiano Di Dermatologia e Venereologia, 2019, 154(4): 418-424. |
| [31] |
CHEN Y, QIU F J, YU B J, et al. Metformin, an AMPK activator, inhibits activation of FLSs but promotes HAPLN1 secretion[J]. Molecular Therapy Methods & Clinical Development, 2020, 17: 1202-1214. |
| [32] |
陈永, 邱富娟, 肖长虹. 类风湿性关节炎患者血浆腺苷酸活化蛋白激酶(AMPK)水平升高并与疾病活动度呈正相关[J]. 细胞与分子免疫学杂志, 2020, 36(5): 438-443. CHEN Y, QIU F J, XIAO C H. Increased level of plasma AMPK is positively correlated with disease activity in patients with rheumatoid arthritis[J]. Chinese Journal of Cellular and Molecular Immunology, 2020, 36(5): 438-443. |
 2022, Vol. 41
2022, Vol. 41




