文章信息
- 杜国明, 吴涛, 卢文士, 刘作民, 王贞仪
- DU Guoming, WU Tao, LU Wenshi, LIU Zuoming, WANG Zhenyi
- 鸡屎藤苷酸对肝癌HepG2细胞炎症因子水平、生长、凋亡、侵袭和血管生成的影响
- Effect of paederosidic acid on inflammatory factor levels, growth, apoptosis, invasion and angiogenesis of hepatocellular carcinoma HepG2 cells
- 天津中医药大学学报, 2022, 41(4): 471-477
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(4): 471-477
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.04.14
-
文章历史
收稿日期: 2022-03-05
2. 新乡医学院第一附属医院普外科,卫辉 453100
2. Department of General Surgery, The First Affiliated Hospital of Xinxiang Medical College, Xinxiang 453100, China
肝癌(HCC)是世界范围内常见的侵袭型恶性肿瘤,也是癌症相关死亡的第二大主要原因,具有复发高、转移快的特点。早期肝癌患者的5年生存率可达60%~80%[1],但不幸的是,大多数患者在确诊时已处于晚期,导致肝癌的病死率高,预后效果差,5年生存率甚至不到20%[2]。传统化学治疗、放射治疗在一定程度上改善患者的临床预后,但其不良反应不容忽视。因此,寻求安全有效的药物对提高预后效果,改善患者生存质量具有重要意义。
鸡屎藤又名鸡矢藤,具有疏肝和胃、活血止痛的功效。研究发现,鸡屎藤颗粒可以抑制TGF-β1/Smad7途径,抑制大鼠的肝纤维化[3]。一般认为,其环烯醚萜苷类为主要活性成分,包括鸡屎藤苷酸[4]。鸡屎藤苷酸具有镇痛、抗炎、抗惊厥[5]、抗肿瘤[6]等药理活性。鸡屎藤抑制的TGF-β1/Smad7途径是某些抗肝癌进展和转移药的靶标[7],而且同时可能用于癌痛[8],是有希望的抗肝癌前药,但鸡屎藤苷酸对肝癌的作用未见报道。本研究旨在体外实验探讨鸡屎藤苷酸对肝癌细胞HepG2炎症因子水平、生长、凋亡、侵袭和血管生成的影响,从肿瘤侵袭迁移的角度对肝癌的治疗及预后提供实验参考。
1 材料 1.1 细胞人肝正常细胞系LO2、人肝癌细胞系SMC-7721、BEL7402、HepG2、脐静脉内皮细胞HUVEC均购自中国科学院细胞库。
1.2 试剂鸡屎藤苷酸(paederosidic acid,PA,分子量:464.44,纯度≥98%),成都普菲德科技有限公司;盐酸厄洛替尼(Erlotinib hydrochloride,纯度≥98%),美国Sigma-Aldrich公司。1%青-链霉素溶液、10%胎牛血清、DMEM培养基,美国Gibco公司;Annexin V-FITC/PI细胞凋亡检测试剂盒,北京索莱宝科技有限公司;人γ干扰素(IFN-γ)试剂盒、白细胞介素-6(IL-6)试剂盒、白细胞介素-10(IL-10)试剂盒,上海江莱生物科技有限公司;B细胞淋巴2(Bcl2)、Bcl2相关X(Bax)、裂解型含半胱氨酸的天冬氨酸蛋白水解酶(Cleaved Caspase-3)、含半胱氨酸的天冬氨酸蛋白水解酶3(Caspase-3)、波形蛋白(Vimentin)、纤维黏连蛋白(FN)、E-钙黏蛋白(E-cad)、血管内皮生长因子(VEGF)等相关抗体,美国Thermo Fisher公司。
1.3 仪器MR-96A酶标仪,深圳迈瑞生物医疗电子股份有限公司;FACS Calibur流式细胞仪,美国BD公司;JC-CHP-80S CO2培养箱,青岛聚创环保集团有限公司;Transwell小室,美国康宁公司;CR22N21N高速冷冻离心机,日本日立Himac公司;ZF-288全自动凝胶成像仪,上海金鹏分析仪器有限公司。
2 方法 2.1 细胞培养将冻存的细胞水浴融化后,接种于含有1%青-链霉素溶液、10%胎牛血清的DMEM培养基中,在37 ℃、5% CO2培养箱中培养,每48 h更换培养基,待细胞铺满瓶底达80%以上,用于后续实验。HUVEC细胞培养条件相同。
2.2 CCK8法检测细胞活力稀释细胞密度为1×104个/mL,接种至96孔板,每孔100 μL。24 h后分别更换为100 μL含有不同浓度的鸡屎藤苷酸溶液(0、1.25、2.5、5、10、20、40、160和320 μg/mL)的培养基,每浓度组设置6个复孔,培养24或48 h后,加入10 μL的CCK8试剂,1 h后,在酶标仪450 nm波长处读取吸光度值OD,计算细胞的相对活力,筛选合适剂量。
2.3 流式检测细胞凋亡取对数生长期的肝癌细胞HepG2,消化、稀释后,加入2.2筛选的合适剂量的鸡屎藤苷酸溶液(20 μg/mL和40 μg/mL),每组设置6个复孔厄洛替尼(0.86 ng/mL)作为阳性对照,培养48 h后,用PBS溶液洗涤,胰酶消化使细胞悬浮,培养基终止消化,800 rpm/min离心5 min,离心半径为13.5 cm,弃上清后,用1×Binding Buffer缓冲液稀释成1×107个/mL的细胞悬液,取100 μL细胞悬液,按照试剂盒说明,将5 μL标记FITC的AnnexinV与5 μL PI染液混匀,避光孵育10 min后,洗去染色液,用流式细胞仪进行检测。
2.4 ELISA检测相关炎症因子的含量取对数生长期的肝癌细胞HepG2,消化、稀释后,加入合适剂量的鸡屎藤苷酸溶液,每组设置6个复孔,培养48 h后,将细胞悬浮于磷酸盐缓冲溶液(PBS)中,反复冻融破坏细胞膜,离心收集上清,分别按照IFN-γ、IL-6、IL-10试剂盒说明进行操作。在波长为450 nm处检测各组吸光度,计算IFN-γ、IL-6、IL-10含量。
2.5 Western blot取对数生长期的肝癌细胞HepG2,消化、稀释后,加入合适剂量的鸡屎藤苷酸溶液,每组设置6个复孔,培养48 h后。用PBS溶液洗涤,加入裂解试剂收集裂解液,离心15 min,用BCA试剂盒测定总蛋白浓度,10% SDS-PAGE胶分离蛋白后转膜,用5%脱脂牛奶室温孵育封闭蛋白2 h。分别加入Bax、Bcl2、Cleaved Caspase-3、Caspase-3、IL-6、IL-10、E-cad、Vimentin、FN以及VEGF等的相应一抗,孵育完成后,室温下,用1×TBST缓冲液清洗PVDF膜10 min,重复3次,二抗室温孵育2 h,1×TBST再洗3次,将PVDF膜正面向上置于洁净的玻璃板上,加入ECL工作液显色。将玻璃置于全自动凝胶成像分析仪中进行曝光,统计灰度值并计算蛋白表达量。
2.6 Transwell检测细胞侵袭将Matrigel胶用PBS稀释后,包被于Transwell小室底膜的上室面,在下室加入800 μL含10%血清的培养基,取不同浓度药液处理肝癌细胞HepG2,调整密度为1×105,接种100 μL于上室,放入培养箱中24 h后,取出侵袭小室,用PBS冲洗培养基,将小室内层未穿过的细胞用湿润的棉签擦除。用预冷的4%多聚甲醛固定处理后,进行0.1%结晶紫溶液染色及显微镜观察。
2.7 内皮细胞成管实验检测肿瘤小管的形成取对数生长期的肝癌细胞HepG2,消化、稀释后,根据分组加入合适剂量的鸡屎藤苷酸或厄洛替尼溶液,培养48 h后,收集培养基,用于配制细胞密度为5×103个/mL的HUVEC细胞悬液,取0.5 mL HUVEC悬液接种于铺设基质胶的48孔板,12 h后,采用普通光学显微镜进行管样结构观察和拍摄,并用图像分析软件IPP 6.1统计分析[9]。
2.8 统计学方法采用SPSS 21.0软件进行数据分析,选择单因素方差分析One-Way ANOVA,数据用均数±标准差(x±s)表示,P<0.05为差异有统计学意义。
3 结果 3.1 鸡屎藤苷酸对肝癌细胞活力的影响鸡屎藤苷酸处理24 h,对肝正常细胞系LO-2影响较小,对肝癌细胞系SMC-7721,HepG2和BEL7402有不同程度的活力抑制,以HepG2最敏感(P<0.05,图 1)。不同时间对鸡屎藤酸苷处理对其药效影响较小,当溶液浓度小于20 μg/mL时,鸡屎藤苷酸对肝癌细胞活力的抑制作用较小,不具有明显差异。当浓度大于40 μg/mL时,鸡屎藤苷酸对肝癌细胞活力的抑制作用明显(P<0.05,图 1),且呈剂量依赖性抑制。实验提示,鸡屎藤苷酸抑制肝癌细胞HepG2生长。选择空白对照、20 μg/mL、40 μg/mL鸡屎藤苷酸剂量及阳性对照厄洛替尼(0.86 ng/mL),进行后续实验。
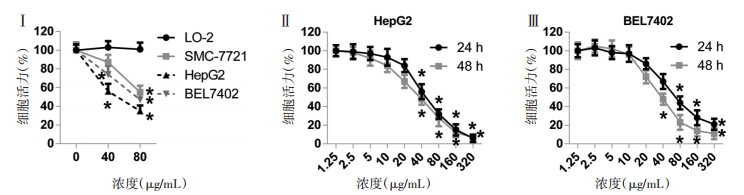
|
| 注:与0μg/mL剂量鸡屎藤苷酸或1.25μg/mL剂量鸡屎藤苷酸比较,*P<0.05。 图 1 不同浓度鸡屎藤苷酸对肝癌细胞系活力的影响 |
与鸡屎藤苷酸0 μg/mL的对照组相比,20 μg/mL组凋亡细胞数差异无统计学意义,但40 μg/mL组的细胞凋亡率显著升高(P<0.05,图 2Ⅰ-Ⅱ),40 μg/mL组Bax/Bcl-2和Cleaved Caspase-3/Caspase-3也升高(P<0.05,图 2Ⅲ-Ⅴ)。实验提示鸡屎藤苷酸促进肝癌细胞HepG2凋亡。
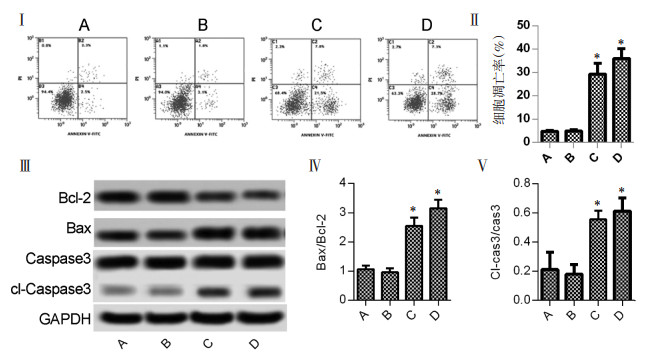
|
| 注:A、B、C、D分别代表空白对照组、20 μg/mL、40 μg/mL鸡屎藤苷酸剂量组和厄洛替尼0.86 ng/mL组;与空白对照组比较,*P<0.05。 图 2 鸡屎藤苷酸对肝癌细胞HepG2凋亡的影响 |
与空白对照组相比,20 μg/mL组侵袭细胞数差异无统计学意义,染色细胞数目减少,40 μg/mL组侵袭细胞的数量明显减少(P<0.05,图 3),实验提示鸡屎藤苷酸抑制肝癌细胞的侵袭。
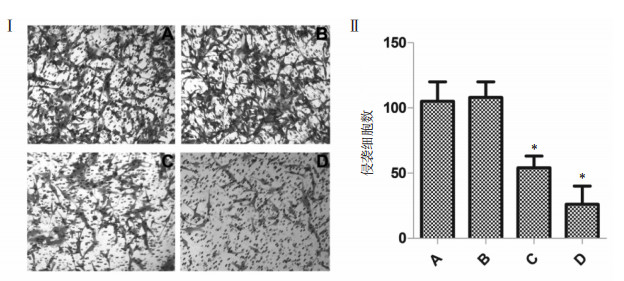
|
| 注:A、B、C、D分别代表空白对照组、20 μg/mL、40 μg/mL鸡屎藤苷酸剂量组和厄洛替尼0.86 ng/mL组;与空白对照组比较,*P<0.05。 图 3 鸡屎藤苷酸对肝癌细胞侵袭的影响 |
与空白对照组相比,20 μg/mL组VEGF表达差异无统计学意义,40 μg/mL组HepG2 VEGF的表达明显下调(P<0.05,图 4I)。小管形成实验表明,20 μg/mL组与空白对照组差异不明显,40 μg/mL组小管形成数明显减少,管腔不完整(P<0.05,图 4Ⅰ-Ⅱ),实验提示鸡屎藤苷酸下调肝癌细胞HepG2血管内皮因子的表达并抑制肿瘤血管的形成。
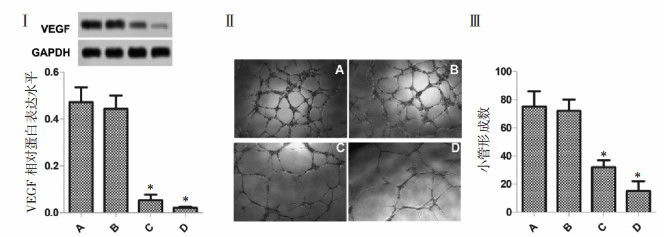
|
| 注:A、B、C、D分别代表空白对照组、20 μg/mL、40 μg/mL鸡屎藤苷酸剂量组和厄洛替尼0.86 ng/mL组;与空白对照组比较,*P<0.05。 图 4 鸡屎藤苷酸对小管形成的影响 |
与空白对照组相比,20 μg/mL组差异无统计学意义,40 μg/mL组IFN-γ、IL-6的含量明显下降,IL-10的含量明显升高(P<0.05,图 5),实验提示鸡屎藤苷酸抑制促炎因子合成、促进抗炎因子释放,缓解炎症的程度。
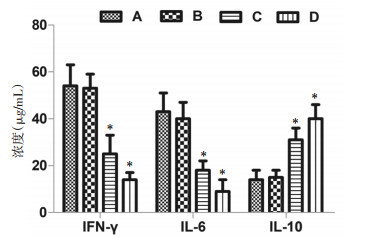
|
| 注:A、B、C、D分别代表空白对照组、20 μg/mL、40 μg/mL鸡屎藤苷酸剂量组和厄洛替尼0.86 ng/mL组;与空白对照组比较,*P<0.05。 图 5 鸡屎藤苷酸对肝癌细胞炎症因子含量的影响 |
与空白对照组相比,20 μg/mL组差异无统计学意义,40 μg/mL组IL-6的表达明显下调,IL-10的表达明显上调(P<0.05,图 6),实验提示鸡屎藤苷酸调节肝癌细胞内炎症因子表达,减少了炎症反应与细胞免疫反应,缓解肝癌的发生发展,与3.5的结果吻合。

|
| 注:A、B、C、D代表空白对照组、20 μg/mL、40 μg/mL鸡屎藤苷酸剂量组和厄洛替尼0.86 ng/mL组;与空白对照组比较,*P<0.05。 图 6 鸡屎藤苷酸对肝癌细胞炎症因子表达的影响 |
与空白对照组相比,20 μg/mL组差异无统计学意义,40 μg/mL组波形蛋白(Vimentin)、纤维粘连蛋白(FN)的表达明显下调,E-钙黏蛋白(E-cad)的表达明显上调(t=19.107、12.544、7.703,P<0.05,图 7),实验提示鸡屎藤苷酸抑制肝癌细胞的侵袭,与3.3的结果吻合。
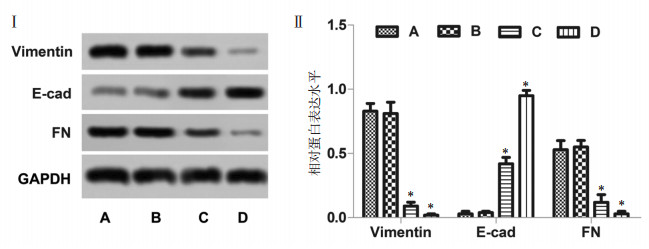
|
| 注:A、B、C、D分别代表空白对照组、20 μg/mL、40 μg/mL鸡屎藤苷酸剂量组和厄洛替尼0.86 ng/mL组;与空白对照组比较,*P<0.05。 图 7 鸡屎藤苷酸对肝癌细胞侵袭相关蛋白表达的影响 |
肝癌是常见的恶性肿瘤之一,对于肝癌的预防及治疗仍是世界面临的巨大挑战,其发生发展与复杂的机制相关。大量研究表明,持续的炎症是促进和加重恶性肿瘤程度的重要原因[10]。
肝癌是典型的炎症驱动型肿瘤,在早期炎症激活纤维化,最终导致肝硬化和肝癌的发生;在肿瘤阶段,肝实质细胞死亡和由此引起的炎症级联激活的伤口愈合反应持续存在[10]。因此,抗炎尤其是肿瘤微环境的炎症,对于肝癌的治疗来说,可能有特别重要的意义。白细胞介素-6(IL-6)、人γ干扰素(IFN-γ)等促炎因子积极参与和调节肿瘤细胞的发生发展[11],白细胞介素-4(IL-4)、白细胞介素-10(IL-10)等抗炎因子,具有免疫抑制作用,缓解炎症的发生,从而减少肿瘤的发生和转移。实验结果显示,IFN-γ、IL-6的含量明显下降,IL-10的含量明显升高,提示鸡屎藤苷酸抑制促炎因子合成、促进抗炎因子释放,缓解炎症的程度。
细胞凋亡(apoptosis)是指为维持内环境稳定,细胞进行有序的自主死亡。但当细胞的凋亡机制受到抑制,不能进行正常的细胞死亡清除时,导致癌变的发生。因此,促进肿瘤细胞的凋亡,能够有效抑制恶性转化,缓解癌症的进程。比如,Liu等[12]的研究显示,苦豆碱通过PI3K/Akt信号通路诱导肝癌细胞凋亡和G2/M细胞周期阻滞,具有抗肿瘤潜力;Chen等[13]的研究表明,氟西汀通过诱导肿瘤细胞凋亡,发挥抗肿瘤作用。本实验结果显示,细胞凋亡率显著升高,Bax/Bcl-2与Cleaved Caspase-3/Caspase-3升高,与上述研究一致,实验提示,鸡屎藤苷酸促进肝癌细胞HepG2凋亡。
纤维粘连蛋白(FN)是细胞外基质中重要的细胞黏附分子,而肿瘤细胞黏附能力的改变被视作肿瘤细胞侵袭和转移的起始[14]。此外,上皮间质转化(EMT)是调控肿瘤细胞侵袭和转移的机制之一,上皮标志物E-钙黏蛋白(E-cad)的减少和间质标志物波形蛋白(Vimentin)、N-钙黏蛋白(N-Cad)、α-平滑肌肌动蛋白(α-SMA)等的增加,使细胞紧密连接、极性丢失和间充质细胞形态转变,导致肿瘤细胞粘附作用减弱而运动能力增强,从而获得更强的迁移和侵袭能力[15]。因此,芍药苷[16]在增加E-cad表达后,对HepG2生长有抑制作用,能显著降低肝癌细胞株的侵袭、转移和黏附。本实验结果显示,侵袭细胞的数量明显减少,波形蛋白(Vimentin)、纤维粘连蛋白(FN)的表达明显下调,E-钙黏蛋白(E-cad)的表达明显上调,与上述研究一致,实验提示鸡屎藤苷酸抑制肝癌细胞的侵袭与转移。
肝癌是高度血管化的恶性疾病,血管生成对癌细胞的生长、侵袭、转移等至关重要[17]。其中,血管内皮生长因子(VEGF)是调节肿瘤血管生成的重要调控因素,据文献报道,VEGF在肝癌组织和细胞内呈现异常表达[18-19]。因此,抑制VEGF的表达是缓解肿瘤的发生发展的重要思路。本实验检测了小管形成,以反映HepG2细胞分泌细胞因子对内皮细胞血管形成能力的促进。结果显示:鸡屎藤苷酸处理导致VEGF表达下调,处理后的培养液使小管形成数明显减少,与上述研究一致。提示鸡屎藤苷酸通过降低VEGF表达,减少肿瘤血管生成,抑制肝癌细胞生长、侵袭、转移,具有良好的抗肿瘤潜力。
在肝癌中,炎症、血管内皮细胞紊乱、细胞外基质和肿瘤微环境的改变等上述机制相互促进,共同导致肿瘤的进展[20]。鸡屎藤苷酸对肝纤维化的TGF- β抑制机制[3],被报道是某些抗肝癌药物的靶标[7],发现其在鸡屎藤酸苷处理的HepG2中也被抑制。同时鸡屎藤苷酸可以直接导致HepG2细胞的凋亡,也能抑制肿瘤的管形成,降低炎症因子水平,并调控侵袭相关蛋白以抑制侵袭。因此,鸡屎藤苷酸抗肝癌作用可能是多方面的。
综上,鸡屎藤苷酸调节炎症因子水平,抑制肝癌细胞HepG2生长、侵袭、血管形成并促进其凋亡,缓解肿瘤的发生发展,具有治疗肝癌的潜力及深入研究的意义。
| [1] |
ZHU K, DAI Z, ZHOU J. Biomarkers for hepatocellular carcinoma: Progression in early diagnosis, prognosis, and personalized therapy[J]. Biomarker Research, 2013, 1(1): 10. DOI:10.1186/2050-7771-1-10 |
| [2] |
YU J, XU Q G, WANG Z G, et al. Circular RNA cSMARCA5 inhibits growth and metastasis in hepatocellular carcinoma[J]. Journal of Hepatology, 2018, 68(6): 1214-1227. DOI:10.1016/j.jhep.2018.01.012 |
| [3] |
袁勇, 吕传柱. 鸡矢藤颗粒剂干预大鼠肝纤维化模型TGF-β1/Smad通路试验[J]. 食品与机械, 2019, 35(9): 6-8. YUAN Y, LYU C Z. Paederia scandens granules of intervention in rat liver fibrosis model experimental study on TGF-β1/Smad pathway[J]. Food & Machinery, 2019, 35(9): 6-8. |
| [4] |
戴良富, 吴娇. 黎药鸡屎藤的化学成分及药理活性研究进展[J]. 亚太传统医药, 2009, 5(2): 117-119. DAI L F, WU J. Advances in studies on chemical constituents and pharmacological activities of Phyllostachys chinensis[J]. Asia-Pacific Traditional Medicine, 2009, 5(2): 117-119. |
| [5] |
YANG T, KONG B, GU J W, et al. Anticonvulsant and sedative effects of paederosidic acid isolated from Paederia scandens (Lour.) Merrill. in mice and rats[J]. Pharmacology, Biochemistry, and Behavior, 2013, 111(11): 97-101. |
| [6] |
YU P, SHI L F, SONG M Y, et al. Antitumor activity of paederosidic acid in human non-small cell lung cancer cells via inducing mitochondria-mediated apoptosis[J]. Chemico-Biological Interactions, 2017, 269(10): 33-40. |
| [7] |
LI X J, ZENG X P. Shikonin suppresses progression and epithelial-mesenchymal transition in hepatocellular carcinoma (HCC) cells by modulating miR-106b/SMAD7/TGF-β signaling pathway[J]. Cell Biology International, 2020, 44(2): 467-476. |
| [8] |
刘建阳, 刘敬伟, 李玉权. 鸡矢藤注射液治疗癌症疼痛及术后镇痛108例临床观察[J]. 实用肿瘤学杂志, 2004, 18(3): 212-213. LIU J Y, LIU J W, LI Y Q. Clinical observation on treatment of 108 cases of cancer pain and postoperative analgesia with Jishanteng injection[J]. Journal of Practical Oncology, 2004, 18(3): 212-213. |
| [9] |
黄河, 魏童. 低水平CUL1通过上调结直肠癌细胞中P21的表达抑制结直肠癌增殖和血管生成[J]. 肿瘤药学, 2020, 10(4): 416-422. HUANG H, WEI T. Low expression of CUL1 inhibits proliferation and angiogenesis of colorectal cancer by upregulating P21 expression in HCT116 and SW480 cells[J]. Anti-Tumor Pharmacy, 2020, 10(4): 416-422. |
| [10] |
BISHAYEE A. The role of inflammation and liver cancer[J]. Advances in Experimental Medicine and Biology, 2014, 816(6): 401-435. |
| [11] |
WANG Y N, MA H Y, ZHAO C Q, et al. Growth-suppressive activity of raloxifene on liver cancer cells by targeting IL-6/GP130 signaling[J]. Oncotarget, 2017, 8(20): 33683-33693. |
| [12] |
LIU J S, HUO C Y, CAO H H, et al. Aloperine induces apoptosis and G2/M cell cycle arrest in hepatocellular carcinoma cells through the PI3K/Akt signaling pathway[J]. Phytomedicine: International Journal of Phytotherapy and Phytopharmacology, 2019, 61(7): 152843. |
| [13] |
CHEN W T, HSU F T, LIU Y C, et al. Fluoxetine induces apoptosis through extrinsic/intrinsic pathways and inhibits ERK/NF-κB-modulated anti-apoptotic and invasive potential in hepatocellular carcinoma cells in vitro[J]. International Journal of Molecular Sciences, 2019, 20(3): 757. |
| [14] |
李力, 郭祥翠, 王倩青, 等. 红芪多糖对卵巢癌SKOV3细胞凋亡、生长和运动能力的影响[J]. 天津医药, 2021, 49(5): 455-459. LI L, GUO X C, WANG Q Q, et al. Effects of Radix hedysari polysaccharide on apoptosis, growth and motility of ovarian cancer SKOV3 cells[J]. Tianjin Medical Journal, 2021, 49(5): 455-459. |
| [15] |
朱会芳, 张哲莹, 贺国洋, 等. 长非编码RNA HOXA10-AS促进肝癌细胞侵袭和迁移[J]. 中国生物化学与分子生物学报, 2020, 36(12): 1438-1445. ZHU H F, ZHANG Z Y, HE G Y, et al. Long non-coding RNA HOXA10-AS promotes invasion and migration of hepatocellular carcinoma cells[J]. Chinese Journal of Biochemistry and Molecular Biology, 2020, 36(12): 1438-1445. |
| [16] |
LU J T, HE W, SONG S S, et al. Paeoniflorin inhibited the tumor invasion and metastasis in human hepatocellular carcinoma cells[J]. Bratislavske Lekarske Listy, 2014, 115(7): 427-433. |
| [17] |
HUANG B, HUANG M P, LI Q. Cancer-associated fibroblasts promote angiogenesis of hepatocellular carcinoma by VEGF-mediated EZH2/VASH1 pathway[J]. Technology in Cancer Research & Treatment, 2019, 18: 1533033819879905. |
| [18] |
HU Z Z, DONG N, LU D, et al. A positive feedback loop between ROS and Mxi1-0 promotes hypoxia-induced VEGF expression in human hepatocellular carcinoma cells[J]. Cellular Signalling, 2017, 31: 79-86. |
| [19] |
夏庆, 尹红梅, 沈阳, 等. 肝癌肿瘤微环境对血管内皮细胞增殖及血管生成能力的影响[J]. 生物医学工程学杂志, 2015, 32(3): 612-617. XIA Q, YIN H M, SHEN Y, et al. Influence of tumor microenvironment of hepatocellular carcinoma on the proliferation of vascular endothelial cells and vascular angiogenesis ability[J]. Journal of Biomedical Engineering, 2015, 32(3): 612-617. |
| [20] |
WANG Y, TAKEISHI K, LI Z, et al. Microenvironment of a tumor-organoid system enhances hepatocellular carcinoma malignancy-related hallmarks[J]. Organogenesis, 2017, 13(3): 83-94. |
 2022, Vol. 41
2022, Vol. 41




