文章信息
- 王申伟, 王琼, 陈军童, 赵艳艳
- WANG Shenwei, WANG Qiong, CHEN Juntong, ZHAO Yanyan
- 淫羊藿苷对TGF-β1诱导的肾小管上皮细胞上皮间质转分化的作用及机制
- The effect and mechanism of icariin on the epithelial-mesenchymal transdifferentiation of renal tubular epithelial cells induced by TGF-β1
- 天津中医药大学学报, 2022, 41(4): 478-483
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(4): 478-483
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.04.15
-
文章历史
收稿日期: 2022-02-26
2. 郑州大学第一附属医院内分泌科,郑州 450000
2. Department of Endocrinology, the First Affiliated Hospital of Zhengzhou University,Zhengzhou 450000, China
肾间质纤维化是各种慢性肾脏病进展到终末期肾病的主要病理特征, 其轻重程度是各种肾脏疾病向肾功能的恶化程度的关键因素, 成为了威胁世界公共健康的主要疾病之一[1-2]。肾小管上皮细胞向上皮-间质转化是肾间质纤维化的发病关键环节, 主要是上皮细胞的黏附能力降低, α-平滑肌肌动蛋白(α-SMA)的表达增加, 基底膜破坏以及细胞侵袭和迁移能力增加[3-4]。上皮质间质转化受许多细胞因子的调控, 如转化生长因子-β1(TGF-β1), 是一种致纤维化因子, 研究表明其对肾小管上皮细胞上皮间质转化至关重要[5]。因此, 阻断或抑制TGF-β1的作用已成为防治肾间质纤维化的重要靶点。
淫羊藿苷是淫羊藿中重要有效成分, 具有补肝肾、强筋骨和祛风湿等作用[6]。研究表明, 淫羊藿苷对肝、肾等脏器具有保护作用, 对防治肾纤维化具有较好的疗效[7]。但淫羊藿苷对肾小管上皮细胞的上皮间质转化的作用尚不明确。基于此, 本研究采用人肾皮质近曲小管上皮细胞(HK-2), 通过TGF-β1诱导后, 分别采用不同浓度的淫羊藿苷干预后, 观察细胞的增殖, 迁移和侵袭能力, 以及上皮间质转化的相关因子α-SMA、上皮细胞钙黏蛋白(E-Cad)、波形蛋白(Vim)以及Samd信号通路的变化。
1 材料与方法 1.1 细胞、主要试剂及试剂盒HK-2细胞购自中科院上海细胞库。FBS胎牛血清、DMEM/F12培养基和0.05%的胰蛋白酶(Gibco, Waltham, MA); 淫羊藿苷(Sigma-Aldrich); TGF-β1(广州聚研生物有限公司); Trizol试剂和BCA试剂(Invitrogen; Thermo Fisher Scientific, lnc.); CCK-8试剂盒(北京索莱宝科技有限公司); 0.25%甲紫溶液(索莱宝科技有限公司); Transwell小室(密理博科技有限公司); PrimeScriptTM RT试剂盒(Takara Biotechnology); SYBR-Green qPCR Master Mix(北京康润诚业生物科技有限公司); RIPA缓冲液、一抗稀释液、二抗稀释液、SDS-PAGE和PVDF膜(上海碧云天生物技术有限公司); 鼠抗人α-SMA、E-cadherin、vimentin、Smad2/3、p-Smad2/3和GAPDH单分子抗体(Abcam); 兔抗鼠二抗(Cell Signaling Technology); 超敏发光液ECL(北京四正柏生物科技有限公司)。
1.2 实验方法 1.2.1 细胞培养HK-2细胞通过常规复苏后, 用含10% FBS的DMEM/F12培养液, 于37 ℃恒温, 5% CO2的培养箱中进行培养。隔日进行传代1次, 实验使用的细胞为对数生长期的细胞。
1.2.2 细胞转染和分组将HK-2细胞接种于6孔板, 待其长至密度40%~50%后, 将其分为空白对照组、TGF-β1组、TGF-β1+淫羊藿苷(10、20、40 μmol/L)组。TGF-β1组是将10 μg/L的TGF-β1干预HK-2细胞24 h。TGF-β1+淫羊藿苷(10、20、40 μmol/L)组是HK-2细胞在10 μg/L TGF-β1诱导24 h后, 换成10、20、40 μmol/L的淫羊藿苷干预24 h。空白对照组是未干预的HK-2细胞。
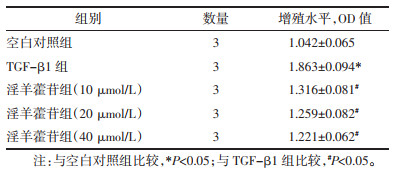
1.2.3 细胞增殖将空白对照组、TGF-β1组、TGF-β1+淫羊藿苷(10、20、40 μmol/L)组在铺于96孔板内, 每孔细胞数量为5 000个/孔。每1组均需要设立6个复孔用于计算该组平均值。在各组药物干预过后, 添加CCK-8试剂, 每孔10 μL/孔。在37 ℃孵育2 h, 放入酶标仪内, 450 nm检测各孔OD值, 分析各组细胞增殖情况。实验均独立重复3次。
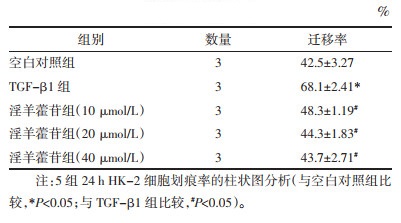
1.2.4 细胞划痕实验待空白对照组、TGF-β1组、TGF-β1+淫羊藿苷(10、20、40 μmol/L)组的HK-2细胞长至80%~90%, 用10 μL枪头尖端在培养皿中央垂直划一道痕迹, 用PBS洗去脱壁的细胞, 于培养箱培养0、24 h后, 放于倒置显微镜观察划痕两侧细胞迁移的距离, 迁移率=(划痕宽度0 h-划痕宽度12 h/24 h)/划痕宽度0 h×100%。该实验需独立重复3次。
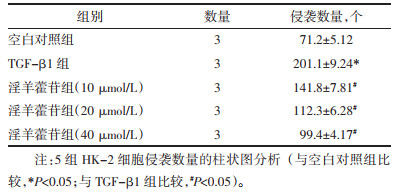
1.2.5 Transwell小室检测细胞侵袭能力实验分为空白对照组、TGF-β1组、TGF-β1+淫羊藿苷(10、20、40 μmol/L)组。TranswellTM小室上层表面加入100 μL的基质胶(Matrigel), 摇匀后放置培养箱40 min。将100 μL不含血清培养基稀释淫羊藿苷分别至10、20、40 μmol/L以及添加10 μg/L TGF-β1, 调整HK-2细胞密度至每毫升3×105个, 取500 μL接种至上层。每组设立3个复孔。培养箱培养12 h后, 将小室取出, 用甲醇固定15 min后, 风干后, 再向孔内添加2.5 mL/L甲紫溶液染色30 min。将小室放在倒置显微镜下随机选取5个视野(×200), 拍照记录迁移下室的细胞总数。该实验需独立重复3次。
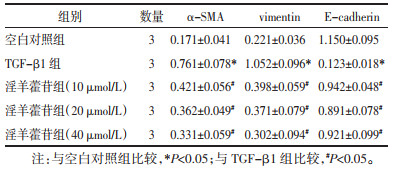
1.2.6 实时荧光定量PCR法检测相关基因mRNA表达水平将空白对照组、TGF-β1组、TGF-β1+淫羊藿苷(10、20、40 μmol/L)组的细胞收集后, 通过Trizol试剂分别提取各组总RNA。通过NanoDrop 2000分光光度计检测RNA纯度和浓度, 使用总RNA逆转录扩增为cDNA(反转录条件: 37 ℃ 60 min, 85 ℃ 5 min)。20 μL PCR反应体系: 0.4 μL目的模板cDNA, 10 μL SYBR-Green qPCR Master Mix和对应的上下游引物各0.4 μL, 8.8 μL ddH2O。PCR扩增条件为: 95 ℃预变性2 min, 95 ℃变性15 s, 60 ℃退火45 s, 72 ℃延伸30 s, 共计40个循环, 在ABI 7500 fast仪器中进行。以GAPDH作为mRNA的标准内参, 基因表达结果均以2-ΔΔCt进行统计。本实验所有PCR引物序列见表 1。
将空白对照组、TGF-β1组、TGF-β1+淫羊藿苷(10、20、40 μmol/L)组细胞液氮碾磨后, 用RIPA缓冲液和PMSF抑制蛋白降解液(100:1)将样本裂解后提取各组总蛋白。通过BCA试剂检测蛋白质的总浓度, 将各组的总蛋白浓度调为一致, 将其于100 ℃进行变性后保存至-20 ℃。SDS-PAGE电泳分离总蛋白后, 将其转膜至PVDF膜。然后用5%脱脂牛奶封闭2 h, TBST洗涤3次, 每次10 min后, 将其放入对应的一抗(α-SMA、E-cadherin、vimentin、Smad2/3、p-Smad2/3和GAPDH)和一抗稀释混悬液(1:1 000)中, 4 ℃孵育过夜。再用TBST洗涤3次, 放入二抗和二抗稀释液(1:4 000)混悬液中, 室温孵育2 h。TBST洗涤3次, 每次10 min, 将超敏发光液ECL滴在膜上, 放入化学发光成像仪(Invitorgen, USA)进行蛋白显影。通过Image J软件进行分析结果, 相对蛋白表达以GAPDH标准化。
1.3 统计学方法应用SPSS 20.0软件进行数据分析, 计量资料以均数±标准差(x±s)表示, 各组间比较采用单因素方差分析, 组间两两比较采用t检验, P<0.05为差异有统计学意义。
2 结果 2.1 淫羊藿苷抑制TGF-β1诱导的HK-2增殖能力CKK-8的结果表明, 与空白对照组比较, TGF-β1组的细胞增殖水平显著增加(P<0.05)。与TGF-β1组比较, 随着淫羊藿苷干预浓度的增加, 细胞增殖水平的差异无统计学意义(P>0.05)。见表 2。
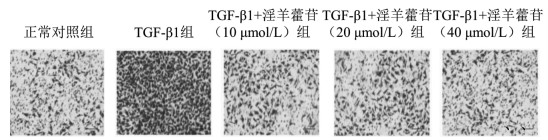
Transwell侵袭实验结果表明, TGF-β1组侵袭细胞数显著高于空白对照组(P<0.05)。TGF-β1+淫羊藿苷(10、20、40 μmol/L)组侵袭细胞数显著低于TGF-β1组(P<0.05), 随着淫羊藿苷干预浓度增加, 细胞侵袭数量的差异无统计学意义(P>0.05)。见图 1A和表 3。
|
| 图 1 5组HK-2细胞的侵袭情况(×200) |
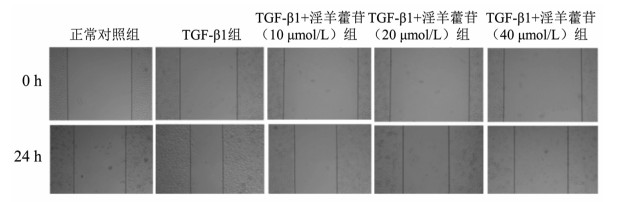
划痕实验结果显示, 与空白对照组比较, TGF-β1组在24 h内迁移率显著增加(P<0.05)。与TGF-β1组比较, TGF-β1+淫羊藿苷(10、20、40 μmol/L)组在24 h内迁移率显著下降(P<0.05)。随着淫羊藿苷增加, 迁移率差异无统计学意义(P>0.05)。见图 2A和表 4。
|
| 图 2 24h 5组HK-2细胞的迁移情况(×40) |
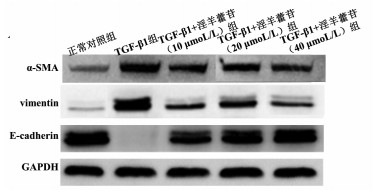
实时定量PCR和Western blot结果显示, 与空白对照组比较, TGF-β1组的α-SMA、vimentin蛋白和mRNA的表达量显著增加(P<0.05), 而E-cadherin蛋白和mRNA表达量显著降低(P<0.05)。与TGF-β1组比较, TGF-β1+淫羊藿苷(10、20、40 μmol/L)组的α-SMA、vimentin蛋白和mRNA的表达量显著降低(P<0.05), E-cadherin蛋白和mRNA表达量显著增加(P<0.05), TGF-β1+淫羊藿苷(10、20、40 μmol/L)组组间比较, 差异无统计学意义(P>0.05)。见图 3A和表 5、6。
|
| 图 3 不同浓度的淫羊藿苷对上皮间质转化关键蛋白和基因表达的影响 |
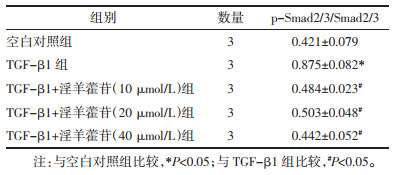
Western blot结果显示, 与空白对照组比较, TGF-β1组的p-Smad2/3/Smad2/3蛋白比值显著增加(P<0.05)。与TGF-β1组比较, TGF-β1+淫羊藿苷(10、20、40 μmol/L)组的p-Smad2/3/Smad2/3蛋白显著降低(P<0.05)。与TGF-β1+淫羊藿苷(20 μmol/L)组比较, TGF-β1+淫羊藿苷(40 μmol/L)组和TGF-β1+淫羊藿苷(10 μmol/L)组的p-Smad2/3/Smad2/3蛋白比值差异无统计学意义(P>0.05)。见图 4和表 7。
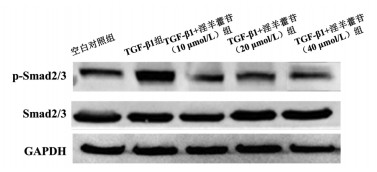
|
| 图 4 不同浓度的淫羊藿苷对Smad信号通路Smad2/3和p-Smad2/3蛋白表达情况 |
近年来, 尽管慢病肾脏病的治疗效果取得进展, 但仍合适的药物和方法对慢病肾脏病患者进行有效的根治, 由于肾间质内的纤维化加剧, 最终发展为终末期肾病[8]。肾小管上皮细胞的上皮间质转化是活化的肌成纤维细胞的重要来源, 其主要表现为上皮细胞的黏附性降低, α-SMA的表达能力减低以及细胞的迁移和侵袭能力增加[4, 10]。上皮间质转化的发生过程需要多种分子参与, 如TGF-β1, 其作为最强的促纤维化因子, 在肾脏纤维化中表达量增加, 可通过Smad信号通路介导上皮间质转化过程[11-12]。在TGF-β1的诱导下, 肾小管上皮细胞表型发生变化, 上皮间质转化的标志性蛋白E-cadherin表达量减少, 间充质标志性蛋白α-SMA的表达量增加, 其机制主要是由于TGF-β1激活转录因子Smad2/3磷酸化, 继而与Smad4共同活化形成低聚复合体, 启动核转录信号, 最终调控肾脏上皮间质转化相关因子的表达[5, 13]。本研究结果显示, 与空白对照组比较, TGF-β1诱导后, HK-2细胞的增殖, 迁移和侵袭能力明显增加, 并且α-SMA、vimentin蛋白和mRNA表达量增多, E-cadherin蛋白和基因表达量减少, 表明TGF-β1刺激后HK-2细胞发生了EMT, 提示构建成功肾小管上皮细胞上皮间质转化模型。进一步研究结果显示, TGF-β1诱导后, HK-2细胞中Smad信号通路被激活, p-Smad2/3与Smad2/3的比值明显增加, 这说明, TGF-β1诱导HK-2细胞中可能是通过激活Smad信号通路而影响其上皮间质转化能力。
淫羊藿苷作为淫羊藿主要的有效成分之一, 具有滋肾壮阳, 保护肾脏等功能[14]。研究表明: 淫羊藿苷对减轻慢性肾衰竭大鼠的肾脏组织纤维化, 抑制肾小管萎缩[15]。淫羊藿苷可抑制由TGF-β1刺激的肾成纤维细胞的增殖和内源性TGF-β1的表达, 对肾纤维化具有较好的效果[16]。本实验结果显示, 10、20、40 μmol/L的淫羊藿苷均可以抑制TGF-β1诱导的HK-2细胞的增殖, 迁移和侵袭能力, 并且随着淫羊藿苷浓度的增加, 其对TGF-β1诱导的HK-2细胞的抑制能力无明显变化。本实验Western blot和qPCR结果显示, α-SMA、vimentin蛋白和基因表达量减少, E-cadherin蛋白和基因表达量增加, 说明淫羊藿苷可抑制TGF-β1诱导的HK-2细胞的上皮间质转化能力, 但不会随着淫羊藿苷浓度增加而抑制能力增加。为了进一步探究淫羊藿苷对HK-2细胞的作用机制, 本研究检测Smad信号通路的变化。实验结果显示, 10、20、40 μmol/L的淫羊藿苷均能抑制TGF-β1诱导HK-2细胞的Smad信号通路的传导, 主要是p-Smad2/3与Smad2/3蛋白比值明显降低。
综上所述, TGF-β1可诱导肾小管上皮细胞的上皮间质转化, 其可通过激活Smad2/3的磷酸化, 从而引起上皮间质转化的相关因子表达发生变化。淫羊藿苷能显著逆转TGF-β1诱导肾小管上皮细胞的上皮间质转化以及增殖, 侵袭和迁移能力, 本研究也证实淫羊藿苷可通过抑制Smad2/3的磷酸化, 从而调控上皮间质转化相关因子α-SMA、vimentin和E-cadherin的表达, 从而影响肾小管上皮细胞的增殖、迁移、侵袭和上皮间质转化能力。由于肾纤维化形成的机制十分复杂, 与多种细胞因子和信号通路相关, 因此, 淫羊藿苷对治疗肾纤维化的效果和作用仍需进一步实验验证。
| [1] |
YIN X N, WANG J, CUI L F, et al. Enhanced glycolysis in the process of renal fibrosis aggravated the development of chronic kidney disease[J]. European Review for Medical and Pharmacological Sciences, 2018, 22(13): 4243-4251. |
| [2] |
LI M, JIA F, ZHOU H, et al. Elevated aerobic glycolysis in renal tubular epithelial cells influences the proliferation and differentiation of podocytes and promotes renal interstitial fibrosis[J]. European Review for Medical and Pharmacological Sciences, 2018, 22(16): 5082-5090. |
| [3] |
SONG Y, PENG C L, LV S S, et al. Adipose-derived stem cells ameliorate renal interstitial fibrosis through inhibition of EMT and inflammatory response via TGF-β1 signaling pathway[J]. International Immunopharmacology, 2017, 44(3): 115-122. |
| [4] |
LIU B C, TANG T T, LV L L, et al. Renal tubule injury: a driving force toward chronic kidney disease[J]. Kidney International, 2018, 93(3): 568-579. DOI:10.1016/j.kint.2017.09.033 |
| [5] |
CHEA S W, LEE K B. TGF-beta mediated epithelial-mesenchymal transition in autosomal dominant polycystic kidney disease[J]. Yonsei Medical Journal, 2009, 50(1): 105-111. DOI:10.3349/ymj.2009.50.1.105 |
| [6] |
HUANG Z D, HE L Q, HUANG D, et al. Icariin protects rats against 5/6 nephrectomy-induced chronic kidney failure by increasing the number of renal stem cells[J]. BMC Complementary and Alternative Medicine, 2015, 15(2): 378. |
| [7] |
MA P, ZHANG S, SU X L, et al. Protective effects of icariin on cisplatin-induced acute renal injury in mice[J]. American Journal of Translational Research, 2015, 7(10): 2105-2114. |
| [8] |
SHENG L L, ZHUANG S G. New insights into the role and mechanism of partial epithelial-mesenchymal transition in kidney fibrosis[J]. Frontiers in Physiology, 2020, 11(2): 569322. |
| [9] |
LIU H F, XIONG J C, HE T, et al. High uric acid-induced epithelial-mesenchymal transition of renal tubular epithelial cells via the TLR4/NF-kB signaling pathway[J]. American Journal of Nephrology, 2017, 46(4): 333-342. DOI:10.1159/000481668 |
| [10] |
ZHANG G M, CUI G H, TONG S X, et al. Salvianolic acid A alleviates the renal damage in rats with chronic renal failure1[J]. Acta Cirurgica Brasileira, 2019, 34(2): e201900204. DOI:10.1590/s0102-8650201900204 |
| [11] |
LIU G, WANG Y H, YANG L W, et al. Tetraspanin 1 as a mediator of fibrosis inhibits EMT process and Smad2/3 and beta-catenin pathway in human pulmonary fibrosis[J]. Journal of Cellular and Molecular Medicine, 2019, 23(5): 3583-3596. DOI:10.1111/jcmm.14258 |
| [12] |
WANG Q L, TAO Y Y, YUAN J L, et al. Salvianolic acid B prevents epithelial-to-mesenchymal transition through the TGF-beta1 signal transduction pathway in vivo and in vitro[J]. BMC Cell Biology, 2010, 11(2): 31. |
| [13] |
YAO Y, CHEN R, WANG G W, et al. Exosomes derived from mesenchymal stem cells reverse EMT via TGF-β1/Smad pathway and promote repair of damaged endometrium[J]. Stem Cell Research & Therapy, 2019, 10(1): 225. |
| [14] |
WANG M, GAO H Y, LI W H, et al. Icariin and its metabolites regulate lipid metabolism: From effects to molecular mechanisms[J]. Biomedecine & Pharmacotherapie, 2020, 131(2): 110675. |
| [15] |
FENG G, SHANG W, WANG Y, et al. Protective effect of icariin on renal ischemia-reperfusion injury in rats and action mechanism[J]. Chineae Journal of Organ Transplantation, 2012, 33(1): 559-562. |
| [16] |
刘利萍, 张鹏慧, 雷佳琦, 等. 淫羊藿苷对TGF-β1诱导的HK-2细胞增殖及纤维连接蛋白表达的影响[J]. 中药新药与临床药理, 2019, 30(3): 271-275. LIU L P, ZHANG P H, LEI J Q, et al. Effects of icariin on proliferation and fibronectin expression of HK-2 cells induced by transforming growth factor-beta1[J]. Traditional Chinese Drug Research & Clinical Pharmacology, 2019, 30(3): 271-275. |
 2022, Vol. 41
2022, Vol. 41