文章信息
- 张红, 耿辉, 曲海丽, 钟霞
- ZHANG Hong, GENG Hui, QU Haili, ZHONG Xia
- 夏枯草水提液对自身免疫性甲状腺炎大鼠5-HT和Th17的影响
- Prunella vulgaris L. attenuates experimental autoimmune thyroiditis by inducing5-hydroxytryptamine expression and inhibiting Th17 T cell
- 天津中医药大学学报, 2022, 41(4): 484-491
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(4): 484-491
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.04.16
-
文章历史
收稿日期: 2022-02-03
2. 山东第一医科大学附属山东省立医院药学部,济南 250021;
3. 山东第一医科大学附属山东省立医院护理部,济南 250021
2. Department of Pharmacy, Shandong Provincial Hospital Affiliated to Shandong First Medical University, Jinan 250021, China;
3. Nursing Department, Shandong Provincial Hospital Affiliated to Shandong First Medical University, Jinan 250021, China
自身免疫性甲状腺炎(AIT)是一种常见的自身免疫性甲状腺疾病, CD4+T细胞异常活化是发病的重要原因[1]。临床中以桥本甲状腺炎多见, 以甲状腺内淋巴细胞(尤其是T淋巴细胞)浸润、抗甲状腺过氧化物酶抗体(TPOAb)和抗甲状腺球蛋白抗体(TgAb)升高为主要特点[2], 是碘充足地区获得性甲减最常见的病因[3]。近几十年来全球范围内AIT的发病率显著提高[4], 中国AIT的患病率为1.6%, 发病率为6.9/1 000[5]。遗传和环境因素共同导致的免疫失调和甲状腺自身免疫抗体对甲状腺本身的攻击是AIT发生的主要原因[6], 目前没有针对病因的治疗方法。
5-羟色胺(5-HT)又名血清素, 作为一种单胺类神经递质被人们熟知, 是调节神经活动的重要物质, 大量研究表明: 中枢5-HT减少可产生情绪低落等抑郁情绪甚至抑郁症[7-9]。近几年来越来越多的研究表明, 5-HT在免疫过程中发挥重要作用[10], 5-HT信号系统可能是免疫炎症介质的一个重要靶点[11]。外周的5-HT可通过作用于表达5-HT受体(5-HTRs)的免疫细胞发挥作用, T淋巴细胞可表达5-HT多种受体, 如5-HT2AR, 5-HT1B等[12]。因此, 推测5-HT可能通过作用于T淋巴细胞参与了AIT的发病, 纠正异常的5-HT可以恢复免疫稳态。
夏枯草性寒、味苦、入肝经, 是治疗甲状腺疾病的最主要中药材之一[13]。夏枯草广泛应用于桥本甲状腺炎的治疗, 郑慧娟等[14]筛选了治疗桥本甲状腺炎的中医药方剂232条共212味中药材, 其中使用夏枯草的方剂有128条, 用药频次在桥本甲状腺炎相关方剂中居于前列。本研究中, 进一步研究夏枯草通过调节色氨酸代谢相关指标5-羟色胺转运体(SERT), 5-HT和Th17治疗自身免疫性甲状腺炎大鼠(EAT)的机制。
1 材料 1.1 药材提取夏枯草采自贵州省毕节市纳雍县, 采集时间: 2018年7月。标本存放于贵州省贵阳市新天药业股份有限公司中药实验室, 标本号: 2017112。
夏枯草水提液由贵州省贵阳市新天药业股份有限公司提取。提取方法: 新鲜的夏枯草果穗在38 ℃的风干机中恒湿风干10 d, 然后用40目筛子研磨; 70 ℃条件下加适量蒸馏水回流提取2 h, 提取液经滤纸组合过滤3次; 滤液浓缩并冷冻干燥, 最后将干燥的提取物溶于1 L生理盐水中。水提物经过过滤灭菌, 并在实验使用之前用凝胶法测定内毒素水平。
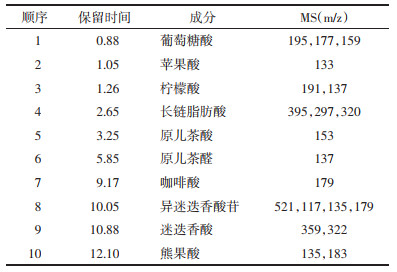
1.2 UPLC-ESI-MS/MS法在LCMS-8050系列质谱仪上用UPLC-ESI-MS鉴定水提物的化学成分。采用Waters ACQUITY HSS T3色谱柱(100 mm×2.1 mm I.D.; 1.8 μmol/L particle size; Waters, USA), 流动相为0.5%甲酸双蒸水(溶剂A)和乙腈(溶剂B)。梯度洗脱条件为: 流速0.4 mL/min, 5%~10%溶剂A梯度洗脱5 min, 10%~35%溶剂A梯度洗脱5~8 min, 35%~65%溶剂A梯度洗脱8~20 min。以氮气为雾化气体, 流速为3.0 L/min, 干气为1 L/min。碰撞气体为氩气, 碰撞电压为35 V, 400 ℃温度段内热气流速为10 L/min。界面温度为300 ℃, DL温度为250 ℃。
1.3 高效液相色谱法(HPLC)迷迭香酸标准品来自中国食品药品生物制品研究所(批号100963538, Sigma-Aldrich, USA; 纯度: 99%)。采用体积排阻色谱柱(Agilent5TC-C18, USA, Agilent), 在Daojin LC-20CE高效液相色谱系统上分析夏枯草提取物的含量。色谱柱为Elite Hypersil 18柱(5 pm, 250 nm×4.6 nm), 流动相为甲醇-0.1%甲酸(18:82, 0~20 min)和甲醇-0.1%甲酸(32:68, 20~60 min), 流速1.0 mL/min, 柱温30℃, 检测波长330 nm, 迷迭香酸≥5 000理论板数。
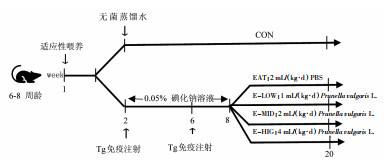
1.4 动物造模和药物干预造模和干预方法见图 1。雌性Lewis大鼠(LEW/Crl-113), 6~8周龄, 购自北京维通利华公司, 饲养于山东省立医院SPF级动物实验中心, 环境温度(24±2) ℃, 自由饮水, 光照: 黑暗=1:1。适应性喂养一周后, 随机分为EAT组和对照组(CON)。EAT模型造模方法如前所述[15]。简言之, 将Tg粉末溶解于浓度为0.2 mg/mL的磷酸盐缓冲溶液(PBS)中, 并与等体积的完全弗氏佐剂(CFA)混合。自第2周至第8周, EAT组大鼠每日饮用0.05%碘化钠溶液, CON组大鼠饮用无菌蒸馏水; 同时, 在第2周和第6周, 采用多点(颈部、双侧腹股沟、足垫)皮下注射方法对EAT组大鼠注射配置好的Tg/CFA溶液(200 μL/只)。第8周开始, 将EAT组大鼠随机分为模型对照组(EAT), 夏枯草低剂量组(E-LOW), 夏枯草中剂量组(E-MID), 夏枯草高剂量组(E-HIG), 每日通过灌胃分别给药2 mL/kg PBS, 1 mL/kg夏枯草提取液, 2 mL/kg夏枯草提取液, 4 mL/kg夏枯草提取液。连续灌胃12周后, 麻醉后经锁骨下静脉采集全血, 一部分离心分离血清, 一部分使用外周血单个核细胞(PBMCs)分离液提取外周血PBMCs; 通过颈正中切口轻轻分离两叶甲状腺。
|
| 图 1 动物造模和药物干预示意图 |
将大鼠上门齿和四肢固定在木板上, 使用脱毛膏清除颈部毛发, 由两名经验丰富的B超医生测量大鼠甲状腺的长径(a)、宽径(b)及厚径(c), 甲状腺体积计算公式为: 按公式V=π/6×a×b×c, 左、右叶及峡部相加为甲状腺总体积。
1.6 甲状腺H & E染色取出甲状腺后迅速用4%多聚甲醛固定, 组织脱水条件: 70%乙醇过夜, 80%乙醇30 min, 90%乙醇30 min, 95乙醇20 min, 95%乙醇20 min, 100%乙醇20 min, 二甲苯Ⅰ 30 min, 二甲苯Ⅱ 30 min, 二甲苯Ⅲ 30 min, 石蜡Ⅰ 1 h, 石蜡Ⅱ 1 h, 石蜡Ⅲ 1 h。
常规方法包埋、切片, 切片厚度3~4 μm, 56 ℃烤片2 h。H&E染色条件: 二甲苯Ⅰ 10min, 二甲苯Ⅱ 8 min, 二甲苯Ⅲ 8 min, 无水乙醇5 min, 90%乙醇3 min, 80%乙醇3 min, 70%乙醇2 min, 自来水冲洗5 min, 苏木素3 min, 自来水冲洗至水清, 1%盐酸乙醇分化3s, 自来水冲洗1 min, 1%伊红浸染5 min, 自来水冲洗1 min, 80%乙醇1 min, 95%乙醇1 min, 无水乙醇Ⅰ 2 min, 无水乙醇Ⅱ 2 min, 中性树胶封片, 晾干, 光镜下观察甲状腺的病理变化。
1.7 酶联免疫吸附测定(ELISA)血清样品制备: 使用2 mL一次性注射器穿刺大鼠锁骨下静脉取1.5~2 mL静脉血, 1 000×g离心15 min, 分离血清至微型离心(EP)管中, 血清短期保存于-20 ℃冰箱, 长期保存于-80 ℃冰箱。
脾组织样品制备: 脾脏取出后剪取一小部分, 用预冷的PBS冲洗后, 脾组织中加入适量生理盐水使用无菌注射器捣碎, 1 000×g离心10 min, 取上清液。
ELISA测定: 根据不同测定指标的试剂盒说明书进行相应的操作。
1.8 流式细胞术测外周血Th17淋巴细胞亚群外周血PBMCs悬液与胞内因子刺激剂共培养: 将刺激剂在37 ℃的水浴锅中完全融化, 每毫升细胞悬液中加入2 μL胞内因子刺激剂, 放入37 ℃ 5%CO2的细胞培养箱中孵育6 h; 收集细胞后, 离心, 弃上清; 加入2.5 mL PBS重悬, 离心, 弃上清; 再次加入2.5 mL PBS重悬, 离心, 弃上清; 用100 μL PBS重悬细胞, 准备标记抗体。
抗体标记: 使用移液器向细胞悬液中加入1 μL CD4-PE/CY7抗体, 冰上避光孵育25 min; 加入2 mL PBS重悬细胞, 离心, 弃上清; 重复上一步; 加入100 μL PBS; 向管底加入100 μL细胞固定液, 震荡, 离心, 避光孵育20~60 min; 加入2 mL 1×破膜液, 重悬细胞, 以400×g离心5 min, 弃上清; 再次加入1×破膜液, 重悬, 离心, 弃上清; 然后进行胞内染色, 管内留约100 μL的破膜液, 加入IL-17A-FITC, 室温避光孵育60 min; 管中加入2 mL 1×破膜液洗涤两次后, 弃上清, 加入150 μL 1×PBS PBS重悬, 加入150 μL的4%多聚甲醛; 用封口膜密封管口, 放入4 ℃冰箱中避光冷藏。
上机检测: 使用LSR Fortessa检测, 调电压调补偿后, 通过FlowJo软件(Tree Star Inc., Ashland, OR, USA)进行数据分析。
1.9 qRT-PCR检测脾脏和小肠中的SERT水平大鼠脾脏和小肠组织取材后迅速放入Triol中并在-80 ℃中保存, 组织总RNA提取按照试剂盒说明操作, 用紫外分光光度计测量OD值并计算RNA浓度; 根据RNA的量, 建立1个20 μL的反应体系, 在RT-PCR仪器中进行逆转录反应: 37 ℃ 15 min, 85 ℃ 5 s, 4 ℃冷却, -20 ℃保存; 在PCR仪上扩增: PCR反应条件:
引物由BioSune Biotechnology Co., Ltd.公司合成; 目的基因扩增用ΔΔCT法计算, A=CT(目的基因, 实验样本)-CT(内标基因, 实验样本), B=CT(目的基因, 对照样本)-CT(内标基因, 对照样本), K=A-B, 表达倍数=2-K, 采用β-actin为内参, 计算TPH1、SERT的CT值。SERT引物序列见表 1。
采用统计软件SPSS 21.0进行统计分析。正态分布的定量变量报告用均值±标准差(x±s)进行表示。采用单因素方差分析进行组间统计比较, 采用配对t检验进行两组间差异的统计比较, P<0.05为差异具有统计学意义。
2 结果 2.1 迷迭香酸是夏枯草的主要活性成分UPLC-ESI-MS/MS色谱图如下, 见图 2。通过匹配每个色谱峰的分子量, 共得到10个组分, 见表 2。迷迭香酸(Rosmarinic Acid)是夏枯草提取物的主要成分。
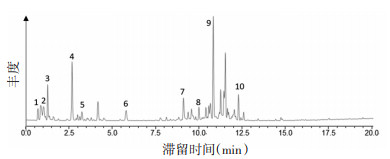
|
| 图 2 夏枯草提取物的UPLC-ESI-MS/MS色谱图 |
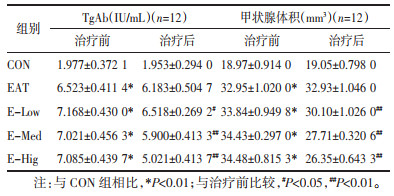
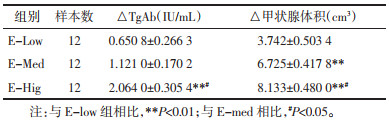
在夏枯草治疗前(第8周), 通过检测大鼠B超体积和血清TgAb水平, 确定大鼠造模成功, 结果表明, 如表 3所示, 相比于CON组, EAT造模的大鼠血清TgAb水平均显著升高(P<0.01), 甲状腺B超体积均显著增大(P<0.01), 结果提示EAT模型构建成功; 经过夏枯草治疗12周后, 再次检测大鼠血清TgAb和B超体积, 并比较治疗前后的差异(见表 3)和低中高剂量组治疗前后甲状腺体积和TgAb减少的差值(见表 4)。结果表明, 夏枯草各剂量治疗后TgAb均下降(P<0.05或P<0.01), 低、中剂量组的前后差值相比没有统计意义, 夏枯草高剂量组灌胃后降低TgAb的效果相最明显(2.064±0.305 4 IU/mL), 差值明显高于中剂量组(P<0.05)和低剂量组(P<0.01);夏枯草各剂量治疗后甲状腺体积均减小(P<0.01), 低、中、高剂量组大鼠灌胃后甲状腺体积较前分别减少3.742±0.503 4 mm3, 6.725± 0.417 8 mm3和8.133 ± 0.480 0 mm3, 分别下降11%, 19.5%和23.6%, 提示夏枯草口服液可呈剂量依赖性减少甲状腺的体积。
在夏枯草治疗结束后, 通过H & E切片观察各组大鼠甲状腺结构, 如图 3所示, CON组大鼠的甲状腺滤泡形态规则, 滤泡间无炎性细胞浸润; EAT组大鼠的甲状腺滤泡被大量破坏, 滤泡间可见大量的淋巴细胞浸润, 说明EAT模型造模成功。E-LOW组大鼠甲状腺滤泡间隙可见大量淋巴细胞浸润, 相比于EAT组治疗作用不明显; E-MID和E-HIG组中甲状腺内淋巴细胞浸润面积明显缩小, 说明中高剂量的夏枯草具有减轻甲状腺炎症的作用。
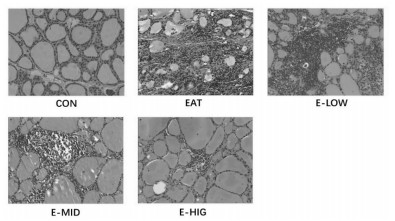
|
| 图 3 各组大鼠甲状腺组织形态和HE染色(×100) |
为了研究夏枯草水提物治疗EAT的机制, 我们通过流式细胞术检测了各组大鼠PBMCs中Th17细胞的表达, 结果表明, 相比于CON组, EAT组大鼠的Th17细胞比例显著增加(P<0.01), 经过治疗后夏枯草低中高剂量组PBMCs的Th17细胞比例显著增加(P<0.01, 见图 4); 通过ELISA方法检测大鼠血清中Th17细胞相关细胞因子IL-17A和IL-6, 如图 5所示, 相比与CON大鼠, EAT大鼠血清中的IL-17A和IL-6均升高(P<0.01), 经过夏枯草治疗后, EAT大鼠血清中IL-17A显著下降(P<0.01), IL-6虽有下降趋势, 但是没有统计学意义(P>0.01)。
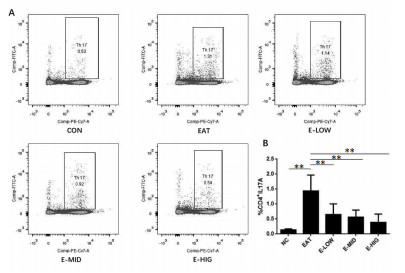
|
| 注:A.各组大鼠PBMCs中Th17的流式散点图;B.各组大鼠PBMCs中CD4+IL17A +抗体标记的Th17细胞的统计分析*P<0.05,**P<0.01。 图 4 夏枯草水提液降低大鼠PBMCs中Th-17淋巴细胞的水平 |
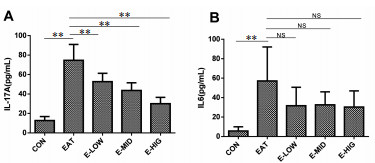
|
| 注:*P<0.05, **P<0.01。 图 5 夏枯草水提液对EAT大鼠血清IL-17A(A)和IL6(B)的影响 |
评估脾脏中SERT的表达。结果表明, 相比于CON组, EAT组脾脏中的SERT显著增加, 中高剂量组大鼠可以降低大鼠脾脏中SERT含量(P<0.01)。

|
| 注:*P<0.05, **P<0.01。 图 6 夏枯草水提液降低大鼠脾脏中SERT mRNA水平 |
与CON组大鼠相比, EAT大鼠脾脏和血清中5-HT下降(P<0.01), 经过夏枯草水提液治疗12周后, 低剂量大鼠脾脏和血清中5-HT无显著变化(P>0.01), 中高剂量组大鼠脾脏和血清中5-HT显著升高(P<0.01, 见图 7)。
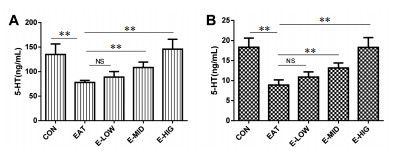
|
| 注:*P<0.05, **P<0.01。 图 7 夏枯草水提液提高大鼠脾脏(A)和血清(B)中5-HT水平 |
本实验中, 通过高碘水结合Tg免疫的方法建立了EAT模型, 该造模方法已经广泛应用于AIT的动物实验研究[16-17]。经过夏枯草水提液治疗后, 结果表明夏枯草可以有效降低EAT大鼠血清中TgAb和甲状腺体积, 减轻甲状腺内炎症浸润, 降低血清中过表达的Th17淋巴细胞比例, 结果还表明, 脾脏中5-HT水平增加可能是抑制Th17的机制。
夏枯草在人体和动物实验中已被证实具有治疗AIT的作用, 夏枯草口服液可以显著降低桥本甲状腺炎患者中TgAb和TPOAb水平[18], 夏枯草水提液可有效减轻EAT大鼠甲状腺内的炎性浸润, 降低自身免疫抗体, 调节Th1/Th2平衡[19]。本研究中, 结果与之前的研究结果一致[20], 夏枯草水提液减轻了EAT大鼠中的炎性细胞浸润, 降低了血清中自身免疫抗体, 减小了甲状腺体积, 证实该药物对EAT具有确切的治疗作用。尽管目前关于夏枯草治疗AIT的研究较多, 但是具体的治疗机制尚不明确, 为进一步研究夏枯草治疗EAT的机制, 我们进行了更深入的研究。
本实验中, 首先检测了大鼠PBMCs中CD4+IL-17+Th17淋巴细胞的比例, EAT大鼠Th17淋巴细胞相比于CON大鼠比例显著升高, 夏枯草治疗后的大鼠Th17淋巴细胞比例显著下降, 结果与之前的研究结果一致, 即桥本甲状腺炎患者外周血中Th17比例显著高于正常人, 服用夏枯草胶囊后可以降低Th17比例[21], 结果表明夏枯草水提液具有调节T淋巴细胞从而调节免疫的作用。
5-HT通过受体5-HT2AR作用于T淋巴细胞参与免疫反应, 推测夏枯草水提液可能通过调控5-HT的表达和活性发挥调节Th17的作用, 与预期一致, 本实验结果表明, EAT模型大鼠中, 脾脏中和外周血清中的5-HT下降; 夏枯草治疗后中高剂量组的血清中5-HT升高, 变化趋势与Th17一致。该结果与一项关于类风湿性关节炎的研究结果一致[22], Yasmine将分别将WT和Tph1-/-(Tph1为合成5-HT的限速酶)类风湿性关节炎小鼠的脾脏制成单细胞悬液, 并分别用或者不用不等浓度的5-HT进行体外培养, 72 h后通过ELISA法检测上清液中IL-17A含量, 结果表明, 相比于WT小鼠脾细胞上清中IL-17A含量, Tph1-/-小鼠脾细胞上清中IL-17A明显升高(P<0.05), Tph1-/-小鼠脾细胞与不同浓度5-HT共培养后的IL-17A水平显著下降(P<0.05), 接近WT小鼠脾细胞的IL-17A水平, 作者认为补充5-HT可以降低过度表达的Th17。另外, SERT具有转运摄取5-HT的功能, 本实验中, 还通过PCR验证了脾脏中SERT的含量, 结果表明, EAT模型组脾脏中SERT升高, 该结果与Cai等[23]在AIT小鼠模型中的研究结果一致, AIT小鼠的大脑额叶皮质SERT上升, 5-HT下降。本研究中, 经过夏枯草治疗后脾脏中SERT下降, 说明夏枯草提取物具有降低SERT减少5-HT再摄取, 从而提高体内5-HT水平的功效。
本实验中, 还检测了Th17的相关细胞因子IL-17A和IL-6, 与预期一致的是, IL-17A在治疗前后的变化与Th17一致, 即在EAT模型中升高, 夏枯草水提液治疗后下降, 值得注意的是, IL-6在EAT模型中升高, 该结果与Sun等[24]在自身免疫性甲状腺炎NOD.H-2h4小鼠模型中发现的血清IL-6的变化趋势一致, 但是治疗后的IL-6虽有下降的趋势却没有统计学意义, 探究其原因可能为: IL-17A和IL-6都可以诱导Th17分化, IL-6虽然在夏枯草治疗后有下降趋势, 但是没有统计学意义(P>0.05), 本研究结果认为IL-6下降可能不是引起Th17下降的主要原因, 夏枯草主要通过降低IL-17A发挥降低Th17的作用。
根据文献报道, IL-1β和TNF-α等促炎细胞因子可直接诱导中枢或者外周系统中SERT的表达[25-29], 而夏枯草已经被证实可有效降低EAT血清IL-17A、IL-6等细胞因子水平[30-31]。因此, 推测夏枯草提取物入血后可能是通过降低促炎细胞因子诱导了SERT的水平的下降。SERT可以回收5-HT, 促进5-HT被细胞内的单胺氧化酶降解, 在免疫系统中, 树突状细胞通过表达SERT, 将5-HT储存到囊泡中并调节T淋巴细胞的行为[32-33], T淋巴细胞是EAT发病机制中的主要细胞。夏枯草导致SERT水平降低, 减少了对5-HT的再摄入, 从而提高脾脏和PBMCs中的5-HT含量, 进一步调控体内表达5-HT受体(5- HTRs)的免疫细胞。体内增多的5-HT被脾脏淋巴结组织树突状细胞捕获, 呈递抗原给T细胞, 抑制Th17细胞分化, 同时可能通过血液迁移到甲状腺组织发挥作用发挥免疫调节作用[23]。
桥本甲状腺炎在归属于中医"瘿病"范畴, 气滞、痰浊、血瘀壅结于颈前是发病的重要病机, 《诸病源候论》认为该病"由忧恚气结所生", 现代研究也认为, 情绪压力导致代谢紊乱或者免疫失调进而参与EAT发病, 因此EAT发病与情志变化密切相关[34]。5-HT在中枢系统具有调节情绪的作用, 在外周具有调节免疫的作用, 因此, 5-HT可能是治疗EAT的一个新的切入点, 深入研究通过调控5-HT治疗EAT具有重要的临床意义。
| [1] |
PYZIK A, GRYWALSKA E, MATYJASZEK-MATUSZEK B, et al. Immune disorders in Hashimoto's thyroiditis: what do we know so far?[J]. Journal of Immunology Research, 2015, 2015: 979167. |
| [2] |
IDDAH M A, MACHARIA B N. Autoimmune thyroid disorders[J]. ISRN Endocrinology, 2013, 2013(7): 509764. |
| [3] |
ZIMMERMANN M B, BOELAERT K. Iodine deficiency and thyroid disorders[J]. The Lancet Diabetes & Endocrinology, 2015, 3(4): 286-295. |
| [4] |
LATINA A, GULLO D, TRIMARCHI F, et al. Hashimoto's thyroiditis: similar and dissimilar characteristics in neighboring areas. Possible implications for the epidemiology of thyroid cance[J]. PLoS One, 2013, 8(3): e55450. DOI:10.1371/journal.pone.0055450 |
| [5] |
陆再英, 钟南山. 内科学[M]. 第7版. 北京: 人民卫生出版社, 2008. LU Z Y, ZHONG N S. Internal Medicine[M]. 7th edition. Beijing: People's Medical Publishing House, 2008. |
| [6] |
TOMARI S, WATANABE M, INOUE N, et al. The polymorphisms in the thyroid peroxidase gene were associated with the development of autoimmune thyroid disease and the serum levels of anti-thyroid peroxidase antibody[J]. Endocrine Journal, 2017, 64(10): 1025-1032. DOI:10.1507/endocrj.EJ17-0191 |
| [7] |
ZHUANG X Y, XU H Y, FANG Z M, et al. Platelet serotonin and serotonin transporter as peripheral surrogates in depression and anxiety patients[J]. European Journal of Pharmacology, 2018, 834(7): 213-220. |
| [8] |
KUPFER D J, FRANK E, PHILLIPS M L. Major depressive disorder: new clinical, neurobiological, and treatment perspectives[J]. The Lancet, 2012, 379(9820): 1045-1055. DOI:10.1016/S0140-6736(11)60602-8 |
| [9] |
BRAMBILLA F, DALLE GRAVE R, CALUGI S, et al. Effects of cognitive-behavioral therapy on eating disorders: neurotransmitter secretory response to treatment[J]. Psychoneuroendocrinology, 2010, 35(5): 729-737. DOI:10.1016/j.psyneuen.2009.10.014 |
| [10] |
YANG Y, ZHU X W, QIN Y F, et al. The anti-inflammatory effect of guchangzhixie-pill by reducing colonic EC cell hyperplasia and serotonin availability in an ulcerative colitis rat model[J]. Evidence-Based Complementary and Alternative Medicine, 2017, 2017(7): 8547257. |
| [11] |
蔡瑶俊. 桥本甲状腺炎对小鼠情绪行为的影响及其神经炎性机制研究[D]. 合肥: 安徽医科大学, 2019. CAI Y J. The effect of hashimoto's thyroiditis on emotional behavior in mice and its neuroinflammatory mechanisms[D]. Hefei: Anhui Medical University, 2019. |
| [12] |
SCHOENICHEN C, BODE C, DUERSCHMIED D. Role of platelet serotonin in innate immune cell recruitment[J]. Frontiers in Bioscience(Landmark Edition), 2019, 24(3): 514-526. DOI:10.2741/4732 |
| [13] |
夏枯草口服液治疗甲状腺肿大/结节类甲状腺疾病临床应用专家共识[J]. 中草药, 2020, 51(8): 2082-2087. Expert consensus statement on treatment of goiter/nodular thyroid disease with Xiakucao Oral Liquid in clinical practice[J]. Chinese Traditional and Herbal Drugs, 2020, 51(8): 2082-2087. |
| [14] |
郑慧娟, 魏璠, 柏力萄, 等. 基于中医传承辅助系统治疗桥本甲状腺炎的组方规律[J]. 世界中医药, 2018, 13(9): 2346-2351. ZHENG H J, WEI F, BAI L T, et al. Analysis on composition principles of prescriptions for Hashimoto thyroiditis by using traditional Chinese medicine inheritance system[J]. World Chinese Medicine, 2018, 13(9): 2346-2351. DOI:10.3969/j.issn.1673-7202.2018.09.060 |
| [15] |
QIU H B, ZHANG J P, GUO Q L, et al. Prunella vulgaris L. attenuates experimental autoimmune thyroiditis by inducing indoleamine 2, 3-dioxygenase 1 expression and regulatory T cell expansion[J]. Biomedecine & Pharmacotherapie, 2020, 128(7): 110288. |
| [16] |
余欣然. 夏枯草胶囊对自身免疫性甲状腺炎大鼠Treg细胞的影响及免疫调节机制研究[D]. 武汉: 湖北中医药大学, 2018. YU X R. The research of the effection of Prunella Capsule on treg cells and immunomodulatory mechanismin in rats with autoimmune thyroiditis[D]. Wuhan: Hubei University of Chinese Medicine, 2018. |
| [17] |
CUI S L, YU J, SHOUJUN L. Iodine intake increases IP-10 expression in the serum and thyroids of rats with experimental autoimmune thyroiditis[J]. International Journal of Endocrinology, 2014, 2014(7): 581069. |
| [18] |
任建民, 吴茂红. 夏枯草口服液辅助治疗桥本氏病甲状腺功能减低的临床观察[J]. 中日友好医院学报, 2006, 20(5): 315. REN J M, WU M H. Clinical observation of Prunella Oral Liquid in adjuvant treatment of Hashimoto's disease hypothyroidism[J]. Journal of China-Japan Friendship Hospital, 2006, 20(5): 315. DOI:10.3969/j.issn.1001-0025.2006.05.020 |
| [19] |
俞灵莺, 傅晓丹, 章晓芳, 等. 夏枯草干预实验性自身免疫甲状腺炎Th1/Th2失衡的研究[J]. 中华全科医学, 2018, 16(5): 725-728, 743. YU L Y, FU X D, ZHANG X F, et al. Effects of the aqueous extract of Prunella vulgaris on Th1/Th2 equilibrium in rats with experimental autoimmune thyroiditis[J]. Chinese Journal of General Practice, 2018, 16(5): 725-728, 743. |
| [20] |
傅晓丹, 章晓芳, 马丽珍, 等. 夏枯草水提液对实验性自身免疫性甲状腺炎的治疗作用及机制研究[J]. 浙江医学, 2020, 42(9): 893-897, 990. FU X D, ZHANG X F, MA L Z, et al. Effect of aqueous extract of Prunella vulgaris on experimental autoimmune thyroiditis in rats[J]. Zhejiang Medical Journal, 2020, 42(9): 893-897, 990. |
| [21] |
刘婧茹, 王清. 夏枯草胶囊对桥本甲状腺炎患者自身抗体及Th17细胞的影响[J]. 中国老年学杂志, 2012, 32(24): 5413-5415. LIU J R, WANG Q. Effects of Xiakucao Capsules on autoantibodies and Th17 cells in patients with Hashimoto's thyroiditis[J]. Chinese Journal of Gerontology, 2012, 32(24): 5413-5415. DOI:10.3969/j.issn.1005-9202.2012.24.023 |
| [22] |
CHABBI-ACHENGLI Y, COMAN T, COLLET C, et al. Serotonin is involved in autoimmune arthritis through Th17 immunity and bone resorption[J]. The American Journal of Pathology, 2016, 186(4): 927-937. DOI:10.1016/j.ajpath.2015.11.018 |
| [23] |
CAI Y J, WANG F, CHEN Z X, et al. Hashimoto's thyroiditis induces neuroinflammation and emotional alterations in euthyroid mice[J]. Journal of Neuroinflammation, 2018, 15(1): 299. DOI:10.1186/s12974-018-1341-z |
| [24] |
SUN X R, GUAN H X, PENG S Q, et al. Growth arrest-specific protein 6 (Gas6) attenuates inflammatory injury and apoptosis in iodine-induced NOD.H-2h4 mice[J]. International Immunopharmacology, 2019,, 73(6): 333-342. |
| [25] |
HOCHSTRASSER T, ULLRICH C, SPERNER-UNTERWEGER B, et al. Inflammatory stimuli reduce survival of serotonergic neurons and induce neuronal expression of indoleamine 2, 3-dioxygenase in rat dorsal raphe nucleus organotypic brain slices[J]. Neuroscience, 2011, 184(8): 128-138. |
| [26] |
ZUNSZAIN P A, ANACKER C, CATTANEO A, et al. Interleukin-1β: a new regulator of the kynurenine pathway affecting human hippocampal neurogenesis[J]. Neuropsychopharmacology, 2012, 37(4): 939-949. DOI:10.1038/npp.2011.277 |
| [27] |
ZHU C B, BLAKELY R D, HEWLETT W A. The proinflammatory cytokines interleukin-1beta and tumor necrosis factor-alpha activate serotonin transporters[J]. Neuropsychopharmacology, 2006, 31(10): 2121-2131. DOI:10.1038/sj.npp.1301029 |
| [28] |
MALYNN S, CAMPOS-TORRES A, MOYNAGH P, et al. The pro-inflammatory cytokine TNF-α regulates the activity and expression of the serotonin transporter(SERT) in astrocytes[J]. Neurochemical Research, 2013, 38(4): 694-704. DOI:10.1007/s11064-012-0967-y |
| [29] |
ZHU C B, LINDLER K M, OWENS A W, et al. Interleukin-1 receptor activation by systemic lipopolysaccharide induces behavioral despair linked to MAPK regulation of CNS serotonin transporters[J]. Neuropsychopharmacology: Official Publication of the American College of Neuropsychopharmacology, 2010, 35(13): 2510-2520. DOI:10.1038/npp.2010.116 |
| [30] |
SACRAMENTO P M, MONTEIRO C, DIAS A S O, et al. Serotonin decreases the production of Th1/Th17 cytokines and elevates the frequency of regulatory CD4+ T-cell subsets in multiple sclerosis patients[J]. European Journal of Immunology, 2018, 48(8): 1376-1388. DOI:10.1002/eji.201847525 |
| [31] |
卢旻昱. 夏枯草对自身免疫性甲状腺炎大鼠的药效及作用机制研究[D]. 成都: 成都中医药大学, 2019. LU M Y. The research of the pesticide effect and mechanism of Prunella vulgaris on rats with autoimmune thyroiditis[D]. Chengdu: Chengdu University of traditional Chinese medi- cine, 2019. |
| [32] |
余欣然, 向楠. 夏枯草对AIT大鼠TSH、TGAb、TPOAb及Th相关细胞因子表达的调节作用研究[J]. 国际检验医学杂志, 2018, 39(13): 1543-1546. YU X R, XIANG N. Explore the effect of Prunella vulgaris on TSH, TGAb, TPOAb and Th cell-related cytokine expression in AIT rats[J]. International Journal of Laboratory Medi- cine, 2018, 39(13): 1543-1546. DOI:10.3969/j.issn.1673-4130.2018.13.003 |
| [33] |
PAPANICOLAOU D A, CHROUSOS G P. Interactions of the endocrine and immune systems in children and young adults[J]. Current Opinion in Pediatrics, 1995, 7(4): 440-444. DOI:10.1097/00008480-199508000-00017 |
| [34] |
TSATSOULIS A. The role of stress in the clinical expression of thyroid autoimmunity[J]. Annals of the New York Academy of Sciences, 2006, 1088(8): 382-395. |
 2022, Vol. 41
2022, Vol. 41