文章信息
- 吕佳霖, 王荣荣, 贺明帅, 姜苗苗
- LYU Jialin, WANG Rongrong, HE Mingshuai, JIANG Miaomiao
- 基于网络药理学探讨女贞子治疗动脉粥样硬化的作用机制
- Study on anti-atherosclerotic effect of Ligustrum lucidum based on network pharmacology
- 天津中医药大学学报, 2022, 41(4): 498-506
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(4): 498-506
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.04.18
-
文章历史
收稿日期: 2022-03-15
动脉粥样硬化(AS)是心血管疾病中常见的疾病, 为缺血性心血管疾病的主要病理基础。AS的主要表现为动脉脂质沉积、平滑肌细胞和纤维基质增殖发展成AS斑块, 这些病变或斑块引起动脉管腔的狭窄和弹性变弱, 导致相应器官缺血性改变, AS斑块保持稳定数年, 但可迅速变得不稳定, 导致血管破裂并引起血栓[1-5]。然而, AS斑块的存在除对血管管腔有影响外, 与急性心血管事件的风险增加也有密切联系, 如心肌梗死和中风[6]。随着中国心血管病患病率持续上升, 心血管疾病死亡率也在不断提高, 且患病逐渐年轻化[7]。现代研究表明AS的发生发展与血脂代谢异常、炎症的形成以及血管内皮细胞损伤关系密切[8]。中医理论认为, AS的基本病理机制多为气虚血瘀[9], 由于"脾病"运化功能失调引起痰浊内生, 心气血阴阳不足导致血液运行无力, 血瘀脉内[10]。目前, 中医药在抗AS方面的研究用药主要包括滋补肝肾类、活血化瘀以及消痰降脂类, 该类药材具有多靶点、多环节、多方向的抗AS的作用机制, 而且毒副作用较小, 对于AS这种发病机制复杂的疾病有其独特的治疗优势[7]。
女贞子为木犀科植物女贞(Ligustrum lucidum Ait.)成熟果实直接干燥所得, 又可称为冬青子, 主要产于中国南方各省份。归肝、肾经, 具有滋补肝肾之效[11]。常用的是其炮制品, 酒女贞子。目前, 从女贞子属中分离到的化合物主要为三萜类, 环烯醚萜类, 苯乙醇类, 黄酮类以及多糖类等化合物, 具有广泛的药理活性, 临床常用于治疗高血糖高血脂、冠心病、脱发、免疫低下等以及化疗后的辅助治疗[12]。研究表明, 女贞子能够通过调节胆固醇和心率使其均恢复正常, 从而改善血脂指标和心肌供血功能[13]。此外, 女贞子还能抑制兔子主动脉血管内皮粥样斑块的形成, 减少AS斑块的面积[14]。AS发生发展过程十分复杂, 女贞子在抗AS方面的研究还不够全面, 其对抗AS有效成分和作用机制的研究也不够完善。
本文旨在通过网络药理学分析女贞子治疗AS的主要活性成分、作用的核心靶点以及潜在复杂的网络关系, 为揭示女贞子作用机制提供科学的参考, 为开发抗AS药物提供可靠的理论依据。
1 实验材料与方法 1.1 材料酒女贞子药材(批号201015)购于北京同仁堂药店。特女贞苷(批号wkq20032004, 纯度≥98%)、芹菜素(批号19112608, 纯度≥98%)、木犀草素(批号: C29N10Q104574, 纯度≥98%)、红景天苷(批号wkq20021708, 纯度≥98%)、辛伐他汀(批号S24506, 纯度≥98%), 购于上海源叶生物科技有限公司; 毛蕊花糖苷(批号19082201, 纯度≥98%), 购于天津众合有限公司。
1.2 女贞子中化学成分的筛选及靶点预测基于TCMSP数据库(https://tcmspw.com/tcmsp.php)和文献整理女贞子中的主要化学成分[15], 将化学分子结构以SDF的格式上传至PharmMapper数据库[16-18](http://www.lilab-ecust.cn /pharmmapper/)。以对接结果Norm Fit ≥ 0.9为筛选条件, 通过Uniprot数据库(https://www.uniprot.org/)并对化合物靶点进行校正。为了说明靶点蛋白在系统上的作用, 将女贞子潜在靶点信息上传数据库STRING 11.0(https://string-db.org), 限定研究物种为"Homo sapiens"(以下所有操作均默认此条件), 最低相互作用阈值取最高等"highest confidence(≥0.9)", 其余参数默认, 得到蛋白互作信息。将从STRING数据库导出的文件, 导入Cytoscape 3.6.1绘制蛋白质互作网络, 利用Cytoscape中Network Analyzer功能, 得到度值等重要参数。
1.3AS疾病靶点与共有靶点以及GO分析与KEGG分析通过TTD[19](https://db.idrblab.org/ttd/)、DisGeNET[20](http://www.disgenet.org/)、Drugbank(https://www.drugbank.com/)[21]数据库分别以疾病名称"atherosclerosis"进行检索, 根据不同数据库的筛选条件, 将筛选结果汇总在一起, 得到AS疾病靶点。通过标准化数据库Uniprot获得靶点的uniprot ID和靶点基因名。且上传化合物和疾病靶点至Venny 2.1.0网页版(https://bioinfogp.cnb.csic.es/tools/venny/index.html)绘制韦恩图, 获得化合物与疾病共有靶点, 并对其通过STRING数据库进行网络拓扑分析, 得到蛋白相互作用(PPI)关系, 利用Cytoscape 3.6.1绘制蛋白质互作网络, 使用"Network Analyzer"功能, 得到度值等重要参数。同时, 在STRING数据库中对共有靶点进行GO分析和KEGG通路分析。
1.4 化学成分液相色谱分析酒女贞子粉粹, 精密称取0.60 g女贞子粉末, 加入80%甲醇-水25 mL, 超声提取30 min, 离心, 取上清, 4 ℃保存备用。精密称取特女贞苷、红景天苷、毛蕊花糖苷、木樨草素、芹菜素标准品分溶于80%甲醇, 浓度分别为1、1、0.04、0.01、0.04 mg/mL, 离心, 取上清, 备用。使用UPLC液相(仪器型号: Waters H class plus)采集女贞子样品和对照品混合图谱。选用色谱柱CORTECS UPLC C18(2.1×100 mm, 1.6 μm); 流动相为乙腈(A)-0.1% 甲酸水(B)溶液; 液相洗脱梯度为0~2 min, 2%~5%A; 2~15 min, 5%~18%A; 15~30 min, 18%~25%A; 30~35 min, 25%~65%A; 进样量为3 μL; 流速为0.3 mL/min; 检测波长设置为254 nm, 柱温为30 ℃。
1.5 巨噬细胞泡沫化及胆固醇含量的测定将RAW264. 7细胞复苏后, 用含有10%胎牛血清的DMEM高糖培养基, 置于37 ℃, 5% CO2培养箱中恒温孵育。观察细胞生长状况, 及时更换培养液或进行传代。实验分为5组, 模型组给予50 μg/mL ox-LDL(广州奕源生物技术有限公司)诱导24 h; 红景天苷组(SA)给予50 μg/mL ox-LDL和10 μmol/L红景天苷共培养24 h; 毛蕊花糖苷组(AC)给予50 μg/mL ox-LDL和10 μmol/L毛蕊花糖苷共培养24 h; 辛伐他汀组(SI)给予50 μg/mL和10 μmol/L辛伐他汀共培养24 h; 空白对照组给予等量DMEM培养基24 h。
细胞经上述处理后, 弃去细胞培养基, PBS清洗后弃液, 加入多聚甲醛固定液, 固定20 min, 弃去固定液; 磷酸盐缓冲溶液(PBS)清洗后弃液, 加入60%异丙醇浸洗5 min, 弃去60%异丙醇; 加入油红O试剂(油红O染色试剂盒, 索莱宝生物科技有限公司, 批号20201126)进行染色, 弃去染色液, 加入蒸馏水清洗数次, 蒸馏水覆盖细胞, 在光学显微镜下观察, 拍照。采集图像, 用Image J pro Plus 6.0分析软件对实验结果进行分析。
各组细胞弃去细胞培养基, PBS清洗后制备细胞裂解液, 用于细胞内总蛋白质(蛋白浓度测定试剂盒, 南京建成有限公司, 批号20201228)和总胆固醇含量(总胆固醇测定试剂盒, 南京建成有限公司, 批号20201220)的测定。
1.6 统计学分析应用GraphPad Prism 8软件分析数据, 数据以平均值±标准差(x±s)表示选择单因素方差分析检验组间是否具有显著性差异, 空白组与模型组之间比较采用#P<0.05, ##P<0.01和###P<0.001表示, 治疗组与模型组之间采用*P<0.05, **P<0.01和***P<0.00表示。
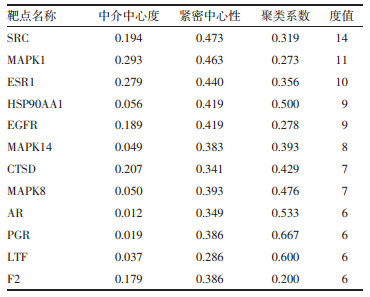
2 结果 2.1 对女贞子中主要化学成分进行靶点预测通过TCMSP数据库与文献整理汇总得到女贞子的主要成分有28个, 其中苯乙醇类8个, 环烯萜类11个, 黄酮类7个, 三萜类2个。苯乙醇苷类化合物分别为红景天苷、毛蕊花糖苷等; 环烯醚萜类有特女贞苷、橄榄苦苷、新女贞苷等; 黄酮类有木犀草素、芹菜素等; 三萜类有齐墩果酸和熊果酸。根据PharmMapper数据库以及经过文献检索, 最终获得女贞子化合物的潜在靶点102个, 对102个靶点蛋白利用STRING数据库进行相互作用分析, 关系网络中关键节点信息, 见表 1。
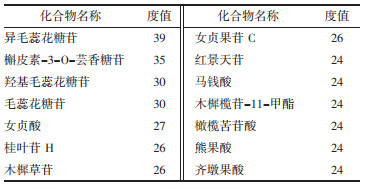
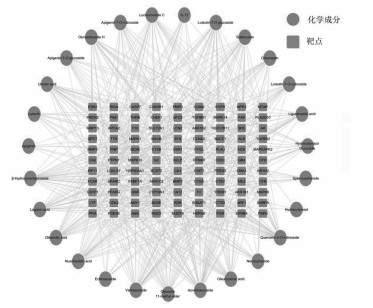
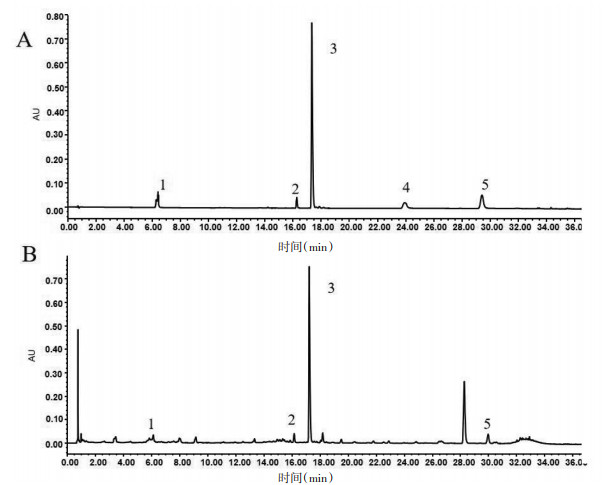
女贞子化合物化学成分及对应预测靶点上传至Cytoscape构建女贞子"成分-靶点"网络图, 见图 1。总共包括537条边和138个节点, 其中化合物节点28个, 靶点110个。在网络中, 度值表示节点在网络中和节点相连路线的条数, 该数值越大则表明该化合物发挥作用的可能性越大。根据网络中度值大于等于2倍中位数进行确定关节成分及靶点, 共筛选得到14个核心化学成分, 见表 2, 推测这些成分为女贞子抗AS的重要组成。通过与标准对照品比对, 从酒炙女贞子中发现4种化合物, 见图 2。其中苯乙醇苷类化合物红景天苷和毛蕊花糖苷为网络药理学预测和色谱分析中得到的共性成分, 因此, 本研究后续会对红景天苷及毛蕊花糖苷抗AS进行细胞活性评价。
|
| 图 1 化合物-靶点网络 |
|
| 注:1. 红景天苷;2. 毛蕊花糖苷;3. 特女贞苷;4. 木犀草素;5. 芹菜素。 图 2 混合对照品UPLC图谱(A)和酒炙女贞子样品UPLC图谱(B) |
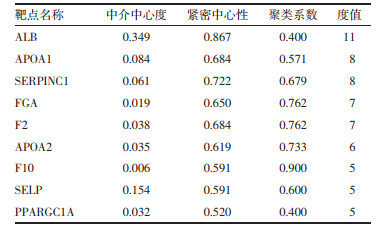
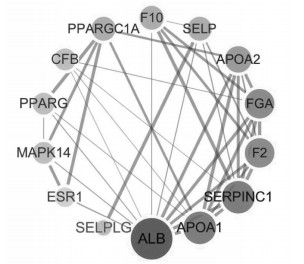
利用TTD、DisGeNET、Drugbank 3个靶点数据库分别以疾病名称"atherosclerosis"进行检索, 通过疾病靶点标准化数据库Uniprot校正, 共得到170个AS疾病相关疾病的靶点。将328个成分靶点与170个疾病靶点经Venny 2.1映射后得到9个共有靶点。将9个共同靶点导入STRING数据库中扩展靶点, 构建共有靶点PPI网络, 将结果以文本形式导出, 然后导入Cytoscape3.6.1软件中, 利用网络分析插件进行网络拓扑分析自由度≥5的靶点有9个, 其在网络中的具体参数信息详见表 2, 相互作用关系, 见图 3。
|
| 图 3 女贞子共有靶点PPI网络 |
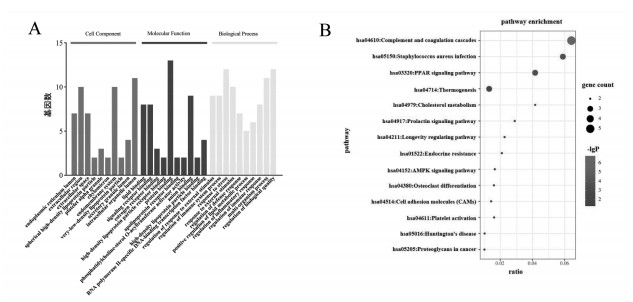
将上述核心靶蛋白基因上传至STRING数据库进行GO富集分析, 设置条件P<0.05, 最终筛选得到352条GO条目。其中生物过程BP相关条目295条, 主要涉及对外界刺激反应的调节、免疫系统过程调节、对压力的反应、脂质代谢过程的正调控等; 分子功能相关条目有40条, 主要涉及脂质结合、信号受体结合、雌激素受体结合、高密度脂蛋白颗粒受体结合、载脂蛋白受体结合等; 细胞组成相关条目有17条, 主要涉及内质网内腔、胞外区、球形高密度脂蛋白颗粒、极低密度脂蛋白颗粒等。结果显示, AS参与多个生物学过程, 且参与脂质代谢过程中, 表明可能通过调节这些生物过程起到治疗AS的作用。将上述得到的GO条目根据P值从小到大分别排序筛选得到前10个条目, 将其以柱状图展示, 见图 4(A)。
|
| 图 4 抗AS-GO富集分析(A)和女贞子成分-疾病靶点的KEGG通路分析(B) |
使用STRING数据库对9个共有靶点进行KEGG通路分析, 根据P值<0.05并结合相关文献进行筛选, 得到与AS相关通路14条, 主要涉及到补体途径、PPAR信号通路、胆固醇代谢等, 将14条信号通路上传至Sangerbox工具进行可视化处理, 气泡图, 见图 4(B)。
利用Cytoscape 3.6.1软件得到"女贞子成分-靶点-KEGG信号通路"的多维网络, 见图 5。网络图谱显示女贞子中的毛蕊花糖苷、红景天苷等化学成分可能是间接通过APOAⅡ、SELP等靶点来调节AMPK、PPAR信号通路及胆固醇代谢通路起到治疗AS的作用。

|
| 图 5 成分-靶点-相关网络图 |
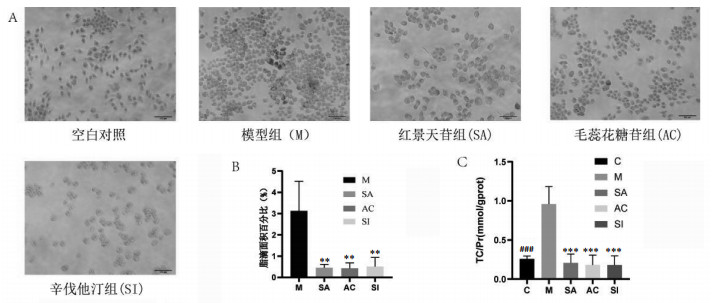
油红O染色结果显示, 细胞经ox-LDL处理后呈现细胞体积增大, 且胞浆内有大量的红色脂滴存在, 呈现典型的细胞泡沫化形态特征, 见图 6。空白对照组细胞内无明显红色脂滴, 红景天苷、毛蕊花糖苷与模型相比红色脂滴明显变小。分析结果显示, 红景天苷和毛蕊花糖苷能抑制ox-LDL所致细胞内脂滴的形成, 改善细胞泡沫化。
|
| 注:治疗组与模型组相比较,**P<0.01,***P<0.001;空白对照组与模型组相比,###P<0.001。 图 6 (A)毛蕊花糖苷和红景天苷对泡沫化细胞的影响(200×)和(B)油红O染色脂滴面积百分比(n=3)以及(C)化合物对细胞内胆固醇水平的影响(n=3) |
与正常对照组相比, 模型组细胞内总胆固醇含量明显升高(P<00.001), 化合物处理组细胞内胆固醇含量显著降低差异(P<00.001)。表明化合物降低胆固醇积累效果良好, 能够显著调节ox-LDL诱导的RAW264.7泡沫化细胞脂质代谢。见图 6 C。
3 讨论女贞子化学成分多样, 药理作用广泛。AS的基本病机为"本虚标实", 气阴两虚为本, 痰、瘀、毒为标, 治疗上益气养阴治其本, 活血、化痰、解毒治其标[22]。研究表明女贞子具有保肝作用、降血脂作用, 降低主动脉粥样斑块血管内皮细胞生长因子表达, 抑制血管内斑块的形成, 减少AS斑块的面积的作用[23-25]。网络分析结果表明女贞子中的活性成分异毛蕊花糖苷、羟基毛蕊花糖苷、毛蕊花糖苷、红景天苷、女贞酸等可能为女贞子抗AS的主要成分。毛蕊花糖苷是一种具有抗氧化、抗炎、抗肿瘤等多种生理活性的水溶性苯乙醇类化合物, 其作用机制广泛[26]。AS的发生机制与多种并发症相关, 其中血小板聚集为AS的发病机制之一。有临床研究表明, 连续服用毛蕊花糖苷(100 mg/d)两周能够显著降低有心血管疾病危险因素的志愿者的血小板聚集, 且几乎没有不良反应, 表明毛蕊花糖苷对心血管具有良好的保护作用[27]。此外, 低密度脂蛋白胆固醇是心血管疾病的主要危险因素, 氧化修饰的低密度脂蛋白在AS的发生和进展中具有重要作用[28-29]。Martin-Nizard等[30]研究发现毛蕊花糖苷能够抑制氧化低密度脂蛋白诱导的细胞毒性, 而抑制脂质过氧化可能是这些分子发挥细胞保护作用的关键机制。而且, Martin-Nizard等[31]发现毛蕊花糖苷对Cu-LDL诱导的血管内皮细胞内皮素有促进作用, 该结果表明毛蕊花糖苷对血管内皮细胞起到良好的保护作用。以上研究均表明毛蕊花糖苷具有治疗AS的潜在价值。大量研究表明红景天苷对抗AS有显著作用, 具有保护内皮功能, 并从AS的发生、发展至恶化的整个过程进行干预, 有望成为治疗AS的重要手段[32]。Sun等[33]研究发现红景天苷可减少细胞内脂质沉积, 延缓内皮细胞衰老进程, 抑制衰老相关分子的表达, 并使视网膜母细胞瘤蛋白磷酸化。Zhu等[34]用ox-LDL诱导HUVECs细胞建立体外AS模型, 不同浓度的红景天苷处理HUVECs细胞, 结果表明红景天苷能够显著提高ox-LDL诱导的HUVECs细胞的活性, 且红景天苷减弱ox-LDL引起的HUVECs的氧化应激, 起到抗AS的作用。
蛋白质互作网络显示女贞子中的有效成分可能是通过APOAⅡ(载脂蛋白)、ESR1(雌激素受体1)、F10(人源全长重组蛋白)、SELP(重组蛋白)、PPARGγ(过氧化物酶体增生激活受体γ)、MAPK14(丝裂原活化蛋白激酶)等共有靶点起作用。APOAⅡ是高密度脂蛋白的主要蛋白质成分, 也是HDL代谢的关键调节因子, 能有效运输PON和PAF-AH等抗氧化酶, 从而保护VLDL免受氧化, 起到对心血管疾病多种保护作用[35]。SELP与AS早期的形成息息相关[36]。AS是一种炎症性疾病, 涉及循环白细胞向血管内皮的募集和粘附, SELP是黏附分子选择素家族的一员, 它能启动白细胞的滚动, 并介导白细胞与内皮、血小板与内皮的相互作用[37]。
GO分析结果显示, 女贞子治疗动脉粥样硬化途径主要涉及到脂质代谢、脂质结合等过程。KEGG通路结果显示女贞子可能通过调节PPAR信号通路、胆固醇代谢、AMPK信号通路等起到治疗AS的作用。PPAR信号通路发挥脂质代谢调节作用, 加速胆固醇逆向转运[38]。AMPK激活诱高密度脂蛋白介导的巨噬细胞胆固醇外流, AMPK活化可通过增加AS血管壁中的胆固醇流出来改善血管功能[39]。
总胆固醇含量过高会引起粥样斑块的沉积, 加剧AS病变进程。因此, 调节巨噬细胞内胆固醇和代谢的平衡, 有助于抑制泡沫化细胞的形成, 从而降低AS病变的发生。在细胞验证实验中, 通过油红O染色检测化合物干预后的泡沫细胞内的脂质沉积, 证实了红景天苷、毛蕊花糖苷能够有效减少ox-LDL诱导的巨噬细胞泡沫化; 通过细胞内总胆固醇测定, 证明了红景天苷和毛蕊化糖苷能够有效降低细胞内总胆固醇水平。此结果与网络药理学预测结果-红景天苷和毛蕊花糖苷可能是女贞子中抗AS作用化学成分一致。
本研究借助网络药理学平台, 预测了女贞子的活性成分和作用靶点, 分析了其抗AS的潜在分子机制。同时, 细胞实验初步验证了女贞子中苯乙醇苷类化学成分红景天苷和毛蕊花糖苷能够改善ox-LDL诱导的细胞泡沫化水平, 降低细胞内总胆固醇的含量。后续还需对其机制作进一步深入研究。该研究从整体水平, 预测和分析了女贞子治疗AS的作用机制, 为后续女贞子的开发和利用起到很好的指导作用。然而, AS的病因与多种因素相关且确切病因尚不明确, 以及目前网络药理学的还处于发展初期的局限性, 后续有待进一步探究。
| [1] |
刘俊田. 动脉粥样硬化发病的炎症机制的研究进展[J]. 西安交通大学学报(医学版), 2015, 36(2): 141-152. LIU J T. Progress in inflammatory pathogenesis of atherosc- lerosis[J]. Journal of Xi'an Jiaotong University (Medical Sciences), 2015, 36(2): 141-152. |
| [2] |
MACH F, BAIGENT C, CATAPANO A L, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk[J]. European Heart Journal, 2020, 41(1): 111-188. DOI:10.1093/eurheartj/ehz455 |
| [3] |
GLASS C K, WITZTUM J L. Atherosclerosis. the road ahead[J]. Cell, 2001, 104(4): 503-516. DOI:10.1016/S0092-8674(01)00238-0 |
| [4] |
ROBINSON J G, FOX K M, BULLANO M F, et al. Athero- sclerosis profile and incidence of cardiovascular events: a population-based survey[J]. BMC Cardiovascular Disorders, 2009, 9(2): 46. |
| [5] |
ZHU Y H, XIAN X M, WANG Z Z, et al. Research progress on the relationship between atherosclerosis and inflammation[J]. Biomolecules, 2018, 8(3): 80. DOI:10.3390/biom8030080 |
| [6] |
EMINI VESELI B, PERROTTA P, DE MEYER G R A, et al. Animal models of atherosclerosis[J]. European Journal of Pharmacology, 2017, 816(11): 3-13. |
| [7] |
马丽媛, 吴亚哲, 陈伟伟. 中国心血管病报告2018要点介绍[C]. 中华高血压杂志, 2019(8): 712-716. MA L Y, WU Y Z, CHEN W W, et al. China cardiovascular disease report[J]. Chinese Journal of Hypertension, 2019, 27(8), 712-716 |
| [8] |
张强, 罗毅. 动脉粥样硬化中药治疗机制的研究进展[J]. 中西医结合心血管病电子杂志, 2019, 7(11): 1-2, 4. ZHANG Q, LUO Y. Advances in research on therapeutic mechanisms of traditional Chinese medicine for atherosclerosis[J]. Cardiovascular Disease Electronic Journal of Integrated Traditional Chinese and Western Medicine, 2019, 7(11): 1-2, 4. |
| [9] |
钱吉利, 高倩萍. 动脉粥样硬化治疗的研究进展[J]. 医学综述, 2017, 23(15): 2993-2997. QIAN J L, GAO Q P. Progress in treatment of atherosclerosis[J]. Medical Recapitulate, 2017, 23(15): 2993-2997. DOI:10.3969/j.issn.1006-2084.2017.15.016 |
| [10] |
何信用, 王俊岩, 贾连群, 等. 浅谈从"心脾论治"防治冠心病[J]. 中医药导报, 2016, 22(16): 12-14. HE X Y, WANG J Y, JIA L Q, et al. Discussion on the treatment of coronary heart disease from heart and spleen[J]. Guiding Journal of Traditional Chinese Medicine and Pharmacy, 2016, 22(16): 12-14. |
| [11] |
国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2015. NationalPharmacopoeia Commission. Pharmacopoeia of the people's republic of China[M]. Beijing: China Medical Science and Technology Press, 2015. |
| [12] |
刘先芳, 梁敬钰, 孙建博, 等. 女贞子化学成分和药理活性研究进展[J]. 海峡药学, 2018, 30(1): 1-8. LIU X F, LIANG J Y, SUN J B, et al. Research progress of the fructus ligustri lucidi on the chemical compounds and pharmacological activity[J]. Strait Pharmaceutical Journal, 2018, 30(1): 1-8. |
| [13] |
张子臻. 女贞子能降血脂、改善心肌供血[J]. 中医杂志, 1998, 39(9): 518. ZHANG Z Z. Ligustrum lucidum can reduce blood lipid and improve myocardial blood supply[J]. Journal of Traditional Chinese Medicine, 1998, 39(9): 518. |
| [14] |
SHEN W, FAN W H, SHI H M. Effects of Rhodiola on expression of vascular endothelial cell growth factor and angiogenesis in aortic atherosclerotic plaque of rabbits[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2008, 28(11): 1022-1025. |
| [15] |
LI H, YAO W F, LIU Q N, et al. Application of UHPLC-ESI-Q-TOF-MS to identify multiple constituents in processed products of the herbal medicine ligustri lucidi fructus[J]. Molecules (Basel, Switzerland), 2017, 22(5): 689. DOI:10.3390/molecules22050689 |
| [16] |
LIU X, OUYANG S, YU B, et al. PharmMapper server: a web server for potential drug target identification using pharmacophore mapping approach[J]. Biomolecules, 2010, 38(web server issue): W609-W614. |
| [17] |
WANG X, PAN C X, GONG J Y, et al. Enhancing the enrichment of pharmacophore-based target prediction for the polypharmacological profiles of drugs[J]. Journal of Chemical Information and Modeling, 2016, 56(6): 1175-1183. DOI:10.1021/acs.jcim.5b00690 |
| [18] |
WANG X, SHEN Y H, WANG S W, et al. PharmMapper 2017 update: a web server for potential drug target identification with a comprehensive target pharmacophore data- base[J]. Nucleic Acids Research, 2017, 45(W1): W356-W360. DOI:10.1093/nar/gkx374 |
| [19] |
LI Y H, YU C Y, LI X X, et al. Therapeutic target database update 2018:enriched resource for facilitating bench-to-clinic research of targeted therapeutics[J]. Nucleic Acids Research, 2017, 46(D1): D1121-D1127. |
| [20] |
PI ÑERO J, BRAVO Á, QUERALT-ROSINACH N, et al. DisGeNET: a comprehensive platform integrating information on human disease-associated genes and variants[J]. Nucleic Acids Research, 2016, 45(D1): D833-D839. |
| [21] |
WISHART D S, FEUNANG Y D, GUO A C, et al. DrugBank 5.0:a major update to the DrugBank database for 2018[J]. Nucleic Acids Research, 2017, 46(D1): D1074-D1082. |
| [22] |
张艳, 宫丽鸿, 礼海. 浅谈动脉粥样硬化的中医病因病机[J]. 时珍国医国药, 2010, 21(5): 1125-1126. ZHANG Y, GONG L H, LI H. Etiology and pathogenesis of atherosclerosis in traditional Chinese medicine[J]. Lishizhen Medicine and Materia Medica Research, 2010, 21(5): 1125-1126. |
| [23] |
徐莹. 女贞子降血糖、降血脂活性及齐墩果酸衍生化研究[D]. 长春: 吉林农业大学, 2016. XU Y. Study on the hypoglycemic and hypolipidemic of ligustri lucidi ait and derivatization of oleanolic acid[D]. Changchun: Jilin Agricultural University, 2016. |
| [24] |
SHEN W, FAN W H, SHI H M. Effects of Rhodiola on expression of vascular endothelial cell growth factor and angiogenesis in aortic atherosclerotic plaque of rabbits[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2008, 28(11): 1022-1025. |
| [25] |
孙瑞娜, 郭韫丽, 汪俊, 等. 女贞子提取物主要活性组分及其抗丙型肝炎病毒复制活性分析[J]. 中国生物化学与分子生物学报, 2013, 29(10): 956-961. SUN R N, GUO Y L, WANG J, et al. Main active components of Ligustrum lucidum extract and their activity to inhibit hepatitis C virus replication[J]. Chinese Journal of Biochemistry and Molecular Biology, 2013, 29(10): 956-961. |
| [26] |
郭梦环, 甘露, 司婧, 等. 毛蕊花糖苷的药理作用及作用机制研究进展[J]. 中成药, 2020, 42(8): 2119-2125. GUO M H, GAN L, SI J, et al. Research Progress on pharmacological action and mechanism of verbascoside[J]. Chinese Traditional Patent Medicine, 2020, 42(8): 2119-2125. |
| [27] |
CAMPO G, PAVASINI R, BISCAGLIA S, et al. Platelet aggregation values in patients with cardiovascular risk factors are reduced by verbascoside treatment. A randomized study[J]. Pharmacological Research, 2015, 97(6): 1-6. |
| [28] |
FASELIS C, IMPRIALOS K, GRASSOS H, et al. Is very low LDL-C harmful?[J]. Current Pharmaceutical Design, 2018, 24(31): 3658-3664. |
| [29] |
FRUCHART J C. Chapter 10 Free radicals and atherosclerosis[J]. New Comprehensive Biochemistry, 1994, 28(2): 257-280. |
| [30] |
MARTIN-NIZARD F, SAHPAZ S, FURMAN C, et al. Natural phenylpropanoids protect endothelial cells against oxidized LDL-induced cytotoxicity[J]. Planta Medica, 2003, 69(3): 207-211. |
| [31] |
MARTIN-NIZARD F, SAHPAZ S, KANDOUSSI A, et al. Natural phenylpropanoids inhibit lipoprotein-induced endothelin-1 secretion by endothelial cells[J]. The Journal of Pharmacy and Pharmacology, 2004, 56(12): 1607-1611. |
| [32] |
张永杰, 赵国安, 林飞, 等. 红景天苷抗动脉粥样硬化机制研究进展[J]. 中国动脉硬化杂志, 2019, 27(6): 547-552. ZHANG Y J, ZHAO G A, LIN F, et al. Advances in research on anti-atherosclerosis mechanism of salidroside[J]. Chinese Journal of Arteriosclerosis, 2019, 27(6): 547-552. |
| [33] |
SUN L, DOU F F, CHEN J L, et al. Salidroside slows the progression of EA.hy926 cell senescence by regulating the cell cycle in an atherosclerosis mode[J]. Molecular Medicine Reports, 2018, 17(1): 257-263. |
| [34] |
ZHU Z S, LI J Y, ZHANG X R. Salidroside protects against ox-LDL-induced endothelial injury by enhancing autophagy mediated by SIRT1-FoxO1 pathway[J]. BMC Complementary and Alternative Medicine, 2019, 19(1): 111. |
| [35] |
MAÏGA S F, KALOPISSIS A D, CHABERT M. Apolipoprotein A-Ⅱ is a key regulatory factor of HDL metabolism as appears from studies with transgenic animals and clinical outcomes[J]. Biochimie, 2014, 96(5): 56-66. |
| [36] |
BJÖRKEGREN J L M, HÄGG S, TALUKDAR H A, et al. Plasma cholesterol-induced lesion networks activated before regression of early, mature, and advanced atherosclerosis[J]. PLoS Genetics, 2014, 10(2): e1004201. |
| [37] |
VOLCIK K A, CATELLIER D, FOLSOM A R, et al. SELP and SELPLG genetic variation is associated with cell surface measures of SELP and SELPLG: the atherosclerosis risk in communities carotid MRI study[J]. Clinical Chemistry, 2009, 55(6): 1076-1082. |
| [38] |
罗毅, 胡名松, 莫中成. AMPK激动剂调控自噬影响动脉粥样硬化[J]. 生命的化学, 2020, 40(7): 1107-1113. LUO Y, HU M S, MO Z C. The treatment of atherosclerosis through regulation of autophagy by AMPK agonists[J]. Chemistry of Life, 2020, 40(7): 1107-1113. |
| [39] |
李成鹏, 雷杰, 祝炜, 等. 基于PPAR信号通路探讨辛温通阳中药对动脉粥样硬化大鼠的保护性机制[J]. 湖北中医药大学学报, 2020, 22(1): 9-13. LI C P, LEI J, ZHU W, et al. Study on the protective mechanism of Xinwen Tongyang Chinese herbal medicine on atherosclerosis rats based on PPAR signaling pathway[J]. Journal of Hubei University of Chinese Medicine, 2020, 22(1): 9-13. |
 2022, Vol. 41
2022, Vol. 41