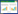文章信息
- 刘华, 周玲玲, 魏丹丹, 徐宜艳, 张慧
- LIU Hua, ZHOU Lingling, WEI Dandan, XU Yiyan, ZHANG Hui
- 红景天苷下调KRT17增加紫杉醇对卵巢癌细胞的化疗敏感性
- Salidroside down-regulates KRT17 and increases the sensitivity of paclitaxel to chemotherapy in ovarian cancer cells
- 天津中医药大学学报, 2022, 41(5): 625-629
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(5): 625-629
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.05.16
-
文章历史
收稿日期: 2022-05-23
2. 襄阳市中心医院,湖北文理学院附属医院妇产科,襄阳 441021
2. Xiangyang Central Hospital, Obstetrics and Gynecology Department of Affiliated Hospital of Hubei University of Arts and Sciences, Xiangyang 441021, China
卵巢癌在女性肿瘤相关发病率中排名前列,由于卵巢癌没有可靠的早期症状和体征,早期发现很困难。相关研究表明,化疗药物易产生难以耐受的不良反应及耐药性,导致治愈率低、复发率高,炎症影响预后[1]。此外,加入其他细胞毒性药物治疗卵巢癌并不能改善预后[2]。因此,为了改善目前的治疗方案,有必要开发新的干预措施。红景天是一种广泛分布于欧洲北部、亚洲和北美洲的中草药,是治疗心脏病、抑郁症和焦虑症的天然药物[3]。随着药理学的发展,红景天苷被认为是红景天的主要功能成分之一,具有抗凋亡、抗自噬、抗炎症、抗氧化应激、神经保护、抗衰老等药理作用。红景天苷还具有浓度依赖性,可抑制不同人肿瘤细胞系的生长,这些肿瘤细胞对红景天苷表现出不同的敏感性[4]。角蛋白家族成员17(KRT17)与肿瘤的发生发展密切相关,其在食管癌、宫颈癌、肠癌中均高表达,发挥着肿瘤基因的作用,但其在卵巢癌中的具体作用机制尚不清楚[5]。由于目前红景天苷对不同肿瘤的体内抗肿瘤活性数据非常有限,尚不清楚特定类型的肿瘤是否可能对红景天苷的抗肿瘤作用特别敏感。本文主要研究红景天苷下调KRT17增加紫杉醇对卵巢癌细胞化疗敏感性的影响。
1 材料和方法 1.1 实验药物和主要试剂RPMI 1640培养基(批号:AC018T)、胎牛血清(批号:26140079)购自美国GIBCO公司;红景天苷购自上海吉至生化科技有限公司(批号:S26151);紫杉醇购自MedChemExpress(批号:HY-B0015);Cell Counting Kit-8(CCK-8)试剂盒(批号:B5058)、Hoechst 33258试剂盒(批号:A3466)购自美国APExBIO生物科技有限公司;5-乙炔基-2’-脱氧尿苷(EDU)试剂盒(批号:ab146186)、兔抗波形蛋白单克隆抗体(批号:ab193555)购自英国Abcam公司;抗体Beclin1(批号:PD017)、P62(批号:PM045)、LC3I/LC3Ⅱ(批号:PM036)、β-actin(批号:PM053-7)购自日本株式会社医学生物学研究所;二喹啉甲酸(BCA)试剂盒购自美国Thermo fisher公司(批号:23225)。
1.2 细胞培养SKOV-3细胞来源于American Type Culture Collection(ATCC)。将细胞培养于含10%胎牛血清的RPMI 1640培养基中,并置于37 ℃、5%二氧化碳(CO2)恒温培养箱中,培养液每24 h更换1次。细胞取对数生长期进行实验。
1.3 CCK-8检测毒性将SKOV-3细胞接种至96孔板,培养12 h后,选用不同浓度的红景天苷(0、5、25、50、100、200 μmol/L)、不同浓度的紫杉醇(0、0.5、1、5、10、20 nmol/L)和不同浓度的红景天苷+紫杉醇(0 μmol/L+0 nmol/L、5 μmol/L+0.5 nmol/L、25 μmol/L+1 nmol/L、50 μmol/L+5 nmol/L、100 μmol/L+10 nmol/L、200 μmol/L+20 nmol/L)对细胞进行处理,预处理24 h后每孔加入10 μL CCK-8溶液,孵育3 h,然后在450 nm处检测吸光度。
1.4 细胞分组选用100 μmol/L红景天苷和10 nmol/L紫杉醇处理进行后续实验,将细胞分为3组:对照组(DMSO)、100 μmol/L红景天苷单独处理组(SAL)、10 nmol/L紫杉醇单独处理组(PTX)、联合处理组(SAL+PTX)。SAL采用100 μmol/L红景天苷处理24 h,PTX采用10 nmol/L紫杉醇处理24 h,SAL+PTX用100 μmol/L红景天苷和10 nmol/L紫杉醇联合处理24 h,DMSO不处理。
1.5 EDU染色检测细胞增殖将各组细胞以每孔1×105接种于96孔板,培养过夜,每孔加入100 μL含50 μmol/L EDU培养基孵育2 h,用磷酸缓冲盐溶液(PBS)洗涤2次,每次5 min。将细胞进行固定和染色后用荧光显微镜进行观测。
1.6 Hoechst 33258检测细胞凋亡根据Hoechst染色试剂盒说明书操作:消化收集细胞,吸尽培养液,加入0.5 mL固定液,固定10 min或更长时间(可4 ℃过夜);去除固定液,PBS洗涤2遍,每次3 min,弃液;加入0.5 mL Hoechst 33258染色液,染色5 min;去除染色液,PBS洗涤2遍,每次3 min,弃液;将1滴抗荧光淬灭封片液滴于载玻片上,盖上贴有细胞的盖玻片,让细胞接触封片液,尽量避免气泡。荧光显微镜可检测到蓝色细胞核。
1.7 免疫荧光法检测自噬将已经爬好细胞的载玻片用PBS清洗15 min,用0.1%Triton X-100通透5 min,用5%牛血清白蛋白(BSA)在PBS中培养30 min,滴加LC3一抗,4 ℃孵育过夜,清洗后,加入异硫氰酸荧光素(FITC)标记的荧光二抗孵育2 h,最后加入4’,6-二脒基-2-苯基吲哚(DAPI)染色避光孵育1 h。清洗后用抗荧光淬灭剂封片。在荧光显微镜下观测并采集图片。
1.8 蛋白免疫印迹(Wester Blot)法检测KRT17和细胞自噬相关蛋白表达水平收集各组细胞并在冰上溶解25 min。以12 000 r/min离心10 min(离心半径3 cm),加入含蛋白酶抑制剂的细胞裂解液进行总蛋白提取,用BCA试剂盒测定蛋白质含量。提取等质量的蛋白质样品(20 mg),在100 ℃条件下变性5 min。然后使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)法分离并转移至聚偏氟乙烯(PVDF)膜,在4 ℃条件下加入相应一抗并孵育过夜,清洗,然后在4 ℃下加入辣根过氧化物酶标记的二抗,孵育2 h,最后加入发光液,曝光处理。Image J软件统计灰度值。
1.9 统计学分析釆用SPSS 23.0软件进行统计分析,所有数据以均数±标准差(x±s)表示,各组采用各组采用单因素方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 CCK-8法检测对SKOV-3细胞的细胞毒性选用不同浓度的红景天苷和紫杉醇对SKOV-3细胞进行处理,检测SKOV-3细胞的存活能力。SAL组细胞100、200 μmol/L与0 μmol/L浓度比较,细胞存活率降低(P<0.05)。PTX组细胞10、20 nmol/L与0 nmol/L浓度比较,细胞存活率降低(P<0.05)。SAL+PTX组100/10、200/20浓度下细胞与0/0浓度比较,存活率降低(P<0.05),且存活率低于PTX组10、20 nmol/L浓度(P<0.05)。说明SAL与PTX随浓度的升高,其对SKOV-3细胞毒性增强。见图 1。
|
| 注:与本组0 μmol/L(或0/0)浓度比较,*P<0.05;与PTX 10、20 nmol/L组比较,#P<0.05。 图 1 细胞毒性检测(x±s) |
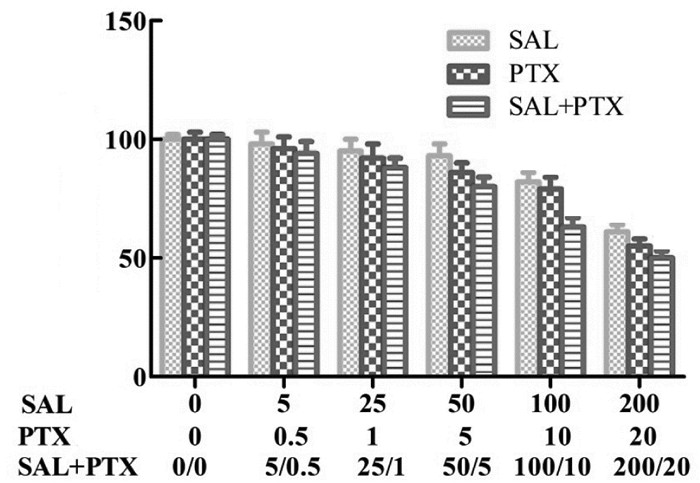
为了检测红景天苷对SKOV-3细胞增殖和凋亡的影响,采用EDU染色检测SKOV-3细胞增殖情况。与DMSO组相比,各处理组细胞增殖数均降低,且SAL+PTX组细胞增殖数低于PTX组,差异有统计学意义(P<0.01)。采用Hoechst 33258染色检测细胞凋亡情况,致密浓染蓝色光点的斑点即为凋亡细胞细胞核。与DMSO组相比,处理组细胞凋亡率依次升高,且PTX组低于SAL+PTX组细胞凋亡率,差异有统计学意义(P<0.01)。说明红景天苷抑制SKOV-3细胞增殖,促进SKOV-3细胞凋亡,且红景天苷与紫杉醇协同处理效果优于SAL组、PTX组。见图 2。

|
| 注:与DMSO组比较,*P<0.01;与PTX组比较,#P<0.01。 图 2 SKOV-3细胞增殖与凋亡(x±s) |
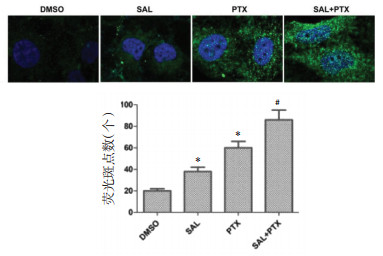
本实验采用免疫荧光法检测自噬体形成情况,与DMSO组比较,SAL组、PTX组细胞内LC3荧光斑点数增加(P<0.01)。与PTX组比较,SAL+PTX组LC3荧光斑点数增加(P<0.01)。表明红景天苷和紫杉醇促进了自噬体形成。见图 3。
|
| 注:与DMSO组比较,*P<0.01;与PTX组比较,#P<0.01。 图 3 免疫荧光检测LC3荧光斑点数(x±s) |
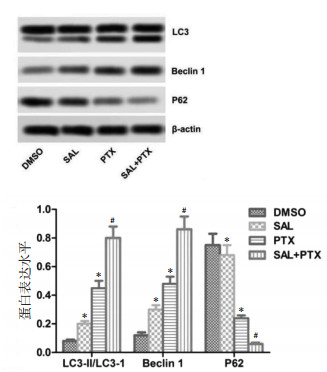
通过Western Blot法检测各组细胞LC3、Beclin1、P62蛋白表达水平,红景天苷、紫杉醇和红景天苷+紫杉醇激活Beclin1的表达,下调自噬抑制基因P62的表达(P<0.01)。LC3-Ⅱ/LC3-I比值增加(P<0.01),说明LC3-I转换为LC3-Ⅱ,提示红景天苷、紫杉醇和红景天苷+紫杉醇促进自噬通量。见图 4。
|
| 注:与DMSO组比较,*P<0.01;与PTX组比较,#P<0.01。 图 4 红景天苷+紫杉醇对SKOV-3细胞LC3、Beclin1、P62蛋白表达水平的影响(x±s) |
通过Western Blot法检测各组细胞KRT17蛋白的表达。与DMSO组比较,SAL组、SAL+PTX组KRT17蛋白表达水平降低(P<0.01),过表达(PC)-KRT17组、PC-KRT17+PTX组KRT17蛋白表达水平升高(P<0.01),PTX组、PC-KRT17+SAL组KRT17蛋白表达水平无显著变化(P > 0.05)。与PC-KRT17组比较,PC-KRT17+SAL组KRT17蛋白表达水平降低(P<0.01),PC-KRT17+PTX组KRT17蛋白表达水平无显著变化(P > 0.05),说明SAL显著下调KRT17在SKOV-3细胞中蛋白水平。见图 5。
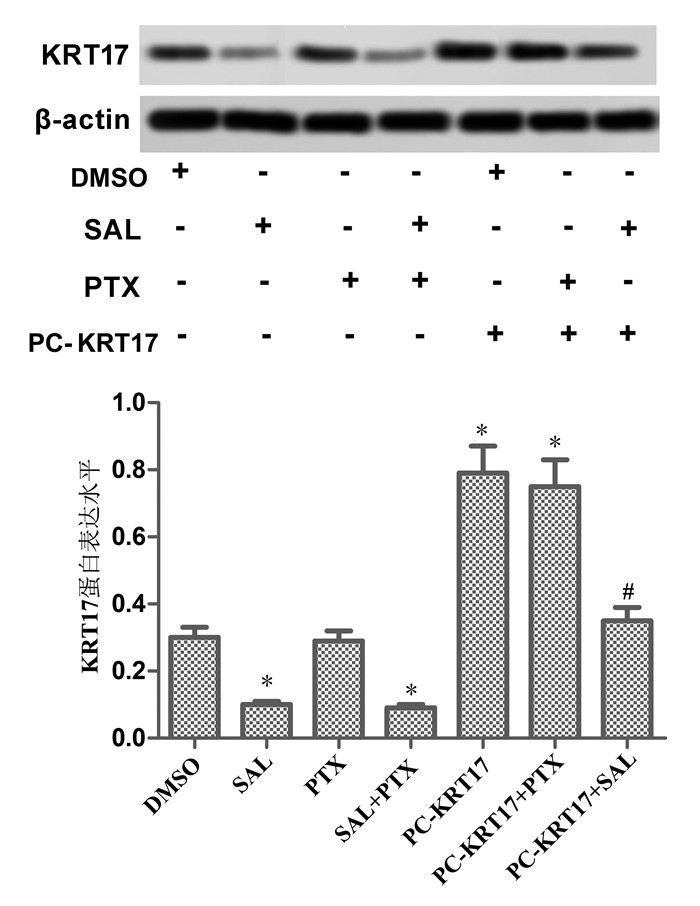
|
| 注:与DMSO组比较,*P<0.01;与PC-KRT17组比较,#P<0.01。 图 5 KRT17蛋白表达(x±s) |
卵巢癌是女性生殖器官较为常见的恶性肿瘤之一。其中,上皮性卵巢癌在所有妇科肿瘤中病死率最高,初始肿瘤细胞减灭术和铂-紫杉醇化疗目前被认为是晚期上皮性卵巢癌治疗的标准[6]。对于广泛播散、侵袭性的肿瘤,另一种治疗策略是延迟手术的新辅助化疗[7]。尽管在过去几十年对卵巢癌的治疗取得了进展,但还是有超过70%的患者复发,因此科学界正在为改善这些患者的预后付出努力,目前的重点方向涉及到治疗计划和新药添加。基于紫杉醇的药物仍然是治疗卵巢癌的一线化疗药物,尽管化疗耐药性和严重的不良反应是不可避免的,耐药性的产生是临床宫颈癌化疗的主要障碍和导致失败的重要原因[8]。以往以紫杉醇为基础的药物生物利用率较低,消除率较高,需要较高剂量给药才能弥补这些缺陷,但不良反应明显[9]。肿瘤内紫杉醇浓度通常较低,所以探寻紫杉醇耐药的潜在机制是必须的。
目前的研究表明,红景天苷对卵巢癌细胞具有抗增殖和促凋亡作用。自噬是细胞自我降解的过程,根据内容物运送到溶酶体的方式,可将自噬分为巨自噬、微自噬和分子伴侣介导自噬[10]。凋亡和自噬往往同时存在、相互调节。在自噬过程中,Beclin1和LC3Ⅱ可作为自噬体标志物,其表达水平升高[11]。自噬相关蛋白p62在卵巢癌中过表达,可促进卵巢癌肿瘤的发生和发展。Ren等[12]研究发现红景天苷通过调控miR-195的表达抑制非小细胞肺癌细胞的存活、迁移和侵袭。Li等[13]研究证实了红景天苷通过自噬、磷脂酰肌醇-3-激酶(PI3K)、蛋白激酶B(Akt)和基质金属蛋白酶-9(MMP-9)信号传导途径降低了肿瘤细胞活力并诱导了膀胱癌细胞的凋亡。本研究结果与上述研究结果一致,红景天苷可抑制SKOV-3细胞增殖,促进SKOV-3细胞凋亡和自噬,且与紫杉醇联用效果更佳。
角蛋白属于细胞骨架的中间纤维,分别作用于多种细胞类型,包括角质形成细胞和上皮细胞。从病理学角度看,角蛋白表达异常涉及非肿瘤疾病和肿瘤。KRT17在肿瘤的发生、迁移和耐药中起重要作用[14]。本研究发现红景天苷和紫杉醇联合处理可降低SKOV-3细胞KRT17蛋白表达,表明红景天苷可能通过下调KRT17蛋白表达抑制SKOV-3细胞增殖、诱导细胞凋亡和自噬。
综上所述,红景天苷和紫杉醇均可抑制SKOV-3细胞增殖,诱导细胞凋亡和自噬,且红景天苷与紫杉醇联用效果更佳,表明红景天苷可增强紫杉醇对SKOV-3细胞的敏感性,这可能是通过下调KRT17表达实现的。本研究可为卵巢癌的临床治疗提供新策略,下一步计划探寻红景天苷联用紫杉醇的具体分子作用机制。
| [1] |
甘蕾, 黄雅可, 黄燕, 等. 阿帕替尼联合多西紫杉醇对卵巢癌干细胞的影响及其作用机制[J]. 医学综述, 2020, 26(23): 4769-4775. GAN L, HUANG Y K, HUANG Y, et al. Effect of apatinib combined with docetaxel on ovarian cancer stem cells and its mechanism[J]. Medical Recapitulate, 2020, 26(23): 4769-4775. DOI:10.3969/j.issn.1006-2084.2020.23.036 |
| [2] |
WU Y H, HUANG Y F, CHEN C C, et al. Akt inhibitor SC66 promotes cell sensitivity to cisplatin in chemoresistant ovarian cancer cells through inhibition of COL11A1 expression[J]. Cell Death & Disease, 2019, 10(2): 322. |
| [3] |
ZHANG Y L, ZHANG X W, YUE Q J, et al. Ethanol extract of Rhodiola rosea L. regulates the number of tumor infiltrating T cells to enhance antitumor effect in Lewis lung cancer-bearing mice[J]. Chinese Journal of Cellular and Molecular Immunology, 2019, 35(2): 103-108. |
| [4] |
QIN Y, LIU H J, LI M, et al. Salidroside improves the hypoxic tumor microenvironment and reverses the drug resistance of platinum drugs via HIF-1α signaling pathway[J]. EBioMedicine, 2018, 38(10): 25-36. |
| [5] |
胡昊, 徐丹铧, 张子臻, 等. 胃癌KRT17表达及其对上皮间质转化的影响[J]. 外科理论与实践, 2017, 22(4): 336-342. HU H, XU D H, ZHANG Z Z, et al. KRT17 expression in gastric cancer associated with epithelial-mesenchymal transition[J]. Journal of Surgery Concepts & Practice, 2017, 22(4): 336-342. |
| [6] |
MARCHETTI C, MUZⅡ L, ROMITO A, et al. First-line treatment of women with advanced ovarian cancer: focus on bevacizumab[J]. OncoTargets and Therapy, 2019, 35(12): 1095-1103. |
| [7] |
KHOURI O R, FREY M K, MUSA F, et al. Neoadjuvant chemotherapy in patients with advanced endometrial cancer[J]. Cancer Chemotherapy and Pharmacology, 2019, 84(2): 281-285. DOI:10.1007/s00280-019-03838-x |
| [8] |
陈璐, 张娟, 栾丽平. 黄芩苷通过增强自噬介导顺铂对宫颈癌C-33A/cis细胞敏感性的影响[J]. 中药药理与临床, 2018, 34(5): 44-47. CHEN L, ZHANG J, LUAN L P. Baicalin improves cisplatin chemosensitivity of cervical cancer C-33A/Cis cells via elevating autophagy[J]. Pharmacology and Clinics of Chinese Materia Medica, 2018, 34(5): 44-47. |
| [9] |
BIO M, RAHMAN K M M, LIM I, et al. Singlet oxygen-activatable Paclitaxel prodrugs via intermolecular activation for combined PDT and chemotherapy[J]. Bioorganic & Medi- cinal Chemistry Letters, 2019, 29(12): 1537-1540. |
| [10] |
MIZUSHIMA N, KOMATSU M. Autophagy: renovation of cells and tissues[J]. Cell, 2011, 147(4): 728-741. |
| [11] |
岳凌峰, 仲照希, 马敬, 等. 奥氮平通过抑制NLRP3炎症小体激活对抑郁症模型大鼠海马神经元的保护作用[J]. 四川大学学报(医学版), 2019, 50(5): 672-678. YUE L F, ZHONG Z X, MA J, et al. The protective effect of olanzapine on the hippocampal neuron of depression model rats via inhibiting NLRP3 inflammasome activation[J]. Journal of Sichuan University(Medical Science Edition), 2019, 50(5): 672-678. |
| [12] |
REN M, XU W J, XU T. Salidroside represses proliferation, migration and invasion of human lung cancer cells through AKT and MEK/ERK signal pathway[J]. Artificial Cells, Nanomedicine, and Biotechnology, 2019, 47(1): 1014-1021. |
| [13] |
LI T, XU K W, LIU Y F. Anticancer effect of salidroside reduces viability through autophagy/PI3K/Akt and MMP-9 signaling pathways in human bladder cancer cells[J]. Oncology Letters, 2018, 16(3): 3162-3168. |
| [14] |
YANG L T, ZHANG S L, WANG G. Keratin 17 in disease pathogenesis: from cancer to dermatoses[J]. The Journal of Pathology, 2019, 247(2): 158-165. |
 2022, Vol. 41
2022, Vol. 41