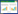文章信息
- 高扬, 高晓燕, 张志强
- GAO Yang, GAO Xiaoyan, ZHANG Zhiqiang
- 川芎配方颗粒的制备及量值传递研究
- Study on preparation and law of quality value transmitting of Chuanxiong Dispensing Granules
- 天津中医药大学学报, 2022, 41(5): 638-643
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(5): 638-643
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.05.18
-
文章历史
收稿日期: 2022-05-15
2. 北京康仁堂药业有限公司,北京 101399
2. Beijing Tcmages Pharmaceutical Co. LTD., Beijing 101399, China
川芎为伞形科植物川芎Ligusticum chuanxiong Hort.的干燥根茎[1],首载于《神农本草经》,原名芎藭[2],至唐代蔺道人《仙授理伤续断秘方》所载方剂才使用“川芎”为处方用名[3]。川芎为古今有名的四川产道地药材,道地产区为彭州市、新都县、郫县、崇庆县和温江县等[3-4]。川芎为临床常用的活血化瘀药,其味辛性温,入肝、胆、心包经,走而不守,属活血化瘀类中药。既能行散,上行达巅顶,又入血分,下行可达血海,故谓其为血中之气药。现代研究表明川芎主要含有挥发油类、苯酞类、萜烯类、有机酸及其酯、生物碱、多糖等多种化学成分[5],具有抗凝血、抑制血小板集聚、扩张血管、改善微循环、保护血管内皮、抗氧化和钙拮抗等药理作用[6]。临床研究表明川芎在心脑血管疾病、泌尿系统疾病及糖尿病病变等治疗领域,疗效显著[7-12]。
中药配方颗粒是以符合炮制规范的传统中药饮片作为原料,采用现代化制药设备及技术,经过提取、分离、浓缩、干燥、制粒而成的中药制剂,在传统中医药理论的指导下,供临床调剂使用。其在制备工艺及质量研究方面,均最大限度地还原了传统中药汤剂,因此中药配方颗粒在药效功能、临床主治、性味归经等方面,均与传统汤剂相同,是中药饮片的重大改革和创新。由于中药配方颗粒生产过程实行全产业链的质量管理,因此其质量更加稳定可控且剂量准确,颗粒剂型更加便于查对与储存,较传统饮片有许多优势。近年来由于配方颗粒调配、服用和携带方便等优点,在中医临床方面为医生和患者提供了更多的选择,越来越受医患青睐。
然而在长达20余年的试点期间,由于国家标准的缺失,川芎配方颗粒因各企业间工艺路线不同、质量标准检测项目及限度不同,导致同一品种不同企业间产品质量差异较大,不利于国家统筹管理及临床统一调配,影响临床调剂及疗效,并阻碍了配方颗粒产业的进一步发展壮大[13]。以往虽有关于川芎配方颗粒生产工艺、含量测定的相关研究,但并未基于标准汤剂的研究理念,尚未解决当前实际问题[14]。目前所报道的文献中,仅是针对川芎饮片或配方颗粒单独进行研究,缺少由饮片至标准汤剂,再到配方颗粒的系统性研究内容,无法保证川芎配方颗粒与标准汤剂的质量一致性。因此,为解决当前川芎配方颗粒的质量差异问题,最大程度保证川芎配方颗粒与汤剂的等效性,依据川芎临床应用特点,进行了合理的标准汤剂工艺设计,收集川芎标准汤剂出膏率、含量、特征图谱等质量指标[15-17],并以此为标准,指导生产工艺的研究,形成川芎配方颗粒质量标准。质量标准的研究,重点关注以上量值传递指标,制定合理限度,保证方法的科学性、准确性,从而能够有效实现产品的全程质量控制,保证川芎配方颗粒与汤剂的等效性,进而保证临床疗效。本文开展川芎配方颗粒的制备及量值传递研究,为其质量标准和控制提供基础。
1 材料与仪器试剂 1.1 材料共收集四川产区18个批次的川芎药材样品,样品信息见表 1。川芎药材经北京康仁堂药业有限公司于立伟鉴定为伞形科植物川芎的干燥根茎,样品置于通风干燥处,备用。
取以上18批川芎药材,按照2020年版《中华人民共和国药典》中川芎【炮制】项下的炮制方法,“除去杂质,分开大小,洗净,润透,切厚片,干燥”,制备18批川芎饮片,样品置于通风干燥处,备用。
1.2 仪器与试剂超高效液相色谱(UPLC)仪器(Waters,美国),数据采集处理系统采用Empower 3色谱数据工作站;微电脑陶瓷煎药壶(上海永达基);JY20002电子天平(上海舜宇恒平),ME104E电子天平(瑞士,梅特勒·托利多),XP26电子天平(瑞士,梅特勒·托利多);DZKW-4电子恒温水浴锅(北京中兴伟业);EYELA旋转蒸发仪及冷却水循环装置(日本,东京理化);DHG-9140A电热鼓风干燥箱(上海一恒);LGJ-50FD真空冷冻干燥机(北京松源华兴)。
川芎对照药材(批号:120918-201612,中国食品药品检定研究院);阿魏酸对照品(批号:110773-201614,中国食品药品检定研究院);洋川芎内酯A对照品(批号:Y-083-170411,北京中科质检生物技术有限公司);藁本内酯对照品(批号:111737-201608,中国食品药品检定研究院);乙腈(色谱纯,Merk);甲酸(色谱纯,Fisher Chemical);蒸馏水(屈臣氏)。
2 实验方法 2.1 川芎标准汤剂的制备以《医疗机构中药煎药室管理规范》和《中药配方颗粒质量控制与标准制定技术要求》为依据,根据川芎饮片及临床应用特点,考察并确定川芎标准汤剂的工艺条件:浸泡30 min,煎煮2次,一煎加入9倍量水,武火煮沸,文火煎煮30 min,滤液趁热过滤;二煎加入7倍量水,武火煮沸,文火煎煮20 min,滤液趁热过滤,合并两煎滤液,减压浓缩至料液比约为1∶1,冷冻干燥,计算出膏率。
2.2 川芎配方颗粒制备工艺研究以所得川芎标准汤剂质量指标作为标准,对川芎配方颗粒生产工艺进行研究,包括提取、浓缩、干燥和制剂工艺的研究。
2.2.1 提取工艺通过正交实验优选川芎提取工艺,结合影响该品种提取效率的主要因素,选择提取次数、提取时间、加水量3个考察因素,以出膏率、阿魏酸含量为评价指标,确定提取工艺为:提取2次,一煎加10倍量水,提取30 min;二煎加10倍量水,提取30 min。
2.2.2 浓缩工艺通过考察不同浓缩温度下阿魏酸的含量及特征图谱的变化情况,确定浓缩温度为70 ℃,浓缩时间以不超过12 h为宜。
2.2.3 干燥工艺通过正交实验优选川芎喷雾干燥工艺,结合影响该品种喷雾干燥的主要因素,选择浓缩液密度、辅料量、喷雾干燥进风温度为考察因素,以出膏率、阿魏酸含量为指标,确定干燥工艺为:浓缩液相对密度为(1.05~1.15)×103 kg/m3,辅料为5%糊精,进风温度为160~170 ℃。
2.2.4 制剂工艺选取0%、5%、11%的辅料比例(按投料量计算),进行制剂工艺研究,以吸湿性、成型性、休止角、堆密度、溶化性作为评价指标,测定颗粒性质,结果显示吸湿性随着糊精的增加呈下降趋势,成型性、休止角、堆密度及溶化性并无明显变化。参照川芎颗粒长期稳定性研究结果,显示在3年内各项指标均比较稳定,所以川芎颗粒添加11%以内的糊精作为制剂补足量,能够保证其成品质量稳定。
2.3 川芎配方颗粒含量测定方法的建立 2.3.1 色谱条件采用Waters ACQUITY BEH Shield RP18(2.1 mm×100 mm,1.7 μm)色谱柱,乙腈(A)-0.1%甲酸溶液(B)为流动相梯度洗脱(0~3 min,5%A~8%A;3~7 min,8%A~19%A;7~12 min,19%A~24%A;12~20 min,24%A~100%A),流速0.4 mL/min,检测波长320 nm,柱温35 ℃,进样量2 μL。
2.3.2 对照品溶液的制备取阿魏酸对照品适量,精密称定,加70%甲醇制成1 mL含40 μg的溶液,即得。
2.3.3 供试品溶液的制备取川芎饮片0.2 g,精密称定,置锥形瓶中,精密加入70%甲醇25 mL,称定质量,超声处理30 min,取出,放冷,再称定质量,用70%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。取川芎标准汤剂0.2 g,精密称定,按照川芎饮片的制备方法制备标准汤剂供试品溶液。取川芎配方颗粒0.2 g,精密称定,按照川芎饮片的制备方法制备配方颗粒供试品溶液。
2.3.4 线性关系考察精密称取阿魏酸对照品6.177 mg(纯度99.0%)于50 mL容量瓶中,加70%甲醇制成1 mL含122.3 μg的溶液作为阿魏酸的对照品母液。分别精密吸取阿魏酸对照品母液1、5、10、15 mL置于20 mL容量瓶中,加70%甲醇稀释至刻度,配置成浓度为6.115、30.575、61.150、91.725、122.300 μg/mL的对照品溶液,按“2.3.1”项下进行分析。以对照品进样浓度(X)为横坐标,峰面积积分值(Y)为纵坐标,得到回归方程Y=26 594X-21 644,r=0.999 6,线性范围为6.115~122.300 μg/mL。
2.3.5 精密度实验精密吸取同一供试品溶液,按照“2.3.1”项下色谱条件,连续测定6次,测定阿魏酸峰面积,结果阿魏酸峰面积的相对标准偏差(RSD)为0.74%。
2.3.6 重复性实验精密称取川芎样品6份,按照“2.3.3”项下方法制备供试品溶液,再按“2.3.1”项下色谱条件测定阿魏酸含量,结果阿魏酸平均含量为0.42%,RSD为1.4%。
2.3.7 稳定性实验取同一供试品溶液,按照“2.3.1”项下色谱条件,分别在0、2、4、6、8、10、12、24 h间隔进样,测定阿魏酸峰面积,结果阿魏酸峰面积的RSD为0.67%。
2.3.8 加样回收实验精密称取阿魏酸对照品4.273 mg(纯度99.0%)于250 mL容量瓶中,加70%甲醇使其溶解并定容至250 mL,作为阿魏酸对照品溶液(1 mL含16.921 08 μg阿魏酸)。取已知含量的样品(阿魏酸含量为0.42%)6份,每份0.1 g,精密称定,精密加入阿魏酸对照品溶液25 mL(0.423 mg阿魏酸),按照“2.3.3”项下方法制备供试品溶液,再按“2.3.1”项下色谱条件测定,结果阿魏酸的平均回收率为102.1%,RSD值为0.41%。
2.4 川芎配方颗粒特征图谱方法的建立 2.4.1 色谱条件除检测波长为280 nm外,其余同“2.3.1”项下条件。
2.4.2 参照物溶液的制备取阿魏酸对照品、洋川芎内酯A对照品和藁本内酯对照品适量,加70%甲醇分别制成1 mL各含50 μg的溶液,即得。
2.4.3 供试品溶液的制备取“2.3.3”项下川芎饮片、标准汤剂、配方颗粒供试品溶液,即得。
2.4.4 精密度实验吸取供试品溶液,按照“2.4.1”项下色谱条件,连续测定6次,以3号峰为参照峰,计算其相对保留时间和相对峰面积。结果各特征峰的相对保留时间和相对峰面积比值RSD均小于2.0%。
2.4.5 重复性实验取川芎样品6份,按照“2.4.3”项下方法制备供试品溶液,再按“2.4.1”项下色谱条件测定特征图谱,以3号峰为参照峰,计算其相对保留时间和相对峰面积。结果各特征峰的相对保留时间和相对峰面积比值RSD均小于2.0%。
2.4.6 稳定性实验取同一供试品溶液,按照“2.4.1”项下色谱条件,分别在0、2、4、6、8、10、12、24 h间隔进样测定特征图谱,以3号峰为参照峰,计算其相对保留时间和相对峰面积。结果各特征峰的相对保留时间和相对峰面积比值RSD均小于3.0%。
3 实验结果 3.1 川芎中阿魏酸的含量及量值传递研究按照“2.3.1”项下色谱条件,测定川芎饮片、标准汤剂、配方颗粒中阿魏酸的含量,同时计算18批饮片到标准汤剂、饮片到配方颗粒过程中阿魏酸的转移率(转移率=制剂中阿魏酸含量×岀膏率÷饮片中阿魏酸含量),结果见表 2。根据数据可知,川芎标准汤剂出膏率平均值为31.4%,标准汤剂中阿魏酸的平均转移率为37.7%,配方颗粒中的平均转移率为28.3%,阿魏酸自饮片至配方颗粒的过程稳定传递,质量可控,可保证川芎配方颗粒质量的均一性。
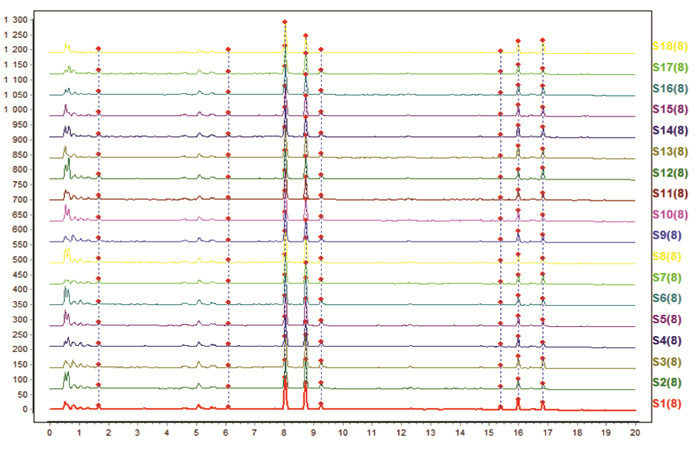
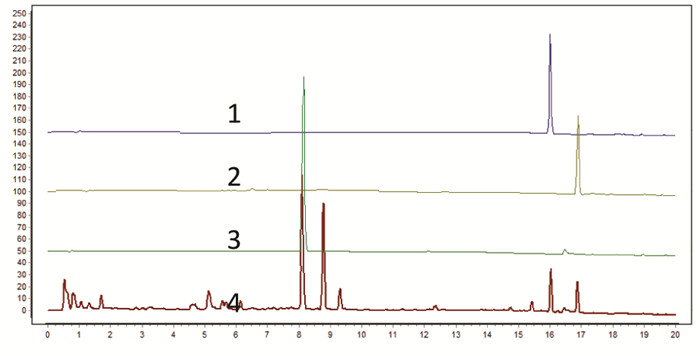
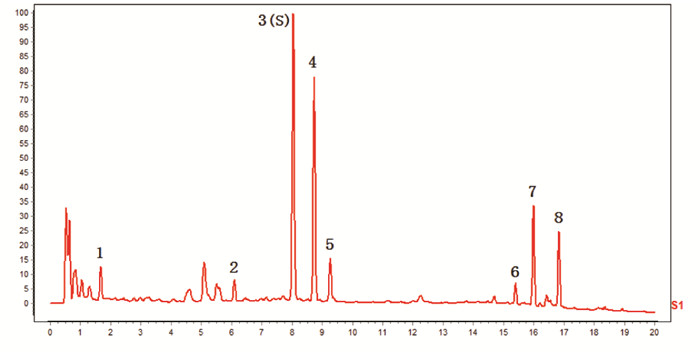
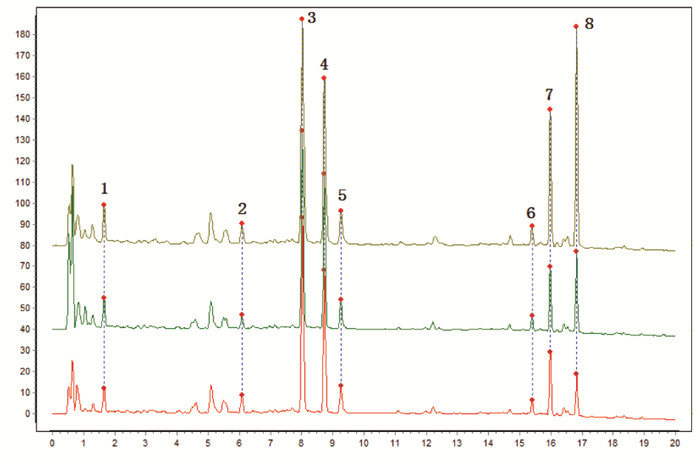
按照“2.4.1”项下色谱条件,测定18批川芎标准汤剂的特征图谱,见图 1。选取8个共有峰作为特征峰,经对照品指认,峰3为阿魏酸,峰7为洋川芎内酯A,峰8为藁本内酯,见图 2。并采用“中药色谱指纹图谱相似度评价系统”(2012版)生成对照特征图谱,见图 3。测定川芎饮片、配方颗粒特征图谱,并针对每一批次样品,自饮片至标准汤剂及配方颗粒,分析8个特征峰的量值传递情况,见图 4。根据图谱可知,川芎饮片、标准汤剂及配方颗粒均稳定呈现8个特征峰,说明川芎饮片中的化学成分基本全部转移至配方颗粒,川芎配方颗粒与标准汤剂基本等效。
|
| 图 1 18批川芎标准汤剂液相图谱 |
|
| 注:1.洋川芎内酯A;2.藁本内酯;3.阿魏酸;4.川芎标准汤剂。 图 2 川芎特征峰对照品指认图 |
|
| 注:3.阿魏酸;7.洋川芎内酯A;8.藁本内酯。 图 3 对照特征图谱 |
|
| 注:A.川芎饮片;B.川芎标准汤剂;C.川芎配方颗粒。 图 4 川芎饮片、标准汤剂、配方颗粒特征图谱量值传递图 |
本研究以标准汤剂为理论依据,通过对18批川芎标准汤剂、配方颗粒制备工艺及质量标准进行研究,建立了川芎标准汤剂煎煮方法,确定以出膏率、阿魏酸含量及转移率、特征图谱为质量指标,并以所得质量指标为依据,进行川芎配方颗粒生产工艺研究,确定生产工艺参数。既往研究仅是对阿魏酸含量、特征图谱或制备工艺进行单项优化[15-17],缺乏川芎配方颗粒的系统性研究,方法整合程度较差,未形成完善的川芎配方颗粒质量研究体系,所得结果亦无法改善当前川芎配方颗粒的质量差异问题。
本研究以乙腈-0.1%甲酸溶液为流动相,采用梯度洗脱方式,对川芎标准汤剂供试品溶液进行全波长测定,结果显示阿魏酸在320 nm处有最大吸收,以此作为阿魏酸含量测定波长。在280 nm处色谱峰信息量较大,各峰分离度较好,以此作为特征图谱检测波长。该方法在同一色谱条件下制备同一供试品溶液,实现1次进样同时测定特征图谱与阿魏酸含量,方法整合程度更高,大大缩短了检测时间,提高了实验效率。所得川芎特征图谱,共确定8个特征峰,基线平稳,色谱峰分离度较好,且从川芎饮片到标准汤剂、配方颗粒均稳定转移,表明物质基础基本一致。18批川芎饮片至川芎标准汤剂中阿魏酸的平均转移率为37.7%,至配方颗粒中的平均转移率为28.3%,可见阿魏酸自饮片至配方颗粒稳定传递,质量可控。基于川芎定性、定量指标的建立,川芎饮片中化学成分可稳定转移至配方颗粒。通过量值传递规律可见,川芎配方颗粒与川芎标准汤剂物质基础基本一致,药效一致。通过统一川芎出膏率及制成总量,亦可保证川芎配方颗粒不同企业间的临床用药当量及质量的一致性,解决目前川芎配方颗粒质量参差不齐的现状,便于临床调剂使用。
| [1] |
国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2020. The National Pharmacopoeia Commission. Pharmacopoeia of People's Republic of China[M]. Beijing: China Medical Science and TechnologyPress, 2020. |
| [2] |
王筠默. 神农本草经[M]. 长春: 吉林科学技术出版社, 1985: 33. WANG J M. Shennong's classic of material medical[M]. Changchun: Jilin Science and Technology Press, 1985: 33. |
| [3] |
齐云, 徐治国, 李祖伦, 等. 芎藭产地及品种考证[J]. 中药材, 1997, 20(10): 531-533. QI Y, XU Z G, LI Z L, et al. Origin and variety of Ligusticum Chuanxiong[J]. Journal of Chinese Medicinal Materials, 1997, 20(10): 531-533. |
| [4] |
刘圆, 贾敏如. 川芎品种、产地的历史考证[J]. 中药材, 2001, 24(5): 364-367. LIU Y, JIA M R. Historical research on varieties and producing areas of Chuanxiong[J]. Journal of Chinese Medicinal Materials, 2001, 24(5): 364-367. DOI:10.3321/j.issn:1001-4454.2001.05.028 |
| [5] |
金玉青, 洪远林, 李建蕊, 等. 川芎的化学成分及药理作用研究进展[J]. 中药与临床, 2013, 4(3): 44-48. JIN Y Q, HONG Y L, LI J R, et al. Advancements in the chemical constituents and pharmacological effects of Chuanxiong[J]. Pharmacy and Clinics of Chinese Materia Medica, 2013, 4(3): 44-48. |
| [6] |
李海强. 中药川芎的现代基础研究及临床应用近况[J]. 现代医药卫生, 2008, 24(13): 1999-2001. LI H Q. Modern basic research and clinical application of Chuanxiong[J]. Modern Medicine & Health, 2008, 24(13): 1999-2001. DOI:10.3969/j.issn.1009-5519.2008.13.075 |
| [7] |
徐艳丽. 注射用大川芎的研究[D]. 沈阳: 沈阳药科大学, 2006. XU Y L. The research of da rhizoma Chuanxiong hydrochloride for injection[D]. Shenyang: Shenyang Pharmaceutical University, 2006. |
| [8] |
周大兴, 陆红, 赵育芳. 不同川芎对血管平滑肌收缩影响的对比研究[J]. 浙江中医学院学报, 2002, 26(2): 46-47. ZHOU D X, LU H, ZHAO Y F. Comparing different Chuanxiongs' effects on contraction of vascular smooth muscles[J]. Journal of Zhejiang College of Traditional Chinese Medicine, 2002, 26(2): 46-47. DOI:10.3969/j.issn.1005-5509.2002.02.030 |
| [9] |
祝兴年. 卡托普利联合川芎嗪治疗急性肾小球肾炎的临床效果观察[J]. 中国临床新医学, 2014, 7(10): 956-958. ZHU X N. Clinical effects of captopril combined with ligustrazine in the treatment of acute glomerulonephritis[J]. Chinese Journal of New Clinical Medicine, 2014, 7(10): 956-958. DOI:10.3969/j.issn.1674-3806.2014.10.21 |
| [10] |
郭茜, 陈永华, 邓颖, 等. 黄芪联合川芎嗪加中药熏洗治疗糖尿病周围神经病变(DPN)疗效观察[J]. 黑龙江医学, 2015, 39(9): 1009-1011. GUO Q, CHEN Y H, DENG Y, et al. Observation on the effect of Astragalus membranaceus combined with ligustrazine in fumigation-washing therapy for diabetic peripheral neuropathy(DPN)[J]. Heilongjiang Medical Journal, 2015, 39(9): 1009-1011. DOI:10.3969/j.issn.1004-5775.2015.09.007 |
| [11] |
陈伟. 川芎嗪治疗糖尿病性视网膜病变的疗效观察[J]. 深圳中西医结合杂志, 2015, 25(6): 104-106. CHEN W. Effect of ligustrazine on diabetes retinopathy[J]. Shenzhen Journal of Integrated Traditional Chinese and Western Medicine, 2015, 25(6): 104-106. |
| [12] |
谭明珠, 刘长山, 苏绍娟, 等. 川芎嗪对链脲佐菌素诱导糖尿病肾病的治疗意义[J]. 中国药业, 2014, 1(21): 7-9. TAN M Z, LIU C S, SU S J, et al. Therapeutical significance of ligustrazine for treating streptozotocin-induced diabetic nephropathy[J]. China Pharmaceuticals, 2014, 1(21): 7-9. |
| [13] |
张肖建, 朱梅羿, 常云凤, 等. 不同厂家川芎配方颗粒的质量对比分析[J]. 中国医院用药评价与分析, 2018, 18(6): 736-738, 742. ZHANG X J, ZHU M Y, CHANG Y F, et al. Quality comparative analysis of Chuanxiong rhizoma formula granules from different manufacturers[J]. Evaluation and Analysis of Drug-Use in Hospitals of China, 2018, 18(6): 736-738, 742. |
| [14] |
林瑞东. 川芎配方颗粒生产工艺和质量标准的研究[D]. 长春: 吉林大学, 2015. LIN R D. Study on the production process and quality standard of Chuangxiong formula granule[D]. Changchun: Jilin University, 2015. |
| [15] |
罗旭, 胡昌江, 吴文辉, 等. 川芎配方颗粒提取工艺及咖啡酸、阿魏酸含量测定[J]. 亚太传统医药, 2014, 10(23): 14-17. LUO X, HU C J, WU W H, et al. Extraction process and content determination of coffee acid and FeruLic acid in Chuanxiong FormuLa Granule[J]. Asia-Pacific Traditional Medicine, 2014, 10(23): 14-17. |
| [16] |
李新贵. 高效液相色谱测定川芎配方颗粒中阿魏酸的含量[J]. 儿科药学杂志, 2017, 23(6): 49-51. LI X G. Determination of content of ferulic acid in Ligusticum Chuanxiong hort formula granule by HPLC[J]. Journal of Pediatric Pharmacy, 2017, 23(6): 49-51. |
| [17] |
王红叶, 冯玉, 甄亚钦, 等. 川芎标准汤剂的UPLC指纹图谱及化学模式研究[J]. 中国药师, 2019, 22(9): 1645-1649. WANG H Y, FENG Y, ZHEN Y Q, et al. UPLC fingerprint and chemical pattern recognition of Ligusticum Chuanxiong hort standard decoction[J]. China Pharmacist, 2019, 22(9): 1645-1649. |
 2022, Vol. 41
2022, Vol. 41