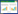文章信息
- 王婷, 李海舰, 廖明, 曾伍姣
- WANG Ting, LI Haijian, LIAO Ming, ZENG Wujiao
- 基于TWEAK/Fn14信号通路探讨大黄酚对OVA诱导哮喘小鼠的保护作用
- Study on the protective effect of rhubarphol on ovalbumin induced asthmatic mice based on TWEAK/Fn14 signal pathway
- 天津中医药大学学报, 2022, 41(5): 644-648
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(5): 644-648
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.05.19
-
文章历史
收稿日期: 2022-06-16
2. 广州医科大学附属肿瘤医院检验科,广州 510095
2. Laboratory Department, Affiliated Cancer Hospital of Guangzhou Medical University, Guangzhou 510095, China
哮喘是一种由多种炎症细胞及细胞因子参与的气道慢性炎症性疾病,其主要特征有可逆性气流受限、一系列气道结构改变和对多种刺激因素呈现高反应性[1]。而临床症状表现为反复发作的气急、咳嗽、喘息、胸闷等。据流行病学数据显示全球目前大约有3.3亿的哮喘患者[2],中国的哮喘患者约有3 000万。值得注意的是随着全球环境污染逐渐加重,全球哮喘患病率呈逐年增长的趋势,严重影响人们的身体健康。目前尚未完全阐明其发病机制,可能与炎症、氧化应激等密切相关[3]。而临床上常常使用糖皮质激素、β2受体激动剂等药物进行对症治疗[4]。但长期大剂量给药可能引起较多的不良反应,故寻找高效低毒的新药是目前急需解决的问题。
大黄酚是大黄中一种药效明确的蒽醌类化合物。现代药理学研究发现大黄酚具有抗氧化、抗凋亡和抗炎等多种药理作用[5],提示其可能对哮喘疾病有较好的疗效。而目前暂未见大黄酚对哮喘的相关研究报道。此外,基于肿瘤坏死因子样凋亡弱诱导因子(TWEAK)/成纤维细胞生长诱导因子14(Fn14)信号通路探讨哮喘相关发病机制的研究报道也较少。本实验旨在阐明大黄酚是否能够通过TWEAK/Fn14信号通路,改善卵清蛋白(OVA)致哮喘小鼠的相关症状,为日后的开发利用提供实验依据。
1 材料与方法 1.1 材料 1.1.1 实验动物SPF级C57BL/6小鼠60只,雌雄各半,体质量18~22 g,购于广东省实验动物中心[许可证号:SCXK(粤)2017-0006]。
1.1.2 药物与试剂大黄酚,纯度>98%,批号:110796-20150622,购于中国药品生物制品检定研究;氢氧化铝粉、OVA、地塞米松,购于美国Sigma公司;DAB免疫组化试剂盒、白细胞介素-4(IL-4)、白细胞介素-5(IL-5)、肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β)酶联免疫吸附(ELISA)试剂盒,购于博士德生物技术有限公司;β-actin、TWEAK和Fn14抗体,购于美国Abcam公司。
1.1.3 仪器403型超声雾化器:江苏鱼跃科技发展有限公司;JK-RM-60型轮转式切片机:上海精学科学仪器有限公司;CX23CX33型Olympus显微镜:日本Olympus公司;SAF-680型酶标仪:上海巴玖实业有限公司;H1650R型高速冷冻离心机:上海卢湘仪有限公司;KEEBIO-VE186型电泳仪:上海嘉鹏科技有限公司。
1.2 方法 1.2.1 实验动物分组SPF级C57BL/6小鼠60只,按体质量随机分成6组,每组10只,分别为正常对照组(CON组)、模型组(OVA组)、地塞米松阳性对照组(DEX组)、大黄酚低剂量组(RHU-L组)、大黄酚中剂量组(RHU-M组)和大黄酚高剂量组(RHU-H组)。
1.2.2 哮喘小鼠模型的建立除CON组外,其余各组分3次(第1、7、14天)对各组小鼠进行OVA致敏,参考文献[6]的建模方法,具体方法如下:小鼠每次腹腔注射200 μL OVA溶液(含4 mg氢氧化铝和100 μg OVA),CON组腹腔注射等量的生理盐水。第21天后对各组小鼠进行雾化激发(连续4 d),CON组以等量生理盐水雾化吸入。RHU-L组、RHU-M组和RHU-H组小鼠在第15天时分别用浓度为50、100、200 mg/kg的大黄酚灌胃给药,DEX组小鼠使用浓度为10 mg/kg的地塞米松灌胃给药,CON组和OVA组灌胃等量生理盐水,每日给药1次。
1.2.3 标本采集及处理各组末次激发24 h后,腹腔注射2%戊巴比妥钠麻醉小鼠。小鼠固定于手术台进行气管插管,小心暴露胸腔,血管夹夹住右主支气管,以0.4 mL磷酸缓冲盐溶液(PBS)重复灌洗左肺,共3次,合并灌洗液,于4 ℃离心机离心(700×g,10 min)。将上清液保存于-80 ℃冰箱,剩余的细胞沉淀用于涂片,再将小鼠右肺剥离,10%中性甲醛浸泡固定。取右肺中叶,常规石蜡包埋切片,用于苏木素-伊红(HE)染色,观察肺组织形态学变化。其余肺组织用生理盐水冲洗后,保存于-80 ℃冰箱,用于蛋白免疫印迹(Western Blot)法检测。
1.2.4 哮喘程度评分根据小鼠行为学变化严重程度对哮喘的严重程度进行分级评估,具体方法如下。无异常:0分;点头或震颤:1分;呛咳:2分;腹肌痉挛:3分;跌倒:4分。
1.2.5 肺泡灌洗液(BALF)中炎症细胞计数BALF的细胞沉淀中加入500 μL生理盐水,混匀后,取100 μL于载玻片中常规制备细胞涂片。严格按照Diff-Quick染色步骤进行染色,光学显微镜下进行炎症细胞计数。
1.2.6 肺组织形态学观察从10%中性甲醛中取出并选取同一部位适量大小的肺组织块,分别经过脱水、透明、浸蜡、包埋、切片等常规石蜡包埋切片步骤,HE染色,光学显微镜下观察各组小鼠肺组织形态学变化。
1.2.7 ELISA法测定BALF中IL-4、IL-5、TNF-α和IL-1β水平严格根据ELISA试剂盒说明书要求,使用酶标仪检测,并根据样品吸光度值确定BALF中IL-4、IL-5、TNF-α和IL-1β水平。
1.2.8 免疫组织化学法检测将各组切片分别进行熔蜡、脱蜡、脱水处理,沸水中进行抗原修复(30 min),然后分别用TWEAK(4 ℃过夜孵育)一抗和二抗(常温孵育2 h)进行孵育。DAB显色,苏木精复染,最后封片,显微镜下观察。
1.2.9 Western Blot法检测将样品进行蛋白裂解后,使用二喹啉甲酸(BCA)试剂盒检测各样品蛋白浓度。每个泳道加入等量的蛋白质样品并分离完成后,转移至硝化纤维素膜中,5%脱脂奶粉室温封闭3 h,并加入稀释的一抗(TWEAK、Fn14、β-actin)4 ℃过夜。洗膜,并用相应的二抗孵育3 h。使用电化学发光(ECL)法进行化学发光,Amersham Imager 600多功能成像仪采集图像。
1.2.10 统计学方法本实验采用SPSS 19.0软件分析各组数据,计量资料采用均数±标准差(x±s)表示,若数据符合正态分布、方差齐性采用单因素方差分析,若不符合正态分布、方差齐性采用非参数秩和检验。P<0.05为差异有统计学意义。
2 结果 2.1 大黄酚对哮喘程度评分的影响与CON组比较,OVA组小鼠哮喘评分上升,出现腹肌抽搐、呛咳及运动功能失调等哮喘症状。给予大黄酚后,小鼠哮喘评分降低,哮喘症状减轻,呈剂量依赖性。见表 1。
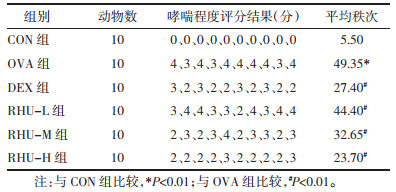
OVA组BALF中总细胞、嗜酸性粒细胞、中性粒细胞和淋巴细胞的数量较CON组升高(P<0.01)。与OVA组相比,DEX组与大黄酚各给药组的总细胞、嗜酸性粒细胞、中性粒细胞和淋巴细胞数量减少(P<0.01)。与RHU-L组比较,RHU-H组和DEX组的总细胞、中性粒细胞和淋巴细胞数量减少(P<0.05)。见表 2。
CON组小鼠气道管壁完整,上皮细胞排列整齐,管腔无狭窄、黏液,无明显炎性细胞浸润。OVA组小鼠气道管壁完整性明显受损,上皮细胞排列紊乱,管腔明显缩窄,可见较多黏液及大量炎性细胞浸润。与OVA组比较,DEX组及大黄酚各给药组气道管壁较OVA组相对完整,上皮细胞脱落数量、管腔黏液、炎性细胞浸润均减少。见图 1。
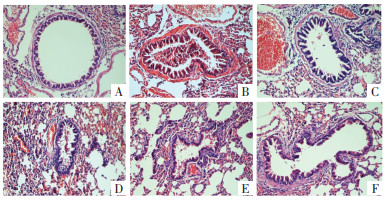
|
| 注:A.CON组;B.OVA组;C.DEX组;D.RHU-L组;E.RHU-M组;F.RHU-H组。 图 1 各组小鼠肺组织病理形态学观察(HE染色,×10) |
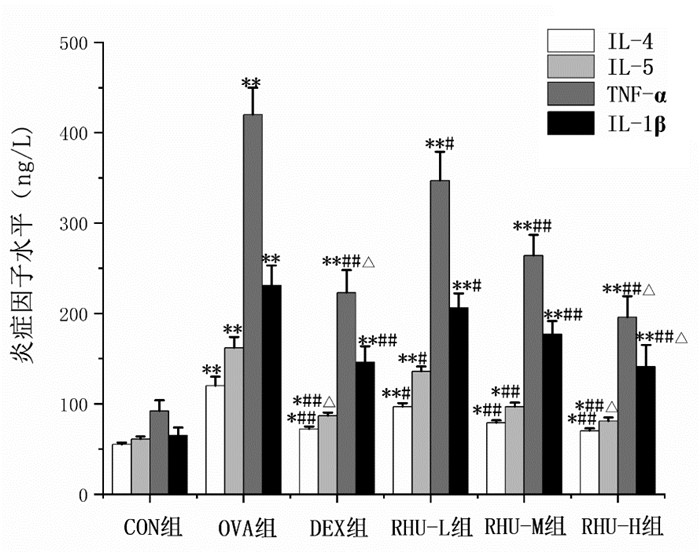
OVA组BALF中IL-4、IL-5、TNF-α和IL-1β水平较CON组升高(P<0.01)。与OVA组相比,DEX组与大黄酚各给药组的IL-4、IL-5、TNF-α和IL-1β水平降低(P<0.05或P<0.01)。与RHU-L组比较,RHU-H组的IL-5、TNF-α和IL-1β水平降低(P<0.05)。见图 2。
|
| 注:与CON组比较,*P<0.05,**P<0.01;与OVA组比较,#P<0.05,##P<0.01;与RHU-L组比较,△P<0.05。 图 2 各组小鼠BALF中IL-4、IL-5、TNF-α和IL-1β水平(x±s,n=10) |
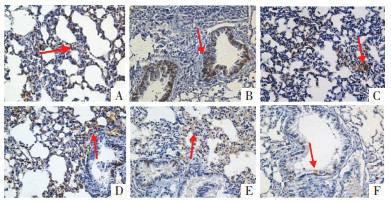
免疫组织化学染色结果可见,与CON组比较,OVA组气道周围TWEAK蛋白表达升高。与OVA组比较,DEX组与大黄酚各给药组的TWEAK蛋白表达降低。见图 3。
|
| 注:A.CON组;B.OVA组;C.DEX组;D.RHU-L组;E.RHU-M组;F.RHU-H组。 图 3 各组小鼠肺组织中TWEAK表达情况(HE染色,×40) |
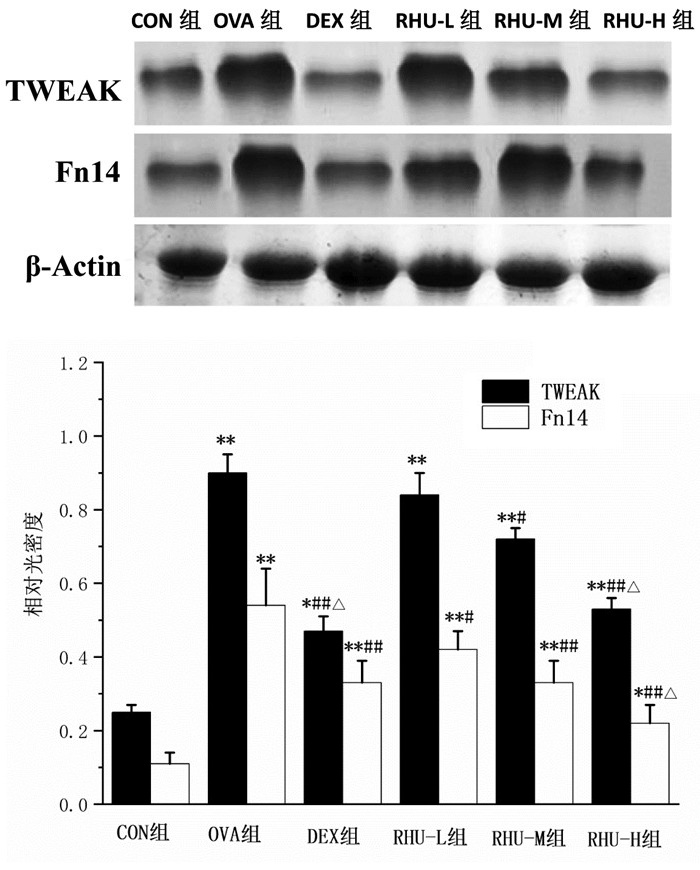
与CON组比较,各组小鼠肺组织中TWEAK和Fn14表达量升高(P < 0.05或P < 0.01)。与OVA组比较,DEX组与大黄酚各给药组小鼠肺组织中TWEAK和Fn14表达量降低(P < 0.05或P < 0.01)。与RHU-L组比较,RHU-H组小鼠TWEAK和Fn14表达量降低(P < 0.05)。见图 4。
|
| 注:与CON组比较,*P<0.05,**P<0.01;与OVA组比较,#P<0.05,##P<0.01;与RHU-L组比较,△P<0.05。 图 4 各组小鼠肺组织中TWEAK和Fn14表达情况(x±s,n=10) |
哮喘属于慢性炎症性疾病范畴,主要特征有炎症细胞浸润(嗜酸性粒细胞、淋巴细胞等)、气道高反应性及黏液分泌过多等,引起一系列的气道炎症性反应。哮喘的发病机制异常复杂,涉及多种炎性细胞和炎性细胞因子。有研究报道TWEAK/Fn14通路在哮喘气道炎症的发生发展中发挥着重要作用[7]。然而,基于长期大剂量使用糖皮质激素会导致较多的不良反应发生,故目前仍需迫切寻求具有高效低毒的治疗药物来提高哮喘患者的生存质量。大黄酚是一种从中药大黄中纯化的单体化合物,现代药理学研究发现大黄酚具有抗氧化、抗凋亡和抗炎等多种药理作用,提示其可能对哮喘有着较好的保护作用。而本研究也证实大黄酚能够通过TWEAK/Fn14信号通路明显减轻OVA诱导哮喘小鼠的炎症性症状,表明大黄酚可能是防治支气管哮喘疾病潜在的有效药物。值得注意的是,本实验使用大黄酚的最高给药剂量(小鼠给药剂量200 mg/kg,折算成人给药剂量为22.17 mg/kg)相当于临床大承气汤中大黄酚的人每日剂量(0.55 mg/kg)的40倍[8],有研究表明大黄蒽醌类成分人的毒性剂量可高达4 500 mg/kg[9]。而本实验分别以50、100、200 mg/kg的大黄酚灌胃给药后,均未发现小鼠出现严重腹泻情况,但大黄酚各给药组小鼠的粪便排泄量比CON组多。此外,该剂量范围内给药尚未发现其他不良反应。
炎性细胞,如嗜酸性粒细胞、嗜中性粒细胞和单核细胞等,迁移至肺组织是形成哮喘气道炎症的重要致病因素,其中炎性细胞的定向迁移受到多种趋化细胞因子的复杂调控,辅助T细胞(Th)1/Th2失衡是目前被广泛接受的哮喘重要发病机制之一[10]。本研究发现OVA诱导的小鼠BALF中增加了大量炎症细胞浸润,包括淋巴细胞、嗜酸性粒细胞、中性粒细胞等。同时,OVA诱导的OVA组小鼠BALF中促炎细胞因子辅助T细胞(Th)1(TNF-α、IL-1β)、Th2(IL-4、IL-5、IL-13)的水平明显升高,表明OVA诱导的小鼠哮喘模型破坏了Th1与Th2的平衡。HE染色结果显示,OVA诱导的OVA组小鼠气管内有大量黏液和炎症细胞浸润。综上所述,提示了小鼠过敏性哮喘模型建立成功。而给予不同剂量的大黄酚后,可明显降低BALF中淋巴细胞、嗜酸性粒细胞和中性粒细胞数量。同时,HE染色结果显示不同剂量大黄酚可减少气管内的黏液分泌和炎症细胞浸润,明显改善小鼠哮喘症状。TWEAK是一种可以表达于多种细胞的Ⅱ型跨膜蛋白,TWEAK通过Fn14发挥对其他细胞的调节作用,包括促进炎症细胞活性、调节细胞生长、血管生成等[11]。有研究发现TWEAK/Fn14通路在哮喘气道炎症发病过程中发挥着重要作用[7]。本研究免疫组织化学染色和Western Blot检测结果表明大黄酚可以降低肺组织中TWEAK和Fn14的表达水平,提示大黄酚可能通过作用于TWEAK/Fn14信号通路,从而改善哮喘气道炎症症状。
综上所述,大黄酚通过减少哮喘程度评分、减少肺组织中黏液量、减轻炎症细胞浸润、抑制炎症细胞因子,并降低TWEAK和Fn14蛋白生成,从而改善哮喘气道炎症,其作用机制可能与调节TWEAK/Fn14信号通路密切相关。
| [1] |
NANDA A, BAPTIST A P, DIVEKAR R, et al. Asthma in the older adult[J]. The Journal of Asthma, 2020, 57(3): 241-252. DOI:10.1080/02770903.2019.1565828 |
| [2] |
RESILIAC J, GRAYSON M H. Epidemiology of infections and development of asthma[J]. Immunology and Allergy Clinics of North America, 2019, 39(3): 297-307. DOI:10.1016/j.iac.2019.03.001 |
| [3] |
ROBINSON D, HUMBERT M, BUHL R, et al. Revisiting Type 2-high and Type 2-low airway inflammation in asthma: current knowledge and therapeutic implications[J]. Clinical & Experimental Allergy, 2017, 47(2): 161-175. |
| [4] |
LU W, LU C, ZHANG C M, et al. One mechanism of glucocorticoid action in asthma may involve the inhibition of IL-25 expression[J]. Experimental and Therapeutic Medicine, 2017, 13(2): 657-661. DOI:10.3892/etm.2016.4002 |
| [5] |
刘伦, 梅俊华, 曾云, 等. 大黄酚对脑缺血再灌注损伤小鼠的抗氧化及神经保护作用研究[J]. 中国临床药理学杂志, 2019, 35(18): 2059-2061, 2078. LIU L, MEI J H, ZENG Y, et al. The antioxidant and neuroprotective effects of rhubarphol on mice with cerebral ischemia reperfusion injury[J]. The Chinese Journal of Clinical Pharmacology, 2019, 35(18): 2059-2061, 2078. |
| [6] |
王重阳, 姜京植, 李俊峰, 等. 隐丹参酮通过TWEAK/Fn14和TGF-β1/Smads信号通路缓解OVA诱导哮喘小鼠气道炎症[J]. 中国药理学通报, 2019, 35(8): 1149-1154. WANG C Y, JIANG J Z, LI J F, et al. Effects of cryptotanshinone on airway inflammation models in asthmatic mice through TWEAK/Fn14 and TGF-β1/Smads signaling pathways[J]. Chinese Pharmacological Bulletin, 2019, 35(8): 1149-1154. DOI:10.3969/j.issn.1001-1978.2019.08.022 |
| [7] |
WANG M, XIE Z J, XU J, et al. TWEAK/Fn14 axis in respiratory diseases[J]. Clinica Chimica Acta, 2020, 509(3): 139-148. |
| [8] |
ZHU C M, ZHANG L G, LIU Z M, et al. TWEAK/Fn14 interaction induces proliferation and migration in human airway smooth muscle cells via activating the NF-κB pathway[J]. Journal of Cellular Biochemistry, 2018, 119(4): 3528-3536. DOI:10.1002/jcb.26525 |
| [9] |
邓诺. 大黄及其总蒽醌肝肾毒性研究[D]. 北京: 中国中医科学院, 2018. DENG N. Study on liver and kidney toxicity of rhubarb and its total anthraquinones[D]. Beijing: China Academy of Chinese Medical Sciences, 2018. |
| [10] |
BOSKABADY M H, NEAMATI A. Improvement of tracheal responsiveness and Th1/Th2 balance in a rat model of asthma, treated with Portulaca oleracea[J]. Alternative Therapies in Health and Medicine, 2020, 26(6): 34-42. |
| [11] |
XU J, HE J, HE H, et al. TWEAK-Fn14 influences neurogenesis status via modulating NF-κB in mice with spinal cord injury[J]. Molecular Neurobiology, 2017, 54(9): 7497-7506. DOI:10.1007/s12035-016-0248-x |
 2022, Vol. 41
2022, Vol. 41