文章信息
- 张环宇, 王文秀, 高晗, 谭伟, 余小磊, 李振国, 田晓轩
- ZHANG Huanyu, WANG Wenxiu, GAO Han, TAN Wei, YU Xiaolei, LI Zhenguo, TIAN Xiaoxuan
- 基于环介导等温扩增技术快速鉴定宽体金线蛭
- Rapid authentication of Whitmania Pigra Whitman based on loop-mediated isothermal amplification technology
- 天津中医药大学学报, 2022, 41(5): 649-652
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(5): 649-652
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.05.20
-
文章历史
收稿日期: 2022-06-03
2. 天津中医药大学中医药研究院,天津 301617;
3. 牡丹江友搏药业 有限责任公司,牡丹江 157000
2. The Institute of Traditional Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
3. YouBo Pharmaceutical Co. Ltd., Mudanjiang 157000, China
水蛭为蚂蟥(Whitmania Pigra Whitman)、水蛭(Hirudo nipponica Whitman)或柳叶蚂蟥(Whitmania acranutata Whitman)的干燥全体[1]。目前中药材市场中主要流通品种为蚂蝗,又名宽体金线蛭,为药用优良品种[2-3]。近年来,水蛭作为原料药被大量用于中药制剂的开发,导致水蛭中药材价格上涨,常有不法药材销售商对水蛭中药材掺假出售[3]。因此,对水蛭的质量鉴别尤为重要。
传统水蛭鉴定方法主要包括性状鉴别及理化鉴别[4-5],这些技术在水蛭鉴定和质量控制中发挥了关键作用。随着分子生物学的发展,分子鉴别技术在中药材鉴定中得到了广泛的应用,与传统的形态和化学检测方法相比,分子技术具有更高的准确度。环介导等温扩增技术(LAMP)是一种新型的等温核酸扩增技术,因其操作简便、仪器费用低廉、结果分析简单、快速等优点成为目前常用的核酸检测技术之一[6-7]。因此,本研究针对水蛭线粒体细胞色素氧化酶I(COI)基因序列设计LAMP引物,结合荧光染料法对宽体金线蛭及其常见混伪品进行快速鉴别。
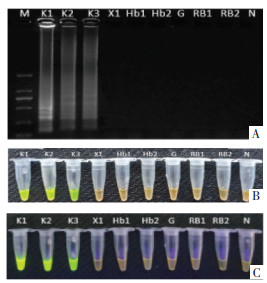
1 材料与仪器 1.1 药品取采自中药材市场的4份水蛭样品进行特异性实验,见表 1。实际样品检测材料共9份水蛭样品,见表 2。样品经牡丹江友搏药业有限责任公司张孝晨根据样品形态等特征进行性状鉴定。
凝胶成像分析仪(Cuene Genins);DYY-8C型核酸电泳仪(北京六一生物科技有限公司);ZHJH-C1112B型超净工作台(上海智城分析仪器制造有限公司);聚合酶链式反应(PCR)仪(Eppendorf);ZF-6型紫外分析仪(上海嘉鹏科技有限公司);JA3003型电子精密天平(天津天马衡基仪器有限公司)。
1.3 试剂Bst 2.0 WarmStart DNA聚合酶(纽英伦生物技术有限公司);Tks Gflex DNA聚合酶(宝日医生物技术有限公司);琼脂糖(Lonza);无水乙醇(天津市大茂化学试剂厂);6×上样缓冲液(Loading buffer,宝日医生物技术有限公司);10 000×SYBR Green I核酸染料(北京索莱宝科技有限公司);DuRed核酸染料(北京泛博生物化学有限公司);D2000 DNA Marker(北京天根生化科技有限公司);50×TAE(合肥志宏生物技术有限公司);无酶水(Biosharp);DNA提取试剂盒(北京天根生化科技有限公司);Tks Gflex DNA聚合酶(宝日医生物技术有限公司);等温扩增反应缓冲液(纽英伦生物技术有限公司);MgSO4(100 mmol/L,纽英伦生物技术有限公司)。
2 实验方法及结果 2.1 引物特异性检测实验剪取4份特异性实验样品(2条宽体金线蛭、1条光润金线蛭、1条日本医蛭)肌肉组织约30 mg,将其放入洁净的1.5 mL离心管中,另取一离心管以无酶水代替DNA模板作为阴性对照。按照动物组织基因组DNA提取试剂盒说明书提取总DNA,取5 μL提取产物,加入1 μL的6×Loading buffer混匀后于DuRed染色的1%琼脂糖凝胶电泳,观察DNA提取质量及长度。使用紫外分光光度计测量所提取的DNA浓度及A260/A280,储存于-20 ℃。选择通用引物COI(见表 3)对提取的DNA进行扩增,25 μL反应体系包括12.5 μL 2×反应缓冲液、0.5 μL 10 μmol/L LCO1490(10 μmol/L)、0.5 μL 10 μmol/L HCO2198(10 μmol/L)、0.5 μL DNA模板、1.25 U Tks Gflex DNA聚合酶、10.5 μL无酶水。引物序列见表 3。PCR检测在PCR仪上进行,扩增程序为:98 ℃预变性1 min,98 ℃变性10 s,52 ℃退火15 s,68 ℃延伸30 s,40个循环,68 ℃再延伸5 min。扩增结束后取5 μL扩增产物,加入1 μL 6×Loading buffer混匀后于DuRed染色的1%琼脂糖凝胶进行电泳,选择阳性PCR产物样品进行一代双端测序。一代测序结果见表 1。
将上述一代测序所得4条水蛭序列进行LAMP引物设计,使用Geneious 8.0.4去除引物区,利用MAFFT v7.271进行对齐,筛选宽体金线蛭特有的变异位点,针对其变异位点在网站(http://primerexplorer.jp/lampv5e/index.html)设计LAMP引物组,挑选3组引物组于Oligo 7进行引物评价,筛选引物质量最佳的1组引物作为本次实验所用引物组。引物由生工生物工程(上海)股份有限公司合成,LAMP引物序列见表 3。
2.3 LAMP法检测中药材宽体金线蛭方法的建立配置反应体系为25 μL,包括0.2 μmol/L sz-F3(10 μmol/L)、0.2 μmol/L sz-B3(10 μmol/L)、1.6 μmol/L sz-FIP(10 μmol/L)、1.6 μmol/L sz-BIP(10 μmol/L)、1×等温扩增反应缓冲液、8 U Bst 2.0 WarmStart DNA聚合酶、6 mmol/L MgSO4(100 mmol/L)、1.4 mmol/L三磷酸脱氧核苷酸(dNTPs)(10 mmol/L)、1 μL DNA模板,加无酶水补充总体积至25 μL。将反应液于64 ℃恒温反应60 min,80 ℃下孵育10 min结束反应。反应结束后取5 μL扩增产物于含DuRed核酸染料的1%琼脂糖凝胶上进行电泳(观察有无梯状条带及条带的明亮程度),电压110 V,电泳30 min。在余下20 μL扩增产物中加入0.2 μL 10 000×SYBR Green Ⅰ核酸染料,在自然灯下及254 nm紫外光下观察颜色变化。
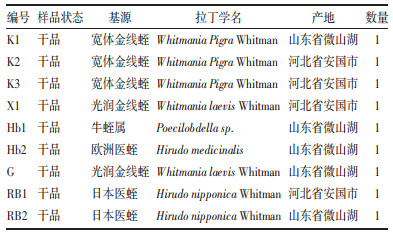
2.4 LAMP特异性检测结果扩增产物于含DuRed核酸染料的1%琼脂糖凝胶上电泳,结果见图 1A,宽体金线蛭呈梯状条带(阳性),对照组无条带产生(阴性)。在余下20 μL扩增产物中加入0.2 μL 10 000×SYBR Green Ⅰ核酸染料,于自然灯下观察结果见图 1B,宽体金线蛭在自然光下变为绿色(阳性),光润金线蛭、日本医蛭、阴性对照均呈橙黄色(阴性)。将加入了0.2 μL 10 000×SYBR Green Ⅰ核酸染料的扩增产物置于254 nm紫外灯下观察颜色变化,结果见图 1C,宽体金线蛭在254 nm紫外光下呈绿色荧光(阳性),对照组无荧光产生(阴性)。以上结果表明,所设计的LAMP引物能对宽体金线蛭进行特异性扩增。
|
| 注:1.宽体金线蛭(Whitmania Pigra);2.宽体金线蛭(Whitmania Pigra Whitman);3.光润金线蛭(Whitmania laevis);4.日本医蛭(Hirudo nipponica Whitman);5.阴性对照(Negative control)。 图 1 LAMP反应特异性检测结果 |
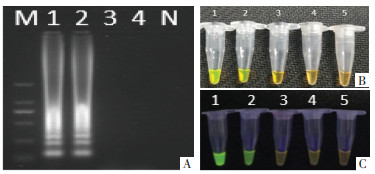
收集市售9份水蛭样品,按照“2.1”项所述方法进行DNA提取、PCR扩增及一代测序,对所收集样品进行分子鉴定,一代测序结果见表 2。运用所设计的LAMP引物按上述步骤进行LAMP扩增,反应时间为60 min,对水蛭实际样品进行检测。检测结果见图 2。扩增产物于含DuRed核酸染料的1%琼脂糖凝胶上进行电泳,结果见图 2A,编号K1、K2、K3样品均呈梯状条带(阳性),对照组无条带产生(阴性)。在余下20 μL扩增产物中加入0.2 μL 10 000×SYBR Green Ⅰ核酸染料,自然灯下观察结果见图 2B,编号K1、K2、K3样品在自然光下变为绿色(阳性),对照组呈橙黄色(阴性)。将加入了0.2 μL 10 000×SYBR Green Ⅰ核酸染料的扩增产物置于254 nm紫外灯下观察,结果见图 2C,编号K1、K2、K3样品在254 nm紫外光下呈绿色荧光(阳性),对照组无荧光产生(阴性)。3种检测方式中的阳性结果样品与表 2中分子鉴定结果为宽体金线蛭的样品一致。以上结果表明,本研究所建立的宽体金线蛭LAMP检测技术可实现对市售宽体金线蛭及其常见混伪品的快速鉴别。
|
| 注:K1.宽体金线蛭(Whitmania Pigra Whitman);K2.宽体金线蛭(Whitmania Pigra Whitman);K3.宽体金线蛭(Whitmania Pigra Whitman);X1.光润金线蛭(Whitmania laevis Whitman);Hb1.牛蛭属(Poecilobdella sp.);Hb2.欧洲医蛭属(Hirudo medicinalis);G.光润金线蛭(Whitmania laevis Whitman);HB1.日本医蛭(Hirudo nipponica Whitman);HB2.日本医蛭(Hirudo nipponica Whitman);N.阴性对照(Negative control)。 图 2 LAMP实际样品检测结果 |
准确检测宽体金线蛭对水蛭的临床用药安全具有重要意义。目前水蛭的鉴别方法,如高效液相色谱法、高效毛细管电泳法等通常需要大型仪器设备,不利于宽体金线蛭的现场快速鉴别。因此,本研究通过设计4条LAMP特异性引物,利用具有链置换活性的Bst 2.0 WarmStart DNA聚合酶,在64 ℃恒温下保温60 min即可结束反应,无需热循环仪。且本研究建立了3种LAMP检测方法,分别为琼脂糖凝胶电泳法及在自然光、254 nm紫外光下肉眼观察核酸染料SYBR Green Ⅰ的颜色变化,以对宽体金线蛭进行准确识别。该检测体系的结果判定只需加入核酸染料,肉眼即可观察到颜色变化,操作简便。因此本研究提供了宽体金线蛭的基源快速鉴定方法,具有操作简便、仪器费用低廉、特异性良好、检测快速等优点。
适宜的靶标序列是DNA分子鉴定准确性的基础保障。研究表明,以COI为靶标序列可将正品水蛭与其他混伪品明显区分[3]。因此,本研究基于线粒体COI基因序列建立了中药材宽体金线蛭的LAMP检测体系。本研究的结果表明,利用LAMP技术可成功将宽体金线蛭与光润金线蛭、日本医蛭、欧洲医蛭及牛蛭属物种区分开来,且特异性良好。
| [1] |
国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2015. The National Pharmacopoeia Commission. Pharmacopoeia of People's Republic of China[M]. Beijing: China Medical Science and TechnologyPress, 2015. |
| [2] |
叶乃卫. 药用水蛭的人工养殖[J]. 农村实用技术, 2002, 5(1): 38-39. YE N W. Artificial breeding of medicinal leeches[J]. Applicable Technologies for Rural Areas, 2002, 5(1): 38-39. |
| [3] |
刘晓帆, 刘春生, 杨瑶珺, 等. 基于COI基因的水蛭及其混伪品的DNA条形码研究[J]. 北京中医药大学学报, 2013, 36(1): 63-66. LIU X F, LIU C S, YANG Y J, et al. DNA barcodes of Shuizhi(Hirudo) and its adulterants studied based on COI gene[J]. Journal of Beijing University of Chinese Medicine, 2013, 36(1): 63-66. |
| [4] |
解学超. 掺伪水蛭的经验鉴别[J]. 齐鲁药事, 2011, 30(10): 588. XIE X C. Empirical identification of the adulterated leeches[J]. Qilu Pharmaceutical Affairs, 2011, 30(10): 588. |
| [5] |
袁晓环, 王春涛, 王晓东. 水蛭药材的鉴别[J]. 牡丹江医学院学报, 2007, 28(3): 81-82. YUAN X H, WANG C T, WANG X D. Identification of leech medicinal herbs[J]. Journal of Mudanjiang Medical College, 2007, 28(3): 81-82. |
| [6] |
MAYR A, LASS-FLÖRL C. Epidemiology and antifungal resistance in invasive Aspergillosis according to primary disease: review of the literature[J]. European Journal of Medical Research, 2011, 16(4): 153-157. DOI:10.1186/2047-783X-16-4-153 |
| [7] |
余淑琳, 蒋超, 黄璐琦, 等. 基于环介导等温扩增技术快速鉴别钩吻[J]. 中药材, 2014, 37(4): 594-596. YU S L, JIANG C, HUANG L Q, et al. Rapid identification of Gelsemium elegans based on ring-mediated isothermal amplification techniques[J]. Journal of Chinese Medicinal Materials, 2014, 37(4): 594-596. |
 2022, Vol. 41
2022, Vol. 41