文章信息
- 余甜, 舒红英, 杨小颀
- YU Tian, SHU Hongying, YANG Xiaoqi
- 复发性流产患者T淋巴细胞及其亚群变化研究进展
- Research progress of T lymphocytes and their subsets in patients with recurrent spontaneous abortion
- 天津中医药大学学报, 2022, 41(5): 661-667
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(5): 661-667
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.05.22
-
文章历史
收稿日期: 2022-04-29
2. 陕西中医药大学第二附属医院, 咸阳 712000
2. The Second Affiliated Hospital of Shaanxi University of Chinese Medicine, Xianyang 712000, China
从免疫学角度来讲,胎儿被认为是一类特殊的同种半异基因移植物。成功种植意味着胚胎所表达的父系抗原没有遭到母体排斥,而是在母-胎界面免疫系统的调节下成功耐受,这得益于母胎间复杂而精确的免疫平衡机制。母-胎界面由母体蜕膜组织和胎盘滋养层组织共同构成,内含多种免疫活性细胞和免疫因子。他们共同构成的子宫免疫微环境是母体与胎儿免疫调节发挥作用的关键场所,能在保证感染防御的同时维持母体对胎儿的免疫耐受平衡。
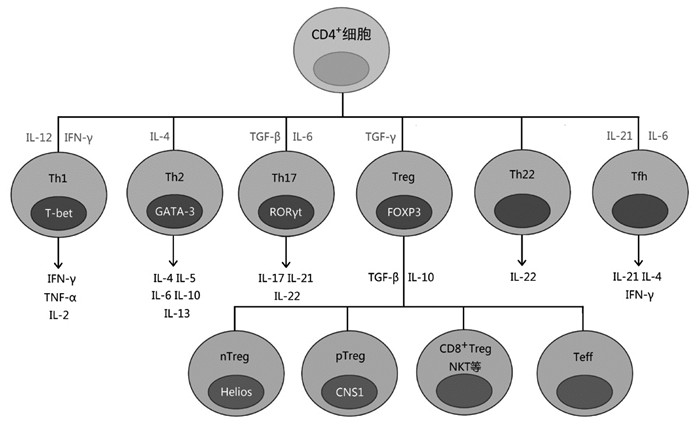
复发性流产(RSA)指与同一性伴侣连续发生3次及以上的孕28周前的自然流产。但国内外大多数学者认为在发生第2次自然流产后就应予以干预,并告知患者引起重视,因其发生再流产的风险已接近3次流产者。RSA病因复杂,除染色体、内分泌、解剖、感染、自身免疫病等传统因素之外,仍有50%~60%患者无法找到明确的病因,称为不明原因的RSA(URSA)[1],且大多与免疫失衡相关。近年来研究发现,URSA患者体内T淋巴细胞及其亚群较正常妊娠组变化显著[2],提示该细胞群参与维持子宫免疫微环境的平衡与稳定,一旦失衡即会造成胎儿种植失败或流产。见图 1。
|
| 注:在免疫细胞的分化历程中,T淋巴细胞进入胸腺后可根据细胞表面表达白细胞分裂抗原(CD)的不同分为CD4+T细胞和CD8+T细胞。前者经不同细胞因子刺激分化为各类辅助T细胞(Th),如Th1、Th2、Th17、Th22,以及调节性T细胞(Treg)和滤泡辅助性T细胞(Tfh)等,其中Treg又可根据诱导来源不同分为自然调节细胞(nTreg)和外周或适应性调节细胞(pTreg或iTreg)。除此之外,CD8+Treg和自然杀伤性T细胞(NKT)等也具有免疫调节作用。CD25低表达的CD4+的非抑制性效应性T细胞(Teff)因与Treg同样表达叉状头/翼螺旋转录因子3(Foxp3),且由Treg分化而来,故此处列入Treg分类中。不同T细胞亚群的抗原特异性决定了他们在母胎界面的功能,从而在妊娠过程中发挥各自的作用。 图 1 RSA患者T淋巴细胞及其亚群 |
T淋巴细胞及亚群与RSA之间密切相关,但其导致免疫失衡的致病机制尚不完全明确,故笔者对RSA母体T淋巴细胞变化的研究进展进行综述,为深入研究其引导的免疫调节在疾病中的作用机制奠定理论基础,以期探索新的治疗方法。
1 Th1/Th2Th细胞均表达CD4,可以通过分泌多种细胞因子引导人体免疫方向的倾斜。其中Th1细胞以分泌白细胞介素(IL)-2、干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)等细胞因子为主,主要介导细胞免疫和局部炎症反应,通过激活细胞免疫和血管内皮促凝参与妊娠病理过程[3]。Th2细胞分泌以IL-4、IL-5、IL-6、IL-10为主的细胞因子,主要促进B细胞增殖和抗体生成,介导体液免疫,可抑制Th1细胞的分化和功能[4],诱导母胎界面免疫耐受的形成,防止过度免疫应答对胚胎着床造成的伤害。早期实验证明,母胎界面免疫平衡向Th2型细胞因子的偏移是妊娠成功的关键[5],近年来也被各种动物模型与临床研究证明。与DBA/2雄性小鼠结合的CBA/J雌性小鼠是公认的自然流产小鼠模型,Luo等[6]的酶联免疫吸附(ELISA)实验结果证明,RSA组小鼠外周血中Th1/Th2细胞因子比值(IFN-γ/IL-4)明显高于正常妊娠组。在URSA患者蜕膜中IFN-γ的表达也明显高于对照组,而IL-4和IL-10的表达相应减低[7]。但近来也有研究显示,具有Th2型免疫优势的正常妇女也会反复出现自然流产现象[8]。由此可推测,成功妊娠的维持不单与Th1/Th2的平衡有关,还可能是与其他细胞共同作用的结果。
2 Th17/TregIL-6和转化生长因子(TGF)-β在小鼠CD4+细胞定向分化为Th17细胞的过程中缺一不可,但在缺乏IL-6的条件下,TGF-β将抑制孤核受体γt(RORγt)转录活化,通过上调Foxp3的表达而促使细胞向Treg细胞分化[9]。Th17细胞/Treg细胞之间的平衡对机体维持自身稳态是至关重要的。虽然两者均需要TGF-β因子进行初始分化,而终末分化细胞却执行相反的功能:Th17细胞分泌促炎性因子IL-17,与多种自身免疫性疾病的发生相关;而Treg细胞分泌IL-10等细胞因子,有抗炎和维持免疫稳态的作用,在妊娠过程中增强母体免疫耐受并防止妊娠母体对胎儿的免疫排斥。研究表明,URSA患者的Treg/Th17和Foxp3/RORγt比值均低于正常对照组[10-11],提示这一平衡向着Th17细胞的方向偏移可能与URSA的发病机制有关。另一组对照研究根据受试者是否具有多次流产史(即URSA)以及是否怀孕将其分为4组,虽然各组患者外周血IL-10、IL-17水平及Th17/Treg细胞比值均保持稳定,但在母胎界面,怀孕的URSA组蜕膜组织中TGF-β1的mRNA和蛋白水平明显降低,而IL-6和Th17/Treg比值明显升高[12]。这一结果表明在反复流产患者的母胎界面,免疫细胞与相关因子的变化程度较外周血中更为明显,且IL-6在Treg/Th17失衡的诱导中起到一定作用。此外,有学者通过ROC曲线分析将Foxp3与RORγt的mRNA检测应用于疾病诊断中,发现两项指标联合检测优于单项检测,能有效提高RSA诊断的特异性和敏感性[13]。
3 Treg细胞由CD4+细胞分化而来的Treg细胞主要分为两大类:nTreg以及pTreg或iTreg,后者主要包括Tr1和Th3。nTreg主要由胸腺内自身抗原诱导生成,而pTreg细胞来自外周血,由外来抗原诱导生成。除此之外,体内发挥免疫抑制效应的Treg细胞还有CD8+Treg细胞和NKT细胞等。Treg细胞群对于怀孕成功的重要性已经在人类和动物模型中得到证实,且在RSA患者体内较Th17细胞变化更为显著,提示其对妊娠结局的影响更为重大[14]。Treg细胞除了可以抑制炎症、防止母体对胎儿过度免疫外,还被证明在妊娠期间有助于调节母体血管功能,支持正常胎儿和胎盘发育[15]。
3.1 nTreg细胞nTreg占外周血CD4+T细胞的10%左右,主要指CD4+CD25+Foxp3+Treg。已知在正常妊娠或是流产患者的早孕蜕膜组织中,都是以nTreg细胞为主[16]。在小鼠模型中测得外周血nTreg的数量在怀孕期间会持续增加,并在孕中期达到峰值,随后下降直到足月达非孕水平[17],提示nTreg细胞的动态变化与成功妊娠相关。nTreg特征性表达Foxp3和高水平IL-2Rα链(CD25),因此有多项试验通过测定Foxp3和CD25来间接反映nTreg的水平。Salek等[18]的实验证明,RSA模型小鼠经骨髓间充质干细胞处理后显著上调Foxp3等Treg相关基因在胎盘和蜕膜中的表达,怀孕小鼠的流产率显著降低,并恢复至正常水平,提示该条件可能会在母胎界面建立一个免疫耐受的微环境,参与调控母体对胎儿的过度免疫反应。
同样,在RSA患者体内测得CD4+CD25+Treg的比例和Foxp3蛋白水平等各项含量明显低于正常妊娠对照组,提示Treg细胞数量的下降可能是URSA的发生机制之一[19]。尤其在排除染色体异常的流产患者中,蜕膜Foxp3+Treg细胞减少更为明显[20]。最近的1项研究表明,RSA组外周血及蜕膜组织中CD4+CD25bright频率及CD4+CD25bright/CD4+都显著低于健康对照组,Logistic回归分析显示CD4+CD25bright频率是流产发生的独立保护因素[21]。同时该作者还提出外周血CD4+CD25+Treg细胞和IL-10水平对RSA具有较高预测价值,联合检测可作为预测既往RSA孕妇再发流产的参考指标[22]。
转录因子家族成员Helios是nTreg细胞的特异性标志物,可用以区别nTreg和pTreg[23]。Inada等[20]的试验证明,在正常妊娠时,蜕膜中Helios-pTreg细胞数量很少,而Helios+效应性Treg细胞的出现率明显高于外周血,提示效应性Treg细胞可能从外周血选择性地迁移到蜕膜中发挥作用。而在正常的流产患者中,蜕膜基底层的Foxp3+细胞数量减少,但在顶叶蜕膜没有减少,这表明Treg细胞在胎儿-母体交界处的迁移失败可能是导致流产发生的原因。
3.2 pTreg细胞保守的非编码序列1(CNS1)是一种Foxp3增强子,只存在于胎盘哺乳动物中,是pTreg细胞发育所必需的。在小鼠模型中可以观察到,pTreg细胞通过识别父系抗原抑制母胎效应性T细胞激活免疫反应。当CNS1缺陷的雌性小鼠与主要组织相容性复合体(MHC)不匹配的雄性小鼠交配时,pTreg细胞的缺乏会导致胚胎自然流产的增加[24]。在妊娠早期植入pTreg后,流产易感模型小鼠脾脏CD4+CD25+Foxp3+Treg细胞数量明显增加,胚胎吸收明显减少[25]。最近的临床试验也显示,与正常非孕者相比,无流产史的怀孕妇女外周性Treg细胞显著增加;但在URSA患者中,pTreg细胞数量在怀孕时较低[12]。由此可见,pTreg可能参与并维持由nTreg启动的免疫耐受状态,在小鼠和人类的胚胎植入和妊娠中起着重要作用。
3.3 其他Treg细胞在CD8+T细胞中也存在一类Treg细胞。CD8+Treg具有免疫抑制作用,可识别胎儿抗原和裂解滋养层细胞。正常妊娠时在母胎交界处发挥有限的细胞毒作用,通过多种途径产生抑制信号,导致滋养层抗原特异性耐受。
NKT细胞共表达T细胞受体和自然杀伤(NK)细胞受体,在不同情况下定量克隆。试验显示URSA患者外周血和蜕膜中NKT样细胞亚群所占比例明显高于正常妊娠和未妊娠妇女,提示NKT样细胞在维持正常妊娠中可能起重要作用;同时推断外周血中CD3+CD56+CD16+NKT样细胞的检测可能为评估患者自然流产的风险提供一种潜在工具[26]。除此之外,CD8+Treg和NKT细胞也可以分泌1型和2型细胞因子,协助维持Th1/Th2等的动态平衡[27]。
4 其他细胞在人类免疫细胞中,Th22分泌IL-22而不表达IL-17、IL-4及IFN-γ,在监控和协调免疫细胞引发炎症的过程中起特殊作用,但在生殖系统的研究甚少[28]。最近的试验发现[29],在RSA患者外周血中,Th22的数量及IL-22浓度都有显著增高;但也有证据表明,正常成功妊娠者外周血及蜕膜中存在IL-22 mRNA增多的现象[30],提示IL-22在妊娠的某些阶段是造成胎儿移植排斥反应的原因,但在其他阶段也可能对怀孕有正向作用,其来源与具体作用及机制有待进一步研究。
CD4+T细胞还可分化为Tfh,通过分泌IL-21等相关因子在Th细胞依赖性B细胞产生抗体的过程中起到关键作用。研究表明,该种细胞与RSA疾病相关的主要亚群有CD4+CXCR5+PD-1+CCR7-Tfh和CD4+CXCR5+PD-1+ICOS+Tfh。两者在RSA患者的蜕膜组织中明显增多,且后者在自身抗体阳性的RSA患者中增加更明显[31]。此外,患者外周血中Tfh与IL-21水平的升高也有效证实了此类细胞与RSA疾病的相关性[32]。
还有一些研究者提到了Teff细胞,它是指CD25低表达的CD4+的非抑制性效应性T细胞,与Treg一样表达Foxp3,可由Treg分化而来,但对免疫耐受起破坏作用。在染色体核型正常的流产病例中,蜕膜组织的Foxp3+Teff细胞增加,母胎界面呈现免疫激活显性状态[20]。但在感染、过度炎症或胎儿发育受到干扰的情况下,Treg能够分化为Teff的能力可终止妊娠并确保孕产妇生存,可见Teff细胞对于妊娠的调节具有积极意义[33]。
5 不同治疗方式对母胎T淋巴细胞的影响 5.1 西医治疗目前大多采取免疫疗法,包括淋巴细胞主动免疫、静脉注射免疫球蛋白(IVIG)、脂肪乳、免疫抑制剂和粒细胞集落刺激因子等。研究表明,淋巴细胞治疗和IVIG的应用均可提高妊娠成功率。在多次植入失败的URSA患者中,注射外源淋巴细胞或IVIG可以通过平衡Th1/Th2来促进胚胎植入,还能促进改善Treg的比例[34-35]。近年来有学者提出,使用更为安全经济的脂肪乳可代替免疫球蛋白降低外周血中的NK细胞含量,且治疗效果比较差异无统计学意义[36]。适量免疫抑制剂,如环孢素A可调节免疫因子,诱导免疫耐受,通过改变RSA患者共抑制分子的表达降低Th17细胞的百分比,促进Treg细胞的优势[37],但因研究样本量不足,其安全性和有效性有待进一步研究。
此外,通过给予孕酮和补充维生素D3可以影响身体免疫状态,同样对RSA有治疗效果。越来越多的临床试验证据表明,孕酮对反复流产或早产风险高的妇女有效[38]。在1项孕激素联合绒毛膜促性素治疗URSA的随机对照试验中,地屈孕酮片组和黄体酮组患者的IL-4、IL-10、Treg/CD4+均升高,IL-6、IL-17、INF-γ、Th17/Treg均降低,且地屈孕酮片组流产率较低,足月分娩率更高。提示孕激素联合绒毛膜促性素可通过调节患者T淋巴细胞因子及炎症因子水平,促进母胎平衡,提高保胎率[39]。还有些数据表明[40],给予外源性雌激素治疗的小鼠Foxp3的表达增强,在怀孕期间Treg功能增加。维生素D3治疗也可通过影响外周血Th1/Th2、Th17/Treg比值,增强免疫耐受,从而改善妊娠结局[41]。
5.2 中医治疗RSA在中医属“数堕胎”“滑胎”等范畴,治疗应以补肾健脾为主,兼补益气血。中医药治疗RSA临证时通过辨证论治,可灵活运用经典方、经验方,并随症加减,在多项临床试验中取得显著成效。实验证明中药自拟固胎煎(由经典名方寿胎丸化载而来)可通过上调小鼠外周血IL-10、TGF-β1的表达水平,下调IL-6、IL-17的表达水平调节母胎免疫[42],起到补肾健脾安胎的功效。此外,减味寿胎丸[43]、补肾固冲方[44]等均可通过提高患者Treg细胞百分率,下调Th17细胞及其分泌的免疫因子含量,降低胚胎吸收率。
妊娠是一个复杂的生理过程,为使胎儿不受母体免疫系统排斥,母胎界面的T淋巴细胞亚群和免疫分子充分发挥各自职能,对耐受平衡进行复杂而精细的调控。近年来在发现部分RSA患者同样具有Th2型免疫优势后,学者们开始将研究重点从经典的Th1/Th2失衡理论转移到Th17/Treg上来,尤其是各类Treg细胞在外周与母胎间的分布和变化,成为了生殖医学领域的研究热点。但当下对于疾病的大多研究仍集中在通过测定细胞因子含量和标志性基因,对比正常妊娠组与RSA患者T淋巴细胞各亚群数量级的差异上。研究结果往往只能说明该细胞群与疾病的免疫病理因素相关,而每种细胞是如何调节抗原免疫耐受形成的机制尚不清楚,他们在RSA中究竟如何发挥作用仍待研究。目前,评估URSA患者的细胞因子功能状态及免疫细胞含量可能对于制定合理的治疗方案具有一定指导意义,但仍需大规模临床研究来支持针对细胞因子治疗的可行性及评估获益风险。笔者综述汇总了既往免疫细胞的相关研究,为深入研究免疫调节在RSA中的作用机制提供理论参考,以探索新的免疫学诊断和治疗方法改善妊娠结局。
| [1] |
Evaluation and treatment of recurrent pregnancy loss: a committee opinion[J]. Fertility and Sterility, 2012, 98(5): 1103-1111.
|
| [2] |
NANCY P, ERLEBACHER A. T cell behavior at the maternal-fetal interface[J]. The International Journal of Developmental Biology, 2014, 58(2): 189-198. |
| [3] |
VAN NIEUWENHOVEN A L V, HEINEMAN M J, FAAS M M. The immunology of successful pregnancy[J]. Human Reproduction Update, 2003, 9(4): 347-357. DOI:10.1093/humupd/dmg026 |
| [4] |
SAITO S, NAKASHIMA A, SHIMA T, et al. Review article: Th1/Th2/Th17 and regulatory T-cell paradigm in pregnancy[J]. American Journal of Reproductive Immunology, 2010, 63(6): 601-610. DOI:10.1111/j.1600-0897.2010.00852.x |
| [5] |
WEGMANN T G, LIN H, GUILBERT L, et al. Bidirectional cytokine interactions in the maternal-fetal relationship: is successful pregnancy a TH2 phenomenon?[J]. Immunology Today, 1993, 14(7): 353-356. DOI:10.1016/0167-5699(93)90235-D |
| [6] |
LUO J, WANG Y Q, QI Q R, et al. Sinomenine improves embryo survival by regulating Th1/Th2 balance in a mouse model of recurrent spontaneous abortion[J]. Medical Science Monitor: International Medical Journal of Experimental and Clinical Research, 2021, 27(3): 709-729. |
| [7] |
PENG Y Z, YIN S, WANG M. Significance of the ratio interferon-γ/interleukin-4 in early diagnosis and immune mechanism of unexplained recurrent spontaneous abortion[J]. International Journal of Gynecology & Obstetrics, 2021, 154(1): 39-43. |
| [8] |
CHAOUAT G, LÉDÉE-BATAILLE N, ZOURBAS S, et al. Cytokines, implantation and early abortion: re-examining the Th1/Th2 paradigm leads to question the single pathway, single therapy concept[J]. American Journal of Reproductive Immunology, 2003, 50(3): 177-186. DOI:10.1034/j.1600-0897.2003.00080.x |
| [9] |
HOSSEINI S, SHOKRI F, ANSARI P S, et al. A shift in the balance of T17 and Treg cells in menstrual blood of women with unexplained recurrent spontaneous abortion[J]. Journal of Reproductive Immunology, 2016, 116(1): 13-22. |
| [10] |
ZHU L Q, CHEN H, LIU M L, et al. Treg/Th17 cell imbalance and IL-6 profile in patients with unexplained recurrent spontaneous abortion[J]. Reproductive Sciences (Thousand Oaks, Calif), 2017, 24(6): 882-890. DOI:10.1177/1933719116670517 |
| [11] |
杨小猛, 赵丹, 杜丽伟, 等. 习惯性流产患者绒毛和蜕膜中Treg/Th17免疫失衡的检测及其临床意义[J]. 检验医学与临床, 2015, 12(1): 22-25. YANG X M, ZHAO D, DU L W, et al. Immune unbalance detection of Treg/Th17 in villus and deciduas in patients with habitual abortion and its clinical significance[J]. Laboratory Medicine and Clinic, 2015, 12(1): 22-25. DOI:10.3969/j.issn.1672-9455.2015.01.009 |
| [12] |
QIAN J F, ZHANG N, LIN J, et al. Distinct pattern of Th17/Treg cells in pregnant women with a history of unexplained recurrent spontaneous abortion[J]. Bioscience Trends, 2018, 12(2): 157-167. DOI:10.5582/bst.2018.01012 |
| [13] |
高艳霞, 郑玉霞. 复发性流产患者外周血FOXP3 mRNA、RORγt mRNA表达及临床诊断价值[J]. 中国计划生育学杂志, 2021, 29(1): 45-48, 211. GAO Y X, ZHENG Y X. Expression of FOXP3 mRNA and RORγt mRNA in peripheral blood of women with recurrent spontaneous abortion and their diagnostic value[J]. Chinese Journal of Family Planning, 2021, 29(1): 45-48, 211. |
| [14] |
张小玲, 王娟. 淋巴细胞主动免疫治疗对原因不明性复发性流产患者Treg及Th17细胞因子的影响[J]. 贵州医药, 2020, 44(10): 1548-1549. ZHANG X L, WANG J. Study on the effective of lymphocyte immunotherapy on Treg and Thl7 cytokines in unexplained recurrent spontaneous abortion patients[J]. Guizhou Medical Journal, 2020, 44(10): 1548-1549. DOI:10.3969/j.issn.1000-744X.2020.10.013 |
| [15] |
CARE A S, BOURQUE S L, MORTON J S, et al. Reduction in regulatory T cells in early pregnancy causes uterine artery dysfunction in mice[J]. Hypertension, 2018, 72(1): 177-187. DOI:10.1161/HYPERTENSIONAHA.118.10858 |
| [16] |
TILBURGS T, SCHERJON S A, VAN DER MAST B J, et al. Fetal-maternal HLA-C mismatch is associated with decidual T cell activation and induction of functional T regulatory cells[J]. Journal of Reproductive Immunology, 2009, 82(2): 148-157. DOI:10.1016/j.jri.2009.05.003 |
| [17] |
THUERE C, ZENCLUSSEN M L, SCHUMACHER A, et al. Kinetics of regulatory T cells during murine pregnancy[J]. American Journal of Reproductive Immunology, 2007, 58(6): 514-523. DOI:10.1111/j.1600-0897.2007.00538.x |
| [18] |
SALEK FARROKHI A, ZARNANI A H, REZAEI KAHMINI F, et al. Mesenchymal stem cells induce expansion of regulatory T cells in abortion-prone mice[J]. Reproduction, 2021, 161(4): 477-487. DOI:10.1530/REP-20-0320 |
| [19] |
冯婷婷, 郭俊成, 刘岳婷, 等. 不明原因复发性流产小鼠模型CD4+CD25+ Treg的比例及Foxp3表达的变化[J]. 免疫学杂志, 2012, 28(7): 595-599. FENG T T, GUO J C, LIU Y T, et al. Change of CD4+CD25+ Treg percentage and Foxp3 expression level in URSA mouse model[J]. Immunological Journal, 2012, 28(7): 595-599. DOI:10.3760/cma.j.issn.0254-5101.2012.07.006 |
| [20] |
INADA K, SHIMA T, ITO M, et al. Helios-positive functional regulatory T cells are decreased in decidua of miscarriage cases with normal fetal chromosomal content[J]. Journal of Reproductive Immunology, 2015, 107(2): 10-19. |
| [21] |
袁惠芝, 郑玉华, 冯敏清, 等. 复发性流产与调节性T细胞及IL-10的相关性分析[J]. 现代医学, 2019, 47(12): 1487-1490. YUAN H Z, ZHENG Y H, FENG M Q, et al. Correlation analysis of recurrent abortion with regulatory T cells and IL-10[J]. Modern Medical Journal, 2019, 47(12): 1487-1490. DOI:10.3969/j.issn.1671-7562.2019.12.010 |
| [22] |
袁惠芝, 郑玉华, 冯敏清, 等. 外周血CD4+CD25+Treg细胞和IL-10水平对复发性流产预测价值[J]. 青岛大学学报(医学版), 2019, 55(5): 581-585. YUAN H Z, ZHENG Y H, FENG M Q, et al. Value of peripheral blood CD4+CD25+treg cells and IL-10 level in predicting recurrent spontaneous abortion[J]. Journal of Qingdao University (Medical Sciences), 2019, 55(5): 581-585. |
| [23] |
THORNTON A M, KORTY P E, TRAN D Q, et al. Expression of Helios, an Ikaros transcription factor family member, differentiates thymic-derived from peripherally induced Foxp3+ T regulatory cells[J]. Journal of Immunology, 2010, 184(7): 3433-3441. DOI:10.4049/jimmunol.0904028 |
| [24] |
SAMSTEIN R M, JOSEFOWICZ S Z, ARVEY A, et al. Extrathymic generation of regulatory T cells in placental mammals mitigates maternal-fetal conflict[J]. Cell, 2012, 150(1): 29-38. DOI:10.1016/j.cell.2012.05.031 |
| [25] |
WANG J, YANG J, YAN Y Q, et al. Effect of adoptive transfer of CD4+ CD25+ Foxp3+ Treg induced by trichostatin A on the prevention of spontaneous abortion[J]. Journal of Reproductive Immunology, 2019, 131(10): 30-35. |
| [26] |
YUAN J, LI J, HUANG S Y, et al. Characterization of the subsets of human NKT-like cells and the expression of Th1/Th2 cytokines in patients with unexplained recurrent spontaneous abortion[J]. Journal of Reproductive Immunology, 2015, 110(7): 81-88. |
| [27] |
LIU J, DONG P, WANG S J, et al. Natural killer, natural killer T, helper and cytotoxic T cells in the decidua from recurrent spontaneous abortion with normal and abnormal chromosome karyotypes[J]. Biochemical and Biophysical Research Communications, 2019, 508(2): 354-360. DOI:10.1016/j.bbrc.2018.11.156 |
| [28] |
DUHEN T, GEIGER R, JARROSSAY D, et al. Production of interleukin 22 but not interleukin 17 by a subset of human skin-homing memory T cells[J]. Nature Immunology, 2009, 10(8): 857-863. DOI:10.1038/ni.1767 |
| [29] |
兰燕芳, 徐浩, 吴淋淋. Th22细胞及其相关细胞因子在原因不明性复发性流产发病机制中的作用[J]. 中国卫生检验杂志, 2017, 27(5): 667-669. LAN Y F, XU H, WU L L. Roles of Th22 cells and their related cytokines in the pathogenesis of unexplained recurrent spontaneous abortion[J]. Chinese Journal of Health Laboratory Technology, 2017, 27(5): 667-669. |
| [30] |
LOGIODICE F, LOMBARDELLI L, KULLOLLI O, et al. Decidual interleukin-22-producing CD4+ T cells (Th17/Th0/IL-22+ and Th17/Th2/IL-22+, Th2/IL-22+, Th0/IL-22+), which also produce IL-4, are involved in the success of pregnancy[J]. International Journal of Molecular Sciences, 2019, 20(2): 428. DOI:10.3390/ijms20020428 |
| [31] |
LUAN X R, KANG X M, LI W P, et al. An investigation of the relationship between recurrent spontaneous abortion and memory T follicular helper cells[J]. American Journal of Reproductive Immunology, 2017, 78(5): 12-14. |
| [32] |
石教启, 伍昌林, 朱亦, 等. Tfh/Treg/Breg细胞与习惯性流产患者免疫紊乱的关系[J]. 中国医药导报, 2016, 13(12): 113-116. SHI J Q, WU C L, ZHU Y, et al. Effect of the Tfh/Treg/Breg subsets on the immune disorder of patients with habitual abortion[J]. China Medical Herald, 2016, 13(12): 113-116. |
| [33] |
D'ADDIO F, RIELLA L V, MFARREJ B G, et al. The link between the PDL1 costimulatory pathway and Th17 in fetomaternal tolerance[J]. Journal of Immunology, 2011, 187(9): 4530-4541. DOI:10.4049/jimmunol.1002031 |
| [34] |
WINGER E E, REED J L, ASHOUSH S, et al. Elevated preconception CD56+16+ and/or Th1:Th2 levels predict benefit from IVIG therapy in subfertile women undergoing IVF[J]. American Journal of Reproductive Immunology, 2011, 66(5): 394-403. DOI:10.1111/j.1600-0897.2011.01018.x |
| [35] |
AHMADI M, ABDOLMOHAMMADI-VAHID S, GHAEBI M, et al. Regulatory T cells improve pregnancy rate in RIF patients after additional IVIG treatment[J]. Systems Biology in Reproductive Medicine, 2017, 63(6): 350-359. DOI:10.1080/19396368.2017.1390007 |
| [36] |
李欣儒, 郑晶. 不明原因复发性流产的治疗进展[J]. 世界最新医学信息文摘, 2018, 18(45): 41-42. LI X R, ZHENG J. Advances in treatment of unexplained recurrent spontaneous abortion[J]. World Latest Medicine Information, 2018, 18(45): 41-42. |
| [37] |
WANG S C, LI M D, SUN F R, et al. Th17/Treg-cell balance in the peripheral blood of pregnant females with a history of recurrent spontaneous abortion receiving progesterone or cyclosporine A[J]. Experimental and Therapeutic Medicine, 2021, 21(1): 37. |
| [38] |
COOMARASAMY A, WILLIAMS H, TRUCHANOWICZ E, et al. A randomized trial of progesterone in women with recurrent miscarriages[J]. The New England Journal of Medicine, 2015, 373(22): 2141-2148. DOI:10.1056/NEJMoa1504927 |
| [39] |
塔拉, 张琰, 王晓彩, 等. 地屈孕酮片联合绒毛膜促性素治疗原因不明复发性流产及对T淋巴细胞和炎症因子影响[J]. 中国计划生育学杂志, 2020, 28(1): 32-35. TA L, ZHANG Y, WANG X C, et al. Clinical efficacy of ditroxyprogesterone tablets combined with choriotropin for treating women with unexplained recurrent abortion and its influence on their T lymphocyte cell and inflammatory factor levels[J]. Chinese Journal of Family Planning, 2020, 28(1): 32-35. |
| [40] |
POLANCZYK M J, HOPKE C, HUAN J Y, et al. Enhanced FoxP3 expression and Treg cell function in pregnant and estrogen-treated mice[J]. Journal of Neuroimmunology, 2005, 170(1): 85-92. |
| [41] |
RAFIEE M, GHARAGOZLOO M, GHAHIRI A, et al. Altered Th17/treg ratio in recurrent miscarriage after treatment with paternal lymphocytes and vitamin D3:a double-blind placebo-controlled study[J]. Iranian Journal of Immunology: IJI, 2015, 12(4): 252-262. |
| [42] |
周兰, 徐彩, 黄海涛, 等. 自拟固胎煎对复发性流产小鼠外周血IL-6、IL-10、IL-17及TGF-β1的影响[J]. 中国性科学, 2021, 30(4): 134-137. ZHOU L, XU C, HUANG H T, et al. Effects of self-prepared Gutai Decoction on IL-6, IL-10, IL-17 and TGF-β1 in peripheral blood of mice with recurrent abortion[J]. Chinese Journal of Human Sexuality, 2021, 30(4): 134-137. |
| [43] |
郝晓丽, 王冬盈, 郜洁, 等. 寿胎丸减味方对肾虚自然流产模型小鼠IL-17的影响[J]. 世界中西医结合杂志, 2020, 15(2): 292-295. HAO X L, WANG D Y, GAO J, et al. Effect of modified Shoutai Pills on IL-17 in mice model of spontaneous abortion due to kidney deficiency[J]. World Journal of Integrated Traditional and Western Medicine, 2020, 15(2): 292-295. |
| [44] |
殷文正, 赖楠楠, 王东梅, 等. 补肾固冲方治疗原因不明复发性自然流产作用机制的研究[J]. 中国计划生育学杂志, 2014, 22(9): 617-621. YIN W Z, LAI N N, WANG D M, et al. The mechanism of Bushen Guchong Decoction on treatment of unexplained recurrent spontaneous abortion[J]. Chinese Journal of Family Planning, 2014, 22(9): 617-621. |
 2022, Vol. 41
2022, Vol. 41