文章信息
- 郑国斌, 马传瑞, 樊官伟
- ZHENG Guobin, MA Chuanrui, FAN Guanwei
- 葛根芩连汤治疗动脉粥样硬化的药理学基础研究进展
- Research progress on pharmacological basis of Gegen Qinlian Decoction in the treatment of atherosclerosis
- 天津中医药大学学报, 2022, 41(5): 668-674
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(5): 668-674
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.05.23
-
文章历史
收稿日期: 2022-05-30
2. 天津医科大学朱宪彝纪念医院, 天津市内分泌研究所, 天津 300134
2. Chu Hsien-I Memorial Hospital & Tianjin Institute of Endocrinologys, Tianjin Medical University, Tianjin 300134, China
动脉粥样硬化(AS)是血管内皮功能紊乱而引发的一系列慢性病变,包括血管的变性、渗出和钙化等,最终导致血管壁增厚和硬化,是包括心肌梗死、中风在内的多种心血管疾病的病理基础,在发达国家有着较高的病死率,在发展中国家发病率也逐年上升,严重危害人类健康[1-2]。AS的病因机制较为复杂,往往是多重因素共同作用的结果,这其中包括了血脂水平升高、血管内皮功能紊乱、局部血流动力学改变和细胞自噬等。此外,AS还和环境与遗传因素密切相关。目前,AS的发病机制虽然还不能被准确地揭示,但血脂水平升高、慢性炎症和内皮细胞功能紊乱是AS的病理学基础已被广大专家和学者接受。
1 AS的病理学基础 1.1 血脂水平升高血脂是临床上对于血清总胆固醇(TC)、三酰甘油(TG)和低密度脂蛋白(LDL)等的总称,血脂异常升高与高血压病、糖尿病和AS等疾病息息相关。其中,LDL中含有大量的不饱和脂肪酸,极易发生氧化修饰,LDL的氧化修饰是AS进程中的重要步骤,其氧化的产物氧化修饰型LDL(ox-LDL)能够促进细胞外基质在细胞外沉积[3],使血管壁增厚,而附着在血管内皮的细胞外基质会捕捉血清中的脂蛋白和炎症因子,损伤血管内皮。
同时LDL的氧化修饰还会产生丙二醛(MDA)等终末端产物,MDA是一种能够攻击细胞和组织的自由基,长期高表达会致使血管内皮细胞受损,导致细胞毒性和正常的生理功能紊乱[4],这也进一步促进了AS的进程。同时,过高的血脂在代谢过程中会产生大量的游离脂肪酸,而这些游离的脂肪酸将作为底物进入柠檬酸循环而增加活性氧(ROS)的含量,ROS是调节蛋白质活性和维持细胞氧化还原状态的重要信号分子,正常情况下,细胞的氧化还原处于一个平衡的稳态,而过量的ROS将会破坏这种平衡,诱发氧化应激,损伤内皮细胞。
此外,血清中的TC含量升高会增大血黏度,使血液和血管壁之间的阻力增大,影响局部血流动力学,在易发生湍流或振荡剪切应力的部位,如血管的分支、弯曲或分叉等部位[5],产生再循环和涡流[6],长此以往将引起血管壁受损,促进了AS的进展。
1.2 慢性炎症慢性炎症导致AS是一个相对较新的观点,直到20世纪80年代,才第一次被人们提及。Ross[7]最早提出AS是一种血管对损伤进行的过度防御反应,因其有变性、渗出和增生等特征,所以符合炎症反应的特点。近年来的研究也证实,炎症是AS的一个始动因素,贯穿于AS始终[8-9]。
在血管内膜中,LDL受到ROS的氧化修饰,从而促进ox-LDL进入巨噬细胞[10]。在临床上,ox-LDL是斑块炎症的标志[11]。天然LDL也可被巨噬细胞通过微胞饮的方式吸收,一旦超过吞噬细胞的代谢能力,LDL就会在细胞内聚集形成脂滴,富含胆固醇的巨噬细胞会转化成泡沫细胞,诱发细胞释放炎性因子[12]。此外,氧化磷脂通过与toll样受体(TLRs)结合触发动脉壁炎症,TLRs是一组广泛表达的模式识别受体,可引起促炎信号,释放促炎因子。促炎因子通过诱导内皮黏附、单核细胞损伤和内皮损伤等,参与了AS的发生和进展;同时,促炎因子也可促进细胞外基质的降解,增加了斑块的不稳定性,升高了AS的风险。
1.3 内皮细胞功能紊乱血管分为内膜、中膜和外膜,其中内膜主要由内皮细胞组成[13]。正常生理条件下,内皮细胞是一种细胞间紧密连接的半透性屏障,调节分子通过血管壁[14],维持血管张力,在维持血管内环境的稳态中起着关键作用。当局部血流动力学改变时,施加在内皮细胞上的机械外力会刺激内皮细胞发生构型和构象的改变,影响细胞与细胞、细胞与细胞外基质之间的生物结构,从而影响内皮细胞正常的生理功能,这可能是导致AS的开端[15]。当炎症因子刺激内皮细胞时,受损的内皮细胞会表达趋化因子和黏附分子,诱导单核细胞转化为巨噬细胞,继而吸收脂蛋白转化成泡沫细胞。同时,位于血管中膜的平滑肌细胞也会发生表型的转化,由收缩表型转化为分泌型[16],从血管中膜向血管内膜迁移,并分泌细胞外基质,使新生血管增多,导致弹性下降,主动脉壁僵硬,促进了AS的发生和发展。
此外,还有研究证实AS和细胞自噬[17-18]、免疫应答[19]等息息相关,其发病机制绝不仅仅是某一单方面的因素,往往是诸多因素或同时共生、或循序渐进相互作用的结果。从以上不难看出,虽然内皮细胞功能紊乱是AS的开端,但过高的血脂水平和慢性炎症刺激才是AS真正的诱因,所以降低血脂水平和抑制炎症能够在很大程度上阻碍AS的发生和进展。
2 葛根芩连汤的中药组成、有效成分和临床应用研究 2.1 葛根芩连汤的中药组成葛根芩连汤出自《伤寒论》,是医圣张仲景的传世名方之一。葛根芩连汤由4味药物组成,分别是葛根、黄芩、黄连、炙甘草,按照5∶3∶3∶2的比例组成,即葛根半斤、黄芩和黄连各3两,炙甘草2两。本方虽然用药并不复杂,却能清里解表,以清热固阴止利为主,兼以透表,临床上常用于治疗太阳表邪内陷所致热下利证。方中以葛根为君,葛根甘、辛、良,既能解表退热,又能升阳止利。以黄芩和黄连为臣,黄芩、黄连苦寒,清里热,厚胃肠,固阴止利。以炙甘草为使,炙甘草缓急和中,调和诸药。4味药合用,清里解表,表里共治,是中医的经典方剂之一。
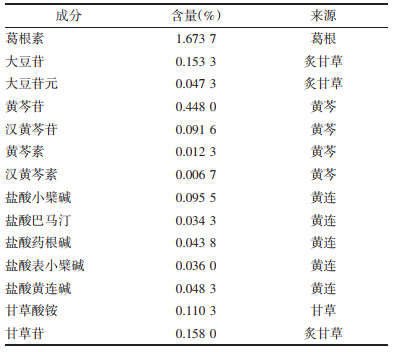
2.2 葛根芩连汤的有效成分研究得益于科学技术的发展,中药成分鉴定和含量测定取得了巨大进步,人们对中药方剂中各药用组分的研究也更加透彻。葛根芩连汤作为中医的一个经典名方,自然也不例外。目前方剂中已有67种成分被鉴定出来[20],14种药用成分的含量被准确测定[21],见表 1、表 2。
葛根芩连汤的药理成分以黄酮类、生物碱类及皂苷类成分为主。现代药理学研究表明,黄酮为一种很强的抗氧剂,可有效清除体内的氧自由基,阻止细胞退化、衰老。此外,黄酮可改善血液循环,降低胆固醇水平[22]。也有证据表明黄酮还含有凝血酶原激活因子,具有抗凝、抗血栓的功效,显著降低了心脑血管疾病的病死率[23]。
生物碱类化合物中以小檗碱最为多见,小檗碱亦称黄连素,是从中药黄连中分离的一种季铵型生物碱,是黄连抗菌的主要有效成分。研究表明,小檗碱对实验动物的脂代谢有显著改善作用,能有效降低游离脂肪酸、TC、TG、LDL等水平。此外,小檗碱还具有抗炎作用,针对于糖尿病、AS等一些与炎症密切相关的慢性疾病的预防与治疗都有不错的效果[24]。
皂苷类成分如黄芩苷、大豆苷、甘草苷等均具有降低血浆内皮素的效果,与此同时还可以帮助增强心肌收缩力,阻止血小板聚集,降低血黏度,在降低TC及抗AS方面有很好的效果。
葛根芩连汤本用于治疗太阳病误下后协热下利之证。尤在泾指出此为“邪陷于里者十之七,而留于表者十之三”,表里受病,法当表里两解[25]。研究证实其能解热、抗菌、抗病毒、降低血糖,此外还有增强机体免疫功能的作用。临床上用于治疗流行性感冒[26]、轮状病毒引起的腹泻[27]、2型糖尿病[28]、小儿慢性牙周炎[29]。此外多项研究显示,葛根芩连汤联合西药在多种慢性疾病的治疗中可以获得更优的治疗效果,如联合阿托伐他汀钙治疗老年冠状动脉粥样硬化性心脏病合并高脂血症[30]、联合半夏厚朴汤治疗慢性咽炎[31]、联合N-乙酰半胱氨酸治疗肺纤维化[32]等方面都有不错效果。
3 葛根芩连汤治疗AS的药理学基础 3.1 降低血脂葛根芩连汤已在众多的临床研究中被证实能够降低血糖和糖化血红蛋白[33-36],相比传统的降糖药物,患者的不良反应发生率更低,安全性更好。在降低血糖的同时,葛根芩连汤也能非常有效地降低患者的TC、TG和LDL水平[37],同样的结果在众多的动物实验中也得到了证实。王丹等[38]在动脉粥样硬化伴牙周炎大鼠模型中发现葛根芩连汤组治疗4周后,牙周组织炎性细胞浸润比模型组减少。与此同时,葛根芩连汤组大鼠的TC、TG、LDL水平低于阿托伐他汀钙组,而高密度脂蛋白(HDL)水平要高于阿托伐他汀钙组,其抗炎作用与甲硝唑联合阿托伐他汀钙组效果相当。李津等[39]通过大鼠实验发现,葛根芩连汤不仅能够降低糖尿病模型大鼠的空腹血糖、TC、TG、LDL,而且还能升高HDL,此外还能升高血清中超氧化物歧化酶(SOD)含量,降低MDA含量。SOD是细胞内自由基的清道夫,可以清除MDA等体内自由基,使细胞和组织免受自由基的破坏,减轻细胞的氧化应激水平,从而起到保护细胞的作用。
3.2 抑制炎症因子释放白介素(IL)家族是重要的炎症标志物,包括IL-1β、IL-6和IL-18等,其中IL-6可通过诱导血小板源性生长因子表达,加速血管平滑肌增殖,从而促进AS进展[40]。在1项最近葛根芩连汤治疗溃疡性结肠炎的临床研究中发现,相比对照组,葛根芩连汤能大大增加治疗组的有效率,降低患者血清中IL-1β、IL-6、肿瘤坏死因子-α(TNF-α)水平,同时还能增加患者外周血CD3+、CD4+、CD4+/CD8+和自然杀伤(NK)细胞水平,提高患者的免疫应答[41]。TNF-α也是重要的炎症标志物,主要由巨噬细胞和单核细胞分泌,TNF-α不仅能够直接损伤血管内皮细胞,引起内皮细胞的炎症反应,同时TNF-α还存在于AS的斑块中,可诱导斑块中巨噬细胞表达,降低斑块的稳定性[42],大大增加了AS的风险。李文娟等[43]发现葛根芩连汤能显著降低血清TNF-α水平,从而减轻细胞毒作用诱导的细胞坏死、血管内膜增厚和内皮功能紊乱,从根本上抑制AS的发生。
脂联素是一种由脂肪细胞特异性分泌的、具有生物活性的类似胶原结构的蛋白,在泡沫细胞以及受损血管内膜下表达,可抑制TNF-α的表达,下调TNF-α诱导的IL-8、细胞间黏附分子-1、血管内皮细胞黏附分子-1等的表达,减轻细胞炎症。同时,脂联素还能降低巨噬细胞中TC水平,抑制巨噬细胞向泡沫细胞转化,进而抑制平滑肌细胞的迁移和增殖,改善内皮功能[44]。罗新新等[45]发现,葛根芩连汤可显著升高糖尿病大鼠血清中的过氧化物酶体增殖物激活受体γ(PPARγ)和脂联素水平,从而抑制炎症因子释放,在血管平滑肌细胞中发挥抗炎和抗增殖作用,抑制AS的形成和发展。Luo等[46]在AS伴牙周炎模型中测定了血清超敏C反应蛋白(hs-CRP)含量,结果表明葛根芩连汤组炎症因子水平明显低于阿托伐他汀钙组,且与甲硝唑联合阿托伐他汀钙组效果相当。
3.3 调节肠道菌群近年来,随着对肠道菌群的深入研究,发现肠道菌群是人体另一个庞大的代谢组织。因其数量众多、种类复杂,被誉为人类“第二基因组”,其相互依存、互利共生,维持着机体内环境的稳态[47]。肠道菌群失调不仅影响食物代谢,也影响短链脂肪酸的代谢。Ma等[48]认为肠道菌群失调是导致高血压病和AS的一个重要成因。冯新格等[49]探讨葛根芩连汤对2型糖尿病湿热证患者肠道菌群的影响,发现葛根芩连汤干预组的空腹血糖、餐后2 h血糖和糖化血红蛋白水平明显优于二甲双胍组,且可有效提高肠道梭菌属和双歧杆菌的菌群数量。Chen等[50]也在大鼠实验中证实,与模型组相比,葛根芩连汤能显著增加大鼠阿克曼氏菌数量,减少肠道炎性疾病相关的梭状芽胞杆菌数量。Xu等[51]的研究也证实葛根芩连汤可参与调节肠道菌群,减轻肠道的慢性炎症状态。
3.4 作用于肾素-血管紧张素系统(RAS)RAS是人体重要的体液调节系统,在正常情况下,它能够促进心血管系统的正常发育,维持心血管功能的稳态,维持体内电解质和体液平衡,是人体血压调节的重要系统。研究表明,RAS与高血压病、心肌肥厚和AS等多种心血管疾病都有着密切的关系[52]。高宁等[53]利用生物信息学的方法探讨葛根芩连汤在治疗心血管系统疾病中的分子机制,发现有3条相关性较为显著的通路,分别是内皮素-1信号、肾素-血管紧张素信号和P2Y嘌呤受体信号途径。已有研究证实[54],在载脂蛋白E基因敲除(ApoE-/-)小鼠中,血管紧张素通过增加一氧化氮(NO)的生物利用度,改善了血管的损伤,从而对AS起到预防作用。
4 展望AS的发生及流行不仅与人口老龄化密切相关,同时与其他疾病及现代生活方式有关,如高脂血症、高血压病、糖尿病、肥胖、运动缺乏、不健康饮食等。近年来,随着中国人口老龄化加剧和生活水平上升,心血管事件的发生风险异常严峻,针对于改善AS的药物研究及开发具有较强的必要性和紧迫性。
AS发病机制复杂,病程进展漫长,随着病程的发展会引发一系列的心血管疾病,严重威胁患者的健康。目前临床上主要以西药治疗为主,大多数都只能改善症状,很难标本兼治,且不良反应较为明显。葛根芩连汤是中医传统的经典古方,外能解表,内能清里,具有清热解毒、抗菌消炎之功,在治疗高血压病、高脂血症和糖尿病等方面都具有显著的疗效,对肠道菌群也有很好的调节作用,能延缓慢性炎症的发生,从而抑制了AS的进程。虽然葛根芩连汤治疗AS符合其药理作用和药理学基础,但在实际的临床工作中,其被用于治疗AS的数据却并不多见,希望越来越多的专家和学者能够积极研究葛根芩连汤和AS之间的关系,阐明其中的机制,为AS的预防和诊疗提供理论依据,这有助于深化中医药基础研究和揭示中药的科学内涵,起到推动中医药现代化、国际化的作用,能够促进中医药产业的发展,同时也能造福更多的AS患者。
| [1] |
LIU A M, WU Q H, GUO J C, et al. Statins: adverse reactions, oxidative stress and metabolic interactions[J]. Pharmacology & Therapeutics, 2019, 195(3): 54-84. |
| [2] |
HANSSON G K. Inflammation, atherosclerosis, and coronary artery disease[J]. The New England Journal of Medicine, 2005, 352(16): 1685-1695. DOI:10.1056/NEJMra043430 |
| [3] |
MERRILEES M J, BEAUMONT B W, BRAUN K R, et al. Neointima formed by arterial smooth muscle cells expressing versican variant V3 is resistant to lipid and macrophage accumulation[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2011, 31(6): 1309-1316. DOI:10.1161/ATVBAHA.111.225573 |
| [4] |
KAPLAN M, SHUR A, TENDLER Y. M1 macrophages but not M2 macrophages are characterized by upregulation of CRP expression via activation of NF-κB: a possible role for ox-LDL in macrophage polarization[J]. Inflammation, 2018, 41(4): 1477-1487. DOI:10.1007/s10753-018-0793-8 |
| [5] |
MORBIDUCCI U, KOK A M, KWAK B R, et al. Atherosclerosis at arterial bifurcations: evidence for the role of haemodynamics and geometry[J]. Thrombosis and Haemostasis, 2016, 115(3): 484-492. DOI:10.1160/th15-07-0597 |
| [6] |
MARCHIO P, GUERRA-OJEDA S, VILA J M, et al. Targeting early atherosclerosis: a focus on oxidative stress and inflammation[J]. Oxidative Medicine and Cellular Longevity, 2019, 2019: 8563845. |
| [7] |
ROSS R. The pathogenesis of atherosclerosis: an update[J]. New England Journal of Medicine, 1986, 314(8): 488-500. DOI:10.1056/NEJM198602203140806 |
| [8] |
LI B, LI W H, LI X L, et al. Inflammation: a novel therapeutic target/direction in atherosclerosis[J]. Current Pharmaceutical Design, 2017, 23(8): 1216-1227. DOI:10.2174/1381612822666161230142931 |
| [9] |
WOLF D, LEY K. Immunity and inflammation in atherosclerosis[J]. Circulation Research, 2019, 124(2): 315-327. DOI:10.1161/CIRCRESAHA.118.313591 |
| [10] |
LEY K, MILLER Y I, HEDRICK C C. Monocyte and macrophage dynamics during atherogenesis[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2011, 31(7): 1506-1516. DOI:10.1161/ATVBAHA.110.221127 |
| [11] |
CHEN L, ISHIGAMI T, DOI H, et al. Gut microbiota and atherosclerosis: role of B cell for atherosclerosis focusing on the gut-immune-B2 cell axis[J]. Journal of Molecular Medicine(Berlin, Germany), 2020, 98(9): 1235-1244. DOI:10.1007/s00109-020-01936-5 |
| [12] |
刘俊田. 动脉粥样硬化发病的炎症机制的研究进展[J]. 西安交通大学学报(医学版), 2015, 36(2): 141-152. LIU J T. Progress in inflammatory pathogenesis of atherosclerosis[J]. Journal of Xi'an Jiaotong University (Medical Sciences), 2015, 36(2): 141-152. |
| [13] |
EBLE J A, NILAND S. The extracellular matrix of blood vessels[J]. Current Pharmaceutical Design, 2009, 15(12): 1385-1400. DOI:10.2174/138161209787846757 |
| [14] |
GALLEY H F, WEBSTER N R. Physiology of the endothelium[J]. British Journal of Anaesthesia, 2004, 93(1): 105-113. DOI:10.1093/bja/aeh163 |
| [15] |
CHIU J J, USAMI S, SHU C E. Vascular endothelial responses to altered shear stress: pathologic implications for atherosclerosis[J]. Annals of Medicine, 2009, 41(1): 19-28. DOI:10.1080/07853890802186921 |
| [16] |
FRISMANTIENE A, PHILIPPOVA M, ERNE P, et al. Smooth muscle cell-driven vascular diseases and molecular mechanisms of VSMC plasticity[J]. Cellular Signalling, 2018, 52(3): 48-64. |
| [17] |
LI Y, SUN D K, ZHENG Y Y, et al. Swimming exercise activates aortic autophagy and limits atherosclerosis in ApoE-/-mice[J]. Obesity Research & Clinical Practice, 2020, 14(3): 264-270. |
| [18] |
MARTINET W, COORNAERT I, PUYLAERT P, et al. Macrophage death as a pharmacological target in atherosclerosis[J]. Frontiers in Pharmacology, 2019, 10(2): 306. |
| [19] |
CHYU K Y, DIMAYUGA P C, SHAH P K. Immunogenetics of atherosclerosis-link between lipids, immunity, and genes[J]. Current Atherosclerosis Reports, 2020, 22(10): 53. DOI:10.1007/s11883-020-00874-4 |
| [20] |
王婷婷, 安叡, 梁琨, 等. 基于UPLC-LTQ-Orbitrap高分辨质谱的葛根芩连汤的化学成分分析[J]. 中草药, 2020, 51(6): 1498-1507. WANG T T, AN R, LIANG K, et al. Chemical constituent analysis of Gegen Qinlian Decoction based on UPLC-LTQ-Orbitrap-MS[J]. Chinese Traditional and Herbal Drugs, 2020, 51(6): 1498-1507. |
| [21] |
毛莹, 张贵君, 刘晶晶, 等. 葛根芩连汤中14种药效组分的HPLC分析[J]. 中国实验方剂学杂志, 2013, 19(2): 108-113. MAO Y, ZHANG G J, LIU J J, et al. Analysis of 14 active compositions alignment in Gengen Qinlian Decoction by HPLC[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2013, 19(2): 108-113. |
| [22] |
耿秀超, 张雨豪, 景佳星, 等. 中药有效成分对血脂异常作用机制的研究进展[J]. 中国实验方剂学杂志, 2020, 26(20): 213-220. GENG X C, ZHANG Y H, JING J X, et al. Advances in mechanism of traditional Chinese medicines and its active ingredients treating dyslipidemia[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2020, 26(20): 213-220. DOI:10.13422/j.cnki.syfjx.20202037 |
| [23] |
叶勇, 欧贤红, 黄秋洁, 等. 藤茶总黄酮及黄酮醇类化合物的抗血栓作用研究[J]. 中药新药与临床药理, 2013, 24(1): 33-36. YE Y, OU X H, HUANG Q J, et al. Antithrombotic effect of total flavonoids and monomeric compounds from Ampelopsis grossedentala[J]. Traditional Chinese Drug Research and Clinical Pharmacology, 2013, 24(1): 33-36. DOI:10.3969/j.issn.1003-9783.2013.01.009 |
| [24] |
FATAHIAN A, HAFTCHESHMEH S M, AZHDARI S, et al. Promising anti-atherosclerotic effect of berberine: evidence from in vitro, in vivo, and clinical studies[J]. Reviews of Physiology, Biochemistry and Pharmacology, 2020, 178(13): 83-110. |
| [25] |
陈丽红, 唐于平, 王强. 葛根芩连汤的现代研究进展[J]. 中草药, 2010, 41(4): 676-680. CHEN L H, TANG Y P, WANG Q. Advances in studies on Gegen Qinlian Decoction[J]. Chinese Traditional and Herbal Drugs, 2010, 41(4): 676-680. |
| [26] |
肖奕珂, 邓力, 陈孝银. 浅析葛根芩连汤治流感的可行性[J]. 吉林中医药, 2019, 39(8): 987-989. XIAO Y K, DENG L, CHEN X Y. Feasibility of Gegen Qinlian Decoction in the treatment of influenza[J]. Jilin Journal of Chinese Medicine, 2019, 39(8): 987-989. |
| [27] |
冯益静, 夏陈伟, 郑永红. 葛根芩连汤治疗轮状病毒肠炎疗效观察[J]. 世界最新医学信息文摘, 2019, 19(86): 117. FENG Y J, XIA C W, ZHENG Y H. Observation on curative effect of Gegen Qinlian Decoction on rotavirus enteritis[J]. World Latest Medicine Information, 2019, 19(86): 117. |
| [28] |
万素云. 葛根芩连汤联合金匮肾气丸对2型糖尿病患者血糖及体型的影响[J]. 河南医学研究, 2020, 29(11): 2055-2056. WAN S Y. Effect of Gegen Qinlian Decoction combined with Jingui Shenqi Pill on blood glucose and body type in patients with type 2 diabetes[J]. Henan Medical Research, 2020, 29(11): 2055-2056. DOI:10.3969/j.issn.1004-437X.2020.11.062 |
| [29] |
丁盛, 厉彬曙, 徐文雄. 葛根芩连汤加减辅助治疗小儿慢性牙周炎的疗效及对龈沟液炎症反应的影响[J]. 中医儿科杂志, 2020, 16(2): 58-61. DING S, LI B S, XU W X. Effect of modified Gegen Qinlian Decoction on chronic periodontitis in children and its effect on inflammatory reaction of gingival crevicular fluid[J]. Journal of Pediatrics of Traditional Chinese Medicine, 2020, 16(2): 58-61. |
| [30] |
费香勇, 刘贵. 葛根芩连汤联合阿托伐他汀对老年冠心病合并高脂血症病人血脂水平的影响[J]. 中西医结合心脑血管病杂志, 2020, 18(2): 212-215. FEI X Y, LIU G. Influences of Gegen Qinlian Decoction combined with atorvastatin on blood lipid level in elderly patients with coronary heart disease and hyperlipidemia[J]. Chinese Journal of Integrative Medicine on Cardio-Cerebrovascular Disease, 2020, 18(2): 212-215. |
| [31] |
王剑. 加减半夏厚朴汤联合葛根芩连汤治疗慢性咽喉炎的疗效观察[J]. 医学信息, 2018, 31(4): 139-140. WANG J. Observation on curative effect of Banxia Houpu Decoction combined with Gegen Qinlian Decoction in treating chronic pharyngitis[J]. Medical Information, 2018, 31(4): 139-140. |
| [32] |
张韬, 雷雪飞, 黄慧敏. 复方葛根芩连汤联合N-乙酰半胱氨酸胶囊治疗肺纤维化患者的临床效果[J]. 世界中医药, 2019, 14(2): 459-461, 465. ZHANG T, LEI X F, HUANG H M. Effects evaluation of compound Gegen Qinlian Decoction combined with N-acetylcysteine capsules in the treatment of pulmonary fibrosis[J]. World Chinese Medicine, 2019, 14(2): 459-461, 465. |
| [33] |
REN L, CHENG Y X, QIN F. Herbal formula Gegen-Qinlian Decoction for type 2 diabetes mellitus: a meta-analysis of randomized controlled trials[J]. Evidence-Based Complementary and Alternative Medicine, 2020, 20(20): 390-397. |
| [34] |
田艳. 葛根芩连汤治疗糖尿病患者的临床疗效及血糖水平分析[J]. 中医临床研究, 2020, 12(36): 68-69, 100. TIAN Y. Analysis of the clinical efficacy of Gegen Qinlian Decoction in treating patients with diabetes and its effect on blood glucose level[J]. Clinical Journal of Chinese Medicine, 2020, 12(36): 68-69, 100. |
| [35] |
李红, 田洁, 王艳, 等. 葛根芩连汤配方颗粒联合基础治疗对2型糖尿病气阴两虚证患者糖代谢指标和胰岛功能的影响[J]. 中医临床研究, 2019, 11(13): 1-5. LI H, TIAN J, WANG Y, et al. Efficacy of the Gegen Qinlian Granule plus basic therapy on glucose metabolism and islet function in patients with type 2 diabetes mellitus with the Qiyin Liangxu syndrome[J]. Clinical Journal of Chinese Medicine, 2019, 11(13): 1-5. |
| [36] |
罗小燕. 分析葛根芩连汤与沙格列汀共同治疗2型糖尿病的效果[J]. 糖尿病新世界, 2019, 22(23): 55-56. LUO X Y. To analyze the effect of Gegen Qinlian Decoction and Saxagliptin on type 2 diabetes[J]. Diabetes New World, 2019, 22(23): 55-56. |
| [37] |
周笑漪. 葛根芩连汤联合利拉鲁肽对肥胖2型糖尿病湿热困脾证的临床疗效[J]. 天津中医药, 2020, 37(12): 1363-1367. ZHOU X Y. Efficacy of Gegen Qinlian Decoction combined with liraglutide in the treatment of obese type 2 diabetes(T2DM) of dampness accumulation in spleen syndrome[J]. Tianjin Journal of Traditional Chinese Medicine, 2020, 37(12): 1363-1367. |
| [38] |
王丹, 李文娟, 赵兵, 等. 葛根芩连汤对动脉粥样硬化伴随牙周炎大鼠的影响[J]. 中国实验方剂学杂志, 2015, 21(6): 145-149. WANG D, LI W J, ZHAO B, et al. Effect of Gegen Qinlian Tang in periodontitis combined atherosclerosis rat model[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2015, 21(6): 145-149. |
| [39] |
李津, 高铁祥, 宋强, 等. 葛根芩连汤对2型糖尿病大鼠降糖降脂作用机理初探[J]. 湖北中医药大学学报, 2015, 17(3): 7-9. LI J, GAO T X, SONG Q, et al. Study on mechanism of effect of Gegen Qinlian Decoction on lowering blood sugar and lipid of type 2 diabetic rats[J]. Journal of Hubei University of Chinese Medicine, 2015, 17(3): 7-9. |
| [40] |
LEINONEN E, HURT-CAMEJO E, WIKLUND O, et al. Insulin resistance and adiposity correlate with acute-phase reaction and soluble cell adhesion molecules in type 2 diabetes[J]. Atherosclerosis, 2003, 166(2): 387-394. |
| [41] |
曾微微, 麦联任, 张玲. 葛根芩连汤联合固肠止泻丸治疗溃疡性结肠炎的疗效及对血清IL-1β、IL-6、TNF-α水平影响[J]. 中华中医药学刊, 2021, 39(9): 212-215. ZENG W W, MAI L R, ZHANG L. Effect of Gegenqinlian decoction combined with Guchang Zhixie Pill on ulcerative colitis and its effect on serum IL-1β, IL-6 and TNF-α levels[J]. Chinese Archives of Traditional Chinese Medicine, 2021, 39(9): 212-215. |
| [42] |
ALLEN R A, LEE E M, ROBERTS D H, et al. Polymorphisms in the TNF-alpha and TNF-receptor genes in patients with coronary artery disease[J]. European Journal of Clinical Investigation, 2001, 31(10): 843-851. |
| [43] |
李文娟, 彭伟, 王丹. 葛根芩连汤对慢性牙周炎合并动脉粥样硬化大鼠血清TNF-α水平的影响[J]. 实用口腔医学杂志, 2015, 31(1): 23-26. LI W J, PEI W, WANG D. Effect of Gegen Qinlian Decoction on the serum TNF-α levels in rats with chronic periodontitis combined with atherosclerosis[J]. The Journal of Practical Stomatology, 2015, 31(1): 23-26. |
| [44] |
WU W D, WANG H Y, JIAO G F, et al. Aerobic exercise suppresses atherosclerosis through adiponectin-nuclear transcription factor κB pathway in apolipoprotein E-deficient mice[J]. The American Journal of the Medical Sciences, 2017, 353(3): 275-281. |
| [45] |
罗新新, 朱水兰, 李冰涛, 等. 葛根芩连汤激活PPARγ上调脂联素和GLUT4表达改善脂肪胰岛素抵抗[J]. 中国中药杂志, 2017, 42(23): 4641-4648. LUO X X, ZHU S L, LI B T, et al. Gegen Qinlian Decoction activates PPARγ to ameliorate adipocytic insulin resistance in diabetic SD rats and IR-3T3-L1 adipocytes[J]. China Journal of Chinese Materia Medica, 2017, 42(23): 4641-4648. |
| [46] |
LUO X, FENG X J, WANG D, et al. Effect of Gegenqinlian decoction on serum hypersensitive C-reactive protein expression in rats with periodontitis complicated with atherosclerosis[J]. Journal of Practical Stomatology, 2015, 31(2): 180-183. |
| [47] |
ROTHSCHILD D, WEISSBROD O, BARKAN E, et al. Environment dominates over host genetics in shaping human gut microbiota[J]. Nature, 2018, 555(76): 210-215. |
| [48] |
MA J L, LI H K. The role of gut microbiota in atherosclerosis and hypertension[J]. Frontiers in Pharmacology, 2018, 9(13): 1082. |
| [49] |
冯新格, 严育忠, 曾艺鹏, 等. 葛根芩连汤对2型糖尿病湿热证肠道菌群的影响[J]. 世界中西医结合杂志, 2016, 11(8): 1110-1112. FENG X G, YAN Y Z, ZENG Y P, et al. The effect of Gegen Qinlian Decoction on intestinal flora in damp-heat syndrome of type 2 diabetes[J]. World Journal of Integrated Traditional and Western Medicine, 2016, 11(8): 1110-1112. |
| [50] |
陈阳, 陆杰, 朱思敏, 等. 基于高通量测序技术研究葛根芩连汤及其配伍对急性肠炎大鼠肠道菌群多样性的影响[J]. 中国中药杂志, 2020, 45(6): 1406-1417. CHEN Y, LU J, ZHU S M, et al. Effect of Gegen Qinlian Decoction and it's different compatibility groups on gut microbiota in rats with acute enteritis based on high-throughput sequencing[J]. China Journal of Chinese Materia Medica, 2020, 45(6): 1406-1417. |
| [51] |
XU J, LIAN F M, ZHAO L H, et al. Structural modulation of gut microbiota during alleviation of type 2 diabetes with a Chinese herbal formula[J]. The ISME Journal, 2015, 9(3): 552-562. |
| [52] |
林善锬. 值得关注的几个肾素血管紧张素系统新进展[J]. 中华高血压杂志, 2017, 25(3): 213-215. LIN S X. Several new developments of renin angiotensin system worth attention[J]. Chinese Journal of Hypertension, 2017, 25(3): 213-215. |
| [53] |
高宁, 任朋英, 姜丽丽, 等. 生物信息学法分析葛根芩连汤治疗心血管系统疾病的分子机理[J]. 华西药学杂志, 2019, 34(2): 187-191. GAO N, REN P Y, JIANG L L, et al. Molecular mechanism of Gegen Qinlian Decoction in treatment of cardiovascular diseases by Bioinformatic analysis method[J]. West China Journal of Pharmaceutical Sciences, 2019, 34(2): 187-191. |
| [54] |
YANG G, ISTAS G, HÖGES S, et al. Angiotensin-(1-7)-induced Mas receptor activation attenuates atherosclerosis through a nitric oxide-dependent mechanism in apolipoproteinE-KO mice[J]. Pflugers Archiv-European Journal of Physiology, 2018, 470(4): 661-667. |
 2022, Vol. 41
2022, Vol. 41