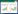文章信息
- 苏瑞, 卢佳, 席智男, 王佳宝, 宋新波, 张晗, 苗琳
- SU Rui, LU Jia, XI Zhinan, WANG Jiabao, SONG Xinbo, ZHANG Han, MIAO Lin
- 清感冬饮通过调控NF-κB/iNOS/NO信号通路抑制LPS诱导的RAW264.7巨噬细胞炎症
- Qinggan Dongyin inhibits LPS-induced inflammation of RAW264.7 macrophages by regulating NF-κB/iNOS/NO signaling pathway
- 天津中医药大学学报, 2022, 41(6): 737-745
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(6): 737-745
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.06.13
-
文章历史
收稿日期: 2022-08-20
2. 天津中医药大学方剂学教育部重点实验室, 天津 301617;
3. 天津中医药大学组分中药国家重点实验室, 天津 301617;
4. 天津中医药大学, 天津 301617;
5. 天津现代创新中药科技有限公司, 天津 300392
2. Key Laboratory of Pharmacology of Traditional Chinese Medical Formulae, Ministry of Education, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
3. State Key Laboratory of Component-based Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
4. Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
5. Tianjin Modern Innovation Traditional Chinese Medicine Technology Co. Ltd., Tianjin 300392, China
清感冬饮是张伯礼院士根据多年临证经验拟定的复方制剂,方中黄芪和虎杖为君药,炒牛蒡子、金银花、紫苏叶、射干和桔梗为臣药,赤芍和山楂为佐药,甘草为使药,红茶为基质,共奏益气固表、清热解毒、清咽利喉、宣肺止咳的功效。清感冬饮主治外感风寒,阳气不足证,临床上用于冬季发作的急慢性咽喉炎、急慢性鼻炎和急慢性支气管炎等呼吸道疾病。
炎症是机体的先天免疫系统针对内源性或外源性刺激产生的一种自我防御反应[1]。多种呼吸道疾病的病理进程中伴随有炎症的产生[2],抑制炎症的恶性发展对于治疗疾病尤为重要。课题组前期研究表明清感冬饮可降低急性咽炎大鼠血清中炎症因子肿瘤坏死因子-α(TNF-α)的含量,但其抗炎机制尚不明确。巨噬细胞作为免疫系统的第一道防线,在炎症的发生、发展和消退中表现丰富的生物学功能[3]。故本研究采用研究炎症性疾病最常用的体外炎症模型,即脂多糖(LPS)诱导的RAW264.7巨噬细胞炎症模型,探究清感冬饮对细胞炎症的影响及其潜在的分子机制[4]。
1 材料 1.1 细胞HEK293T细胞由南开大学药学院白钢教授和姜民老师所在实验室提供;小鼠RAW264.7巨噬细胞株购自中国科学院上海生命科学研究院细胞资源中心。
1.2 药品清感冬饮,功效:益气固表、清热解毒、清咽利喉、宣肺止咳。由天津中医药大学现代中药创新中心提供,批号:KG20200219-3。
1.3 仪器TECAN酶标仪(北京海天友诚科技有限公司);Thermo CO2细胞培养箱、Thermo Fisher高速冷冻离心机(美国Thermo Fisher Scientific公司);Multilabel Plate Reader功能读板仪(美国Perkins Elmer公司);Nikon倒置显微镜(日本Nikon公司);NanoPhotometer N60 Touch超微量分光光度计(德国IMPLEN公司);T100梯度PCR仪(美国BioRAD公司);实时荧光定量PCR仪(瑞士Roche公司);智能活细胞成像分析仪(美国BioTek公司);全能型成像系统(美国BioRAD公司)。
1.4 试剂DMEM高糖型培养基、胎牛血清(FBS)、磷酸盐缓冲液(PBS)、青霉素-链霉素(以色列Biological Industries生物科技公司);萤火虫荧光素酶报告基因载体(pGL4.37、pGL4.32、pGL4.75)、Dual-Luciferase®检测系统(美国Promega公司);脂多糖(美国Sigma公司);CCK-8和LDH检测试剂盒(日本同仁化学研究所);一氧化氮(NO)检测试剂盒、Hoechst 33258染色液、细胞核蛋白与细胞浆蛋白抽提试剂盒和抗荧光淬灭剂(上海碧云天生物技术有限公司);ELISA试剂盒[TNF-α、白细胞介素-6(IL-6)和白细胞介素-1β(IL-1β)]、胰蛋白酶和TRIzol试剂(美国Invitrogen生命技术有限公司);叔丁基对苯二酚(tBHQ)和地塞米松(Dex,美国MedChemExpress公司);TNF-α(美国PeproTech公司);聚乙烯亚胺(PEI,美国Polysciences公司);High Capacity cDNA Reverse Transcription试剂盒和一氧化氮合酶(iNOS)抗体(美国Thermo Fisher Scientific公司);FastStart Universal SYBR Green Master(Rox,瑞士Roche公司);三磷酸甘油醛脱氢酶(GAPDH)抗体(美国Affinity公司);核因子-κB p65(p65)抗体(美国CST公司);核纤层蛋白B1(LaminB1)抗体(美国Abcam公司)。
2 方法 2.1 HEK293T细胞培养HEK293T细胞使用DMEM高糖型培养基(含体积分数为1%青霉素-链霉素和体积分数为10% FBS)于37 ℃、5% CO2培养箱培养,待细胞生长至对数生长期以0.25%胰酶进行消化传代并开展实验。
2.2 RAW264.7巨噬细胞培养RAW264.7巨噬细胞用含体积分数10% FBS的DMEM高糖型培养基,置于37 ℃、5% CO2培养箱培养,待细胞生长至对数生长期进行传代与实验。
2.3 清感冬饮的准备将黄芪(3 g)、虎杖(3 g)、牛蒡子(3 g)、射干(2 g)、桔梗(2 g)、赤芍(2 g)、紫苏叶(2 g)、金银花(3 g)、山楂(1枚)和甘草(1 g)混合,加入10倍量蒸馏水,浸泡40 min,煮沸,过滤,重复上述步骤,合并两次所得滤液,于60 ℃以下浓缩,使其糖度为15~17 Brix,喷雾干燥,于干燥罐中储存备用。
精密称取清感冬饮50 mg溶于1 mL灭菌超纯水中,超声处理30 min后,过0.22 μm无菌滤膜,得50 mg/mL清感冬饮溶液,用DMEM培养基将其稀释为100、10、1、0.1、0.01 μg/mL目标溶液。
2.4 细胞活力检测分别取对数生长期的HEK293T细胞和RAW264.7巨噬细胞,以2×105个/mL密度接种于96孔板,置于细胞培养箱中培养24 h。弃去96孔板内原有培养基,给药组加入0.01、0.1、1、10、100 μg/mL的清感冬饮,对照组加入DMEM高糖型培养基,100 μL/孔。培养一定时间后,吸取上清液置于新的96孔板中,按LDH试剂盒说明书操作,孵育15 min后于490 nm处测定吸光度。原96孔板按CCK-8试剂盒说明书操作,孵育一定时间后于450 nm处检测吸光度。两种方法均以空白对照组为基准,计算清感冬饮给药组LDH漏出量和细胞活力的百分率。每组6个复孔,重复3次。
2.5 清感冬饮对ARE、NF-κB转录活性的影响 2.5.1 HEK293T细胞瞬时共转染取对数生长期的HEK293T细胞,以2×105个/mL的密度接种于96孔板,待细胞生长密度达到70%~80%时,使用1 mg/mL PEI转染试剂转染ARE(pGL4.37)或NF-κB荧光素酶报告质粒(pGL4.32),100 ng/孔,同时加入海肾荧光素酶报告质粒(pGL4.75),10 ng/孔,培养24 h。
2.5.2 基于双荧光素酶报告系统检测HEK293T细胞抗氧化反应元件(ARE)和核因子-κB(NF-κB)转录活性对于转染ARE荧光素酶报告质粒的细胞,给药分组设置为:空白对照组、10 μmol/L tBHQ阳性药组、清感冬饮安全浓度给药组;对于转染NF-κB荧光素酶报告质粒的细胞,给药分组设置为:空白对照组、10 ng/mL TNF-α模型组、10 μmol/L地塞米松阳性药组、清感冬饮安全浓度给药组。均培养6 h后弃上清液,PBS洗涤细胞2次,100 μL/孔,加入细胞裂解液裂解细胞,按照Dual-Luciferase检测系统说明书检测荧光强度,并计算相对荧光素酶活性值(相对荧光比率(L/S)=Luciferase活性值/Renilla活性值)。每组实验设置6个复孔,重复3次。
2.6 建立LPS诱导的RAW264.7巨噬细胞炎症模型RAW264.7巨噬细胞以2×105个/mL密度接种于96孔板,24 h后分组处理细胞。模型组加入终浓度为1 μg/mL LPS;清感冬饮给药组细胞用终浓度为1 μg/mL LPS与终浓度为0.01、0.1、1、10、100 μg/mL清感冬饮共处理24 h,100 μL/孔,空白对照组加入等体积的DMEM高糖型培养基。
2.7 Griess法检测RAW264.7巨噬细胞NO释放量收集对数生长期的RAW264.7巨噬细胞,按2×105个/mL密度接种于96孔板,培养24 h。给药分组设置同“2.6”项,每个浓度6个复孔。加药处理24 h,收集各组细胞培养液上清进行NO释放量检测。以浓度为0、1、2、5、10、20、40、60、100 μmol/L的标准品绘制标准曲线。在96孔板中依次加入标准品及样品、Griess Reagent I、Griess ReagentⅡ,各50 μL/孔,540 nm处测定吸光度。根据标准品曲线计算样品中NO浓度。
2.8 ELISA法检测炎症因子TNF-α、IL-6和IL-1β释放量收集对数生长期的RAW264.7巨噬细胞,按2×105个/mL密度接种于96孔板。实验分组同“2.6”项,每个浓度3个复孔。给药24 h后离心,收集各组细胞培养液上清,按ELISA试剂盒说明书检测上清液中TNF-α、IL-6和IL-1β的浓度。
2.9 qRT-PCR法检测TNF-α、IL-6和IL-1β mRNA的表达收集对数生长期的RAW264.7巨噬细胞,按1.5×105个/mL密度接种于60 mm培养皿,培养24 h。给药分组设置为空白对照组(Control)、LPS、1、10、100 μg/mL清感冬饮组,每个浓度3个复孔。加药处理24 h后,使用Trizol试剂从各组细胞中提取总RNA。样品的RNA浓度及纯度通过NanoPhotometer N60 Touch超微量分光光度计测定。按照High Capacity cDNA Reverse Transcription Kit说明书将总RNA逆转录为cDNA,反应条件为25 ℃,10 min;37 ℃,120 min;85 ℃,5 min;4 ℃,Hold。以cDNA为模板,使用FastStart Universal SYBR Green Master(Rox)和目标引物,见表 1,进行目的基因扩增,扩增程序为50 ℃,2 min;95 ℃,10 min;95 ℃,10 s;60 ℃,30 s,45 cycles。以GAPDH为内参,GAPDH引物购自生工生物工程(上海)股份有限公司。使用2-ΔΔCT法计算mRNA表达水平,以目的基因的相对表达量做图。
将细胞爬片玻片置于24孔板中,收集对数生长期的RAW264.7巨噬细胞,按6×104个/mL密度接种于24孔板中,培养24 h。实验分组设置同“2.9”项。给药24 h后,对各组细胞依次进行如下处理:预冷的PBS清洗细胞3次、4%多聚甲醛室温固定细胞30 min、0.3% TritionX-100室温通透30 min、5%山羊血清37 ℃封闭30 min、p65(1∶200)一抗4 ℃孵育过夜、二抗(1∶1 000)37 ℃避光孵育1 h、Hoechst 33258室温染核10 min、抗荧光淬灭封片剂封片。荧光显微镜下观察p65的定位及表达情况并拍照。Image J软件分析图片,计算平均荧光强度。
2.11 Western bolt法检测RAW264.7巨噬细胞中p65和iNOS蛋白表达水平收集对数生长期的RAW264.7巨噬细胞,按2.5×105个/mL密度接种于100 mm培养皿中,培养24 h。实验分组设置同“2.9”项。按照细胞核蛋白与细胞浆蛋白抽提试剂盒说明书和细胞总蛋白抽提流程提取各组细胞蛋白。采用BCA法测定蛋白质浓度并进行定量变性。蛋白样品经10%SDS-PAGE分离后,转移到0.45 μmPVDF膜上,在5%脱脂奶粉中室温封闭2 h,随后将PVDF膜与一抗(p65、iNOS、GAPDH和Lamin B1)4℃孵育过夜,用对应的二抗室温孵育1 h后显影。利用Image J软件对条带进行灰度值分析,以GAPDH与Lamin B1为内参,计算目标蛋白的相对表达量。
2.12 统计学方法应用SPSS20.0软件进行统计学分析,数据用均数±标准差(x±s)表示,组间比较采用单因素方差分析(One-way ANOVA),P<0.05表示具有统计学意义。应用GraphPad Prism 5.0软件进行绘图。
3 结果 3.1 清感冬饮对HEK293T细胞的安全作用浓度筛选不同浓度的清感冬饮处理HEK293T细胞6 h后,0.01~10 μg/mL清感冬饮组HEK293T细胞活力和LDH漏出量与空白对照组相比无显著性差异(P>0.05),100 μg/mL清感冬饮对HEK293T细胞生长有抑制作用(P<0.01),故采用0.01~10 μg/mL清感冬饮探讨其抗氧化、抗炎作用,见图 1。

|
| 注:与空白对照组比较,#P<0.05,##P<0.01。 图 1 QGDY对HEK293T细胞活力(a)及LDH漏出量(b)的影响(x±s,n=18) |
0.01~100 μg/mL清感冬饮处理RAW264.7巨噬细胞24 h后,细胞存活率均大于95%。与空白对照组相比,10~100 μg/mL清感冬饮使细胞活力显著上升,1~100 μg/mL清感冬饮使LDH漏出量显著降低(P<0.01,P<0.001),表明0.01~100 μg/mL清感冬饮干预24 h对RAW264.7无细胞毒性作用,见图 2。采用药物的安全浓度探讨清感冬饮的抗炎作用。

|
| 注:与空白对照组比较,#P<0.05,##P<0.01。 图 2 QGDY对RAW264.7巨噬细胞活力(a)及LDH漏出量(b)的影响(x±s,n=18) |
与空白对照组相比,tBHQ阳性药组ARE的表达显著升高(P<0.001)。0.01、0.1、1、10、100 μg/mL清感冬饮组ARE表达水平相较于空白对照组无统计学差异,表明清感冬饮无明显抗氧化活性,见图 3。

|
| 注:与空白对照组比较,###P<0.001。 图 3 QGDY对HEK293T细胞ARE荧光素酶活性的影响(x±s,n=18) |
与空白对照组比较,HEK293T细胞经TNF-α诱导后NF-κB的表达显著升高(P<0.001),表明NF-κB双荧光素酶报告系统构建成功。与TNF-α模型组相比,阳性药地塞米松给药浓度为10 μmol/L时能显著抑制NF-κB的表达(P<0.001),1~10 μg/mL清感冬饮能显著抑制TNF-α诱导的NF-κB启动子的活性(P<0.05,P<0.01),见图 4。

|
| 注:与空白对照组比较,###P<0.001;与TNF-α模型组比较,*P<0.05,**P<0.01,***P<0.001。 图 4 QGDY对HEK293T细胞NF-κB启动子荧光素酶活性的影响(x±s,n=18) |
正常情况下,RAW264.7巨噬细胞呈现轮廓清晰的圆形或椭圆形。如图 5所示,经LPS刺激后,与空白对照组相比,细胞伸出伪足,变为梭形或多边形,体积增大,包膜变暗,细胞质中溶酶体颗粒和液泡数量增加,细胞核突出。当清感冬饮的给药浓度达到1 μg/mL及其以上时,由LPS刺激诱发的形态异常得到不同程度的改善,具体表现为细胞形态趋近于类圆形,包膜变亮,细胞质中溶酶体颗粒和液泡数量明显减少,体积缩小。
|
| 注:A. The Control group;B. LPS group;C. LPS+QGDY (0.01 μg/mL);D. LPS+QGDY (0.1 μg/mL);E. LPS+QGDY (1 μg/mL);F. LPS+QGDY (10 μg/mL);G. LPS+QGDY (100 μg/mL) 图 5 QGDY对LPS诱导RAW264.7巨噬细胞形态变化的影响(20×) |
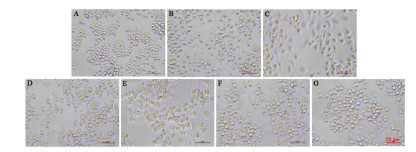
与空白对照组比较,模型组的RAW264.7巨噬细胞经LPS诱导后NO释放量显著升高(P<0.001),表明该细胞炎症模型构建成功。与LPS模型组比较,1~100 μg/mL清感冬饮能呈剂量依赖性显著抑制NO释放(P<0.05,P<0.01,P<0.001),见图 6。
|
| 注:与空白对照组比较,###P<0.001;与LPS模型组比较,*P<0.05,**P<0.01,***P<0.001。 图 6 QGDY对LPS诱导的RAW264.7巨噬细胞NO释放量的影响(x±s,n=18) |
空白对照组细胞培养液上清中TNF-α、IL-6和IL-1β的含量均较低,经LPS刺激后,模型组TNF-α、IL-6和IL-1β释放量均显著增加(P<0.001)。与LPS模型组比较,1~100 μg/mL清感冬饮干预组的TNF-α、IL-6和IL-1β释放量显著降低(P<0.01,P<0.001),且呈现剂量依赖性,见图 7。

|
| 注:与空白对照组比较,###P<0.001;与LPS模型组比较,**P<0.01,***P<0.001。 图 7 QGDY对LPS诱导的RAW264.7巨噬细胞TNF-α(a)、IL-6(b)和IL-1β(c)释放量的影响(x±s,n=9) |
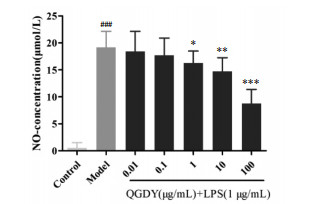
通过qRT-PCR检测各组细胞TNF-α、IL-6和IL-1β mRNA表达水平。如图 8所示,与空白对照组相比,LPS显著增加促炎细胞因子TNF-α、IL-6和IL-1β mRNA表达(P<0.001)。与LPS模型组相比,10~100 μg/mL清感冬饮可明显抑制LPS诱导的RAW264.7巨噬细胞中TNF-α、IL-6和IL-1β mRNA表达(P<0.05,P<0.001)。
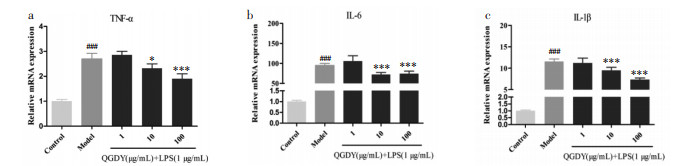
|
| 注:与空白对照组比较,###P<0.001;与LPS模型组比较,*P<0.05,***P<0.001。 图 8 QGDY对LPS诱导的RAW264.7巨噬细胞TNF-α(a)、IL-6(b)和IL-1β(c)mRNA表达水平的影响(x±s,n=9) |
通常,p65(红色荧光)主要定位于细胞胞浆中。当细胞经1 μg/mL LPS刺激后,细胞核区可见明显的红色荧光(P<0.001),表明LPS促使p65从胞浆移位入核。与LPS模型组相比,10~100 μg/mL清感冬饮使细胞核内p65平均荧光强度减弱,显著抑制LPS诱导的RAW264.7巨噬细胞中p65核移位(P<0.01,P<0.001),见图 9。

|
| 注:与空白对照组比较,###P<0.001;与LPS模型组比较,**P<0.01,***P<0.001。 图 9 QGDY对LPS诱导的RAW264.7巨噬细胞中p65核移位的影响(40×)(x±s,n=6) |

|
| 注:与空白对照组比较,#P<0.05,##P<0.01;与LPS模型组比较,*P<0.05,**P<0.01,***P<0.001。 图 10 QGDY对LPS诱导的RAW264.7巨噬细胞NF-κB p65(a和b)和iNOS(c)蛋白表达水平的影响(x±s,n=3) |
Western blot结果显示,1 μg/mL LPS作用于RAW264.7巨噬细胞后,可显著抑制细胞浆中p65蛋白表达(P<0.05),显著上调细胞核中p65蛋白与iNOS总蛋白的表达(P<0.01)。与LPS模型组比较,100 μg/mL清感冬饮显著升高细胞浆中p65蛋白的表达(P<0.01),显著降低iNOS蛋白的表达(P<0.05),10~100 μg/mL清感冬饮显著降低细胞核中p65蛋白的表达(P<0.05,P<0.001)。
4 讨论炎症是机体由内部或外部刺激诱发的复杂生物过程,参与多种疾病的病理进程[5]。NF-κB信号通路已被充分证明是重要的促炎信号通路之一[6]。炎症反应和氧化应激之间存在密切联系,炎症会诱发氧化应激的发生[7]。Kelch样环氧氯丙烷相关蛋白1(Keap1)/核转录因子E2相关因子2(Nrf2)/ARE信号通路作为氧化应激的生物反应中心,调节许多抗氧化基因的转录[7]。基于上述事实,采用了增殖快、较易培养、转染效率高的HEK293T细胞[8],分别建立ARE和NF-κB双荧光素酶报告系统,初步确定清感冬饮具有抗炎活性,而无明显抗氧化活性。
巨噬细胞是免疫反应的效应细胞,参与炎症反应的多个环节。RAW264.7是小鼠腹腔单核巨噬细胞,是一种广泛应用于炎症研究的体外巨噬细胞系[9]。LPS诱导RAW264.7巨噬细胞炎症模型是研究炎症性疾病和筛选抗炎活性物质最常用的体外炎症模型[4]。LPS也称为内毒素,是革兰氏阴性细菌外膜的主要组成部分,可被模式识别受体(PRR)识别,如Toll样受体4(TLR4)[10]。LPS与巨噬细胞膜表面的TLR4结合,激活转录因子,例如NF-κB,进而释放炎症介质NO、TNF-α、IL-6和IL-1β等,从而加速炎症性疾病的发展[11]。清感冬饮能否作用于NF-κB抑制巨噬细胞炎症介质释放成为后续的研究重点。
iNOS是在细菌产物(如LPS)刺激宿主时催化L-精氨酸(L-Arg)产生NO的关键酶,NO过量产生会引起急性和慢性炎症,导致细胞死亡、组织损伤等病理变化[12-13]。因此,调节iNOS基因的表达是治疗涉及NO参与的炎症性疾病最直接、最关键的方式。本研究发现,清感冬饮可以显著减少LPS诱导的RAW264.7巨噬细胞中NO的过量产生,表明清感冬饮通过抑制NO的产生来抑制炎症。进一步研究发现,清感冬饮通过显著抑制iNOS的表达来抑制NO过量产生。
iNOS基因的启动子包括NF-κB、激活蛋白-1(AP-1)及信号转导和转录激活因子1(STAT-1)等识别位点[13]。巨噬细胞中NF-κB的活化可使iNOS的表达水平明显增加,导致NO释放量持续升高,进而使得巨噬细胞分泌促炎细胞因子TNF-α[14]。TNF-α可以调节炎性细胞因子级联反应以刺激其他促炎细胞因子的释放,例如IL-6和IL-1β[15]。IL-6和IL-1β在先天性和适应性免疫反应中起重要作用,机体适量的分泌IL-6和IL-1β有助于感染的恢复,但其过度积累会使炎性损伤级联效应放大,进一步加剧炎症反应,形成恶行循环[16-17]。因此,调节促炎细胞因子的产生被认为是控制炎症性疾病恶化的一种有效策略。ELISA实验结果显示,与对照组相比,RAW264.7巨噬细胞经LPS诱导后TNF-α、IL-6和IL-1β的释放量显著增加,而清感冬饮显著抑制了LPS诱导的RAW264.7巨噬细胞中TNF-α、IL-6和IL-1β的产生,且呈剂量依赖性。为了进一步验证上述结果,笔者对TNF-α、IL-6和IL-1β进行了qRT-PCR分析。发现清感冬饮显著下调LPS处理后TNF-α、IL-6和IL-1β的mRNA表达水平,在细胞转录水平显示出清感冬饮的抗炎活性。
NF-κB是一种转录因子,在调节与免疫和炎症反应相关的基因表达中起重要作用。正常情况下,NF-κB在细胞质中与(核因子-κB抑制蛋白)IκB结合形成复合物,以非活性形式存在[18]。当LPS与巨噬细胞膜上的TLRs结合时,NF-κB信号会响应LPS的刺激而被激活,核因子-κB抑制蛋白激酶α(IKK)使IκBα磷酸化,磷酸化的IκBα被泛素化并随后被26S蛋白酶体降解,NF-κB移位到细胞核[19]。在细胞核中,p65和p50两个亚基(尤其是p65)与靶基因启动子区域的特定DNA序列结合并调节相关基因的转录[20]。在本研究中,采用免疫荧光法对p65亚基进行定位,采用蛋白免疫印迹法测定NF-κB信号通路相关蛋白表达情况。得出如下结论:清感冬饮显著抑制活化巨噬细胞中的p65移位,并下调细胞核内p65蛋白表达水平。
综上所述,本研究表明清感冬饮通过抑制NF-κB/iNOS/NO信号通路的激活,抑制促炎因子TNF-α、IL-6和IL-1β的过度分泌,从而发挥抗炎作用。本实验从细胞水平探讨了清感冬饮的抗炎作用机制,为清感冬饮在临床上进一步推广应用提供实验依据。后续课题组将通过在体实验深入研究清感冬饮的抗炎机制,并明确清感冬饮的抗炎活性成分。
| [1] |
XUE L L, WU W S, MA X, et al. Modulation of LPS-induced inflammation in RAW264.7 murine cells by novel isoflavonoids from Millettia pulchra[J]. Bioorganic Chemistry, 2020, 97(6): 103693. |
| [2] |
仲伟婷. 商陆皂苷甲对实验性诱导呼吸道炎症的作用及机制[D]. 长春: 吉林大学, 2015. ZHONG W T. The effects and regulated mechanism of esculentoside a on experimentally induced respiratory inflammation[D]. Changchun: Jilin University, 2015. |
| [3] |
BEUTLER B. Innate immunity: an overview[J]. Molecular Immunology, 2004, 40(12): 845-859. DOI:10.1016/j.molimm.2003.10.005 |
| [4] |
HAN S, GAO H W, CHEN S R, et al. Procyanidin A1 alleviates inflammatory response induced by LPS through NF-κB, MAPK, and Nrf2/HO-1 pathways in RAW264.7 cells[J]. Scientific Reports, 2019, 13(9): 15087. |
| [5] |
LI X X, ZHENG X T, LIU Z J, et al. Cryptotanshinone from Salvia miltiorrhiza Bunge (Danshen) inhibited inflammatory responses via TLR4/MyD88 signaling pathway[J]. Chinese Medicine, 2020, 15(3): 20. |
| [6] |
LAWRENCE T. The nuclear factor NF-kappaB pathway in inflammation[J]. Cold Spring Harbor Perspectives in Biology, 2009, 1(6): a001651. |
| [7] |
STEFANSON A L, BAKOVIC M. Dietary regulation of Keap1/Nrf2/ARE pathway: focus on plant-derived compounds and trace minerals[J]. Nutrients, 2014, 6(9): 3777-3801. DOI:10.3390/nu6093777 |
| [8] |
SUN X M, HIA H C, GOH P E, et al. High-density transient gene expression in suspension-adapted 293 EBNA1 cells[J]. Biotechnology and Bioengineering, 2008, 99(1): 108-116. DOI:10.1002/bit.21537 |
| [9] |
TACIAK B, BIAȽASEK M, BRANIEWSKA A, et al. Evaluation of phenotypic and functional stability of RAW 264.7 cell line through serial passages[J]. PLoS One, 2018, 13(6): e0198943. DOI:10.1371/journal.pone.0198943 |
| [10] |
ROSADINI C V, KAGAN J C. Early innate immune responses to bacterial LPS[J]. Current Opinion in Immunology, 2017, 44(7): 14-19. |
| [11] |
KIM A T, KIM D O. Anti-inflammatory effects of vanadiumbinding protein from Halocynthia roretzi in LPS-stimulated RAW264.7 macrophages through NF-κB and MAPK pathways[J]. International Journal of Biological Macromolecules, 2019, 133(1): 732-738. |
| [12] |
CAO Y F, LI F, LUO Y Y, et al. 20-hydroxy-3-oxolupan-28oic acid attenuates inflammatory responses by regulating PI3K-Akt and MAPKs signaling pathways in LPS-stimulated RAW264.7 macrophages[J]. Molecules (Basel, Switzerland), 2019, 24(3): 386. DOI:10.3390/molecules24030386 |
| [13] |
FAN H, WU Q, PENG L P, et al. Phyllolobium chinense fisch flavonoids (PCFF) suppresses the M1 polarization of LPS-stimulated RAW264.7 macrophages by inhibiting NFκB/iNOS signaling pathway[J]. Frontiers in Pharmacology, 2020, 11(3): 864. |
| [14] |
PARK S B, PARK G H, KIM H N, et al. Anti-inflammatory effect of the extracts from the branch of Taxillus yadoriki being parasitic in Neolitsea sericea in LPS-stimulated RAW264.7 cells[J]. Biomedicine & Pharmacotherapy, 2018, 104(8): 1-7. |
| [15] |
ROY A, SRIVASTAVA M, SAQIB U, et al. Potential therapeutic targets for inflammation in toll-like receptor 4(TLR4)mediated signaling pathways[J]. International Immunopharmacology, 2016, 40(5): 79-89. |
| [16] |
CHEN T, MOU Y, TAN J N, et al. The protective effect of CDDO-Me on lipopolysaccharide-induced acute lung injury in mice[J]. International Immunopharmacology, 2015, 25(1): 55-64. |
| [17] |
NGUYEN P H, ZHAO B T, LEE J H, et al. Isolation of benzoic and cinnamic acid derivatives from the grains of sorghum bicolor and their inhibition of lipopolysaccharideinduced nitric oxide production in RAW 264.7 cells[J]. Food Chemistry, 2015, 168(13): 512-519. |
| [18] |
CHITHRA M A, IJINU T P, KHARKWAL H, et al. Phenolic rich cocos nucifera inflorescence extract ameliorates inflammatory responses in LPS-stimulated RAW264.7 macrophages and toxin-induced murine models[J]. Inflammopharmacology, 2020, 28(4): 1073-1089. |
| [19] |
TAK P P, FIRESTEIN G S. NF-kappaB: a key role in inflammatory diseases[J]. The Journal of Clinical Investigation, 2001, 107(1): 7-11. |
| [20] |
WANG Q C, LIU W X, YUE Y, et al. Proteoglycan from Bacillus sp. BS11 inhibits the inflammatory response by suppressing the MAPK and NF-κB pathways in lipopolysaccharide-induced RAW264.7 macrophages[J]. Marine Drugs, 2020, 18(12): 585. |
 2022, Vol. 41
2022, Vol. 41