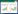文章信息
- 吴梓君, 范栢爽, 罗嘉仪, 魏欣, 李思勤, 王丽莉, 何新
- WU Zijun, FAN Baishuang, Luo Jiayi, Wei Xin, Li Siqin, WANG Lili, HE Xin
- 龙胆泻肝汤对大鼠急性肝性脑病的防治作用研究
- Study on the preventive effect of Longdan Xiegan Decoction on acute hepatic encephalopathy in rats
- 天津中医药大学学报, 2022, 41(6): 746-753
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(6): 746-753
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.06.14
-
文章历史
收稿日期: 2022-09-01
2. 中国医学科学院/北京协和医学院药物研究所, 天然药物活性物质与功能国家重点实验室, 北京 100050;
3. 广东药科大学, 广州 510006
2. State Key Laboratory of Bioactive Substance and Function of Natural Medicines, Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China;
3. Guangdong Pharmaceutical University, Guangzhou 510006, China
肝性脑病,又称为肝昏迷,是一种由于急、慢性肝功能严重障碍或各种门静脉-体循环分流异常所致的,以代谢紊乱为基础的、轻重程度不同的神经精神异常综合征[1]。其临床表现随着病情的加重依次表现为人格改变、行为失常、扑翼样震颤直至出现意识障碍、昏迷和死亡。世界消化病学会将肝性脑病分为A,B,C 3个类型[2],其中与急性肝衰竭相关的A型肝性脑病具有病势凶险、预后差、病死率高达80%等特点[3],因此对肝性脑病的积极防治尤为重要。目前主要的治疗方法有药物治疗、手术治疗和营养治疗等[4],其中运用中医中药方法,如:中药口服、中药保留灌肠、针灸等[5-7]治疗肝性脑病是对肝性脑病治疗研究的热点,正在被广泛探索。
龙胆泻肝汤出自汪昂的《医方集解》,该方由龙胆草(6 g)、黄芩(9 g)、栀子(9 g)、泽泻(9 g)、木通(12 g)、当归(3 g)、生地黄(9 g)、柴胡(6 g)、车前子(9 g)、生甘草(6 g)10味中药组成[8]。具有清泻肝胆实火,清利肝经湿热的功效,是治疗肝胆实火上炎证和肝经湿热下注证的经典方剂,现代临床上主要用于治疗急性黄疸型肝炎[9]、急性胆囊炎[10]、急性膀胱炎[11]等属肝经实火、湿热者。研究发现,黄芩中的黄芩素及其衍生物[3, 12]、当归中的多糖[13]等对大鼠肝性脑病具有良好的治疗作用;以柴胡为君药的小柴胡汤可通过激活NRF2信号通路治疗大鼠A型肝性脑病[14]。因此对于龙胆泻肝汤治疗肝性脑病的研究,多见于龙胆泻肝汤中单味中药或个别中药成分对肝性脑病的治疗及相关机制的研究,但对于该方剂整体对肝性脑病的作用尚未有相关报道。基于此本研究以硫代乙酰胺(TAA)所致的急性肝性脑病大鼠为疾病模型,研究龙胆泻肝汤对肝性脑病的防治作用,为临床应用龙胆泻肝汤治疗肝性脑病提供实验参考。
1 材料与方法 1.1 材料 1.1.1 实验动物Wistar雄性大鼠,32只,体质量为(220±20) g,SPF级,购于北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006。大鼠饲养于室内温度(25.0±1.0) ℃,相对湿度在(50.0±10.0)%的房间内,期间保持12.0 h光照和12.0 h避光循环,大鼠自由饮水、饮食,适应性饲养1周后开始相关实验研究。
1.1.2 药物与试剂龙胆、黄芩、栀子、泽泻、木通、当归、生地、柴胡、车前子、甘草饮片,购于北京同仁堂,均符合《中国药典》(2020版一部)规定;硫代乙酰胺(批号:G217BA0025,生工生物工程(上海)股份有限公司);乳果糖口服液(批号:20020003,北京韩美药品有限公司);水合氯醛(批号:20120629,天津科密欧化学试剂有限公司);10%甲醛固定液(天津科密欧化学试剂有限公司);PBS(批号:20210911,北京索莱宝科技有限公司);肿瘤坏死因子(TNF-α)试剂盒(批号:P279185,美国R&D Systems公司);白细胞介素-6(IL-6)试剂盒(批号:I14016563,武汉华美有限公司);γ-氨基丁酸(GABA)试剂盒(批号:34358236,美国Mybiosource公司);谷氨酸(Glu)试剂盒(批号:20210816C,美国Mybiosource公司);丙二醛(MDA)试剂盒(批号:32337166,美国Mybiosource公司)。
1.1.3 主要仪器动物行为视频分析系统(型号:EthoVision XT 8.5,诺达思信息技术公司);快速血氨测定仪(型号:NX10N,日本Fujifilm公司);全自动生化分析仪(型号:7020,日本Hitach公司);高速离心机(型号:ALLEGRA-64R,美国Beckman公司);十万分之一天平(型号:AX205,瑞士Mettler Toledo公司);微型漩涡混合仪(型号:WH-3,上海沪西分析仪器厂有限公司);台式pH计(型号:FE28-Micro,瑞士Mettler Toledo公司);酶标仪(型号:M200PRO,瑞士Tecan公司)。
1.2 方法 1.2.1 龙胆泻肝汤的制备按照龙胆泻肝汤的配伍比例称取一定量饮片,加入10倍量蒸馏水,浸泡30 min,回流提取两次,每次1 h,过滤,合并两次滤液,浓缩后于无菌瓶中保存于4 ℃冰箱中备用。
1.2.2 实验分组、造模及给药适应性饲养后,将32只SPF级Wistar大鼠随机分为4组,每组8只,分别为正常组、模型组、阳性药组(乳果糖,6 g/kg)和龙胆泻肝汤组(7 g/kg)。根据分组,大鼠分别按体质量灌胃不同药物,连续给药7天。在第5天给药结束后开始造模,模型组、乳果糖组和龙胆泻肝汤组大鼠均腹腔注射TAA 300 mg/kg[3],连续两天,正常组腹腔注射给予等体积生理盐水,造模期间大鼠自由饮食、饮水。从首次腹腔注射TAA开始,为防止大鼠出现电解质紊乱等并发症,每隔12 h于皮下注射电解质液(包括:3 mL 10%葡萄糖、2 mL生理盐水和20 μmol KCl的等量混合液)。
1.2.3 大鼠一般状态观察及大脑功能分级TAA造模后,观察大鼠的一般状态,包括精神状态、毛色、饮食量、二便等;比较各组大鼠体质量情况,在造模后每隔12 h进行称质量。利用Zimmermamn法[15]大鼠脑功能分级进行评分,比较造模后各组大鼠的行为活动是否正常,从而初步判定各组大鼠的脑功能分级情况。具体分级评分标准如下表 1所示。
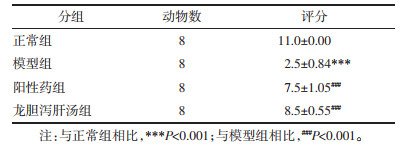
Morris水迷宫实验是用于测定动物空间认知能力和记忆能力的经典实验。大鼠每日训练4次,每次120 s,共训练5 d,第6天开始进行检测。于直径1.5 m的圆形黑色水池中注入自来水,使水面高于平台约1.5 cm,水中加入黑色染料混匀,控制水温在19~22 ℃。将水池分为4个象限,在每个象限上方都贴有1个形状不相同的塑料牌,按顺序依次让大鼠头朝池壁从4个象限入水,从大鼠入水即刻计算机开始跟踪。当训练时间已到或大鼠已爬上平台,停止跟踪,并让大鼠在平台上休息20 s,记录下大鼠寻找到平台所花费的时间(即逃避潜伏期)。于末次定位航行实验结束后,撤去平台,统计出大鼠穿越原平台位置的次数(即穿环指数)。
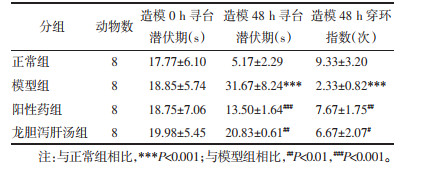
1.2.5 血氨及结肠内容物pH测定行为学检测后,将各组大鼠麻醉,于大鼠眼内眦取少量血液,采用快速血氨测定仪检测全血中氨的含量。取大鼠回盲部后端结肠大约10 cm,用蒸馏水冲洗肠组织内部,获得结肠内容物冲洗液,将该冲洗液离心后,取上清液,用0.45 μm微孔滤膜过滤后,测量pH值。
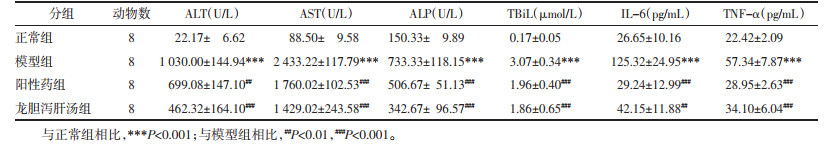
1.2.6 血清生化指标及炎症因子测定于大鼠腹主动脉处取血,处理后采用自动生化检测仪检测丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、总胆红素(TBiL)的含量。利用酶联免疫反应(ELISA)试剂盒测定血清中IL-6和TNF-α的含量。
1.2.7 肝、脑脏器系数测定取大鼠肝脏、大脑,将血液冲洗干净用滤纸吸干水渍后进行称重,计算脏器系数。
1.2.8 肝组织病理学检查剪取大鼠左叶肝脏组织,置于10%多聚甲醛组织固定液中保存,随后进行常规包埋、切片、脱蜡和苏木精-伊红染色,在光学显微镜下(×100)观察肝脏组织病理变化。
1.2.9 神经递质及MDA的检测称取一定量大鼠脑组织,制备成10%的组织匀浆液,按照试剂盒说明书的步骤进行操作,检测各组大鼠脑组织中的GABA、Glu和MDA的含量。
1.2.10 数据处理及分析利用GraphPad Prism软件对数据进行统计分析,结果用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,P < 0.05表示差异具有统计学意义。
2 结果 2.1 大鼠一般情况观察、大脑分级评分及体质量变化各组大鼠在造模前精神状态良好,被毛密而润泽,正常饮食水,二便正常,阳性药组大鼠粪便略有增加;造模后,模型组大鼠被毛松散,毛色偏黄无光泽,饮食减少,饮水增加,尿液增多,粪便减少,出现活动减少、步态不稳、反应迟钝、共济失调等症状;各给药组均出现与模型组类似症状,但较模型组相比症状有所缓解,各组大鼠大脑分级评分如表 2所示。
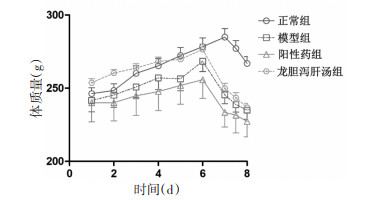
各组大鼠造模前后体质量变化如图 1所示,给药前及给药期间,正常组、模型组、阳性药组和龙胆泻肝汤组大鼠体质量增加,造模12 h后,除正常组外,其余各组大鼠体质量降低,正常组大鼠在禁食后体质量降低。
|
| 图 1 各组大鼠造模前后体质量变化情况(x±s) |
如表 3所示,在造模前各组大鼠随训练时间的延长,逃避潜伏期逐渐减少,与训练第1天相比,其余几天均具有显著性差异(P < 0.001),与训练第2天相比,训练第4、5天的逃避潜伏期显著减少;训练第4、5两天大鼠逃避潜伏期之间无显著性差异,表明各组大鼠学习稳定、水平相当,可用于进一步研究。与正常组相比,模型组大鼠的逃避潜伏期显著增加(P < 0.001),与模型组相比,阳性药组和龙胆泻肝汤组的逃避潜伏期显著降低;穿环指数显示,与空白组相比,模型组大鼠的穿环指数显著减少(P < 0.001),与模型组相比,阳性药组和龙胆泻肝汤组穿环指数显著增加。龙胆泻肝汤可改善肝性脑病大鼠的学习和记忆能力。
血氨结果显示,与正常组相比,模型组大鼠的血氨含量显著升高(P < 0.001),而给予各给药组干预后,与模型组相比,各给药组均显著降低了血氨。
大鼠结肠内容物pH值结果显示,与正常组相比,模型组大鼠的肠道pH值显著增加(P < 0.001),在给予各给药组干预后,与模型组相比,各给药组均显著降低了肠道pH值,几乎接近正常肠道pH值。
2.4 各组大鼠血清肝功能指标及炎症因子变化在生化指标中,与正常组相比,模型组大鼠的ALT、AST、ALP和TBiL水平均显著上升(P < 0.001),表明造模后大鼠肝脏损伤,而给予各给药组干预后,与模型组相比,各给药组均可显著降低大鼠血清中ALT、AST、ALP和TBiL的含量。龙胆泻肝汤可显著改善肝性脑病大鼠肝功能,发挥保护肝脏的作用。
在对炎症因子的改变中:与正常组相比,模型组大鼠血清中IL-6和TNF-α的含量显著增加(P < 0.001),给予龙胆泻肝汤后,与模型组相比,大鼠血清中IL-6和TNF-α的含量显著降低(P < 0.01)。表明肝性脑病大鼠给予龙胆泻肝汤后可降低血清中IL-6和TNF-α的含量,从而发挥抗炎的作用。
2.5 对肝性脑病大鼠脏器系数的影响如图 2所示,在肝和脑脏器系数中,与正常组相比,模型组大鼠的肝和脑脏器系数均显著增加(P < 0.001),在给予各给药组干预后,与模型组相比,阳性药组可显著降低肝性脑病大鼠的肝和脑脏器系数,龙胆泻肝汤组对肝脏器系数有一定程度的降低,但未有显著性差异,其对脑脏器系数降低显著(P < 0.001)。

|
| 图 2 大鼠造模48 h后肝、脑脏器系数变化(x±s) |
各组大鼠肝脏病理学结果如图 3所示:正常组大鼠肝脏被膜光滑,小叶结构正常,肝细胞未见变性或坏死;模型组大鼠肝细胞轻中度水样变性,可见明显的肝细胞溶解、坏死,坏死区可见中度炎细胞浸润,纤维组织增生较明显,小叶结构失常;阳性药组大鼠肝细胞多见轻中度水样变性,可见明显的肝细胞溶解、坏死,与模型组比较差异不明显。龙胆泻肝汤组大鼠肝细胞轻度水样变性,肝细胞溶解与坏死减少,少量纤维组织增生,小叶结构尚正常。

|
| 图 3 各组大鼠肝脏病理形态的变化(HE染色,×100) |
结果显示:与正常组相比,模型组大鼠大脑中GABA和MDA的含量显著增加(P < 0.001),给予龙胆泻肝汤后,与模型组相比,大脑中GABA和MDA的含量显著降低。与正常组相比,模型组大鼠大脑中Glu的水平显著降低(P < 0.001),给予龙胆泻肝汤后,与模型组相比,大脑中Glu的水平显著增加。表明龙胆泻肝汤通过降低肝性脑病大鼠脑中兴奋性神经递质GABA的含量,增加抑制性神经递质Glu及MDA含量,发挥治疗肝性脑病的作用。
肝性脑病是在急、慢性肝病基础上由于肝脏受损,使其对体内物质代谢紊乱,造成内源性物质失衡,引发的脑的神经功能紊乱。由于肝功能衰竭导致脑功能障碍的病理生理机制复杂,涉及多个方面,因此,肝性脑病的发病机制尚未明确,也没有有效的防治手段,这种情况严重地影响了患者的生活质量和生存期,因此对于肝性脑病的治疗一直是国内外研究的热点[16-17]。建立良好的疾病动物模型,对疾病的用药治疗具有重要的意义。研究显示,TAA在引发肝损伤的同时可引起脑代谢异常,多用于研究谷氨酰胺、GABA及氧化应激等在肝性脑病发病机制中的作用,其制备的A型肝性脑病模型可重复性好,造模时间短,成功率高,更接近人肝性脑病的发病特点,因而被广泛使用[18-19]。
临床评价药物对肝性脑病的治疗作用,主要以患者的认知障碍程度、血氨及肝功能水平作为主要的观察指标[20-22]。本研究采用经典的Morris水迷宫试验考察动物的学习与记忆能力[23],选择逃避潜伏期和穿环指数作为评价指标。结果显示,模型组大鼠的逃避潜伏期显著延长,穿环指数显著减少,而在给予龙胆泻肝汤后,大鼠的逃避潜伏期显著降低,穿环指数增加,表明龙胆泻肝汤可改善肝性脑病大鼠的空间学习和记忆能力。血氨的累积是肝性脑病发展的重要因素[24],因此降低血氨水平是治疗肝性脑病的有效措施之一。同时体内氨的增多引起肠道pH值的改变,可能引起肠道菌群的失调[25]。在本研究中,模型组大鼠的血氨值和结肠内容物pH值均显著增加,给予龙胆泻肝汤后血氨水平及肠道pH显著降低。此实验选择ALT、AST、ALP、TBiL四个指标用于评价肝损伤情况。ALT和AST是临床常用于评价肝损伤的重要标志[26],且ALT是急性肝细胞损害的敏感标志;ALP和TBiL是反映肝胆功能的主要标志。研究结果显示,模型组大鼠血清中四个指标水平均显著增加,给予龙胆泻肝汤治疗后,4个指标水平显著降低,表明龙胆泻肝汤具有良好的保肝作用。
在药理/毒理实验中,动物的受损脏器质量可以发生改变,故脏器系数也随之而改变[27-28]。脏器的系数增大,表示脏器充血、水肿或增生肥大等。结果显示,模型组大鼠的肝、脑脏脏器系数显著增加,而给予龙胆泻肝汤治疗后,肝脏器系数有所减小,但未有显著性差异,脑脏器系数显著减小,表明龙胆泻肝汤可以改善肝性脑病大鼠的脏器系数。
研究表明,肝性脑病的发生与炎症因子的增多有关[29-30],肝细胞的损伤可诱发全身释放促炎因子,如TNF-α、IL-6等[31]。结果显示:模型组大鼠血清内TNF-α和IL-6的含量显著增加,给予龙胆泻肝汤后,TNF-α和IL-6的含量显著降低,表明龙胆泻肝汤具有良好的抗炎保肝作用。
神经递质功能障碍也是肝性脑病发病机制之一[32-33]。GABA是一种重要的中枢神经系统抑制性神经递质,过量的GABA的神经传递造成了部分肝性脑病的发生[34-35]。Glu是中枢神经系统中含量最为丰富的兴奋性神经递质,其含量的减少将导致大脑抑制作用的增加[36]。在本研究中,模型组大鼠的GABA含量显著增加,Glu的含量显著降低,给予龙胆泻肝汤后,大鼠大脑GABA水平显著降低,Glu水平显著增加,表明龙胆泻肝汤可调节肝性脑病大鼠大脑神经递质的失衡。
研究显示肝性脑病与氧化应激相关,在多种急性肝衰竭大鼠模型中,大鼠脑的抗氧化能力降低。MDA是机体内多种不饱和脂肪酸在氧自由基作用下发生脂质过氧化而产生的最重要的产物之一,可以反映机体脂质过氧化速率和强度,也能间接反映过氧化损伤程度。在此研究中,模型组大鼠脑中MDA的含量显著升高,给予龙胆泻肝汤后,MDA的含量显著降低,表明龙胆泻肝汤可改善肝性脑病大鼠的氧化应激水平,发挥治疗肝性脑病的作用。
综上,龙胆泻肝汤对TAA所致的大鼠急性肝性脑病模型具有显著疗效,通过改善模型大鼠的学习和记忆能力,降低血氨和肠道pH值,降低脏器系数和肝功能生化指标,降低模型大鼠血清中炎症因子含量,调节脑组织中GABA、Glu及MDA水平,多方面综合发挥治疗肝性脑病的作用。
| [1] |
中华医学会肝病学分会, 中华医学会消化病学分会. 中国肝性脑病诊治共识意见(2013年, 重庆)[J]. 中国医学前沿杂志(电子版), 2014, 6(2): 81-93. CHINESE SOCIETY of GASTROENTEROLOGY, CHINESE SOCIETY of HEPATOLOGY. Chinese consensus on diagnosis and treatment of hepatic encephalopathy (2013, Chongqing)[J]. Chinese Journal of the Frontiers of Medical Science (Electronic Version), 2014, 6(2): 81-93. |
| [2] |
FERENCI P, LOCKWOOD A, MULLEN K, et al. Hepatic encephalopathy-definition, nomenclature, diagnosis, and quantification: final report of the working party at the 11th world congresses of gastroenterology, Vienna, 1998[J]. Hepatology, 2002, 35(3): 716-721. DOI:10.1053/jhep.2002.31250 |
| [3] |
黄楠楠, 胡鹏, 吴增光, 等. 6, 7-二乙酰黄芩素对大鼠急性肝性脑病的防治作用及机制研究[J]. 药物评价研究, 2020, 43(10): 1957-1963. HUANG N N, HU P, WU Z G, et al. Preventive effect and mechanism of baicalein 6, 7-diacetate on acute hepatic encephalopathy in rats[J]. Drug Evaluation Research, 2020, 43(10): 1957-1963. |
| [4] |
徐小元, 丁惠国, 李文刚, 等. 肝硬化肝性脑病诊疗指南[J]. 临床肝胆病杂志, 2018, 34(10): 2076-2089. XU X Y, DING H G, LI W G. Guidelines on the management of hepatic encephalopathy in cirrhosis[J]. The Journal of Clinical Hepatobiliary Diseases, 2018, 34(10): 2076-2089. DOI:10.3969/j.issn.1001-5256.2018.10.007 |
| [5] |
刘敏环, 李剀, 郑慧军. 安宫牛黄丸对肝性脑病大鼠TNF-α/NF-κB信号通路及神经功能的影响[J]. 现代药物与临床, 2021, 36(11): 2217-2223. LIU M H, LI K, ZHENG H J. Effect of Angong Niuhuang Pill on TNF-α/NF-κB signal pathway and neurological function in rats with hepatic encephalopathy[J]. Drugs & Clinic, 2021, 36(11): 2217-2223. |
| [6] |
孟唤男, 刘永刚, 杨璇, 等. 益木脑液灌肠佐治肝硬化并发肝性脑病32例疗效观察[J]. 国医论坛, 2016, 31(5): 50-52. MENG H N, LIU Y G, YANG X, et al. Effect of Yimunao Liquid enema on 32 cases of liver cirrhosis complicated with hepatic encephalopathy[J]. Forum on Traditional Chinese Medicine, 2016, 31(5): 50-52. |
| [7] |
苗芙蕊, 麦威, 蒋筱. 隔姜灸期门、中脘穴对轻微型肝性脑病模型大鼠肝功能及脑内GSH-PX、CAT活力、LRP1表达的影响[J]. 时珍国医国药, 2021, 32(11): 2807-2810. MIAO F R, MAI W, JIANG X. Effects of portal and middle acupuncture points on liver function and expression of GSHPX, CAT viability and LRP1 in rats with mild hepatic encephalopathy[J]. Lishizhen Medicine and Materia Medica Research, 2021, 32(11): 2807-2810. DOI:10.3969/j.issn.1008-0805.2021.11.72 |
| [8] |
邓中甲. 方剂学[M]. 北京: 中国中医药出版社, 2012. DENG Z J. Prescriptions of traditional Chinese medicine[M]. Beijing: China Press of Traditional Chinese Medicine, 2012. |
| [9] |
王宏艳. 龙胆泻肝汤治疗急性黄疸型肝炎70例的体会[J]. 内蒙古中医药, 2016, 35(17): 150. WANG H Y. Experience of 70 cases of Longdang Xiegan Decoction in the treatment of acute acute jaundice hepatitis[J]. Nei Mongol Journal of Traditional Chinese Medicine, 2016, 35(17): 150. DOI:10.3969/j.issn.1006-0979.2016.17.141 |
| [10] |
李杰, 黄萍萍. 龙胆泻肝汤对急性胆囊炎腹腔镜下胆囊切除术后康复的影响[J]. 实用中西医结合临床, 2019, 19(5): 28-30. LI J, HUANG P P. Effect of Longdang Xiegan Decoction on rehabilitation after laparoscopic cholecystectomy in acute cholecystitis[J]. Practical Clinical Journal of Integrated Traditional Chinese and Western Medicine, 2019, 19(5): 28-30. |
| [11] |
张作营. 龙胆泻肝片治疗急性膀胱炎的疗效分析[J]. 现代诊断与治疗, 2013, 24(5): 1008-1009. ZHANG Z Y. Efficacy analysis of Longdang Xiegan Pills in the treatment of acute cystitis[J]. Modern Diagnosis & Treatment, 2013, 24(5): 1008-1009. DOI:10.3969/j.issn.1001-8174.2013.05.030 |
| [12] |
范栢爽, 吴梓君, 刘世豪, 等. 黄芩素衍生物对大鼠急性肝性脑病模型的干预[J]. 天津中医药, 2021, 38(11): 1456-1462. FAN B S, WU Z J, LIU S H, et al. Study on the intervention effect of baicalein derivative on acute hepatic encephalopathy in rats[J]. Tianjin Journal of Traditional Chinese Medicine, 2021, 38(11): 1456-1462. DOI:10.11656/j.issn.1672-1519.2021.11.20 |
| [13] |
卿轶. 当归多糖对大鼠肝性脑病的预防作用及其机制的实验研究[D]. 重庆: 重庆医科大学, 2008. QING Y. Investigate the prevention of Angelica sinensis polysaccharide on the rats from hepatic encephalopathy and its mechanism[D]. Chongqing: Chongqing Medical University, 2008. |
| [14] |
贾为壹. 小柴胡汤激活NRF2信号通路对大鼠A型肝性脑病治疗作用及机制研究[D]. 遵义: 遵义医科大学, 2020. JIA W Y. Xiaochaihutang improves the acute hepatic encephalopathy by activating NRF2 pathway in rats[D]. Zunyi: Zunyi Medical University, 2020. |
| [15] |
ZIMMERMANN C, FERENCI P, PIFL C, et al. Hepatic encephalopathy in thioacetamide-induced acute liver failure in rats: characterization of an improved model and study of amino acid-ergic neurotransmission[J]. Hepatology, 1989, 9(4): 594-601. DOI:10.1002/hep.1840090414 |
| [16] |
BUTTERWORTH R F. Ammonia removal by metabolic scavengers for the prevention and treatment of hepatic encephalopathy in cirrhosis[J]. Drugs in R&D, 2021, 21(2): 123-132. |
| [17] |
KRISHNARAO A, GORDON F D. Hepatic Encephalopathy[J]. Clinics in liver disease, 2020, 16(2): 301-320. |
| [18] |
MLADENOVIĆ D, KRSTIĆ D, COLOVIĆ M, et al. Different sensitivity of various brain structures to thioacetamideinduced lipid peroxidation[J]. Medicinal Chemistry (Shariqah (United Arab Emirates)), 2012, 8(1): 52-58. |
| [19] |
RAMA RAO K V, REDDY P V B, TONG X Y, et al. Brain edema in acute liver failure: inhibition by L-histidine[J]. The American Journal of Pathology, 2010, 176(3): 1400-1408. |
| [20] |
李艳乐, 刘笑宇, 姚建宁, 等. 乙型肝炎肝硬化并发肝性脑病患者血氨水平与认知障碍关系研究[J]. 实用肝脏病杂志, 2022, 25(1): 74-78. LI Y L, LIU X Y, YAO J N, et al. Serum ammonia level changes and its correlation to cognitive impairment in patients with hepatitis B cirrhosis and hepatic encephalopathy[J]. Journal of Practical Hepatology, 2022, 25(1): 74-78. |
| [21] |
吴玉叶, 原苗苗. 门冬氨酸鸟氨酸联合乳果糖对肝性脑病患者肝功能及血氨浓度变化的影响[J]. 医药论坛杂志, 2017, 38(6): 70-72. WU Y Y, YUAN M M. Effects of Nmda ornithine combined with lactulose on liver function and serum ammonia concentration in patients with hepatic encephalopathy[J]. Journal of Medical Forum, 2017, 38(6): 70-72. |
| [22] |
吕艳杰. 精氨酸联合纳洛酮治疗肝硬化合并肝性脑病的疗效[J]. 中国实用医药, 2022, 17(2): 130-132. LYU Y J. Efficacy of arginine combined with naloxone in the treatment of cirrhotic with hepatic encephalopathy[J]. China Practical Medicine, 2022, 17(2): 130-132. |
| [23] |
VORHEES C V, WILLIAMS M T. Morris water maze: procedures for assessing spatial and related forms of learning and memory[J]. Nature Protocols, 2006, 1(2): 848-858. |
| [24] |
王怀唐, 郭银燕, 庆琳琳, 等. 脑电图联合血氨检测对肝性脑病的诊断价值[J]. 中国医药科学, 2021, 11(5): 234-236. WANG H T, GUO Y Y, QING L L, et al. Diagnostic value of EEG combined with blood ammonia detection in hepatic encephalopathy[J]. China Medicine and Pharmacy, 2021, 11(5): 234-236. |
| [25] |
李变玲, 黄会芳, 王晓阳, 等. 肠道菌群与肝性脑病的关系及其治疗措施研究进展[J]. 解放军医学杂志, 2021, 46(9): 860-864. LI B L, HUANG H F, WANG X Y, et al. Research progress of intestinal flora and hepatic encephalopathy[J]. Medical Journal of Chinese PLA, 2021, 46(9): 860-864. |
| [26] |
于春艳. 血生化指标和纤维化指标在肝硬化患者中的表达价值分析及临床意义研究[J]. 中国医学创新, 2021, 18(14): 159-163. YU C Y. Study on the expression value and clinical significance of blood biochemical indexes and fibrosis indexes in patients with liver cirrhosis[J]. Medical Innovation of China, 2021, 18(14): 159-163. |
| [27] |
袁本利. 药物安全评价中脏器系数的意义及不足[J]. 中国新药杂志, 2003, 12(11): 960-963. YUAN B L. The significance and shortcoming of organ/body weight ratio used in drug safety evaluation[J]. Chinese New Drugs Journal, 2003, 12(11): 960-963. |
| [28] |
王燕, 厉彦翔. Wistar大鼠血液生化指标、体重及主要脏器系数参考值的研究[J]. 中国民族民间医药, 2011, 20(23): 9-10. WANG Y, LI Y X. Research of normal reference range of blood biochemical indicators, body weight and the main orgain coefficient of wistar rats[J]. Chinese Journal of Ethnomedicine and Ethnopharmacy, 2011, 20(23): 9-10. |
| [29] |
柳萍飞, 包健. 亚临床肝性脑病患者肠道菌群和血清炎症因子水平变化及益生菌的干预作用[J]. 中国微生态学杂志, 2020, 32(2): 180-182, 186. LIU P F, BAO J. Changes of intestinal flora and serum inflammatory factor levels of patients with subclinical hepatic encephalopathy and the intervention effect of probiotics[J]. Chinese Journal of Microecology, 2020, 32(2): 180-182, 186. |
| [30] |
王柯尹, 吴一鸣, 陆许贞, 等. 乙型肝炎肝硬化合并肝性脑病患者血清LPS、TNF-α和IL-6的表达变化及意义[J]. 中国现代医生, 2017, 55(10): 12-15. WANG K Y, WU Y M, LU X Z, et al. Changes of expression of serum LPS, TNF-α and IL-6 in patients with hepatitis Brelated cirrhosis complicated with hepatic encephalopathy and its significance[J]. China Modern Doctor, 2017, 55(10): 12-15. |
| [31] |
覃秀容. 大黄煎剂对湿热内蕴证肝性脑病患者血清炎症因子和认知功能的影响[D]. 南宁: 广西中医药大学, 2021. QIN X R. Effects of da Huang Jian ji on serum inflammatory factors and cognitive functions in patients with hepatic encephalopathy with damp-heat syndrome[D]. Nanning: Guangxi University of Chinese Medicine, 2021. |
| [32] |
AHBOUCHA S, BUTTERWORTH R F. The neurosteroid system: implication in the pathophysiology of hepatic encephalopathy[J]. Neurochemistry International, 2008, 52(4/5): 575-587. |
| [33] |
PALOMERO-GALLAGHER N, ZILLES K. Neurotransmitter receptor alterations in hepatic encephalopathy: a review[J]. Archives of Biochemistry and Biophysics, 2013, 536(2): 109-121. |
| [34] |
SCHAFER D, JONES E A. Hepatic encephalopathy and the γ-aminobutyric-acid neurotransmitter system[J]. The Lancet, 1982, 319(8262): 18-20. |
| [35] |
LLANSOLA M, MONTOLIU C, AGUSTI A, et al. Interplay between glutamatergic and GABAergic neurotransmission alterations in cognitive and motor impairment in minimal hepatic encephalopathy[J]. Neurochemistry International, 2015, 88(6): 15-19. |
| [36] |
CHAN H, ZWINGMANN C, PANNUNZIO M, et al. Effects of ammonia on high affinity glutamate uptake and glutamate transporter EAAT3 expression in cultured rat cerebellar granule cells[J]. Neurochemistry International, 2003, 43(2): 137-146. |
 2022, Vol. 41
2022, Vol. 41