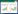文章信息
- 耿馨悦, 高晓燕
- GENG Xinyue, GAO Xiaoyan
- 赞化鹿茸丸治疗肾阳虚模型大鼠药效学研究
- Pharmacodynamics study of Zanhua Lurong Pills in the treatment of kidney-yang deficiency model rats
- 天津中医药大学学报, 2022, 41(6): 754-760
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(6): 754-760
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.06.15
-
文章历史
收稿日期: 2022-06-26
肾阳虚是指肾阳气亏虚,温煦功能下降而导致的腰膝酸软、畏寒肢冷、精神不振、舌淡胖苔白、脉沉弱无力为主要表现的证候[1-2]。肾阳为机体阳气之本,有温煦,推动之功。肾阳充足,机体活动旺盛;肾阳不足,则温煦、兴奋、蒸化、封藏等功能下降,将会引起机体衰弱以及生殖机能减退等证状。现代医学研究认为,肾阳虚证广泛存在于临床内、外、妇、儿、五官等各科疾病中,与多种慢性病、老年病的发生、发展和预后相关[3]。由于生活节奏的加快和工作生活压力的增大,肾阳虚的患病人群也越来越多,因此,探讨研究治疗肾阳虚证的药物具有临床意义的。
肾阳虚证临床上的一般治疗法则为:温补肾阳、温阳利水、补肾纳气、补肾固摄等。鹿茸丸源自《三因极一病证方论》,原方主治失志伤肾,肾虚消渴,小便无度,具有补肾益气,滋阴温阳的作用。赞化鹿茸丸是在前药方的基础上发展起来的,被《中华人民共和国卫生部药品标准》中药成方制剂第二册收载,由鹿茸(去毛)、当归、酸枣仁(炒)、鹿角霜、柏子仁、熟地黄、肉苁蓉、鹿角胶、黄芪、附子(制)10味药组成,具有补气养血,扶肾壮阳,调经祛寒之功效。临床上用于诸虚百损,心肾不交,肝肾不足引起的阳痿不举,疝气腹痛,女子带下,胞寒不孕,体质虚弱,腰腿酸痛等。但目前尚缺乏赞化鹿茸丸干预肾阳虚证的相关疗效的研究。因此本试验通过肌注氢化可的松建立肾阳虚大鼠模型[4],探讨赞化鹿茸丸对肾阳虚模型大鼠的影响,为临床更好的用药提供依据。
1 材料和方法 1.1 药物与试剂赞化鹿茸丸(购自葵花药业股份有限公司);氢化可的松(购自上海源叶生物科技有限公司);水合氯醛(购自上海源叶生物科技有限公司)。
1.2 实验动物SPF级SD大鼠,雌、雄各18只。雄性体质量为(180±20) g;雌性体质量为(180±20) g。动物饲养于北京中医药大学,温度(20±2) ℃,湿度(60±5) %,自由饮食饮水。
1.3 实验仪器D-37520高速冷冻离心机(Thermo Scientific,Germany);TLE204电子天平[梅特勒-托利多仪器(上海)有限公司];荧光倒置生物显微镜(日本Olympus公司)。
1.4 模型建立本研究选用SD大鼠通过肌肉注射氢化可的松3周造肾阳虚大鼠模型[5-7]。雄性SD大鼠适应性饲养1周后,随机选取6只作正常对照组,其余作为造模组。正常对照组注射生理盐水,造模组每日按25 mg/kg肌肉注射氢化可的松1次,连续给药三周,制备雄性肾阳虚模型大鼠。雌性SD大鼠造模方法同雄性SD大鼠。造模过程中,每隔7 d称量记录各组大鼠体质量,并记录大鼠的行为学特征,观察是否出现反应迟钝、活动减少、体毛枯燥并失去光泽、爪甲与耳廓颜色变淡、弓背蜷缩、畏寒怕冷喜扎堆,以及尿量增加、食量及饮水量减少、体温及体质量显著下降等表现,评价肾阳虚模型是否造模成功[8]。
1.5 分组与给药正常对照组外,雄性/雌性造模大鼠分为模型组、模型给药组,每组6只。正常对照组和模型组灌胃0.9%氯化钠溶液;模型给药组灌胃赞化鹿茸丸(按2.4 g/kg给药)。连续给药3周。治疗期间各组大鼠正常饮食。
1.6 赞化鹿茸丸对肾阳虚模型大鼠的治疗作用评价 1.6.1 一般活动状态评价连续给药3周后,分别对雌性大鼠和雄性大鼠的正常对照组、模型组、模型给药组的体质量进行测定,比较差异;同时观察大鼠被毛光泽程度、行动反应是否依旧迟钝、蜷缩畏冷以及及多尿等情况有无改善。
1.6.2 雄性肾阳虚大鼠模型睾丸组织结构评价各组雄性大鼠摘取单侧睾丸,用生理盐水洗净后,放入4%多聚甲醛溶液中,固定、脱水、包埋、切片,HE染色,用光学显微镜观察各组大鼠睾丸病理变化,记录其病变性质和程度。
1.6.3 脏器指数评价给药3周后,大鼠腹腔注射水合氯醛(0.33 g/mL)进行麻醉,雄性大鼠摘取单侧睾丸、精囊腺和单侧肾脏;雌性大鼠摘取子宫、双侧卵巢及单侧肾脏(去除周围脂肪),以电子天平称各脏器质量,计算脏器指数。脏器指数(mg/g)=脏器质量(mg)/体质量(g)。
1.6.4 生化指标评价给药3周后,大鼠腹腔注射水合氯醛(0.33 g/mL)进行麻醉,腹主动脉取血5 mL左右,于4 ℃下3 500 r/min离心10 min,保留血清。血清送于北京鼎国昌盛生物技术有限责任公司,对大鼠血清中的肿瘤坏死因子-α(TNF-α)、睾酮(T)、雌二醇(E2)进行测定。
1.7 统计学方法数据采用SPSS 22.0统计软件单因素方差分析(one-way ANOVA)统计,LSD检验比较两组间差异,结果均以均数±标准差(x±s)表示,以P<0.05为差异有统计学意义。
2 结果 2.1 肾阳虚大鼠模型的评价造模两周后,雌性/雄性大鼠正常对照组活泼好动,形体肥胖,反应灵敏,毛发光泽;造模组行动迟缓,形体消瘦,被毛疏松无华,时有脱毛,耳朵颜色发白,蜷缩弓背,畏寒扎堆,小便增多,食量减少。雌性/雄性大鼠造模组体重明显减轻(P<0.001)。造模3周后,雌性/雄性大鼠正常对照组体质量稳步增长,造模组体质量和正常对照组体质量相比相差较大(P<0.001)。具体数据见表 1、表 2。此外,造模组大鼠出现明显的体毛发枯变疏且无光泽、皮肉松弛、反应迟钝,活动明显减少,畏寒、弓背蜷缩等现象,以及食量减少,尿量增多、溏便等情况。综合以上各项因素,本次造模成功,可以进行下一步工作。
实验过程中,正常对照组大鼠无明显异常表现,体态丰满,体毛紧密有光泽,反应灵敏,尿量与排便正常,体质量逐步增加;模型组大鼠出现体毛发枯变疏且无光泽,反应迟钝,畏寒、弓背蜷缩,活动明显减少,食量降低,出现多尿等情况。而给药赞化鹿茸丸后,模型给药组相较于模型组上述情况均有不同程度的改善,身形虽也略显消瘦,出现少许蜷缩现象,但反应比较活泼,体毛较有光泽,多尿情况好转。从给药后大鼠体质量进行分析,模型组体重恢复均高于模型组,说明赞化鹿茸丸对肾阳虚证之“形体消瘦”具有明显改善作用,虽两组差异无统计学意义。见表 3、表 4。
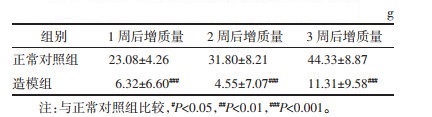
在光镜下观察各组大鼠睾丸病理切片(放大倍数依次为4×10、10×10、20×10),就其病变程度进行非定量分析。结果显示,正常对照组睾丸组织结构完整,生精小管发达,各级生精细胞排列紧密,生精小管管腔内可见大量精子,睾丸间质少。模型组管壁萎缩,生精小管内细胞层数减少,排列疏松,初级精母细胞和次级精母细胞数均减少,并伴随有精母细胞死亡脱落,管腔内还有大量脱落的精子细胞;睾丸间质组织增生,间质细胞数量减少,呈现睾丸萎缩图像。模型给药组睾丸结构较模型组有很大程度的改善,表现为生精小管管壁增厚,细胞层数增多,精子细胞和精子生成增加,间质细胞数量恢复。见图 1。
|
| 注:A.正常对照组;B.模型组;C.模型给药组。 图 1 雄性大鼠各组睾丸横切面 |
给药3周后,雌性大鼠摘取子宫、双侧卵巢及单侧肾脏(去除周围脂肪),计算脏器指数。与正常对照组比较,模型组的子宫、肾脏的脏器指数显著降低(P<0.05)。模型给药组与正常对照组比较,子宫、肾脏的脏器指数无显著性差异;与模型组相比较,肾脏脏器指数有显著提高(P<0.05),子宫指数有所提高,但无显著差异。卵巢指数,各组均无差异。结果表明,给药赞化鹿茸丸能够在一定程度提高肾阳虚雌性大鼠模型的子宫和肾脏的脏器指数。见图 2。

|
| 注:与正常对照组相比,#P<0.05,##P<0.01,###P<0.001;与模型组相比,*P<0.05,**P<0.01,***P<0.001。 图 2 雌性大鼠脏器指数(x±s,动物数=6) |
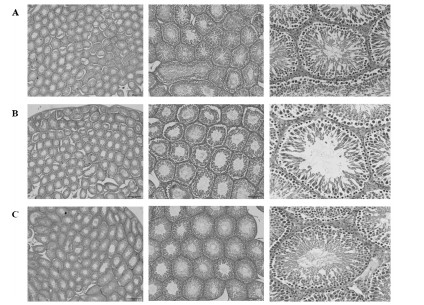
给药3周后,雄性大鼠摘取单侧睾丸、精囊腺和单侧肾脏,计算脏器指数。与正常对照组比较,模型组的睾丸与肾脏的脏器指数显著降低(P<0.05);模型给药组睾丸与肾脏的脏器指数,与正常对照组相比无明显差异,与模型组相比有显著提高(P<0.01)。精囊腺指数,各组均无差异。结果显示,赞化鹿茸丸能够在一定程度提高肾阳虚雄性大鼠模型睾丸及肾脏的脏器指数,改善肾脏异常。见图 3。

|
| 注:与正常对照组相比,#P<0.05,##P<0.01,###P<0.001;与模型组相比,*P<0.05,**P<0.01,***P<0.001。 图 3 雄性大鼠脏器指数(x±s,动物数=6) |
造模后,雄性模型组大鼠血清中T水平与其正常对照组相比显著下降(P<0.000 1);赞化鹿茸丸干预后,雄性模型给药组大鼠血清中T水平与造模组相比显著提高(P<0.01),与其正常对照组相比无明显差异。雌性模型组大鼠血清E2与其正常对照组相比显著下降(P<0.01);赞化鹿茸丸干预后,雌性模型给药组大鼠血清中E2与造模组相比显著提高(P<0.01),与其正常对照组相比无明显差异。结果表明,造模后,雄性模型组大鼠血清中T水平下降,雌性模型组大鼠血清中E2水平下降,赞化鹿茸丸干预能在一定程度使T和E2回调,使其恢复之正常水平。雌性模型给药组大鼠血清中的T和雄性模型给药组大鼠血清中E2水平虽无显著变化,但也呈现出造模后下降,赞化鹿茸丸干预后升高的趋势。结果见图 4。
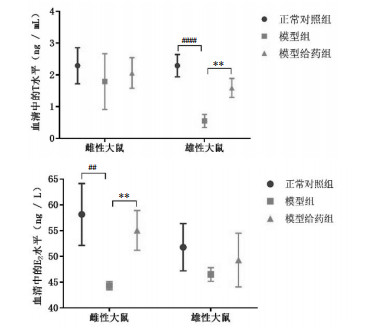
|
| 注:与正常对照组相比,#P<0.05,##P<0.01,###P<0.001,###P<0.000 1;与模型组相比,*P<0.05,**P<0.01,***P<0.001。 图 4 血清中的T和E2水平(x±s,动物数=6) |
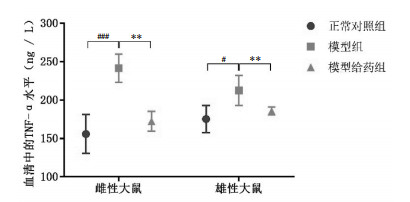
造模后,雌性/雄性模型组大鼠血清中TNF-α水平与其正常对照组相比显著升高(P<0.001,P<0.05);给药赞化鹿茸丸后,雌性/雄性模型给药组大鼠血清中TNF-α水平与造模组相比显著降低(P<0.01),与正常对照组相比无明显差异。结果表明,赞化鹿茸丸能够在一定程度调节大鼠血清中TNF-α水平,见图 5。
|
| 注:与正常对照组相比,#P<0.05,##P<0.01,###P<0.001;与模型组相比,*P<0.05,**P<0.01,***P<0.001。 图 5 血清中TNF-α水平(x±s,动物数=6) |
肾中阳气为人体阳气之根本,具有温煦、蒸腾、气化、推动、激发以及固摄等生理作用,是机体生长发育和生命活动的根本。王琦教授《中医藏象学》将肾阳虚证解释为元阳不足、命门火衰:“肾阳虚又称命门火衰,命火式微,是以元阳不足、气化无权而出现的温煦失职、水湿内盛以及性机能衰弱等临床表现的概称”[9]。肾阳虚证在临床多发,临床表现为腰膝酸痛,畏寒怕冷,四肢发凉,精神萎靡,头晕目眩,心悸咳喘,耳鸣,记忆力减退,须发早白,男子阳痿、早泄、遗精,女子代下,胞寒不孕等[10]。
赞化鹿茸丸方中,鹿茸为君药,性味甘、咸、温,归肾、肝经,具有温肾壮阳、益精补血、强筋健骨、调冲任、托疮毒之效;用于肾阳不足、精血亏虚、阳痿滑精、宫冷不孕、羸瘦、神疲、畏寒、眩晕、耳鸣、耳聋、腰脊冷痛、筋骨痿软、崩漏带下、阴疽不敛等。鹿茸首载于《神农本草经》:“味甘,温,主漏下恶血,寒热,惊痫,益气强志,生齿不老。”唐代《药性论》记载其“主补男子腰肾虚冷,脚膝无力,梦交,精溢自出,女人崩中漏血,炙末空心温酒服方寸匕。”明确指出鹿茸具有补肾壮阳的功效[11]。余下药味,当归补血活血;酸枣仁(炒)养血安神;鹿角霜温肾壮阳;柏子仁养心安神;熟地黄滋补肾阴;肉苁蓉温肾壮阳;鹿角胶温补肝肾,益精养血;黄芪补气升阳;附子回阳助阳[12]。全方共奏补气养血,扶肾壮阳,调经去寒之功。故本试验通过肌注氢化可的松所建立的肾阳虚大鼠模型,从补肾益精的角度探究了赞化鹿茸丸对肾阳虚模型动物的影响。本研究实验结果也表明赞化鹿茸丸对肾阳虚大鼠模型有一定治疗效果,该方可以明显改善肾阳虚模型大鼠的临床症状,如体质量下降、四肢末端发白、精神萎靡,被毛疏松等症状,同时相关脏器指数、睾丸组织结构等也有明显改善。
现代医学研究认为肾阳虚的发生与神经内分泌免疫系统有关,肾阳虚证主要表现出下丘脑-垂体-靶腺轴功能紊乱,进而导致激素分泌紊乱[13-14]。下丘脑-垂体-靶腺轴也应用于肾阳虚证动物模型的建立:即针对不同的轴使用相应的药物破坏其正常功能,从而导致肾阳虚的发生[15-16]。本文所采用的建模方法为肌肉注射氢化可的松,它是利用外源性糖皮质激素抑制垂体前叶的促肾上腺皮质激素的分泌,从而抑制下丘脑-垂体-肾上腺轴(Hypothalamic-pituitary adrenal Axis,HPA)的功能,诱发病理性肾阳虚证的症状[17];此外,也有研究报道氢化可的松对下丘脑-垂体-性腺轴(Hypothalamic-pituitary-gonadal Axis,HPG)也具有明显抑制作用,造成性激素降低[18-20]。本实验结果中,雄性模型大鼠血清中的T和雌性模型组大鼠血清中的E2相较于正常组显著下降,赞化鹿茸丸干预后,T和E2均恢复到正常水平,故推测赞化鹿茸丸可能通过下丘脑-垂体-性腺轴来调节肾阳虚大鼠模型的体内激素的分泌,从而干预肾阳虚模型大鼠,发挥治疗作用。赞化鹿茸丸对血清中的TNF-α也具有一定的调节作用。TNF-α是主要的炎症因子,参与正常炎症反应,与炎症的产生和发展息息相关[21]。研究表明,炎症与许多肾功能障碍疾病相关,如急性肾损伤、慢性肾脏病等[22-24]。本文中,模型组与正常对照组相比,其血清中的TNF-α显著增加(P<0.05),但赞化鹿茸丸干预后,TNF-α恢复至正常水平。故推测赞化鹿茸丸可能通过降低肾阳虚模型大鼠的TNF-α表达,抑制炎症反应,从而起到治疗作用。
综上所述,本研究揭示了赞化鹿茸丸对肾阳虚动物模型具有一定的治疗作用,为临床的应用提供依据和参考。
| [1] |
林森, 冯松杰. 肾阳虚证历史回顾及现代研究[J]. 河北中医, 2011, 33(3): 463-465. LIN S, FENG S J. Historical review and modern research on kidney-yang deficiency syndrome[J]. Hebei Journal of Traditional Chinese Medicine, 2011, 33(3): 463-465. |
| [2] |
谷建军, 任路. 肾阳虚证形成源流及其关键问题探讨[J]. 辽宁中医药大学学报, 2021, 23(12): 9-13. GU J J, REN L. Discussion on the origin and development of kidney-yang deficiency syndrome and its key problems[J]. Journal of Liaoning University of Traditional Chinese Medicine, 2021, 23(12): 9-13. |
| [3] |
李秀娟, 白璐铭, 尚德阳, 等. 论"命门"学说对"肾阳虚证"形成的影响[J]. 实用中医内科杂志, 2022, 36(4): 4-6. LI X J, BAI L M, SHANG D Y, et al. On the Influence of the Theory of "vital gate" on the formation of"kidney-yang deficiency syndrome"[J]. Journal of Practical Traditional Chinese Internal Medicine, 2022, 36(4): 4-6. |
| [4] |
李威, 王顺谱, 杨凤云. 肾阳虚证动物模型建立方法及评定标准研究进展[J]. 江西中医药, 2021, 52(8): 74-76. LI W, WANG S P, YANG F Y. Research progress on establishment method and evaluation standard of animal model of kidney-yang deficiency syndrome[J]. Jiangxi Journal of Traditional Chinese Medicine, 2021, 52(8): 74-76. |
| [5] |
苟小军, 韩宝侠, 王朝廷, 等. 肾阳虚证造模方法考察[J]. 吉林中医药, 2009, 29(9): 814-815. GOU X J, HAN B X, WANG T, et al. Study on the modeling method of kidney yang deficiency syndrome[J]. Jilin Journal of Traditional Chinese Medicine, 2009, 29(9): 814-815. DOI:10.3969/j.issn.1003-5699.2009.09.044 |
| [6] |
何书芬, 居文政, 胡浩彬, 等. 肾阳虚型抑郁症大鼠模型的建立和评价[J]. 中国药理学通报, 2017, 33(1): 40-143. HE S F, JU W Z, HU H B, et al. Establishment and evaluation of animal model of depression rats with kidney yang deficiency[J]. Chinese Pharmacological Bulletin, 2017, 33(1): 140-143. DOI:10.3969/j.issn.1001-1978.2017.01.024 |
| [7] |
方萍, 苏洁, 陈炜, 等. 无比山药丸对腺嘌呤致肾阳虚模型大鼠肾脏病变的影响[J]. 中药药理与临床, 2021, 37(3): 11-16. FANG P, SU J, CHEN W, et al. Effect of Wubishanyao Pills on renal lesion of Shenyangxu model rats induced by adenine[J]. Pharmacology and Clinics of Chinese Materia Medica, 2021, 37(3): 11-16. |
| [8] |
唐维我, 张会永, 李芹, 等. 肾阳虚证动物模型造模方法及模型评价[J]. 世界科学技术-中医药现代化, 2021, 23(4): 1317-1324. TANG W W, ZHANG H Y, LI Q, et al. Modeling methods and model evaluation of animal models for kidney Yang deficiency syndrome[J]. Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology, 2021, 23(4): 1317-1324. |
| [9] |
王琦. 中医藏象学[M]. 北京: 人民卫生出版社, 1997. WANG Q. Theory of viscera[M]. Beijing: People' s Medical Publishing House, 1997. |
| [10] |
柳永青. 肾阳虚证的分子机制进展和展望[J]. 湖南中医药大学学报, 2009, 29(10): 66-67. LIU Y Q. Progress and prospects of the molecular mechanism of kidney-yang deficiency syndrome[J]. Journal of Traditional Chinese Medicine University of Hunan, 2009, 29(10): 66-67. |
| [11] |
杨世雷. 补肾良药话鹿茸[J]. 中国现代药物应用, 2016, 10(9): 265-266. YANG S L. Deer antler as a kidney tonifying medicine[J]. Chinese Journal of Modern Drug Application, 2016, 10(9): 265-266. |
| [12] |
国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2020. Chines Pharmacopoeia Commission. Pharmacopoeia of the People' s Republic of China[M]. Beijing: China Medical Science Publishing House, 2020. |
| [13] |
沈自尹. 从肾本质研究到证本质研究的思考与实践: 中西医结合研究推动了更高层次的中医与西医互补[J]. 上海中医药杂志, 2000, 34(4): 4-7. SHEN Z Y. Contemplation and practice on research from kidney essence to syndrome essence-promotion of mutual supplement of Chinese and Western medicines to a higher level by research on Integration of Chinese and Western[J]. Shanghai Journal of Traditional Chinese Medicine, 2000, 34(4): 4-7. |
| [14] |
郑幼镭, 郭春荣, 孙祝美, 等. 肾阳虚证的生物学基础研究进展[J]. 中国中医药科技, 2019, 26(2): 318-319. ZHENG Y L, GUO C R, SUN Z M, et al. Advances in biological basis of kidney yang deficiency syndrome[J]. Chinese Journal of Traditional Medical Science and Technology, 2019, 26(2): 318-319. |
| [15] |
伍庆华, 王建红, 祁风义. 肾阳虚与下丘脑-垂体-靶腺轴研究概述[J]. 江西中医学院学报, 2006, 18(6): 73-74. WU Q H, WANG J H, QI F Y. Overview of studies on kidney yang deficiency and hypothalamus-pituitary-target gland axis[J]. Journal of Jiangxi University of Traditional Chinese Medicine, 2006, 18(6): 73-74. |
| [16] |
童骏峰, 徐志伟, 杨元宵, 等. 腺嘌呤与氢化可的松所致大鼠肾阳虚证模型比较研究[J]. 中华中医药杂志, 2015, 30(11): 3901-3904. TONG J F, XU Z W, YANG Y X, et al. Comparative study on syndrome of deficiency of kidney Yang rat model induced by adenine and hydrocortisone[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2015, 30(11): 3901-3904. |
| [17] |
沈鸿, 汪芳, 孙建辉, 等. 人参黄精汤和西洋参地黄汤对肾阳虚模型动物的补肾壮阳作用和免疫调节功效[J]. 世界中医药, 2021, 16(15): 2306-2309, 2315. SHEN H, WANG F, SUN J H, et al. Kidney-tonifying and yang-strengthening effects and immune regulation effects of Renshen Huangjing Decoction and Xiyangshen Dihuang Decoction[J]. World Chinese Medicine, 2021, 16(15): 2306-2309, 2315. |
| [18] |
REHEMAN A, GAO Z Y, TURSUN X, et al. Optimization of extraction technology of Majun mupakhi Ela and its effect on hydrocortisone-induced kidney-yang deficiency in mice[J]. Scientific Reports, 2019, 9: 4628. |
| [19] |
张帆, 曾灵. 肾阳虚型围绝经模型大鼠构建及其下丘脑-垂体-性腺轴激素水平研究[J]. 中医临床研究, 2016, 8(7): 7-9. ZHANG F, ZENG L. Research on structuring the model of Shenyangxu type perimenopause rats and sex hormones of hypothalmus-pituitary-adrenal axis[J]. Clinical Journal of Chinese Medicine, 2016, 8(7): 7-9. |
| [20] |
黎祖荣, 郑宝玉, 王瑞国, 等. 巴戟天经不同比例甘草炮制后对腺嘌呤致肾阳虚模型大鼠肾功能和HPG轴改善作用的比较[J]. 中国实验方剂学杂志, 2022, 28(19): 128-138. LI Z R, ZHENG B Y, WANG R G, et al. Effect of morindae officinalis Radix processed with different proportions of glycyrrhizae Radix et rhizoma on improvement of renal function and HPG axis of kidney Yang deficiency model rats induced by adenine[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2022, 28(19): 128-138. |
| [21] |
CICHA I, URSCHEL K. TNF-α in the cardiovascular system: from physiology to therapy[J]. International Journal of Interferon, Cytokine and Mediator Research, 2015, 9. |
| [22] |
YAO W, CHEN Y, LI Z, et al. Single cell RNA sequencing identifies a unique inflammatory macrophage subset as a druggable target for alleviating acute kidney injury[J]. Advanced Science(Weinh), 2022, 9(12): e2103675. |
| [23] |
SATO Y, YANAGITA M. Immune cells and inflammation in AKI to CKD progression[J]. American Journal of Physiology Renal Physiology, 2018, 315(6): F1501-F1512. |
| [24] |
刘运华, 张新雪, 郑鹏飞, 等. 慢性肾脏病肾阳虚证"病证结合大鼠"模型的对比研究[J]. 世界科学技术-中医药现代化, 2021, 23(11): 3897-3906. LIU Y H, ZHANG X X, ZHENG P F, et al. Comparative study on rat models of chronic kidney disease with kidney yang deficiency syndrome "combination of disease and syndrome"[J]. Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology, 2021, 23(11): 3897-3906. |
 2022, Vol. 41
2022, Vol. 41