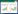文章信息
- 崔乃菠, 马境谦, 余河水, 李正, 何永志, 别松涛
- CUI Naibo, MA Jingqian, YU Heshui, LI Zheng, HE Yongzhi, BIE Songtao
- 基于刃天青微平板法检测金黄色葡萄球菌对天然产物的敏感性
- Susceptibility tests of Staphylococcus aureus to natural products using the resazurin method
- 天津中医药大学学报, 2022, 41(6): 774-779
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(6): 774-779
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.06.18
-
文章历史
收稿日期: 2022-09-09
2. 组分中药国家重点实验室, 天津 301617;
3. 中药制药工程市级实验教学示范中心, 天津 301617
2. State Key Laboratory of Component Traditional Chinese Medicine, Tianjin 301617, China;
3. Municipal Experimental Teaching Demonstration Center of Traditional Chinese Medicine Pharmaceutical Engineering, Tianjin 301617, China
金黄色葡萄球菌(Staphylococcus aureus)是革兰氏阳性菌(G+菌),在自然界中分布广泛,不仅会导致皮肤和软组织感染[1],也是导致食物中毒的常见食源性细菌[2]。研究表明,由于抗生素的不合理使用导致金黄色葡萄球菌耐药性增强[3],影响了很多疾病的有效防治,逐渐成为了全球性的公共卫生问题[4]。从植物中分离出的天然产物具有不易产生耐药性、毒副作用低、来源广泛等特点,成为了国内外学者研究的新热点[5-7]。目前,有多种方法可用于金黄色葡萄球菌的药敏性研究。传统的微量肉汤法主要依赖于孔内浑浊度判定药物的抑菌效果,所用时间较长且无法判断细菌的存活状态。其他显色方法(例如MTT法)只能根据反应终点判定药物的最低抑菌浓度(MIC),不能动态的反应细菌的生长状态。鉴于此需要一种快速、高通量、低成本、易观察的检测方法筛选抗菌药物。
刃天青(resazurin)是一种无毒的氧化还原染料,因其安全、经济等特点已被广泛用于真菌及细菌的药敏实验[8-10]。在细胞质中,刃天青可在多种还原酶的作用下由蓝色态被还原为粉色、具有强荧光的试卤灵(resorufin),见图 1,进一步反应会变成无色且无荧光的二氢试卤灵(dihydroresorufin)[11]。反应过程中,刃天青的减少与细菌数量的增加存在直接关系[12]。所以,可以通过颜色变化结合荧光法或分光光度法来判断药物的抑菌效果[13]。影响刃天青显色的因素包括培养基的种类、刃天青浓度、菌悬液浓度和反应时间等[14]。本实验目的在于优化刃天青的工作条件,基于肉眼观察和微孔板吸光度检测考察五种天然产物对金黄色葡萄球菌的MIC,求得毒力回归方程、相关系数(R2)和半抑菌浓度(IC50)。计算Z值,判定刃天青显色法对高通量筛选药物的可行性,为抗金黄色葡萄球菌药物的快速检测提供了新思路。

|
| 图 1 刃天青显色法原理 |
金黄色葡萄球菌(Staphylococcus aureus,CMCC(B)26003)购自中国食品药品检定研究所。
1.2 试剂与试药大黄酸(LOT:T06J10F92311)、盐酸小檗碱(LOT:S01A10K94340)、槲皮素(LOT:C28J11Y116820)、兰雪醌(LOT:Z30M7H12124)购自上海源叶生物有限公司;棉子酚(LOT:028M4048V)购自于SIGMA;氯霉素(批号:3251476)购自美国EMD Millipore公司;刃天青(LOT:No.415E035)、MH培养基、酵母浸出粉胨葡萄糖肉汤培养基(PDB)、胰蛋白胨大豆肉汤培养基(TSB)、磷酸盐缓冲液(PBS)购自于北京索莱宝科技有限公司;LB培养基、M63肉汤培养基购自于生工生物工程(上海)股份有限公司;二甲基亚砜(DMSO)购自于天津市风船化学试剂科技有限公司。
1.3 实验仪器智能恒温培养振荡器,天津欧诺仪器股份有限公司;生化培养箱,上海跃进医疗器械有限公司;INFINITE F50全波长酶标仪,美国TECAN公司;SB-5200DTD型数控超声波清洗机,宁波新芝生物科技股份有限公司;CP1003电子天平,奥豪斯仪器(常州)有限公司;AB135-S电子分析天平,瑞典Mettler Toledo公司;洁净工作台,苏州安泰空气技术有限公司;立式压力蒸汽灭菌器,上海云泰仪器仪表有限公司。
2 方法 2.1 菌悬液配置从金黄色葡萄球菌的固体培养基上挑取3~5个形态学相似的单菌落,置于5 mL培养基中,37 ℃、220 rpm培养18~22 h至细菌的对数生长期。
2.2 药液配置刃天青母液配置:用无菌水配置刃天青母液浓度为5 mg/mL,过0.22 μm滤膜除菌,放置于-20 ℃冰箱避光保存,使用时用培养基稀释至所需浓度。抗菌药物母液的配置:DMSO配置大黄酸母液浓度为12 800 μg/mL,兰雪醌、棉子酚、槲皮素母液浓度为51 200 μg/mL。盐酸小檗碱用PBS缓冲液(pH:7.2~7.4)配置母液浓度为3 200 μg/mL。氯霉素母液根据美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI2019)的要求配置为1 600 μg/mL。
2.3 刃天青反应条件的优化 2.3.1 刃天青浓度对显色法的影响在96孔板中加入LB培养基80 μL和20 μL的刃天青,倍半稀释刃天青的孔内终浓度为160~0.625 μg/mL,每个浓度设置3组平行;用培养基稀释菌悬液浓度为5×105 CFU/mL,加100 μL于96孔板中。设置加20 μL刃天青和180 μL空白培养基的孔作为对照。37 ℃、120 rmp恒温振荡培养12 h,每小时观察颜色变化,并用酶标仪测定其吸光度值(OD570-OD600)。
2.3.2 菌悬液浓度对刃天青显色法的影响在96孔板中加入LB培养基80 μL和20 μL孔内终浓度为20 μg/mL的刃天青,培养基稀释菌悬液浓度为5×108~5×102 CFU/mL,加100 μL于96孔板中,每个浓度设置3组平行。对照设置和培养条件如2.3.1。
2.3.3 不同培养基对刃天青显色法的影响在96孔板中加入不同的培养基(LB、MH、TSB、M63、PDB)80 μL,孔内终浓度为20 μg/mL的刃天青20 μL和浓度为5×105 CFU/mL的菌悬液100 μL。每种培养基平行实验3次。对照设置和培养条件如2.3.1。
2.3.4 确定刃天青反应时间96孔板中加入LB培养基80 μL,孔内终浓度为20 μg/mL的刃天青20 μL和浓度为5×105 CFU/mL的菌悬液100 μL。对照设置和培养条件如2.3.1。刃天青颜色从氧化状态的蓝色变为还原状态的粉色则说明细菌生长。
2.4 天然产物抑菌活性的测定刃天青法:根据筛选出的刃天青工作的最优氧化还原条件,利用刃天青显色法进行药敏实验。加入80 μL不同浓度的含药培养基于96孔板的1-10列,(大黄酸和兰雪醌的孔内终浓度为128~0.25 μg/mL;棉子酚和槲皮素的孔内终浓度为1 024~2 μg/mL;盐酸小檗碱的孔内终浓度为128~0.25 μg/mL),选用氯霉素作为抗生素对照(孔内终浓度为32~0.0625 μg/mL)。调节菌悬液浓度为0.5麦氏浊度(1×108 CFU/mL)[15],用培养基1∶200稀释菌液浓度为5×105 CFU/mL,刃天青浓度为200 μg/mL,加100 μL菌液和20 μL刃天青于96孔板中。11列加100 μL菌悬液、20 μL刃天青和80 μL空白培养基作为阴性对照,12列加180 μL培养基和20 μL刃天青作为阳性对照,放置于37 ℃恒温培养箱中,120 rpm培养9 h,通过测定吸光度和观察颜色变化来判定药物的抑菌效果。用以下公式计算抑菌率[16]。

|
微量肉汤法:96孔板的1-10列分别加入100 μL不同浓度药液和浓度为5×105 CFU/mL的菌悬液,药液的孔内终浓度同刃天青法,11列加100 μL的空白培养基和菌悬液作为阳性对照,12列加200 μL的空白培养基作为阴性对照。并计算其抑菌率。
2.5 数据处理用Origin 2019b软件进行绘图,得到刃天青反应最优条件。根据几率值表将药物抑菌率转化得到的几率值作为纵坐标(y),药物浓度的对数值为横坐标(x),得到五种药物在两种检测方法下的毒力回归方程、R2和IC50。并通过下列公式计算Z因子[17],分析刃天青在高通量实验中的可行性。

|
其中,SD-,SD+分别表示阴性对照组和阳性对照组的标准偏差;Ave-,Ave+分别表示阴性对照组和阳性对照组的平均值。
3 结果与分析 3.1 刃天青反应条件的优化 3.1.1 刃天青浓度的影响实验数据显示,刃天青浓度范围在2.5~40 μg/mL时,刃天青浓度与吸光度值之间的线性关系良好(图 2),其线性关系为y=0.036 7x+0.003 2,R2=0.998 9。反应过程中,当刃天青浓度小于5 μg/mL时,吸光值较低,颜色变化不明显,不利于观察,即使在线性范围内,也不适合作为下一步的反应条件;刃天青浓度大于40 μg/mL时,吸光值增加速率变慢;大于80 μg/mL时,吸光值开始下降,可能是因为刃天青浓度过高会抑制细菌体内还原酶的活性[18]。本研究选择刃天青的孔内反应浓度为20 μg/mL进行下一步实验。

|
| 图 2 刃天青浓度对吸光值的影响 |
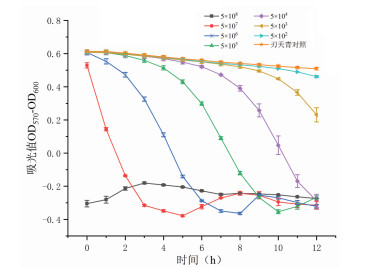
在反应时间12 h内,20 μg/mL的刃天青浓度下,菌悬液浓度为5×104 CFU/mL~5×107 CFU/mL时,刃天青的颜色变化明显,初始态和终止态的吸光度值相差较大(图 3),适用于刃天青显色法的检测。若菌浓过高,刃天青变色所需时间过短,可能药物还未与细菌作用,刃天青就已被还原,降低检测方法的敏感性[19];若菌浓过低,实验孔颜色和吸光度值都与刃天青对照组无明显差异,不适用于刃天青显色。故选用菌悬液浓度为5×105 CFU/mL进行药物敏感性实验,该浓度刃天青显色明显,便于观察。
|
| 图 3 菌悬液浓度对吸光值的影响 |
图 4为LB、MH、TSB、YPD、M63五种培养基在刃天青浓度为20 μg/mL,菌悬液浓度为5×105 CFU/mL的条件下,吸光值随时间的变化曲线。数据表明,LB、MH、TSB 3种培养基的吸光值变化较大,颜色变化明显,易用肉眼观察,适用于刃天青显色法检测。M63培养基在加入刃天青后立即变为浅粉色,YPD培养基颜色变化也不明显。这可能与培养基灭菌后酸化有关[21]。培养基酸化后将刃天青转化为淡粉色物质。本实验选用LB培养基进行下一步操作。

|
| 图 4 培养基类型对吸光值的影响 |
刃天青显色依赖于细菌体内还原酶将蓝色的氧化态还原为粉色的还原态,但是若进一步反应,则会变为无色。所以选用刃天青浓度为20 μg/mL,菌悬液浓度为5×105 CFU/mL时,孔内颜色完全变为粉色的时间点作为反应时间。选用9 h为药敏实验的反应时间,该时间点的目测结果与数据显示(图 5)结果一致。

|
| 图 5 刃天青反应时间的确定 |
采用上述刃天青显色法所确定的最优条件,以氯霉素为抗生素对照,测定大黄酸、盐酸小檗碱、兰雪醌、槲皮素、棉子酚对金黄色葡萄球菌的抑制作用。肉眼观察得到五种药物的MIC(以盐酸小檗碱为例,图 6),求得毒力回归方程、R2和IC50(表 1)。结果表明刃天青显色法观察得到5种天然产物的MIC与微量肉汤法得到的结果一致。大黄酸、兰雪醌、棉子酚、槲皮素、盐酸小檗碱、氯霉素的MIC分别为8、4、1 024、256、64和2 μg/mL。其中,大黄酸和兰雪醌的抑菌活性突出,几乎可以达到抗生素水平。刃天青显色法所得的R2略高于或与微量肉汤法得到的R2相差不大,两种方法所求得的IC50也较为接近,说明刃天青显色法的灵敏性和准确性较好,适用于天然产物抑菌活性的判定。Z因子是评判高通量筛选方法稳定性和可行性的标准,用来评价细菌在96孔板中的生长是否具有一致性。若Z < 0,则说明该方法无法区分阴性对照和阳性对照,不适合高通量筛选;若0≤Z < 0.5,说明该方法处于临界状态;若0.5≤Z < 1,则说明该方法稳健性和灵敏性好,适用于高通量筛选药物[16]。两种方法的Z因子范围均在0.5~1之间,且刃天青检测法略高于微量肉汤法,说明刃天青显色法稳健性和灵敏性良好,适用于高通量筛选抗金黄色葡萄球菌的药物。

|
| 注:a为0 h时,孔内均为蓝色;b为反应9 h后,当盐酸小檗碱孔内浓度小于64 μg/mL,刃天青被还原为粉色或粉紫色。第11列为不加药对照组,第12列只加刃天青和培养基。 图 6 刃天青在盐酸小檗碱药敏性实验中的颜色变化 |
本实验发现,刃天青在一定浓度范围内(2.5~40 μg/mL),吸光值变化与其呈正相关关系,显色灵敏。这与唐静等[12]的实验结果相一致。当刃天青浓度过低时(≤5 μg/mL),颜色变化不明显;当刃天青浓度过高时(≥40 μg/mL),两者之间的线性关系不好,原因可能是刃天青浓度过高会抑制细菌体内还原酶的活性[19],还原得到试卤灵的效率变低。所以,刃天青浓度范围应在10~40 μg/mL之间。在考察菌悬液浓度对吸光值的影响时,浓度为5×104 CFU/mL~5×107 CFU/mL的菌悬液对刃天青显色反应灵敏。若接种物浓度过高,会使刃天青显色过快,降低实验灵敏性;若接种物浓度过低,细菌体内的还原酶不足以将所有刃天青还原,显色前后变化都不明显。培养基结果表明,用LB、MH、TSB培养的菌悬液的吸光值随着时间变化明显,颜色变化易于观察,适用于刃天青显色法检测。但M63、YPD培养的菌悬液在加入刃天青后就开始变色,原因是刃天青不仅是检验氧化还原反应的指标,也是酸碱指示剂。M63和YPD培养基在灭菌后酸化,将刃天青还原为无色化合物。所以,在基于刃天青显色的微量滴定法,培养基不仅需要提供足够的营养以确保细菌的生长,还应考虑培养基对刃天青显色的影响,避免使用产生低pH的培养基。本次实验选择拐点9 h作为药敏实验的反应时间,该时间点孔内刃天青由蓝色的氧化态变为粉色的还原态,且没有进一步被还原为无色。常用的微量肉汤法对反应时间并没有明确的规定,12、18、24 h均有被选用为反应终点时间。终点时间选定的不同可能会引起测定结果出现偏差,反应时间过长可能会导致药物活性降低从而造成测得的MIC偏高;反应时间过短,可能会导致药物未与细菌完全作用而致使测得的MIC偏低。相较于微量肉汤法,刃天青显色法选用孔内颜色变化的时间点作为终止反应时间,不仅所用时间缩短而且结果较为准确。
刃天青显色法的药敏实验结果表明,大黄酸、棉子酚、槲皮素、兰雪醌、盐酸小檗碱五种天然产物对金黄色葡萄球菌均具有一定的抑制作用。其中,大黄酸和兰雪醌的抑菌活性几乎与抗生素达到同一水平。刃天青法测得的MIC与微量肉汤法所得到的结果相同。参考袁高庆等[19]的方法求得毒力回归方程,其R2略高于或与微量肉汤法相近,两种方法求得的IC50相差不大。刃天青显色法的Z值为0.91,在0.5~1之间,适用于高通量的药敏实验。
本研究显示,以刃天青为检测试剂,在96孔板中进行金黄色葡萄球菌的药敏实验,更容易确定反应时间且反应时间较短,灵敏性和准确度高,不影响细胞的正常代谢[12],易于通过颜色变化动态检测细菌的代谢活性,从而判断药物的抑菌效果,为高通量筛选抗菌药物提供了新思路。
| [1] |
PERIASAMY H, ISWARYA S, PAVITHRA N, et al. In vitro antibacterial activity of plumbagin isolated from Plumbago zeylanica L. against methicillin-resistant Staphylococcus aureus[J]. Letters in Applied Microbiology, 2019, 69(1): 41-49. |
| [2] |
刘保光, 谢苗, 董颖, 等. 金黄色葡萄球菌研究现状[J]. 动物医学进展, 2021, 42(4): 128-130. LIU B G, XIE M, DONG Y, et al. Research status of Staphylococcus aureus[J]. Progress in Veterinary Medicine, 2021, 42(4): 128-130. DOI:10.3969/j.issn.1007-5038.2021.04.026 |
| [3] |
WU Q X, SABOKROO N, WANG Y J, et al. Systematic review and meta-analysis of the epidemiology of vancomycinresistance Staphylococcus aureus isolates[J]. Antimicrobial Resistance and Infection Control, 2021, 10(1): 101. DOI:10.1186/s13756-021-00967-y |
| [4] |
YANG W, LIU J, BLAŽEKOVIĆ B, et al. In vitro antibacterial effects of Tanreqing injection combined with vancomycin or linezolid against methicillin-resistant Staphylococcus aureus[J]. BMC Complementary and Alternative Medicine, 2018, 18(1): 169. DOI:10.1186/s12906-018-2231-8 |
| [5] |
杨文淇, 赵增祥, 徐耀, 等. 中药活性成分抑制多重耐药菌的研究进展[J]. 中国病原生物学杂志, 2021, 16(6): 734-737. YANG W Q, ZHAO Z X, XU Y, et al. Advances in the use of constituents of traditional Chinese medicines to inhibit multidrug-resistant bacteria[J]. Journal of Pathogen Biology, 2021, 16(6): 734-737. |
| [6] |
杨扬, 周鹏程, 胡润华, 等. 中药抗耐甲氧西林金黄色葡萄球菌体外实验研究进展[J]. 湖南中医杂志, 2021, 37(1): 173-176. YANG Y, ZHOU P C, HU R H, et al. Research progress of traditional Chinese medicine against methicillin-resistant Staphylococcus aureus in vitro[J]. Hunan Journal of Traditional Chinese Medicine, 2021, 37(1): 173-176. |
| [7] |
GUPTA V K, KUMAR M M, BISHT D, et al. Plants in our combating strategies against Mycobacterium tuberculosis: progress made and obstacles met[J]. Pharmaceutical Biology, 2017, 55(1): 1536-1544. DOI:10.1080/13880209.2017.1309440 |
| [8] |
JAFARI A, TAZIKI M, ASKI H, et al. Evaluation of the accuracy of the microplate alamar blue assay and the proportion method for the prompt detection of Mycobacterium tuberculosis and susceptibility of multidrug-resistant Mycobacterium tuberculosis clinical isolates[J]. International Journal of Mycobacteriology, 2021, 9(5): 67. DOI:10.4103/2212-5531.307119 |
| [9] |
马小华, 向延根, 刘栋宾, 等. 刃天青法检测青蒿琥酯对耐药结核分枝杆菌药物敏感性初步研究[J]. 标记免疫分析与临床, 2018, 25(1): 120-125, 129. MA X H, XIANG Y G, LIU D B, et al. Preliminary study on the effect of artesunate to drug-resistantce mycobacterium tuberculosis detected by resazurin method[J]. Labeled ImmunoassaysandClinicalMedicine, 2018, 25(1): 120-125, 129. |
| [10] |
NIU R M, LIU Y F, XIE X R, et al. Resazurin reduction assays for screening the synergistic antibacterial effects of flavonoids[J]. Toxicon, 2019, 158(13): S81-S82. |
| [11] |
CHOI J, BAEK J, KWEON D, et al. Rapid determination of carbapenem resistance by low-cost colorimetric methods: propidium iodide and alamar blue staining[J]. Journal of Microbiology (Seoul, Korea), 2020, 58(5): 415-421. |
| [12] |
BARUA P, YOU M P, BAYLISS K, et al. A rapid and miniaturized system using alamar blue to assess fungal spore viability: implications for biosecurity[J]. European Journal of Plant Pathology, 2017, 148(1): 139-150. |
| [13] |
GÜNTHER F, SCHERRER M, KAISER S J, et al. Comparative testing of disinfectant efficacy on planktonic bacteria and bacterial biofilms using a new assay based on kinetic analysis of metabolic activity[J]. Journal of Applied Microbiology, 2017, 122(3): 625-633. |
| [14] |
符雨诗, 梅秀凤, 韩国兴, 等. 基于刃天青微平板法测定交链格孢菌橘致病型对戊唑醇和苯醚甲环唑的敏感性[J]. 农药学学报, 2017, 19(5): 543-549. FU Y S, MEI X F, HAN G X, et al. Sensitivity assay of alternaria alternata tangerine pathotype from China to tebuconazole and difenoconazole using resazurin-based microtiter[J]. Chinese Journal of Pesticide Science, 2017, 19(5): 543-549. |
| [15] |
WIEGAND I, HILPERT K, HANCOCK R E W. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances[J]. Nature Protocols, 2008, 3(2): 163-175. |
| [16] |
QUAVE C L, PLANO L R W, BENNETT B C. Quorum sensing inhibitors of Staphylococcus aureus from Italian medicinal plants[J]. Planta Medica, 2011, 77(2): 188-195. |
| [17] |
LAFLEUR M D, LUCUMI E, NAPPER A D, et al. Novel high-throughput screen against Candida albicans identifies antifungal potentiators and agents effective against biofilms[J]. Journal of Antimicrobial Chemotherapy, 2011, 66(4): 820-826. |
| [18] |
唐静, 谈满良, 赵江林, 等. 多孔板-MTT比色法测定植物抗菌成分对细菌的抑制活性[J]. 天然产物研究与开发, 2008, 20(6): 949-952. TANG J, TAN M L, ZHAO J L, et al. Detection of plant antibacterial components by using microplate-MTT colorimetric assay[J]. Natural Product Research and Development, 2008, 20(6): 949-952. |
| [19] |
袁高庆, 黎起秦, 秦健, 等. 噻唑蓝法和刃天青法检测植物成分对两种病原细菌的抑菌活性[J]. 植物保护学报, 2011, 38(4): 306-312. YUAN G Q, LI Q Q, QIN J, et al. Methythiazol tetrazolium and resazurin assays for detectionof antibacterialactivities of plant constituents against two bacterial pathogens[J]. Journal of Plant Protection, 2011, 38(4): 306-312. |
 2022, Vol. 41
2022, Vol. 41