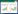文章信息
- 卫倩鹤, 王齐, 曹瑞, 王丽芝, 王海英
- WEI Qianhe, WANG Qi, CAO Rui, WANG Lizhi, WANG Haiying
- 紫芝倍半萜合酶GsSTPS2可溶性表达条件的探索
- Study on soluble expression conditions of sesquiterpene synthase GsSTPS2 from Ganoderma sinense
- 天津中医药大学学报, 2022, 41(6): 780-788
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(6): 780-788
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.06.19
-
文章历史
收稿日期: 2022-09-01
中药灵芝为多孔菌科真菌赤芝Ganoderma lucidum(Leyss. ex Fr.)Karst.或紫芝Ganoderma sinense Zhao,Xu et Zhang的干燥子实体,性平,味甘;归心、肺、肝、肾经,具有补气安神,止咳平喘等功效,在中国具有2000多年的药用历史[1-2]。灵芝中除含有三萜、多糖、甾醇、核苷类等化学成分外,还含有丰富的倍半萜类化合物[3]。倍半萜是一类由3个异戊二烯单元组成的化合物,由倍半萜合酶以法尼基焦磷酸(FPP)为底物催化生成[4]。真菌中的一些倍半萜类化合物具有抗肿瘤、抗菌、抗虫、植物生长调节、免疫调节等生物活性[5-6],研究真菌的倍半萜合酶对于开发其倍半萜化合物具有重要意义。灵芝作为中国著名的药用真菌之一,陈士林等已对其进行了基因组测序和注释[7-8]。这为灵芝倍半萜合酶家族的功能研究提供了基础。目前关于灵芝倍半萜合酶家族的功能验证实验还比较少[9-12],因此进一步挖掘新的紫芝倍半萜合酶基因并进行功能验证实验,对研究紫芝体内倍半萜生物合成途径,开发紫芝体内新的活性倍半萜产物具有重要意义。前期研究发现紫芝倍半萜合酶GsSTPS2可催化生成异香叶醇,该化合物具有杀白蚁、抗蠕虫和植物生长调节作用,有良好的应用价值和前景。但同时发现GsSTPS2的可溶性较差,分离纯化较为困难,这有碍于该酶的进一步开发应用。因此,本研究筛选了不同表达载体及表达菌株,并对其菌体密度、表达温度、时间及IPTG诱导浓度进行了优化,以期获得重组紫芝倍半萜合酶GsSTPS2蛋白可溶性表达的最佳条件,为灵芝倍半萜高效酶的开发提供依据。
1 材料与方法 1.1 实验材料 1.1.1 菌种和质粒紫芝菌种5.69购自中国普通微生物菌种保藏管理中心(CGMCC)。DH5α感受态细胞和Rosetta(DE3)感受态细胞购自天根公司。pGEM-T Easy载体购自普洛麦格公司,pET28a和pET32a空载体由本实验室保存。
1.1.2 试剂百泰克公司的通用植物总RNA提取试剂盒(离心柱型);宝日医公司的PrimeScriptTM cDNA第一链合成试剂盒、Pyrobest DNA聚合酶、DNA A-Tailing试剂盒、T4 DNA连接酶、Hind Ⅲ限制性内切酶、BamH Ⅰ限制性内切酶;凯杰公司的QIAquick PCR纯化试剂盒;天根公司的Taq聚合酶预混液、质粒小提试剂盒(离心柱型);凯基生物公司的5×SDS-PAGE蛋白上样缓冲液;索莱宝公司的氨苄青霉素、氯霉素、卡那霉素、IPTG溶液(50 mg/mL);默克公司的DVB/CAR/PDMS复合萃取头(50/30 μm);哲斯泰公司的20 mL顶空瓶。
1.2 方法 1.2.1 紫芝倍半萜合酶GsSTPS2的生信分析使用Basic Local Alignment Search Tool在线网站(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对GsSTPS2进行Protein BLAST分析。使用NCBI Conserved Domain Search在线网站(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行GsSTPS2的蛋白质保守结构域分析。使用Euk-mPLoc 2.0在线工具(http://www.csbio.sjtu.edu.cn/bioinf/euk-multi-2/)对GsSTPS2进行亚细胞定位预测。使用SignalP 4.0 Server在线工具(http://www.cbs.dtu.dk/services/SignalP-4.0/)对GsSTPS2进行信号肽预测。使用TMHMM Server v. 2.0在线工具(http://www.cbs.dtu.dk/services/TMHMM/)对GsSTPS2进行跨膜结构域的预测。使用SOPMA在线工具(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)对GsSTPS2的蛋白二级结构进行预测分析。使用I-TASSER在线工具(https://zhanglab.ccmb.med.umich.edu/I-TASSER/)对GsSTPS2的蛋白三级结构进行预测分析。使用MEGA-X软件构建系统发育树。
1.2.2 紫芝倍半萜合酶GsSTPS2的克隆与重组克隆质粒的构建本实验基于紫芝基因组(GCA_002760635.1)的注释结果获得紫芝倍半萜合酶GsSTPS2的cDNA序列。活化紫芝菌种后,将其接种于PDA液体培养基中于25 ℃条件下暗培养7~10 d,而后收集紫芝菌丝提取总RNA并反转录成cDNA。使用引物对GsSTPS2_F(5’-CCGGATCCATGTCGGATAACTCGGAGAACAT-3’)和GsSTPS2_R(5’-GGAAGCTTAACCTGCTCAAGTTCCTCGATC-3’)通过PCR技术以紫芝菌丝体cDNA为模板扩增GsSTPS2的全长。PCR程序为94 ℃预变性3 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,共30个循环,72 ℃延伸5 min。扩增产物经琼脂糖凝胶电泳回收目的条带后,对目的基因末端进行加A操作,接着将其连接在pGEM-T Easy载体上并转入大肠杆菌DH5α细胞中,通过菌落PCR筛选阳性转化子进行sanger测序,最终获得含有正确目的基因序列的重组质粒。
1.2.3 重组大肠杆菌表达载体pET28a-GsSTPS2的构建及其在大肠杆菌BL21(DE3)中的异源表达使用限制性内切酶HindIII和BamHI对重组克隆质粒和pET28a空质粒进行双酶切操作。经胶回收操作后,将GsSTPS2基因片段连接到pET28a载体片段上。将重组表达质粒转入DH5α细胞中,通过菌落PCR法挑取阳性转化子并测序,提取正确的重组大肠杆菌表达质粒pET28a-GsSTPS2。分别将重组表达质粒pET28a-GsSTPS2和pET28a空质粒转入大肠杆菌BL21(DE3)感受态细胞中,于37 ℃条件下培养12~16 h。挑取阳性转化子于LB液体培养基(含25 mg/L的卡那霉素)中过夜振荡培养,取200 μL菌液转接至10 mL新鲜LB培养基中继续培养,当菌液的OD600为0.5左右时,向其中加入IPTG溶液使其终浓度为0.5 mmol/L,在37 ℃,220 rpm条件下培养4 h。取2 mL诱导培养完成的菌液进行离心操作并收集菌体,加入稀释好的1×SDS-PAGE蛋白上样缓冲液于沸水浴中煮沸10 min,最后通过SDS-PAGE电泳检测目的蛋白的表达情况。
1.2.4 重组大肠杆菌表达载体pET32a-GsSTPS2的构建及其在大肠杆菌Rosetta(DE3)中的异源表达通过双酶切操作将GsSTPS2片段从pET28a载体上更换至pET32a载体上,而后转入大肠杆菌Rosetta(DE3)感受态细胞中,于37 ℃条件下培养12~16 h。挑取阳性转化子于LB液体培养基(含50 mg/L的氨苄青霉素和30 mg/L的氯霉素)中过夜振荡培养,而后吸取200 μL菌液至10 mL新鲜的含抗性的LB培养基中继续培养至OD600为0.5左右,向其中加入终浓度为0.5 mmol/L的IPTG溶液,在37 ℃,220 rpm条件下诱导培养4 h。经蛋白处理操作后,使用SDS-PAGE电泳检测目的蛋白的表达情况。
1.2.5 重组蛋白表达条件的优化菌体密度OD600对GsSTPS2表达的影响。将含重组质粒pET32a-GsSTPS2的大肠杆菌Rosetta(DE3)接种在含抗性的LB液体培养基中过夜培养,而后以2%的接种量转接至新鲜培养基,在37 ℃,220 rpm的条件下继续培养至OD600分别为0.5,0.8和1.0,此时加入终浓度为0.5 mmol/L的IPTG,在30 ℃,220 rpm的条件下诱导培养4 h。
诱导温度对GsSTPS2表达的影响。细菌培养方法同上,当OD600为0.8时,加入终浓度为0.5 mmol/L的IPTG,分别在37 ℃,30 ℃,25 ℃,18 ℃,220 rpm的条件下诱导培养4 h。
诱导时间对GsSTPS2表达的影响。细菌培养方法同上,当OD600为0.8时,加入终浓度为0.5 mmol/L的IPTG,分别在18 ℃,220 rpm的条件下诱导培养0 h,2 h,4 h,6 h,8 h,12 h,16 h,20 h,24 h。
IPTG终浓度对GsSTPS2表达的影响。细菌培养方法同上,当OD600达到0.8时,分别加入不同体积的IPTG溶液使其终浓度为0、0.1、0.3、0.5、0.7、1.0、2.0 mmol/L,在18 ℃,220 rpm的条件下诱导培养12 h。
对上述不同培养条件下获得的产物依次进行超声破碎,离心,煮沸等操作,分别上样上清和沉淀样品进行SDS-PAGE电泳,而后使用Image Lab 5.2.1软件对获得的PAGE胶图进行分析和相对定量,确定最适OD600、最适诱导温度、最适诱导时间和最适IPTG终浓度。
1.2.6 HS-SPME-GC-MS分析挑选3个阳性转化子按照1.2.5优化出的最适条件进行诱导培养,取诱导培养完成的菌液于4 ℃,5 000 rpm的条件下离心20 min,吸取10 mL上清培养液至20 mL顶空样品瓶中,此即为重组大肠杆菌代谢物的HS-SPME-GC-MS分析样品。采用DVB/CAR/PDMS固相微萃取萃取头(50/30 μm,Supelco)萃取挥发性成分,然后由MPS-7890B-7000D(配置有多功能采样器MPS的GC-MS分析系统)完成分析。MPS自动萃取程序为50 ℃静置孵育20 min,萃取15 min,250 ℃脱附5 min,萃取头在萃取前和脱附后分别老化3 min,用于消除不同样品间的交叉污染。色谱条件:毛细管柱为HP-5ms 30 m×250 μm×0.25 μm。氦气流速为1 mL/min。升温程序为60 ℃保持2 min,然后以6 ℃/min升至250 ℃,最后在250 ℃保持3 min。在获得质谱数据之前,溶剂延迟2 min。质谱条件:电离源为EI,MSD为70 ev,离子源温度为230 ℃,挥发性化合物的扫描范围为30~500 μm/z。
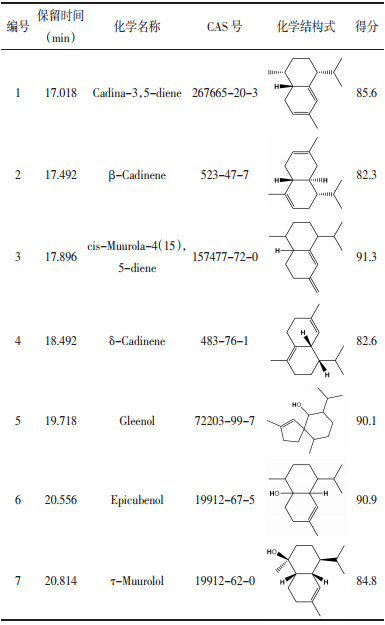
2 结果与分析 2.1 紫芝倍半萜合酶GsSTPS2的生信分析基于紫芝基因组和转录组注释信息,筛选出紫芝倍半萜合酶GsSTPS2(GenBank登录号:MT584777.1),其开放阅读框为1 071 bp,编码356个氨基酸,计算分子量为40.47 kD,等电点为4.85。信号肽和跨膜结构域预测结果显示,GsSTPS2没有信号肽和跨膜结构域(图 1A,B)。亚细胞预测结果显示,GsSTPS2定位于细胞质中。保守域预测结果显示,GsSTPS2和Terpene_cyclase_nonplant_C1相似,且含有1个Isoprenoid-Biosyn-C1 superfamily的保守区,表明GsSTPS2具备倍半萜合酶的基本特征和功能(图 1C)。二级结构预测结果显示,GsSTPS2的二级结构组成为α螺旋占58.71%,β转角占2.53%,延伸链占6.74%,无规卷曲占32.02%(图 1D)。GsSTPS2的三级结构预测结果如图 1E所示,该模型具有良好的质量(C-score值为0.03),其结构与4okmA(蛇床二烯合酶)的结构相似度最高。
|
| 注:A.信号肽预测;B.跨膜结构域预测;C.保守域预测;D.二级结构预测;E.三级结构预测。 图 1 GsSTPS2的生物信息学分析 |
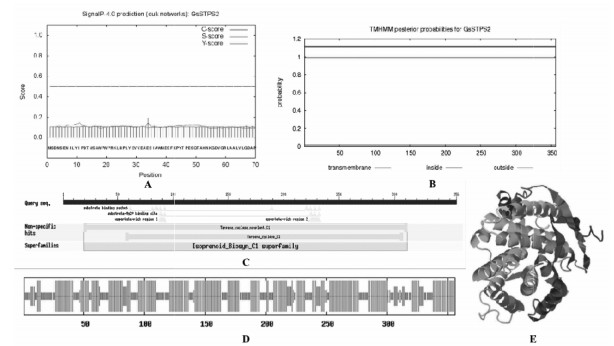
如图 2A所示,PCR扩增获得大小在1 000 bp左右的条带,这与GsSTPS2的cDNA序列大小一致。对测序正确的阳性转化子进行提质粒操作,如图 2B所示,提取的质粒大小均在5 000 bp以上,与目的重组克隆质粒pGEM-T Easy-GsSTPS2大小一致。
|
| 注:A:GsSTPS2的基因扩增;B:重组克隆质粒pGEM-T Easy-GsSTPS2的琼脂糖凝胶电泳图。 图 2 GsSTPS2基因的克隆和克隆载体的构建 |
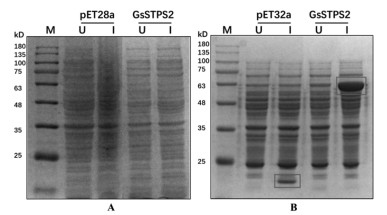
如图 3A所示,以pET28a空载体作为阴性对照,GsSTPS2在35-48kD间无明显蛋白条带,表明目的蛋白在BL21(DE3)中没有表达或表达量很低。如图 3B所示,以pET32a空质粒为阴性对照,GsSTPS2在Rosetta(DE3)中有明显蛋白表达。GsSTPS2的蛋白分子量约为40 kD,Trx蛋白和His蛋白的分子量约为23 kD,GsSTPS2-His-Trx融合蛋白分子量在63 kD左右,符合预期大小。
|
| 注:A. pET28a-GsSTPS2在BL21(DE3)中的异源表达;B. pET32a-GsSTPS2在Rosetta(DE3)中的异源表达;其中U代表未诱导的全菌溶液,I代表诱导后的全菌溶液,pET28a空载体和pET32a空载体均为阴性对照。 图 3 GsSTPS2的SDS-PAGE电泳图 |
外源基因在大肠杆菌中的表达受多种因素的影响,通过优化诱导表达条件可提高其可溶性表达量。本实验采用单因素法分析诱导表达条件,依次从菌体密度、诱导温度、诱导时间、IPTG终浓度这4个方面进行GsSTPS2表达条件的优化。
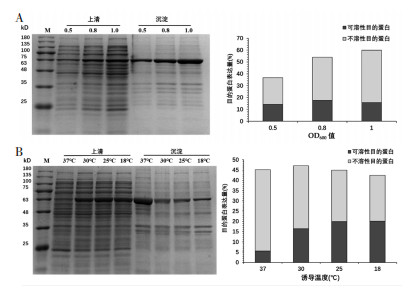
2.4.1 菌体密度OD600对GsSTPS2表达的影响如图 4A所示,GsSTPS2的总蛋白表达量随着OD600的增加而持续增加,当OD600为1.0时达到最大。GsSTPS2的可溶性蛋白表达量随OD600的增加呈现出“先增加后减少”的趋势,当OD600为0.8时可溶性表达量达到最大,占上清总蛋白的17.62%。
|
| 图 4 菌体密度OD600和诱导温度对GsSTPS2表达的影响 |
如图 4B所示,GsSTPS2的总蛋白表达量随温度降低呈现“先增加后减少”的趋势,当温度为30 ℃总蛋白表达量最大。GsSTPS2的可溶性蛋白表达量随温度降低而逐渐增加,当温度为18 ℃时可溶性表达量达到最大,占上清总蛋白的20.08%。
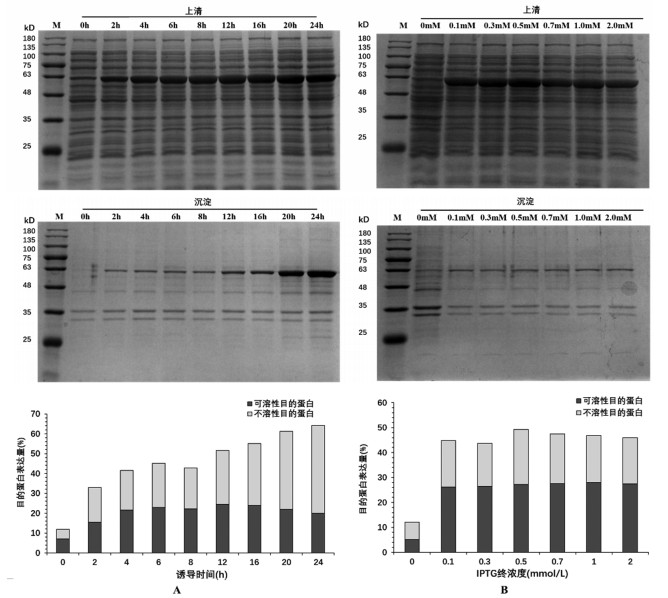
2.4.3 诱导时间对GsSTPS2表达的影响如图 5A所示,随培养时间的延长,总蛋白表达量呈现“先增加后减少再增加”的趋势,在培养时间为24 h时表达量最高;可溶性蛋白的表达量呈现“先增加后减少再增加再减少”的趋势,在12 h可溶性表达量最高,占上清总蛋白的24.48%。
|
| 图 5 诱导时间和和IPTG终浓度对GsSTPS2表达的影响 |
如图 5B所示,随IPTG终浓度的增高,GsSTPS2总蛋白表达量呈现“先增加再减少再增加再减少”的趋势,当IPTG终浓度为0.5 mmol/L时总蛋白表达量最高。当IPTG终浓度为1.0 mmol/L时GsSTPS2的可溶性蛋白表达量最高,占上清总蛋白的28.07%。此外,不含有IPTG的大肠杆菌内源性蛋白表达量比含有IPTG的大肠杆菌内源性表达量高,表明添加IPTG不仅可以启动目的蛋白表达,还可以抑制内源性蛋白的表达。
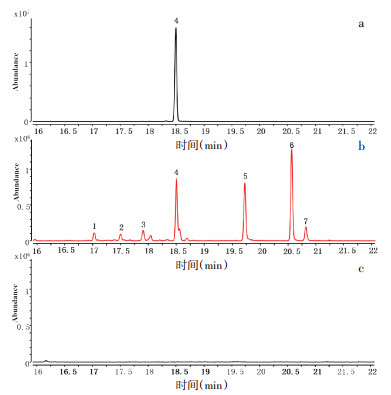
2.5 GsSTPS2在大肠杆菌体内的催化产物鉴定通过比对实验获得的挥发性产物的质谱数据和NIST MS Search 2.3(2017版)中标准化合物的质谱数据来分析鉴定GsSTPS2在大肠杆菌体内的催化产物,其中化合物4通过与δ-杜松烯标准品比对进行进一步的鉴定。如表 1和图 6所示,以pET32a空质粒为阴性对照,对GsSTPS2重组大肠杆菌代谢产物进行分析,检测到4个分子量为204 m/z的倍半萜碳氢化合物和3个分子量为222 m/z的倍半萜含氧衍生物,其中化合物4(δ-杜松烯)、化合物5(异香叶醇)和化合物6(荜澄茄油烯醇)的响应值较高,化合物1(杜松-3,5-二烯)、化合物2(β-杜松烯)、化合物3(顺-衣兰油-4(15),5-二烯)和化合物7(τ-依兰油醇)的响应值较低。
|
| 注:a. δ-杜松烯标准品;b. GsSTPS2;c. pET32a空载体(阴性对照)。 图 6 GsSTPS2催化产物的HS-SPME-GC-MS分析 |
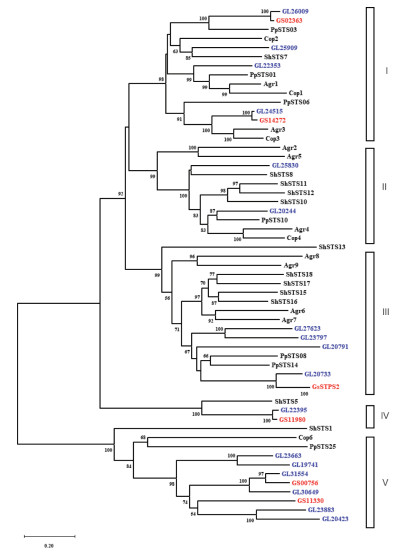
SWISS-PROT数据库收录的是EMBL核酸序列数据库中经过注释和校对的蛋白质序列[13],将GsSTPS2与SWISS-PROT数据库的蛋白质序列进行BLAST分析,发现GsSTPS2与来自毛韧革菌(Stereumhirsutum)、灰盖鬼伞(Coprinus cinereus)、茶树菇(Agrocybeaegerita)、褐腐菌(Postia placenta)这4个担子菌的倍半萜合酶相似度较高。将GsSTPS2的氨基酸序列与来自上述4个担子菌的倍半萜合酶及已功能验证过的17个赤芝倍半萜合酶和其他5个紫芝倍半萜合酶进行系统发育分析发现,所有的倍半萜合酶序列聚类为5支(图 7),Grayson T. Wawrzyn等人基于真菌倍半萜合酶氨基酸序列建立的系统发育树同样聚为5支[14]。在这6个担子菌中,紫芝的倍半萜合酶与赤芝的倍半萜合酶亲缘关系最近。17个赤芝倍半萜合酶在5个分支中均有分布,目前已功能验证的5个紫芝倍半萜合酶分布在进化枝Ⅰ、Ⅳ、Ⅴ中,GsSTPS2聚类在第Ⅲ支,且与GL20733的亲缘关系最近。此外,GsSTPS2的产物与GL20733的产物也具有相似的化学结构[9],其中荜澄茄油烯醇与库贝醇互为立体异构体,τ-依兰油醇与α-毕橙茄醇、α-衣兰油醇和τ-毕橙茄醇互为立体异构体,这表明了基于氨基酸序列的系统发育分析在预测酶促反应机制和终产物结构方面的潜力。
|
| 注:赤芝倍半萜合酶使用蓝色字体标注,紫芝倍半萜合酶使用红色字体标注。 图 7 GsSTPS2与其他功能性担子菌倍半萜合酶的系统发育分析 |
兰艳平等人将棉花去泛素化酶基因GhOTUD5构建在pET-22b载体上并转入大肠杆菌细胞中,发现目的基因在BL21(DE3)中不表达,在Transetta(DE3)菌株中成功表达[15]。本研究首先将GsSTPS2基因连接到了常用的pET28a载体上并转入BL21(DE3)细胞中,发现没有目的蛋白表达。接着将目的基因更换至pET32a载体上并转入Rosetta(DE3)中,实现了异源表达。这些结果均表明基因在大肠杆菌中的异源表达与载体和菌株密切相关。在实验初期,根据基因特性选择合适的菌株和载体,并考虑菌株和载体的适配性,将促进外源基因在大肠杆菌中的成功表达。如pET32a载体含有Trx基因,可以促进靶蛋白的可溶性表达;Rosetta(DE3)株含有稀有密码子,能够提高真核基因在大肠杆菌中的表达水平。
3.2 优化诱导条件可促进目的蛋白的可溶性表达真核基因在原核表达系统中表达水平的高低与除了与原核表达质粒、宿主菌的类型有关外,还与诱导目的蛋白表达的条件等有关[16]。为了提高GsSTPS2的可溶性蛋白的表达量,我们采用不同菌体密度、诱导温度、诱导时间及IPTG终浓度对重组蛋白进行了培养,对比分析获得了GsSTPS2的最佳诱导条件:初始菌液OD600为0.8,诱导温度为18 ℃,诱导时间为12 h,IPTG终浓度为1 mmol/L,并采用最优条件进行重组大肠杆菌的诱导与培养,而后采用HS-SPME-GC-MS法对培养基中的挥发性成分进行鉴定与分析。与其他3种条件相比,降低温度是促进外源基因可溶性表达的最关键条件。高温诱导时,大肠杆菌的生长速度加快,蛋白合成速度也随之加快,目的蛋白来不及进行正确折叠,从而形成没有活性的包涵体。陈德鑫等[17]对烟草NteIF2α(真核翻译起始因2α)基因表达中发现,37 ℃诱导时该基因形成包涵体,当诱导温度降低至16 ℃时,该基因形成了一定的可溶性蛋白,该研究结果进一步支持了降低温度有利于目的蛋白可溶性表达的观点。
3.3 倍半萜高效合成酶的挖掘对开发新的倍半萜化合物具有重要意义倍半萜类化合物具有丰富的碳氢骨架和生物活性,是一类重要的次级代谢产物[18-19]。倍半萜合酶作为其生物合成中的关键酶,具有重要的研究价值。在高等真菌中,担子菌具有比子囊菌更为丰富的倍半萜合酶基因,每个担子菌体内均含有几种到几十种不等的倍半萜合酶[20-21]。目前除灵芝外,仅有极少数的担子菌倍半萜合酶家族完成了功能验证研究,如茶树菇[22]、毛韧革菌[23]、灰盖鬼伞[24]、褐腐菌[14]、发光脐菇(Omphalotusolearius)[25]、Clitopilus pseudo-pinsitu[26]等,未来仍需对更多的担子菌倍半萜合酶家族进行相关研究。此外,已发现多种担子菌倍半萜合酶具有催化生成重要生物活性化合物的能力。隐杯伞素具有明显的抗癌活性,发光脐菇倍半萜合酶Omp6和Omp7可催化生成隐杯伞素的前体Δ6-protoilludene[14]。担子菌Lignosusrhinocerotis倍半萜合酶GME3638催化生成的主产物榧树醇对乳腺癌细胞(MCF7)表现出强选择性的细胞毒性[27]。异香叶醇作为GsSTPS2的主产物之一,具有杀白蚁、抗蠕虫和植物生长调节作用[28-29]。采用代谢工程手段构建GsSTPS2的高产大肠杆菌菌株,将有助于实现更高效绿色的异香叶醇的合成。
本研究通过将紫芝倍半萜合酶GsSTPS2克隆到pET32a表达载体上并转入Rosetta(DE3)细胞中实现了GsSTPS2在大肠杆菌中的高效异源表达,通过对不同诱导温度、诱导时间及IPTG诱导浓度的比较分析获得了GsSTPS2的最佳诱导条件:初始菌液OD600为0.8,诱导温度为18 ℃,诱导时间为12 h,IPTG终浓度为1 mmol/L,使其可溶性表达由17.62%提高到28.07%。在此基础上采用HS-SPME-GC-MS的方法鉴定了GsSTPS2的功能,其可催化生成倍半萜碳氢化合物δ-杜松烯、杜松-3,5-二烯、β-杜松烯和顺-衣兰油-4(15),5-二烯及倍半萜含氧衍生物异香叶醇,荜澄茄油烯醇和τ-依兰油醇。本研究开发了1种新的紫芝倍半萜合酶GsSTPS2,并针对其较差的可溶性进行了重组蛋白可溶性表达条件的探索,为进一步通过酶工程改造酶催化活性高效生产异香叶醇提供了数据支持,也为通过合成生物学方法生产异香叶醇奠定了基础。
| [1] |
国家药典委员会. 中华人民共和国药典[S]. 北京: 中国医药科技出版社, 2020: 195. National Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China[S]. Beijing: China Medical Science and Technology Publishing House, 2020: 195. |
| [2] |
LI S F, DONG C H, WEN H A, et al. Development of LingZhi industry in China-emanated from the artificial cultivation in the Institute of Microbiology, Chinese Academy of Sciences (IMCAS)[J]. Mycology, 2016, 7(2): 74-80. DOI:10.1080/21501203.2016.1171805 |
| [3] |
谢怡琼, 王琪瑞, 孙思雅, 等. 灵芝的药理作用和临床应用研究进展[J]. 临床医学研究与实践, 2020, 5(10): 191-193. XIE Y Q, WANG Q R, SUN S Y, et al. Research progress on the pharmacological effects and clinical applications of Ganoderma lucidum[J]. Clinical Research and Practice, 2020, 5(10): 191-193. DOI:10.19347/j.cnki.2096-1413.202010077 |
| [4] |
WANG D, WANG Y L, ZHANG P, et al. New sesquiterpenoid derivatives from Ganoderma sinense with nitric oxide inhibitory activity[J]. Phytochemistry Letters, 2020, 35(6): 84-87. |
| [5] |
WANG H, WANG Y, LIU P P, et al. Purpurides B and C, two new sesquiterpene esters from the aciduric fungus Penicillium purpurogenum JS03-21[J]. Chemistry & Biodiversity, 2013, 10(7): 1185-1192. |
| [6] |
周国峰, 杨郁, 徐锐, 等. 蘑菇来源萜类化合物研究进展[J]. 国际药学研究杂志, 2020, 47(11): 928-945. ZHOU G F, YANG Y, XU R, et al. Research progress in terpenoids derived from mushrooms[J]. Journal of International Pharmaceutical Research, 2020, 47(11): 928-945. DOI:10.13220/j.cnki.jipr.2020.11.008 |
| [7] |
CHEN S L, XU J, LIU C, et al. Genome sequence of the model medicinal mushroom Ganoderma lucidum[J]. Nature Communications, 2012, 3(1): 913. DOI:10.1038/ncomms1923 |
| [8] |
ZHU Y J, XU J, SUN C, et al. Chromosome-level genome map provides insights into diverse defense mechanisms in the medicinal fungus Ganoderma sinense[J]. Scientific Reports, 2015, 6(5): 11087. |
| [9] |
褚丽华. 灵芝挥发性萜类组研究[D]. 北京: 北京协和医学院, 2019. CHU L H. The volatile terpenome investigation of Ganoderma lucidium[D]. Beijing: Peking Union Medical College, 2019. |
| [10] |
曾欣宜. 基于全基因组分析的灵芝萜类合酶功能多样性研究[D]. 北京: 北京协和医学院, 2016. ZENG X Y. The functional diversity of terpene synthases in Ganoderma lucidum based on the whole genomic analysis[D]. Beijing: Peking Union Medical College 2016. |
| [11] |
褚丽华, 王丽芝, 陈士林, 等. 一个紫芝多产物倍半萜合酶的功能鉴定[J]. 中国实验方剂学杂志, 2019, 25(12): 151-157. CHU L H, WANG L Z, CHEN S L, et al. Functional identification of a multi-product sesquiterpene synthase from Ganoderma sinense[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2019, 25(12): 151-157. |
| [12] |
王丽芝, 王海英, 浦香东, 等. 基于紫芝基因组的倍半萜合酶基因的发掘与功能鉴定[J]. 中国科学: 生命科学, 2018, 48(4): 447-454. WANG L Z, WANG H Y, PU X D, et al. Cloning and characterization of sesquiterpene synthase genes from the Ganoderma sinense genome[J]. Scientia Sinica (Vitae), 2018, 48(4): 447-454. |
| [13] |
BAIROCH A, APWEILER R. The SWISS-PROT protein sequence database and its supplement TrEMBL in 2000[J]. Nucleic Acids Research, 2000, 28(1): 45-48. DOI:10.1093/nar/28.1.45 |
| [14] |
WAWRZYN G T, QUIN M B, CHOUDHARY S, et al. Draft genome of Omphalotus olearius provides a predictive framework for sesquiterpenoid natural product biosynthesis in Basidiomycota[J]. Chemistry & Biology, 2012, 19(6): 772-783. |
| [15] |
兰艳平, 刘东, 赵岩, 等. 棉花去泛素化酶基因GhOTUD5原核表达条件的优化[J]. 分子植物育种, 2020, 18(10): 3223-3231. LAN Y P, LIU D, ZHAO Y, et al. Optimization of prokaryotic expression conditions of cotton deubiquitinase gene GhOTUD5[J]. MolecularPlantBreeding, 2020, 18(10): 3223-3231. |
| [16] |
陈明, 陈文静. 几种微生物表达系统的比较[J]. 安徽农学通报(上半月刊), 2011, 17(3): 68-71. CHEN M, CHEN W J. Comparisons of some microbial expression systems[J]. Anhui Agricultural Science Bulletin, 2011, 17(3): 68-71. |
| [17] |
陈德鑫, 李雯雯, 李思斌, 等. 烟草NteIF2α的原核表达、纯化及多克隆抗体制备和应用[J]. 农业生物技术学报, 2017, 25(1): 50-57. CHEN D X, LI W W, LI S B, et al. Prokaryotic expression, purification of NteIF2α and preparation and application of polyclonal antibody in Nicotiana tabacum[J]. Journal of Agricultural Biotechnology, 2017, 25(1): 50-57. |
| [18] |
张强, 谢冬梅, 张磊, 等. 吉玛烯衍生型倍半萜内酯: 生物合成的机遇与挑战[J]. 中国中药杂志, 2021, 46(8): 2020-2028. ZHANG Q, XIE D M, ZHANG L, et al. Germacrene-derived sesquiterpene lactones: opportunities and challenges for biosynthesis[J]. China Journal of Chinese Materia Medica, 2021, 46(8): 2020-2028. |
| [19] |
KRAMER R, ABRAHAM W R. Volatile sesquiterpenes from fungi: what are they good for?[J]. Phytochemistry Reviews, 2012, 11(1): 15-37. DOI:10.1007/s11101-011-9216-2 |
| [20] |
SCHMIDT-DANNERT C. Biosynthesis of terpenoid natural products in fungi[J]. Advances in Biochemical Engineering/Biotechnology, 2015, 148(14): 19-61. |
| [21] |
QUIN M B, FLYNN C M, SCHMIDT-DANNERT C. Traversing the fungal terpenome[J]. Natural Product Reports, 2014, 31(10): 1449-1473. DOI:10.1039/C4NP00075G |
| [22] |
ZHANG C, CHEN X, ORBAN A, et al. Agrocybeaegerita serves as a gateway for identifying sesquiterpene biosynthetic enzymes in higher fungi[J]. ACS Chemical Biology, 2020, 15(5): 1268-1277. DOI:10.1021/acschembio.0c00155 |
| [23] |
QUIN M B, FLYNN C M, WAWRZYN G T, et al. Mushroom hunting by using bioinformatics: application of a predictive framework facilitates the selective identification of sesquiterpene synthases in basidiomycota[J]. ChemBioChem, 2013, 14(18): 2480-2491. DOI:10.1002/cbic.201300349 |
| [24] |
AGGER S, LOPEZ-GALLEGO F, SCHMIDT-DANNERT C. Diversity of sesquiterpene synthases in the basidiomycete Coprinus cinereus[J]. Molecular Microbiology, 2009, 72(5): 1181-1195. DOI:10.1111/j.1365-2958.2009.06717.x |
| [25] |
ICHINOSE H, KITAOKA T. Insight into metabolic diversity of the brown-rot basidiomycete postia placenta responsible for sesquiterpene biosynthesis: semi-comprehensive screening of cytochrome P450 monooxygenase involved in protoilludene metabolism[J]. Microbial Biotechnology, 2018, 11(5): 952-965. DOI:10.1111/1751-7915.13304 |
| [26] |
NAGAMINE S, LIU C W, NISHISHITA J, et al. Ascomycete aspergillus oryzae is an efficient expression host for production of basidiomycete terpenes by using genomic DNA sequences[J]. Applied and Environmental Microbiology, 2019, 85(15): e00409-e00419. |
| [27] |
YAP H Y Y, MURIA-GONZALEZ M J, KONG B H, et al. Heterologous expression of cytotoxic sesquiterpenoids from the medicinal mushroom Lignosus rhinocerotis in yeast[J]. Microbial Cell Factories, 2017, 16(1): 103. DOI:10.1186/s12934-017-0713-x |
| [28] |
JERKOVI Ć I, KRANJAC M, MARIJANOVI Ć Z, et al. Chemical diversity of headspace and volatile oil composition of two brown algae (Taonia Atomaria and Padina pavonica) from the adriatic sea[J]. Molecules (Basel, Switzerland), 2019, 24(3): 495. |
| [29] |
SMITH L K, BAXENDALE I R. Total syntheses of natural products containing spirocarbocycles[J]. Organic & Biomolecular Chemistry, 2015, 13(39): 9907-9933. |
 2022, Vol. 41
2022, Vol. 41