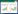文章信息
- 陈海燕, 曾雪莉
- CHEN Haiyan, ZENG Xueli
- 花旗松素通过PI3K/AKT/mTOR通路对宫颈癌SiHa细胞自噬、凋亡和衰老的影响
- Effects of taxifolin on autophagy, apoptosis and senescence of SiHa cells in cervical cancer through PI3K/AKT/mTOR pathway
- 天津中医药大学学报, 2022, 41(6): 789-796
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(6): 789-796
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.06.20
-
文章历史
收稿日期: 2022-08-20
宫颈癌(cervical cancer)在子宫颈表面的组织中发展,是影响全世界女性的最常见的癌症之一,每年有大量的的女性因此而死亡[1]。发生子宫颈癌的主要危险因素是人乳头瘤病毒(HPV)的持续感染,且其感染通常是无症状和短暂的[2]。筛选和治疗方法的进步显着改善了临床结局,然而由于对标准疗法化疗的耐药性发展,晚期宫颈癌的治疗仍然是一个挑战[3]。因此探寻治疗宫颈癌的有效方式是迫切的。抗肿瘤中药由于高抗癌效力和低毒性,已在临床上得到广泛应用,传统中药与健康生活方式的结合通常可以完全缓解轻度和中度疾病。花旗松素(Taxifolin)又名二氢槲皮素、紫叶杉素,是提取自水红花子、土茯苓等植物中的一种生物类黄酮准维生素P,具有抗肿瘤、抗病毒、抗菌、消炎等多种药理活性[4]。已有研究表明花旗松素具有良好的体外抑制人宫颈癌Hela细胞增殖作用[5]。目前还没有关于花旗松素对宫颈癌SiHa细胞影响的研究,本文旨在研究花旗松素对宫颈癌SiHa细胞自噬,凋亡和衰老的影响,以期为宫颈癌的临床治疗提供实验依据。
1 材料与方法 1.1 药物与主要试剂花旗松素(批号:111816-201102,纯度≥98.9%,中国食品药品检定研究院);达尔伯克改良伊格尔培养基(Dulbecco’s modified Eagle’s medium,DMEM)培养基、胎牛血清、胰蛋白酶和青-链霉素(货号分别为:12100-046、10082-147、10082-147、15140-122,均购于美国Gibco公司);MTT细胞增殖及细胞毒性检测试剂盒(批号:G020-1-1,南京建成生物工程研究所);CCK-8试剂盒、聚氰基丙烯酸正丁酯(bicinchoninic acid,BCA)蛋白浓度测定试剂盒和Annexin V-FITC细胞凋亡检测试剂盒(批号分别为:C0037、P0012S、C1062S,上海碧云天生物技术研究所);兔抗单克隆抗体Beclin1、p62、LC3II/LC3I、Bcl-2、Bax、Caspase-3、cleaved caspase-3、Caspase-9、cleaved Caspase-9、磷脂酰肌醇-3-激酶(PI3K)、p-PI3K、蛋白激酶B(AKT)、p-AKT、哺乳动物雷帕霉素靶蛋白(mTOR)、p-mTOR(货号分别为:ab62557、ab56416、ab128025、ab196495、ab53154、ab13847、ab2302、ab52298、ab2324、ab191606、ab182651、ab106693、ab192623、ab2732、ab84400,英国Abcam公司)。
1.2 细胞及细胞培养人子宫颈鳞状癌SiHa细胞株(购于中国科学院典型培养物保藏委员会细胞库),细胞培养于10%胎牛血清和1%青-链霉素的高糖DMEM培养基中,并放置在37 ℃,5% CO2恒温培养箱中。培养基每2~3 d更换1次,当需要收集细胞时,用0.25%胰蛋白酶消化。实验用细胞为对数生长期细胞。
1.3 MTT检测细胞增殖将宫颈癌SiHa细胞接种于96孔板(100 μL/孔)孵育24h后,用不同浓度(0、0.1、0.5、1、2.5、5、10、20、40、80、120、150、200 μmol/L)花旗松素处理细胞,置于37 ℃,含5% CO2细胞培养箱中培养24 h,每孔加入MTT溶液50 μL,孵育4 h,吸出上清液,每孔加150 μL DMSO,用平板摇床摇匀,用酶标仪在570 nm处检测各浓度OD值。实验重复3次,取平均值并计算药物半数抑制浓度IC50值,选择20 μmol/L Taxifolin为最高浓度,倍数递减确定给药浓度梯度为:20、10、5 μmol/L进行后续实验。
1.4 CCK-8法检测细胞细胞增殖倍数取对数生长期宫颈癌SiHa细胞,胰蛋白酶消化制成细胞悬液,以每孔4×103个细胞接种于96孔板,每孔100 μL,培养24 h,加入Taxifolin(0、5、10、20 μmol/L)处理24、48、72 h,于每个检测时间点(0、24、48、72 h)分别加入稀释到10%的CCK-8溶液10 μL,置于37 ℃,含5% CO2细胞培养箱中孵育4 h,用酶标仪在450 nm处检测吸光值,计算细胞增殖倍数。
1.5 Western blot检测Beclin1、p62、LC3II/LC3I、PI3K、p-PI3K、AKT、p-AKT、mTOR、p-mTOR及凋亡相关蛋白表达水平取对数生长期宫颈癌SiHa细胞接种至6孔板,置于37 ℃、5% CO2的细胞培养箱中,加入Taxifolin(0、5、10、20 μmol/L)处理24 h,处理后将细胞用磷酸盐缓冲溶液(PBS)将清洗3次,再加入含蛋白酶抑制剂的细胞裂解液进行总蛋白提取,BCA试剂盒测定蛋白质含量;提取等量蛋白质样品,100 ℃变性5 min。然后进行十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳分离并转移至聚偏二氟乙烯(PVDF)膜,5%的牛血清白蛋白(BSA)室温封闭2 h后加入相应的一抗,4 ℃过夜孵育,次日,清洗后再加入辣根过氧化物酶标记的二抗,室温孵育1 h,清洗。最后加入发光液后,于凝胶成像仪进行曝光拍照,并用ImageJ软件统计灰度值计算相对表达量。GAPDH作为上样量参照,至少重复3个独立的实验。
1.6 免疫荧光检测LC3+含量将经Taxifolin(0、5、10、20 μmol/L)处理24 h后的宫颈癌SiHa细胞接种于细胞爬片上,用PBS浸洗3次,每次3 min;用多聚甲醛固定15 min,用PBS浸洗3次,每次3 min。0.5% Triton X-100室温通透20 min,PBS浸洗3次,每次3 min,吸水纸吸干PBS,在玻片上滴加正常山羊血清,室温封闭30 min,吸掉封闭液,加入一抗,孵育过夜,PBS浸洗,避光加入荧光二抗,孵育1 h,PBS浸洗,滴加DAPI避光孵育5 min,用含荧光淬灭剂的封片液封片,于荧光显微镜下观察采集图像。
1.7 流式检测细胞凋亡宫颈癌SiHa细胞经Taxifolin(0、5、10、20 μmol/L)处理24 h,胰酶消化收集各组悬浮细胞到10 mL的离心管中,每样本细胞数为3×106/mL,1 000 r/min离心5 min,弃去培养液,用孵育缓冲液洗涤1次,1 000 r/min离心5 min,用100 μL的标记溶液重悬细胞,室温下避光孵育15 min,1 000 r/min离心5 min沉淀细胞孵育缓冲液洗1次,加入荧光(SA-FLOUS)溶液4 ℃下孵育20 min,避光并不时振动,流式细胞仪分析:流式细胞仪激发光波长用488 nm,用一波长为515nm的通带滤器检测FITC荧光,另一波长大于560 nm的滤器检测PI。
1.8 JC-1法检测线粒体膜电位将宫颈癌SiHa细胞接种于6孔板中,加入Taxifolin(0、5、10、20 μmol/L)处理24 h后用PBS清洗3次,孵育24 h,加入JC-1(5 μg/mL)室温避光反应30 min。用流式分选仪检测,记录红色和绿色荧光强度。
1.9 加入AKT激活剂SC79对SiHa细胞的影响选择20 μmol/L剂量花旗松素处理细胞,将细胞随机分为4组:Control组、Taxifolin 20 μmol/L组、SC79组和Taxifolin 20 μmol/L+SC79组。Control组不做处理,Taxifolin 20 μmol/L组用20 μmol/L花旗松素处理24 h,SC79组用AKT激活剂SC79处理24 h,Taxifolin 20 μmol/L+SC79组用20 μmol/L花旗松素和AKT激活剂SC79联合处理24 h。检测各组细胞凋亡、自噬及相关蛋白表达。
1.10 统计学方法采用SPSS 22.0软件进行统计学分析。正态分布计量资料以均数±标准差(x±s)表示,采用t检验,以P<0.05为差异有统计学意义。
2 结果 2.1 降低宫颈癌SiHa细胞活力与Taxifolin 0 μmol/L浓度时相比较,Taxifolin 40、80、120、150、200 μmol/L浓度细胞活力显著降低(P<0.05)。结果见图 1。

|
| 注:与0 μmol/L比较,*P<0.05。 图 1 Taxifolin不同浓度处理宫颈癌SiHa细胞24 h细胞活力的变化 |
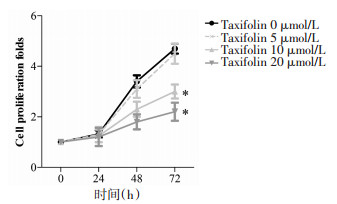
与Taxifolin 0 μmol/L组相比较,Taxifolin 10、20 μmol/L组细胞增殖倍数显著降低(P<0.05)。结果见图 2。
|
| 注:与Taxifolin 0 μmol/L组比较,*P<0.05。 图 2 各组宫颈癌SiHa细胞增殖倍数的比较 |
与Taxifolin 0 μmol/L组相比较,Taxifolin 10、20 μmol/L组p62蛋白水平显著降低(P<0.05),Beclin1、LC3II/LC3I蛋白水平显著升高(P<0.05)。结果见图 3。

|
| 注:A. WB实验检测各组细胞Beclin1、p62、LC3II、LC3I蛋白表达;B. 半定量分析各组细胞Beclin1、p62、LC3II、LC3I蛋白表达水平;与Taxifolin 0 μmol/L组比较,*P<0.05。 图 3 各组宫颈癌SiHa细胞自噬蛋白Beclin1、p62、LC3II、LC3I的比较 |
与Taxifolin 0 μmol/L组相比较,Taxifolin 10、20 μmol/L组LC3+含量显著升高(P<0.05)。结果见图 4。

|
| 注:A.免疫荧光检测各组细胞LC3+含量;B.半定量分析LC3+含量。与Taxifolin 0 μmol/L组比较,*P<0.05。 图 4 各组宫颈癌SiHa细胞LC3+含量的比较 |
与Taxifolin 0 μmol/L组相比较,Taxifolin 5、10、20 μmol/L组细胞凋亡率显著升高(P<0.05)。结果见图 5。

|
| 注:A.流式细胞仪检测各组细胞细胞凋亡率;B.半定量分析各组细胞凋亡率。与Taxifolin 0 μmol/L组比较,*P<0.05 图 5 各组宫颈癌SiHa细胞细胞凋亡率的比较 |
与Taxifolin 0 μmol/L组相比较,Taxifolin 5、10、20 μmol/L组线粒体膜电位显著升高(P<0.05)。结果见图 6。

|
| 注:A.流式检测各组细胞线粒体膜电位;B.半定量分析各组细胞线粒体膜电位。与Taxifolin 0μmol/L组比较,*P<0.05。 图 6 各组宫颈癌SiHa细胞线粒体膜电位的比较 |
与Taxifolin 0 μmol/L组相比较,Taxifolin 10、20 μmol/L组Bcl-2/Bax比值显著降低(P<0.05),cleaved Caspase-3/Caspase-3、cleaved Caspase-9/Caspase-9比值升高(P<0.05)。结果见图 7。

|
| 注:与Taxifolin 0 μmol/L组比较,*P<0.05。 图 7 各组宫颈癌SiHa细胞Bcl-2、Bax、Caspase-3、Caspase-9表达水平的比较 |
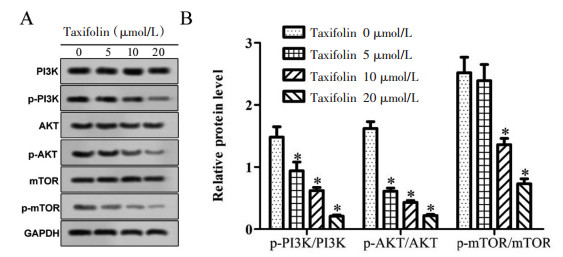
与Taxifolin 0 μmol/L组相比较,Taxifolin 10、20 μmol/L组p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR比值显著降低(P<0.05)。结果见图 8。
|
| 注:A. WB检测各组细胞PI3K、p-PI3K、AKT、p-AKT、mTOR、p-mTOR蛋白表达;B.半定量分析各组细胞PI3K、p-PI3K、AKT、p-AKT、mTOR、p-mTOR蛋白表达水平。与Taxifolin 0 μmol/L组比较,*P<0.05。 图 8 各组宫颈癌SiHa细胞PI3K、p-PI3K、AKT、p-AKT、mTOR、p-mTOR蛋白表达水平的比较 |
与Control组相比较,Taxifolin 20 μmol/L组p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR比值和P62蛋白水平显著降低(P<0.05),细胞凋亡率和Beclin1、LC3II/LC3I蛋白水平显著升高(P<0.05)。SC79组Taxifolin 20 μmol/L组p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR比值和P62蛋白水平显著升高(P<0.05),细胞凋亡率和Beclin1、LC3II/LC3I蛋白水平显著降低(P<0.05);与SC79组相比较,Taxifolin 20 μM+SC79组p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR比值和P62蛋白水平显著降低(P<0.05),细胞凋亡率和Beclin1、LC3II/LC3I蛋白水平显著升高(P<0.05)。结果见图 9。

|
| 注:A. Western blot检测各组细胞PI3K、p-PI3K、AKT、p-AKT、mTOR、p-mTOR蛋白表达;B. 半定量分析各组细胞PI3K、p-PI3K、AKT、p-AKT、mTOR、p-mTOR蛋白表达水平;C. 流式细胞仪检测各组细胞细胞凋亡率;D:半定量分析各组细胞凋亡率;E. Western blot实验检测各组细胞Beclin1、p62、LC3II、LC3I蛋白表达;F. 半定量分析各组细胞Beclin1、p62、LC3II、LC3I蛋白表达水平;与Control组比较,*P<0.05;与SC79组比较,#P<0.05。 图 9 加入AKT激活剂后花旗松素对SiHa细胞的影响 |
宫颈癌是全世界女性中最常被诊断出的癌症,仅次于乳腺癌,结肠直肠癌和肺癌[6]。在许多不发达国家,宫颈癌患者的5年生存率不到40%[7]。由于宫颈癌的强大增殖,侵袭和转移能力,晚期宫颈癌患者的预后仍然很差。由于化学疗法的治疗是有限且昂贵的,因此探寻治疗宫颈癌的药物是迫切的。花旗松素是维生素P族中的一种有机化合物,是一种植物黄酮类化合物,大量研究表明花旗松素对多种肿瘤具有抑制作用。本研究发现,花旗松素具有抑制宫颈癌SiHa细胞活力的作用。
抗癌药活性的主要机制之一是抑制癌细胞的生长。Li等[8]研究发现花旗松素通过抑制乳房癌细胞增殖对乳房癌具有治疗作用。Manigandan等[9]研究发现通过干预肿瘤细胞增殖和分化过程中的中的Wnt/β-catenin通路,发现花旗松素可以对结肠癌起到抑癌的作用。本文与上述结果研究一致,结果表明花旗红素具有抑制宫颈癌SiHa增殖作用。
自噬抑制某些癌细胞的生长[10]。自噬是一种主要的细胞内降解过程,参与维持机体的内环境稳态,近年来研究发现自噬功能异常与宫颈癌的发生发展以及治疗耐受等密切相关[11]。Beclin1是酵母Atg6基因在人类基因中的同源体,上调Beclin1的表达可诱导自噬的形成[12]。自噬标记蛋白p62是多泛素化结合蛋白,自噬发生缺陷可以上调p62的表达。LC3由可溶形式LC3I和脂化形式(称为LC3Ⅱ)组成。LC3Ⅱ的存在与自噬直接相关,因为LCⅡ是在自噬小体形成中募集的,细胞应激触发LC3Ⅰ缀合到磷脂酰乙醇胺以构成lapidated LC3Ⅱ,这是自噬体的一个组件,是自噬的标记物[13],LC3Ⅱ/LC3Ⅰ的比例反应了自噬水平情况。本研究发现,花旗红素具有下调宫颈癌SiHa细胞Beclin1蛋白表达水平,上调p62、LC3Ⅱ/LC3Ⅰ蛋白表达水平的作用。提示花旗红素可诱导宫颈癌SiHa细胞自噬。
细胞凋亡是细胞的程序性死亡,凋亡维持细胞的存活及死亡平衡,细胞凋亡缺陷可引起癌症自身免疫,而细胞凋亡增强则可引起退行性疾病[14]。线粒体在哺乳动物细胞凋亡的内在途径中具有重要作用。在各种类型的癌症中,凋亡抑制剂被高度表达,而凋亡启动子大多被灭活,导致一定程度的耐药性。因此,通过调调控在癌细胞中的细胞凋亡的正常响应的再活化是希望的治疗方法[15]。Zhou等[16]研究发现花旗红素通过诱导凋亡,细胞周期停滞和抑制PI3K/AKT/mTOR途径来抑制瘢痕细胞癌的生长。符小玲等[17]研究发现花旗松素可以时间和浓度依赖性的方式抑制体外培养的人非小细胞肺癌细胞增殖并促进其凋亡。本文与上述结果研究一致,结果表明花旗红素具有促进宫颈癌SiHa细胞凋亡的作用。
线粒体膜电位是由存在于线粒体内膜的质子泵将基质内的质子泵入外室所形成的横跨线粒体内膜的线粒体膜电位,其为维持线粒体进行氧化磷酸化、产生三磷酸腺苷、保持线粒体功能的基础[18]。Xiao等[19]研究发现花旗松素通过抑制线粒体膜电位下降,减轻ROS从而保护H9C2细胞的氧化应激损伤。本研究发现,花旗红素具有升高宫颈癌SiHa细胞线粒体膜电位的作用。
细胞衰老是指细胞脱离细胞周期并不可逆地丧失增殖能力后进入的一种相对稳定的状态,是正常细胞的必然归宿。而越来越多的研究发现,肿瘤细胞往往具有衰老障碍而表现出无限增殖的能力。在多种衰老细胞中,某些抑癌基因的过表达会引起细胞进入衰老程序,细胞绕过衰老途径是其永生化及癌变进展的必要条件。本研究发现,花旗红素具有降低宫颈癌SiHa细胞Bcl-2/Bax mRNA水平,升高Caspase-3、Caspase-9水平的作用。提示花旗红素可抑制宫颈癌SiHa细胞衰老。
磷脂酰肌醇3激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白(PI3K/Akt/mTOR)信号传导通路是哺乳动物细胞内重要的信号传导通路之一,它通过影响其下游多种效应分子的活化状态,发挥抑制细胞凋亡、促进增殖的作用。Zhou等[16]研究发现花旗松素通过诱导凋亡,细胞周期停滞和抑制PI3K/AKT/mTOR途径来抑制瘢痕细胞癌的生长。本研究发现,花旗松素具有降低宫颈癌SiHa细胞p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR比值的作用,且加入PI3K/AKT信号通路激活剂SC79可逆转花旗松素对SiHa细胞凋亡、自噬及PI3K/AKT信号通路相关蛋白表达的影响。提示花旗松素通过抑制PI3K/AKT/mTOR通路的活化调控宫颈癌SiHa细胞的生物学行为。
综上所述,花旗松素对宫颈癌SiHa细胞具有抑制增殖、衰老,促进凋亡、自噬,升高线粒体膜电位的作用,这可能是通过抑制PI3K/AKT/mTOR通路的活化实现的,提示花旗松素可用于临床治疗宫颈癌的潜力,为临床治疗提供实验依据。但花旗松素难溶于水,导致生物利用率低,限制了其在医药和临床上的使用,下一步计划研究提高花旗松素的生物利用率。
| [1] |
王品, 李勤. 阴道微生态与宫颈人乳头瘤病毒感染相关研究[J]. 临床误诊误治, 2019, 32(5): 108-113. WANG P, LI Q. The relationship between vaginal microecology and cervical human papillomavirus infection[J]. Clinical Misdiagnosis & Mistherapy, 2019, 32(5): 108-113. DOI:10.3969/j.issn.1002-3429.2019.05.023 |
| [2] |
蒋杰, 毕玉晰, 李志茹, 等. 人乳头瘤病毒E6/E7在宫颈癌中的研究进展[J]. 临床误诊误治, 2018, 31(11): 101-105. JIANG J, BI Y X, LI Z R, et al. Research progress of human papillomavirus E6/E7 in cervical cancer[J]. Clinical Misdiagnosis & Mistherapy, 2018, 31(11): 101-105. DOI:10.3969/j.issn.1002-3429.2018.11.022 |
| [3] |
赵肖丽, 周伟慢, 王华, 等. 伊立替康联合顺铂同步放化疗治疗晚期宫颈癌的临床价值及毒副反应分析[J]. 解放军医药杂志, 2019, 31(8): 30-33. ZHAO X L, ZHOU W M, WANG H, et al. Clinical value and toxic and side effects of irinotecan combined with cisplatin by concurrent chemoradiotherapy in treatment of patients with advanced cervical cancer[J]. Medical & Pharmaceutical Journal of Chinese PLA, 2019, 31(8): 30-33. DOI:10.3969/j.issn.2095-140X.2019.08.007 |
| [4] |
杨松霖, 杜姣姣, 赵丽娟, 等. 花旗松素的研究进展及展望[J]. 化工管理, 2018(22): 54-55, 59. YANG S L, DU J J, ZHAO L J, et al. Research progress and prospect of taxifolin[J]. Chemical Enterprise Management, 2018(22): 54-55, 59. DOI:10.3969/j.issn.1008-4800.2018.22.034 |
| [5] |
翟延君, 程飞, 王添敏, 等. 花旗松素对人宫颈癌Hela细胞的体外抗肿瘤活性及其机理研究[J]. 中成药, 2011, 33(12): 2052-2055. ZHAI Y J, CHENG F, WANG T M, et al. In vitro anticancer activity of taxifolin on human cervical cancer Hela cells and its mechanism[J]. Chinese Traditional Patent Medicine, 2011, 33(12): 2052-2055. DOI:10.3969/j.issn.1001-1528.2011.12.007 |
| [6] |
李永红, 李玉嫦, 柯妍, 等. 斑蝥酸钠调控PI3K/Akt/mTOR通路对宫颈癌细胞自噬的研究[J]. 医学分子生物学杂志, 2019, 16(4): 321-327. LI Y H, LI Y C, KE Y, et al. Effect of sodium cantharidate on autophagy of cervical cancer cells by regulating PI3K/Akt/mTOR pathway[J]. Journal of Medical Molecular Biology, 2019, 16(4): 321-327. DOI:10.3870/j.issn.1672-8009.2019.04.005 |
| [7] |
彭荫伟. 小分子Survivin抑制剂YM155对人子宫颈癌SiHa和ME-180细胞增殖、凋亡的影响及机制研究[J]. 医学分子生物学杂志, 2018, 15(5): 320-326. PENG Y W. Effects of survivin inhibitor YM155 on proliferation and apoptosis of SiHa and ME-180 cervical cancer cells and the mechanism involved[J]. Journal of Medical Molecular Biology, 2018, 15(5): 320-326. DOI:10.3870/j.issn.1672-8009.2018.05.011 |
| [8] |
LI J, HU L, ZHOU T, et al. Taxifolin inhibits breast cancer cells proliferation, migration and invasion by promoting mesenchymal to epithelial transition via β-catenin signaling[J]. Life Sciences, 2019, 232(12): 116617. |
| [9] |
MANIGANDAN K, MANIMARAN D, JAYARAJ R L, et al. Taxifolin curbs NF-κB-mediated Wnt/β-catenin signaling via up-regulating Nrf2 pathway in experimental colon carcinogenesis[J]. Biochimie, 2015, 119(7): 103-112. |
| [10] |
孙英甲, 乐利明, 荔志云. 异甘草素抗胶质瘤作用机制的研究进展[J]. 解放军医药杂志, 2020, 32(1): 110-113. SUN Y J, YUE L M, LI Z Y. Research progress of the antiglioma mechanism of isoglycyrrhizin[J]. Medical & Pharmaceutical Journal of Chinese PLA, 2020, 32(1): 110-113. |
| [11] |
何白云, 王艳林, 黄利鸣. 细胞自噬与宫颈癌关系的研究进展[J]. 现代妇产科进展, 2018, 27(2): 149-152. HE B Y, WANG Y L, HUANG L M. Research progress on the relationship between autophagy and cervical cancer[J]. Progress in Obstetrics and Gynecology, 2018, 27(2): 149-152. |
| [12] |
TSAI J H, HSU L S, HUANG H C, et al. 1-(2-hydroxy-5methylphenyl)-3-phenyl-1, 3-propanedione induces G1 cell cycle arrest and autophagy in HeLa cervical cancer cells[J]. International Journal of Molecular Sciences, 2016, 17(8): 1274. DOI:10.3390/ijms17081274 |
| [13] |
MIRACCO C, CEVENINI G, FRANCHI A, et al. Beclin 1 and LC3 autophagic gene expression in cutaneous melanocytic lesions[J]. Human Pathology, 2010, 41(4): 503-512. DOI:10.1016/j.humpath.2009.09.004 |
| [14] |
HASSAN M, WATARI H, ABUALMAATY A, et al. Apoptosis and molecular targeting therapy in cancer[J]. BioMed Research International, 2014, 2014(3): 150845. |
| [15] |
KAUFMANN S H, VAUX D L. Alterations in the apoptotic machinery and their potential role in anticancer drug resistance[J]. Oncogene, 2003, 22(47): 7414-7430. DOI:10.1038/sj.onc.1206945 |
| [16] |
ZHOU W, GUO Z. Taxifolin inhibits the scar cell carcinoma growth by inducing apoptosis, cell cycle arrest and suppression of PI3K/AKT/mTOR pathway[J]. Journal of B. U. ON.: Official Journal of the Balkan Union of Oncology, 2019, 24(2): 853-858. |
| [17] |
符小玲, 赵兴丹, 张倩, 等. 花旗松素对人非小细胞肺癌细胞A549的作用及其机制的研究[J]. 肿瘤药学, 2018, 8(4): 519-523, 527. FU X L, ZHAO X D, ZHANG Q, et al. Effects of taxifolin on human non-small cell lung cancer A549 cells and its mechanism[J]. Anti-Tumor Pharmacy, 2018, 8(4): 519-523, 527. |
| [18] |
KROEMER G. Mitochondrial control of apoptosis: An introduction[J]. Biochemical and Biophysical Research Communications, 2003, 304(3): 433-435. |
| [19] |
叶艳琼, 王晓莉, 蔡骞, 等. 花旗松素对过氧化氢诱导H9C2细胞焦亡的保护作用[J]. 中南大学学报(医学版), 2017, 42(12): 1367-1374. YE Y Q, WANG X L, CAI Q, et al. Protective effect of taxifolin on H2O2-induced H9C2 cell pyroptosis[J]. Journal of Central South University (Medical Science), 2017, 42(12): 1367-1374. |
 2022, Vol. 41
2022, Vol. 41