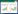文章信息
- 申倩, 沈雨蕾, 曾雪倩, 李俊辰, 张建岭, 庞博
- SHEN Qian, SHEN Yulei, ZENG Xueqian, LI Junchen, ZHANG Jianling, PANG Bo
- 中药活性成分对肿瘤细胞周期基因的调控作用
- Regulatory effect of active components of traditional Chinese medicine on tumor cell cycle genes
- 天津中医药大学学报, 2022, 41(6): 806-811
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(6): 806-811
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.06.22
-
文章历史
收稿日期: 2022-09-10
2. 北京中医药大学, 北京 100029;
3. 上海中医药大学, 上海 201203;
4. 天津中医药大学, 天津 301617
2. Beijing University of Traditional Chinese Medicine, Beijing 100029, China;
3. Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China;
4. Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
细胞周期分为分裂间期和分裂期(M期),其中分裂间期又可分为DNA合成前期(G1期)、DNA合成期(S期)、DNA合成后期(G2期)[1-3]。G1期是细胞由静止期(G0期)转向细胞增殖周期的起点。S期时细胞内完成染色体DNA复制,形成两条姐妹染色体单体。在G2期,合成有丝分裂所需的RNA和蛋白质等,为M期做准备。M期即有丝分裂期,又可以分为初期、前期、中期、后期和末期,最终分裂形成两个基因相同的子细胞[1-3]。细胞周期是细胞增殖的核心环节,受到多种因素的调控和影响,如Ras-MAPK、PI3K、Wnt和Notch[4-5]等细胞生长信号途径,受刺激后可引起细胞由静止期(G0期)进入增殖周期。在细胞周期中,细胞周期蛋白(Cyclin)、细胞周期蛋白依赖性蛋白激酶(Cyclin-Dependent Kinase,CDK)和细胞周期蛋白依赖性激酶抑制因子(Cyclin-dependent kinase inhibitors,CKI)为生物细胞周期过程中的3类核心调控分子[6]。
Cyclin(CyclinA-T)、CDK(CDK1-9)以及CKI的两大家族INK4(p15、p16、p18和p19)和CIP/KIP(p21、p27和p57)[7]均在细胞周期的不同阶段表达不同的蛋白分子,其进一步在激活和失活中相互转换,从而使得细胞周期顺序进行(图 1)。在细胞周期各阶段中,两大家族的成员形成不同的Cyclin-CDK蛋白激酶复合物。Cyclin-CDK蛋白激酶复合物在细胞周期的特定阶段、特定时间点形成和激活,CDK磷酸化特定底物,启动与细胞周期有关基因的转录。这个过程是细胞通过不同的细胞周期阶段尤其是G1/S和G2/M检查点必不可少的,对细胞周期各阶段的完成以及进入下一个阶段起关键和决定性作用,是细胞周期各阶段中最突出的生物学标志性事件[3]。见图 1。CKI常与蛋白激酶复合物结合而抑制其活性,从而抑制或阻止细胞周期的进程[8]。目前研究显示,几乎所有的人类肿瘤细胞均

|
| 图 1 中药活性成分调节癌细胞周期Cyclin、CDK和CKI基因表达,阻滞细胞周期进展 |
存在Cyclin、CDK和CKI基因的突变、扩增和/或表达的异常,在调控细胞周期检查点中起重要作用的p53和pRb信号途径也存在50%以上基因结构的异常[9]。这些结构的异常使得细胞周期和细胞凋亡的调控解除或检查点失能,进一步使携带缺陷基因的细胞因不能被及时阻滞和凋亡,造成持续的细胞周期循环和损伤基因富集,最终使得细胞转化为肿瘤细胞,并无限增殖[10-12]。从某种程度上来说,细胞周期基因的调控在开启或关闭肿瘤细胞生死的过程中起至关重要的作用[13]。因此,针对细胞周期基因分子靶点的调控是目前抗癌药物研究的热点。本文就近年来国内外关于直接调控细胞周期基因分子表达而影响肿瘤细胞周期,具有抑制肿瘤细胞增殖,甚至杀伤肿瘤细胞的多种中药活性成分的研究进行梳理、综述。
1 DNA合成前期(G1期)在G1期前期,细胞生长信号持续刺激CyclinD基因[基因家族:CCND1(11q13.3)、CCND2(12q13.32)、CCND3(6q21.1)],使其大量表达并与CDK4(CDK4,12q4.1)或CDK6(CDK6,7q21.2)结合,诱导CyclinD-CDK4/CDK6复合物活化[14]。在G1后期,CyclinE基因[基因家族:CCNE1(19q12)、CCNE2(8q22.1)]开始高表达,与CDK2(CDK2,12q13.2)结合后,在S期初期达到最大值,促进细胞周期通过G1/S检查点由G1期转入S期[3, 6, 14]。在G1期,INK4家族成员能够抑制CyclinD-CDK4/6复合物,使得细胞周期阻滞于G1/S期[5]。
Wang等[15]探究补骨脂素对于人肝癌细胞SMMC7721的作用机制,发现补骨脂素能够调节CyclinD1和CyclinE的表达,使其内质网和细胞质结构异常,导致细胞周期被阻滞于G1期,从而抑制肝癌细胞的增殖。Zhang等[16]的实验研究表明,重楼皂苷通过使CDK2表达下降,p21(Cyclin dependent kinase inhibitor 1A,p21,6q21.3)表达升高来抑制人非小细胞肺癌A549的生长。Li[16]等人通过斑蝥素对人表皮样癌细胞A431及其移植小鼠模型的细胞毒性作用实验发现斑蝥素可显著降低细胞中CyclinE、CDK6和CyclinD的蛋白表达水平,诱导细胞在G0/G1期阻滞,从而降低人表皮样癌细胞A431存活率,诱导细胞凋亡。王斌等[18]的研究发现黄连总生物碱联合运动能够下调原位移植4T1乳腺癌小鼠肿瘤细胞CDK4、CDK6、cyclinD1、CDK2和cyclinE蛋白的表达水平,从而使细胞阻滞于G1/S期。樊帅军等[19]发现,汉黄芩素通过降低CyclinD1、CyclinE、CDK2和CDK4蛋白表达,同时使CIP/KIP家族的激酶抑制因子p21和p27蛋白表达升高将结肠癌细胞LoVo阻滞于G0/G1期。钟伟枫等[20]的实验结果显示,龙葵素能抑制裸鼠前列腺癌细胞Du145移植瘤细胞CyclinD1、CyclinE1、CDK2、CDK4和CDK6的表达,促进p21的表达,从而调控细胞周期G1/S关卡抑制前列腺癌细胞裸鼠移植瘤的生长。侯新[21]等人的研究表明,苦豆碱能够通过降低CyclinD1的表达,进而抑制宫颈癌细胞Hela的增殖。
G1期形成的Cyclin-CDK复合物能催化G1/S细胞周期进展的主要抑制性蛋白Rb磷酸化,使其与调节细胞周期进展和细胞增殖的重要转录因子E2F解离,从而阻断其抑制E2F的活性,使细胞进入S期[24]。Rb-E2F是遏制外源性信号的“限制点”,因此,抑制G1期癌基因CyclinD、CyclinE、CDK4和CDK6的表达或增加抑癌基因p53(野生型)、p16、p18、p21和p27等表达可使癌细胞被阻滞于G1期,达到抑制细胞增殖,甚至诱导细胞凋亡的作用[5],见图 1。
在探究柴胡皂苷-D抑制宫颈癌细胞Hela的分子机制时,刘志华等[22]的实验发现,柴胡皂苷-D通过降低CyclinD1和CylcinE的表达,增加p53和p21表达,使得宫颈癌细胞Hela阻滞在G1期。Zhu等[23]发现,甘草次酸能够显著抑制CyclinD1、CyclinD3、CyclinE、CDK4、CDK6、CDK2和E2F-1表达,并能上调非小细胞肺癌细胞A549和NCI-H460 p16(Cyclin-dependent kinase inhibitor 2A,p16,9q21.3)、p18(Cyclin-dependent kinase inhibitor 2C,p18,1p32.3)、p21和p27(Cyclin-dependent kinase inhibitor 1B,p27,12p13.1)的表达。由于P16、p18、p21和p27均可竞争结合CDK4/6,使Rb磷酸化被抑制,因此甘草次酸能够通过Rb/E2F通路发挥抑制作用,导致细胞的生长抑制。
中药活性成分,重楼皂苷、斑蝥素、汉黄芩素、龙葵素、甘草次酸等对G1期相关基因具有调控作用,具有进一步研究和开发价值。
2 DNA合成期(S期)S期最主要的Cyclin/CDK复合物是CyclinA/CDK2[CyclinA基因家族:CCNA1(13q3.3),CCNA2(4q27)],它能启动DNA复制,产生两条完全相同的姐妹染色体。从此期开始与外生长信号脱离,仅调节细胞周期内的调节基因的表达才可影响细胞周期的进展[2-7]。中药活性成分,甘草查尔酮B、丹参酮Ⅰ、丹参酮ⅡA、补骨脂酚和淫羊藿苷等对S期基因具有调节作用。
实验研究发现,甘草查尔酮B能够通过降低S期cyclinA、CDK1及CDK2的mRNA表达诱导膀胱癌肿瘤细胞阻滞于S期[25]。周少荷[26]的研究显示丹参酮Ⅰ通过使肝癌细胞7721中Cycline A1蛋白的表达量增少,p21的表达量增加,进而使Cyclin-CDK复合物不能有效形成,同时,CIP/KIP家族抑制蛋白p21高表达,促使细胞被阻滞在S期。周新强等[27]的实验研究发现丹参酮ⅡA通过使食管癌细胞系Eca-109的S期检查点的正向调控基因Cyclin A和CDK2蛋白表达降低,影响DNA复制,使细胞阻滞在S期。除此之外,简晓顺等[28]还发现丹参酮ⅡA可能通过上调P27抑制CDK2,导致非小细胞肺癌细胞NCI-H520阻滞于S期。张哲楠等[29]研究发现,补骨脂酚可诱导人乳腺癌细胞MCF-7产生活性氧,使p53和p21蛋白表达增加,通过p53/p21途径,使得CDK2和CyclinA2表达减少,进而引起细胞阻滞于S期。有研究发现,淫羊藿苷可通过抑制髓母细胞瘤细胞中细胞周期相关蛋白cyclinA、CDK2、cyclinB1的表达诱导其在S期发生阻滞[30]。见图 1。
3 DNA合成后期(G2期)到分裂期(M期)在G2期形成的CyclinA-CDK1(CDK1,10q21.2)及晚期形成的CyclinB-CDK1[CyclinB基因家族:CCNB1(5q13.2,),CCNB2(15q22.2)]在促进G2到M期转化中起着关键的作用[31]。CyclinB-CDK1又被称为成熟促进因子,能够转入细胞核,磷酸化核内底物,进而调控有丝分裂[3-5]。负调节CIP/KIP家族的成员对细胞周期Cyclin-CDK复合物均具有重要的负调节作用[3-7]。因此,G2/M期在肿瘤的发生发展以及治疗方面至关重要[32]。
Zhang等[33]的研究表明九里香碱可导致肺癌细胞A549被阻滞在G2/M期,其机制与药物处理后CyclinD、CyclinE、CDK2、CDK4和CDK6表达降低,而p21和p27表达升高有关。薯蓣皂苷元[34]在诱导肝癌细胞Bel-7721、SMMC-7721和HepG2生长抑制实验中显示,薯蓣皂苷元可引起细胞G2/M期阻滞,机制与上调p21和p27的表达有关。Meiyin Chang等[35]发现芳樟醇通过引起p53、p21、p27、p16和p18基因的过表达,从而抑制Cyclin-CDK的活性导致宫颈癌细胞HeLa在G2/M期停滞。Kim等[36]观察紫草素对胃癌细胞AGS的细胞毒性作用,发现紫草素通过调控细胞中的p21基因,将细胞周期阻滞于G2/M期,从而抑制细胞增殖。Liu等[37]用吉玛酮处理人肝癌细胞HepG2和Bel7402,结果显示吉玛酮下调CyclinB1和CKD1的表达,使细胞被阻滞于G2/M期。Liu等[38]将杜荆素化合物1用于黑色素瘤细胞的治疗实验中,发现其通过下调CDK1,CDK6,CyclinE和CyclinA的表达,上调p21的表达,使细胞阻滞于G2/M期。Li等[39]发现大戟甘能够通过增加磷酸化CDK1(Tyr15)蛋白水平而诱导宫颈癌细胞HeLa的细胞周期阻滞于G2/M期。
苦杏仁苷对于多种晚期肿瘤都有很好的抑制作用。Shi等[40]的研究显示苦杏仁苷通过抑制CDK1、CDK2、CDK4、CyclinA和CyclinB的表达使肾癌细胞周期阻滞在G2/M期,它也能通过抑制CDK1、CDK2、CDK4、CyclinA、CyclinB和CyclinD3的表达,促进p19和p27的表达(抑制CDK活性),使前列腺癌的细胞周期阻滞在G2/M期。罗燕等[41]的研究显示柴胡皂苷D可通过降低CyclinA1、CyclinA2、CyclinB1、CyclinB2的蛋白和mRNA的表达,从而通过减少Cyclin-CDK蛋白激酶形成使乳腺癌细胞MDA-MB-231阻滞于G2期。见图 1。
这些研究显示,薯蓣皂苷元、芳樟醇、紫草素、苦杏仁苷、柴胡皂苷D等对G2期和M期基因具有调控作用,具有进一步研究和开发价值。
4 结语与展望目前研究显示:中药活性成分主要通过调控抑制肿瘤细胞周期G1期的CyclinD-CDK4/6和CyclinE-CDK2,S期的CyclinA-CDK2,G2期的CyclinA-CDK1以及M期的CyclinB-CDK1表达,升高INK4家族的p16、p18、p19和CIP/KIP家族的p21、p27、p57的表达来阻滞肿瘤细胞的细胞周期。细胞周期受到高度精细调节,与其上游Ras-MAPK、PI3K、Wnt和Notch等多种癌基因信号途径、p53/p21等多种抑癌基因信号途径及其下游E2F等多种靶基因密切联系。这些信号途径的异常与Cyclin、CDK、CDKI家族基因突变、扩增或表达失控都是通过细胞周期而最终发挥“癌生物学”作用的,因此亟待针对细胞周期药物的研究和开发。本文汇总、归纳了中药活性成分对细胞周期Cyclin、CDK、CDKI家族基因及其表达的调控作用。研究显示1种中药活性成分可调节1-7种细胞周期基因(表1),涉及癌基因和抑癌基因的表达,其作用是明确的,但对细胞周期基因表达的精准调节机制以及其更深层次的相互关系还需要进一步梳理和明晰。目前,尚存在的另一个问题是,几乎所有肿瘤都至少存在1项Cyclin、CDK和CKI基因突变或表达异常,但中药活性成分对这些突变基因及异常表达基因的调控作用研究尚少,仍待开展研究和解析。综上分析可以得出,药物靶向作用于肿瘤细胞周期基因是控制肿瘤细胞生死,抑制其无限制增殖的末节核心开关,因此在此领域的中药活性成分(如,斑蝥素、汉黄芩素、紫草素、苦杏仁苷等)药效基因靶点研究是具有巨大潜力的研究领域,需要研究者不断深入探索。
| [1] |
SHERR C J. Cancer cell cycles[J]. Science, 1996, 274(5293): 1672-1677. DOI:10.1126/science.274.5293.1672 |
| [2] |
POON R Y C. Cell cycle control: a system of interlinking oscillators[M]. Cell Cycle Oscillators, 2016;1342(11): 3-19.
|
| [3] |
OTTO T, SICINSKI P. Cell cycle proteins as promising targets in cancer therapy[J]. Nature Reviews Cancer, 2017, 17(2): 93-115. DOI:10.1038/nrc.2016.138 |
| [4] |
董福光, 熊慧, 武学润, 等. 天然药物及其提取物对癌细胞关键癌基因和抑癌基因的调控作用[J]. 中国中西医结合杂志, 2019, 39(12): 1516-1522. DONG F G, XIONG H, WU X R, et al. Advances in regulation of natural drugs and their extracts on key oncogenes and tumor suppressor genes in cancer cells[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2019, 39(12): 1516-1522. |
| [5] |
RODENAK-KLADNIEW B, CASTRO A, STÄRKEL P, et al. Linalool induces cell cycle arrest and apoptosis in HepG2 cells through oxidative stress generation and modulation of Ras/MAPK and Akt/mTOR pathways[J]. Life Sciences, 2018, 199(9): 48-59. |
| [6] |
GALBRAITH M D, BENDER H, ESPINOSA J M. Therapeutic targeting of transcriptional cyclin-dependent kinases[J]. Transcription, 2019, 10(2): 118-136. DOI:10.1080/21541264.2018.1539615 |
| [7] |
SHERR C J. The Pezcoller lecture: Cancer cell cycles revisited[J]. Cancer Research, 2000, 60(14): 3689-3695. |
| [8] |
BONELLI P, TUCCILLO F M, BORRELLI A, et al. CDK/CCN and CDKI alterations for cancer prognosis and therapeutic predictivity[J]. BioMed Research International, 2014, 2014(8): 361020. |
| [9] |
WENZEL E S, SINGH A T K. Cell-cycle checkpoints and aneuploidy on the path to cancer[J]. In Vivo (Athens, Greece), 2018, 32(1): 1-5. |
| [10] |
王清华, 赵贵君. 肿瘤中细胞周期相关激酶的研究进展[J]. 北京医学, 2020, 42(4): 320-322. WANG Q H, ZHAO G J. Advances in cell cycle-associated kinases in tumors[J]. Beijing Medical Journal, 2020, 42(4): 320-322. |
| [11] |
高鑫, 张淑芳. 细胞分裂周期相关蛋白促肿瘤作用的研究进展[J]. 解放军医学院学报, 2019, 40(9): 904-907. GAO X, ZHANG S F. Research advances in role of cell cycle division-associated protein in tumors[J]. Academic Journal of Chinese PLA Medical School, 2019, 40(9): 904-907. |
| [12] |
郭爱叶, 李泮, 高岚. 细胞周期检测点激酶与肿瘤的关系研究进展[J]. 肿瘤基础与临床, 2019, 32(2): 181-184. GUO A Y, LI P, GAO L. Research progress on the relationship between cell cycle detection point kinase and tumor[J]. Journal of Basic and Clinical Oncology, 2019, 32(2): 181-184. DOI:10.3969/j.issn.1673-5412.2019.02.027 |
| [13] |
ZHENG K, HE Z D, KITAZATO K, et al. Selective autophagy regulates cell cycle in cancer therapy[J]. Theranostics, 2019, 9(1): 104-125. DOI:10.7150/thno.30308 |
| [14] |
SOBHANI N, D'ANGELO A, PITTACOLO M, et al. Updates on the CDK4/6 inhibitory strategy and combinations in breast cancer[J]. Cells, 2019, 8(4): 321. DOI:10.3390/cells8040321 |
| [15] |
WANG X, PENG P, PAN Z, et al. Psoralen inhibits malignant proliferation and induces apoptosis through triggering endoplasmic Reticulum stress in human SMMC7721 hepatoma cells[J]. Biological Research, 2019, 52(1): 34. DOI:10.1186/s40659-019-0241-8 |
| [16] |
ZHANG J, YANG Y, LEI L, et al. Rhizoma paridis saponins induces cell cycle arrest and apoptosis in non-small cell lung carcinoma A549 cells[J]. Medical Science Monitor, 2015, 21(3): 2535-2541. |
| [17] |
LI C C, YU F S, FAN M J, et al. Anticancer effects of cantharidin in A431 human skin cancer (Epidermoid carcinoma) cells in vitro and in vivo[J]. Environmental Toxicology, 2017, 32(3): 723-738. DOI:10.1002/tox.22273 |
| [18] |
王斌, 许诗雨, 刘嘉欣, 等. 黄连总生物碱联合运动通过阻滞细胞周期G1/S转换抑制原位移植4T1乳腺癌小鼠荷瘤生长的研究[J]. 中国中药杂志, 2019, 44(8): 1635-1641. WANG B, XU S Y, LIU J X, et al. Total alkaloids of Coptidis Rhizoma combined with exercise inhibits tumor growth of orthotopically transplanted 4T1 breast cancer mice by blocking cell cycle G1/S transformation[J]. China Journal of Chinese Materia Medica, 2019, 44(8): 1635-1641. |
| [19] |
樊帅君, 陈志成, 周菊明. 汉黄芩素对结肠癌LoVo细胞增殖、凋亡和周期及G1/S关卡调控因子的影响[J]. 时珍国医国药, 2017, 28(3): 555-557. FAN S J, CHEN Z C, ZHOU J M. Effects of hbaicalin on proliferation, apoptosis, cycle and G1/S checkpoint regulator of colon cancer LoVo cells[J]. Lishizhen Medicine and Materia Medica Research, 2017, 28(3): 555-557. |
| [20] |
钟伟枫, 刘思平, 潘斌, 等. 龙葵素通过诱导细胞周期G1/S阻滞抑制裸鼠前列腺癌细胞Du145移植瘤生长[J]. 南方医科大学学报, 2016, 36(5): 665-670. ZHONG W F, LIU S P, PAN B, et al. Solanine inhibits prostate cancer Du145 xenograft growth in nude mice by inducing cell cycle arrest in G1/S phase[J]. Journal of Southern Medical University, 2016, 36(5): 665-670. DOI:10.3969/j.issn.1673-4254.2016.05.013 |
| [21] |
侯新, 洪莉. 苦豆碱对宫颈癌Hela细胞的增殖、凋亡的影响[J]. 中国药师, 2020, 23(9): 1736-1740. HOU X, HONG L. Effects of aloperine on the proliferation and apoptosis of cervical cancer hela cells[J]. China Pharmacist, 2020, 23(9): 1736-1740. |
| [22] |
刘志华, 王刚, 沈建飞. 柴胡皂苷-D抑制宫颈癌Hela细胞的分子机制研究[J]. 中华中医药学刊, 2016, 34(12): 2931-2934. LIU Z H, WANG G, SHEN J F. Mechanism of saikosaponin-D inhibiting cervical cell hela[J]. Chinese Archives of Traditional Chinese Medicine, 2016, 34(12): 2931-2934. |
| [23] |
ZHU J, CHEN M J, CHEN N, et al. Glycyrrhetinic acid induces G1-phase cell cycle arrest in human non-small cell lung cancer cells through endoplasmic Reticulum stress pathway[J]. International Journal of Oncology, 2015, 46(3): 981-988. DOI:10.3892/ijo.2015.2819 |
| [24] |
KENT L N, LEONE G. The broken cycle: E2F dysfunction in cancer[J]. Nature Reviews Cancer, 2019, 19(6): 326-338. |
| [25] |
YUAN X, LI T, XIAO E L, et al. Licochalcone B inhibits growth of bladder cancer cells by arresting cell cycle progression and inducing apoptosis[J]. Food and Chemical Toxicology, 2014, 65(2): 242-251. |
| [26] |
周少荷. 丹参酮Ⅰ调控人肝癌7721细胞凋亡机制的研究[D]. 西安: 西北大学, 2018. ZHOU S H. Study on apoptosis mechanism of human hepatocellular carcinoma 7721 cells induced by tanshinone Ⅰ[D]. Xi'an: Northwest University, 2018. |
| [27] |
ZHANG Y, LI S, HE H, et al. Influence of Tanshinone IIA on apoptosis of human esophageal carcinoma Eca-109 cells and its molecular mechanism[J]. Thoracic Cancer, 2017, 8(4): 296-303. |
| [28] |
简晓顺, 尹一子, 舒文莹, 等. 丹参酮ⅡA通过上调P27表达诱导非小细胞肺癌NCI-H520细胞周期S期阻滞[A]. 广东省药学会, 2014: 1. JIAN X S, YIN Y Z, SHU W Y, et al. Tanshinone Ⅱ by raising A P27 expression induced by NCI H520-non-small cell lung cancer cell cycle S phase of the block[A]. Guangdong Pharmaceutical Society, 2014: 1. |
| [29] |
张哲楠, 邱琬婷, 曹世杰. 补骨脂酚诱导人乳腺癌MCF-7细胞S期周期阻滞及机制研究[J]. 中草药, 2020, 51(3): 702-709. ZHANG Z N, QIU W T, CAO S J. Effects and mechanism of bakuchiol-induced S-phase cell cycle arrest in human breast cancer MCF-7 cells[J]. Chinese Traditional and Herbal Drugs, 2020, 51(3): 702-709. |
| [30] |
孙勇. 淫羊藿苷对髓母细胞瘤细胞生长的作用及其机制研究[D]. 济南: 山东大学, 2017. SUN Y. The effect of icariin and its mechanism on medulloblastoma cell growth[D]. Ji'nan: Shandong University, 2017. |
| [31] |
冷远秀, 徐林, 陈芳, 等. 细胞周期蛋白B1在恶性肿瘤中的研究进展[J]. 重庆医科大学学报, 2021, 46(1): 1-4. LENG Y X, XU L, CHEN F, et al. Advances of cyclin B1 in malignant tumors[J]. Journal of Chongqing Medical University, 2021, 46(1): 1-4. |
| [32] |
林琳, 周菊英. 介导肿瘤细胞G2期周期阻滞的分子机制[J]. 国际肿瘤学杂志, 2017, 44(3): 186-189. LIN L, ZHOU J Y. Molecular mechanism of G2 phase cell cycle arrest in tumor cells[J]. Journal of International Oncology, 2017, 44(3): 186-189. |
| [33] |
ZHANG J, GAO Y, MA C, et al. Murrayanine induces cell cycle arrest, oxidative stress, and inhibition of phosphorylated p38 expression in A549 lung adenocarcinoma cells[J]. Medical Science Monitor, 2019, 25(3): 2002-2008. |
| [34] |
LI Y J, WANG X R, CHENG S L, et al. Diosgenin induces G2/M cell cycle arrest and apoptosis in human hepatocellular carcinoma cells[J]. Oncology Reports, 2015, 33(2): 693-698. |
| [35] |
CHANG M Y, SHIEH D E, CHEN C C, et al. Linalool induces cell cycle arrest and apoptosis in leukemia cells and cervical cancer cells through CDKIs[J]. International Journal of Molecular Sciences, 2015, 16(12): 28169-28179. |
| [36] |
KIM S J, KIM J M, SHIM S H, et al. Shikonin induces cell cycle arrest in human gastric cancer (AGS) by early growth response 1(Egr1)-mediated p21 gene expression[J]. Journal of Ethnopharmacology, 2014, 151(3): 1064-1071. |
| [37] |
LIU Y Y, WANG W, FANG B, et al. Anti-tumor effect of germacrone on human hepatoma cell lines through inducing G2/M cell cycle arrest and promoting apoptosis[J]. European Journal of Pharmacology, 2013, 698(1/2/3)): 95-102. |
| [38] |
LIU N, WANG K S, QI M, et al. Vitexin compound 1, a novel extraction from a Chinese herb, suppresses melanoma cell growth through DNA damage by increasing ROS levels[J]. Journal of Experimental & Clinical Cancer Research, 2018, 37(1): 269. |
| [39] |
LI X Q, BAI Y L, ZHANG D L, et al. Euphornin reduces proliferation of human cervical adenocarcinoma HeLa cells through induction of apoptosis and G2/M cell cycle arrest[J]. OncoTargets and Therapy, 2018, 11: 4395-4405. |
| [40] |
SHI J M, CHEN Q Q, XU M, et al. Recent updates and future perspectives about amygdalin as a potential anticancer agent: a review[J]. Cancer Medicine, 2019, 8(6): 3004-3011. |
| [41] |
罗燕, 蒋益兰, 李勇敏, 等. 柴胡皂苷D对乳腺癌MDAMB-231细胞增殖、周期及周期相关调控因子表达的影响[J]. 中国中西医结合杂志, 2019, 39(5): 61-65. LUO Y, JIANG Y L, LI Y M, et al. Effects of Saponin D on proliferation, cycle and expression of cycl-related regulatory factors in breast cancer MDA-MB-231 cells[J]. Chinese Association of Integrative Medicine, 2019, 39(5): 61-65. |
 2022, Vol. 41
2022, Vol. 41