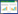文章信息
- 倪英群, 方朝晖, 李居一, 施慧, 余丹丹, 刘光菊, 陈文娟
- NI Yingqun, FANG Zhaohui, LI Juyi, SHI Hui, YU Dandan, LIU Guangju, CHEN Wenjuan
- 丹蛭降糖胶囊调控β-catenin蛋白在高磷诱导的糖尿病大鼠下肢血管内皮细胞钙化中的作用
- Effect of Danzhi Jiangtang Capsule on regulating β-catenin protein on high phosphorus-induced calcification of vascular endothelial cell in lower limb in diabetic mice
- 天津中医药大学学报, 2023, 42(1): 81-86
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(1): 81-86
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.01.16
-
文章历史
收稿日期: 2022-10-10
2. 安徽中医药大学, 合肥 230038
2. Anhui University of Traditional Chinese Medicine, Hefei 230038, China
血管钙化(VC)是糖尿病病情恶化、病死率增加的高危因素。在对21万例患者随访10年的Meta分析中显示,VC患者的总死亡风险和心血管事件风险是无血管钙化患者的3~4倍[1]。无论1型还是2型糖尿病患者,VC的发生率均高于非糖尿病患者[2-3]。糖尿病VC可分为内膜钙化和中膜钙化,内膜钙化与内膜增生和动脉粥样硬化性病变密切相关,累及大血管,相较于中膜钙化更易致血栓形成、斑块破裂,发生心血管事件。受多种因素的影响,内皮细胞可通过内皮-间充质转化(EndMT)激活骨形态发生信号,也可通过释放细胞因子及基质囊泡等促进血管平滑肌细胞发生成骨样分化,导致VC。因此,围绕内皮细胞(EC)的相关研究是VC防治领域的一个热点。目前,EC钙化的确切机制仍不清楚,临床治疗上还缺乏有效的措施。中医药具有延缓或阻止并发症、提高患者生活质量、多靶点整体论治、减少西药依赖、调节失调的脏腑功能等多重优势,为此一些学者开始了中药单体、复方等方面的研究,并取得了一定进展。中医学理论将糖尿病血管钙化归属于“瘀血”“胸痹”“脉痹”范畴,病位在脉[4],基本病机为“瘀血内阻”,治疗原则当以益气活血为主。本课题组前期研究已经证实具有益气活血功效的丹蛭降糖胶囊能够下调Wnt/β-链蛋白(β-catenin)通路的信号分子β-catenin水平,改善颈动脉内膜中层(IMT)厚度、缩小斑块面积、保护血管[5]。以此为基础,本项目研究丹蛭降糖胶囊通过Wnt/β-catenin调控下肢血管内皮细胞钙化的作用,以期拓宽糖尿病血管病变的防治途径。
1 材料与方法 1.1 动物健康SD大鼠,购自安徽省实验动物中心,动物许可证号:SCXK(皖)2017-001。18~20周龄,体质量均在(180±20)g。安徽中医药大学实验中心动物房饲养,保持室温、相对湿度45%~75%,自然光照周期,适应性喂养1周。
1.2 实验药物丹蛭降糖胶囊(太子参、牡丹皮、生地黄、泽泻、菟丝子、水蛭):0.38 g/粒,安徽中医药大学第一附属医院制剂中心生产,皖药制字:Z20090006,批号:20190316,国家专利号:ZL200310112845.1。
1.3 试剂主要试剂:VWF抗体(11778-1-AP,proteintech,中国);In Situ Cell Death Detection Kit(11684795910,罗氏,瑞士);抗荧光淬灭剂(S2100,Solarbio,中国);4’,6-二脒基-2-苯基吲哚(DAPI,D106471-5 mg,阿拉丁,中国);Super M-MLV反转录酶(PR6502,BioTeke,中国);2×Power Taq聚合酶链反应(PCR)MasterMix(PR1702,BioTeke,中国);DMEM培养基(12100-038,普诺赛,中国)。
1.4 仪器主要仪器:激光扫描共聚焦显微镜(OLYMPUS);超速冷冻离心机(H-2050R,湖南湘仪);荧光定量PCR仪(Exicycler,BIONEER);二氧化碳(CO2)培养箱(HF-90,上海力申)。
2 方法 2.1 模型建立、细胞提取、分组SD大鼠10只适应性饲养1周后,予高脂饲料喂养(普通饲料68.5%、猪油10%、蔗糖20%、猪胆盐0.5%、胆固醇1%),第13周模型组单次腹腔注射链脲佐菌素(STZ,35 mg/kg)并继续高脂饮食,第14周检测大鼠空腹血糖,按照2型糖尿病的诊断标准,空腹血糖>11.1 mmol/L为造模成功[6]。造模成功后取大鼠右下肢股动脉,提取大鼠EC,根据EC的培养方式(用含10%胎牛血清的DMEM培养基于37 ℃,5%CO2)进行培养。分组为:高磷组、丹蛭组、氯化锂(LiCL)组。另取10只健康大鼠,取同一位置单个EC作为空白组。调整各组稳转EC状态,除空白组外,其余各组加入高磷培养基(含有10 mmol/L β-甘油磷酸盐、50 mg/mL维生素C和1×10-7 mol/L胰岛素)诱导细胞钙化,同时丹蛭组和LiCL组给予10%含药血清(丹蛭降糖胶囊)干预。48 h后,LiCL组给予20 mmol/L LiCl继续干预处理48 h。
2.2 含药血清的制备及干预方法取10只健康SD大鼠,体质量(180±20)g,随机分为2组,即空白组和实验组。实验组以灌胃的方式给予丹蛭降糖胶囊5.4 g生药/(kg·d,相当于60 kg成人等效剂量10倍);同时空白组灌胃给予3 mL生理盐水。两组均连续给药7 d。末次给药后,常规麻醉大鼠,无菌条件下取腹主动脉血,于3 000 r/min离心后取血清(离心半径为10 cm),56 ℃水浴灭活30 min,同组混匀,0.22 μm滤膜过滤除菌,在-80 ℃条件下真空干燥48 h,干燥粉末-20 ℃保存备用。
2.3 检测指标及方法 2.3.1 细胞凋亡和增殖的检测实验采用原位末端标记(TUNEL)法和噻唑蓝(MTT)法检测:1)大鼠股动脉EC培养在M199培养基中,进行细胞传代,当细胞长至80%~90%时,去除培养基,加磷酸缓冲盐溶液(PBS)洗1~2次,进行胰酶消化1~3 min后,终止消化,将消化的细胞转移至15 mL离心管中,1 000 r/min离心5 min(离心半径为10 cm)。倒掉上清后,1∶3传代至培养皿中培养。将细胞分别种在6孔板中,每孔种1×106个细胞。2)待细胞贴壁后,使用不同含药血清的培养基培养细胞。3)24 h后,收集培养上清,胰酶消化,1 000 r/min离心5 min(离心半径为10 cm),弃上清。PBS洗3次,4 ℃,1 000 r/min离心5 min(离心半径为10 cm),弃上清。4)加入100 μL binding buffer重悬细胞,加入5 μL PI和5 μL FITC-Annexin V,混合均匀,常温避光孵育15 min,加入400 μL binding buffer混匀,立刻用流式细胞仪检测。MTT法测细胞增殖接上述步骤3):培养24 h后,向培养基中加入10 μL MTT(5 mg/mL),在细胞培养箱中继续培养约3 h。去除培养基,每孔加入100 μL二甲基亚砜(DMSO),摇晃均匀,570 nm波长测定吸光度。
2.3.2 实时定量(RT)-PCR mRNA检测Trizol法提取总细胞RNA,进行反转录。逆转录实验步骤按照试剂盒说明书操作,引物(沈阳万类生物科技有限公司)序列为α平滑肌肌动蛋白(α-SMA):F-GG GCATCCACGAAACCACCT,R-GAGCCGCCGATCCA GACAGA,扩增长度:216 bp;β-catenin:F-GTGAAG TTCTTGGCTATTACGA,R-TAGAGCAGACAGACAG CACCTT,扩增长度:184 bp;碱性磷酸酶(ALP):F-GTGGTATTGTAGGTGCTGTGGTC,R-ACGGTGTC GTAGCCTTCTGG,扩增长度:178 bp;骨桥蛋白(OPN):F-GCTTGGCTTACGGACTGA,R-GCAACTGGGATG ACCTTG,扩增长度:139 bp;卷曲同源物1(FZD1):F-ATGACGGCACCAAGACAGA,R-GGCAAGGGAT GGCATAACTC,扩增长度:180 bp;骨形态发生蛋白2(BMP2):F-GTTCTGTCCCTACTGATGAGTTTCT,R-CTGGCTGTGGCAGGCTTTAT,扩增长度:136 bp。
2.3.3 细胞β-catenin蛋白定位的检测各组取适量细胞悬液滴片,4%多聚甲醛4 ℃固定20 min,0.3%Triton X-100透膜,10%山羊血清封闭30 min。分别滴加兔抗鼠抗体β-catenin(1∶100),湿盒内4 ℃孵育过夜。次日室温放置30 min,PBS浸洗3次,加入Cy3标记的羊抗兔免疫荧光二抗(1∶300),37 ℃孵育1 h,DAPI复染细胞核,激光扫描共聚焦显微镜下观察细胞β-catenin蛋白定位。
2.4 统计学方法采用SPSS 19.0软件进行统计学处理,实验数据采用均数±标准差(x±s)表示,若方差齐,多组间比较采用单因素方差分析,两两比较采用LSD检验。P < 0.05为差异有统计学意义。
3 结果 3.1 丹蛭降糖胶囊对EC钙离子含量及细胞增殖、凋亡数量的影响与空白组相比,高磷组大鼠下肢EC钙离子含量、细胞凋亡数量升高,细胞增殖数量减少,差异具有统计学意义(P < 0.01)。与高磷组相比,丹蛭组大鼠下肢EC钙离子含量降低,细胞凋亡数量减少,细胞增殖数量升高,差异具有统计学意义(P < 0.01)。与丹蛭组比较,LiCL组细胞凋亡数量、钙离子含量增加,细胞增殖数量减少,差异具有统计学意义(P<0.01)。见表 1。
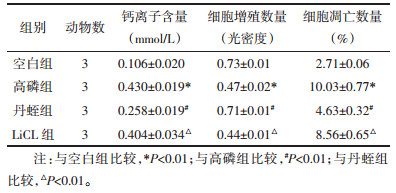
与空白对照组比较,高磷组大鼠下肢EC α-SMA、β-catenin、ALP、OPN、BMP2、FZD1表达升高,差异有统计学意义(P < 0.01)。与高磷组比较,丹蛭组大鼠下肢EC α-SMA、β-catenin、ALP、OPN、BMP2、FZD1表达降低,差异有统计学意义(P < 0.01)。与丹蛭组比较,LiCL组α-SMA、β-catenin、ALP、OPN、BMP2及FZD1表达增加,差异有统计学意义(P < 0.01)。见表 2。
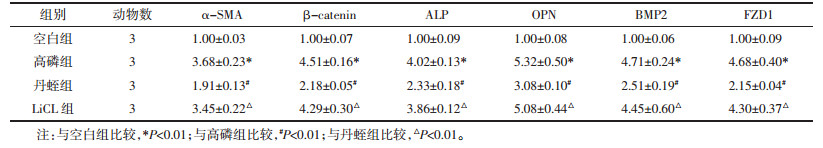
激光扫描共聚焦显微镜观察结果表明,β-catenin蛋白免疫荧光呈绿色,细胞核DAPI染色呈蓝色;空白组、丹蛭组β-catenin表达于细胞质且表达量少;高磷组多表达于细胞核内,且表达量上调,显现青蓝色荧光。与丹蛭组比较,LiCL组显微镜下观察显示细胞核内β-catenin表达量增加。见图 1。
|
| 图 1 丹蛭降糖胶囊对β-catenin蛋白定位的影响(×400) |
血管内皮钙化程度和部位已成为预测糖尿病患者心血管病死率的最佳指标[7-8]。维生素C是类似于骨代谢的一种主动的、多因素参与的、可调控的生物学过程[9]。钙离子作为主要的细胞内信使,参与调控许多细胞和组织的生理活动,包括凝血过程、肌肉收缩、新陈代谢、神经递质合成与释放、激素合成与分泌。在静息状态下,细胞内钙离子浓度总是保持在极低水平,细胞内外的钙离子浓度相差大约为1万倍。当血管EC损伤时,细胞会通过多种途径瞬间提高细胞内局部或全部的钙离子浓度,这就增加了对钙离子的需求[10-11]。同时损伤的EC产生大量因子,如炎症因子、转化生长因子-β等,可诱导血管壁细胞具有成骨分化的能力,能合成和分泌多种骨形成蛋白,如ALP、BMP2、OPN、骨粘连蛋白(ON)和骨钙素(OCN)等,在细胞外基质或细胞质中形成钙结节[12]。
研究发现,高糖激活Wnt信号通路,上调OCN、BMP2等骨相关蛋白的表达,促进人血管平滑肌细胞钙化[13]。Wnt家族是一种重要的细胞外信号配体,可通过与细胞膜表面受体FZD1及其共激活受体细胞外的部分结合,抑制β-catenin磷酸化,在细胞胞浆中大量聚集,促使其进入细胞核,进而调控细胞分化、增殖、凋亡等过程[14],是发生血管钙化的关键路径。β-catenin是介导Wnt经典信号途径的枢纽分子,研究发现β-catenin将有助于认知糖尿病血管钙化的分子机制。为此,本项目以β-catenin及细胞表型转化蛋白为主要考察指标,评价具有益气活血功效的纯中药制剂丹蛭降糖胶囊干预糖尿病血管EC钙化的作用。
中医认为,脉形成的物质基础是“气”与“血”。《素问·五常政大论》云:“人受天地之气以化生命也。”万物及人体均由“气”构成,人体经脉亦莫能外。《灵枢·决气》言:“奎遏营气,令无所避,是谓脉。”《灵枢·本脏》曰:“经脉者,行血气而营阴阳。”《妇人大全良方》记载:“夫人之生,以气血为本,人之病,未有不先伤其气血者。”成熟的脉管是血液赖以持续运行及营养脏腑组织的保障,故《灵枢·痈疽》中说:“中焦出气如露,上注豁谷而渗孙脉……血和则孙脉先满,溢乃注于络脉,皆盈乃注于经脉。”《黄帝内经》还将“脉”视为一个独立的实体脏器——“奇恒之腑”。中医理论认为,糖尿病日久气虚而致血行受阻则瘀滞不通,痰瘀互结,渐成痼结,痹阻血脉导致血管病变,加速血管钙化的进程,形成了“气血-脉-血管钙化”辨证理论,基本病机为“气虚瘀血内阻”,治疗原则当以益气活血为主。
本课题组以新安医学为理论基础[15-16],研制出的益气活血中药复方——丹蛭降糖胶囊(方药组成为太子参、生地黄、菟丝子、牡丹皮、水蛭、泽泻)已获得国家发明专利。在防治2型糖尿病血管病变中已得到广泛应用近20年,并取得良好的临床疗效。本方以太子参补益脾肾之气,生地黄滋养脾肾之阴,菟丝子补肾固精,牡丹皮、水蛭行气活血,化瘀通络,使肾络通畅,泽泻清热去痰浊。全方阴阳互济,通补兼施,寒温并调,补不碍邪,攻不伤正,共奏益气养阴、活血化瘀之功,以期达到阴阳平、瘀阻除、肾脉通之功效。课题组前期研究已表明,丹蛭降糖胶囊具有改善、修复内皮功能及抗氧化、抗炎、促进血管新生等作用[17-19]。
血磷升高可通过细胞Runt相关转录因子2(RUNX2)的表达以及产生基质囊泡,同时也可使骨细胞诱发成纤维细胞生长因子23(FGF23)的过表达等多种途径触发血管钙化[20-21],故本研究以高磷诱导下肢血管EC建立钙化模型,给予丹蛭降糖胶囊含药血清及β-catenin激动剂LiCL干预。结果显示,高磷组大鼠下肢EC钙离子含量、细胞凋亡数量及α-SMA、β-catenin、ALP、OPN、BMP2、FZD1指标表达升高,细胞增殖数量减少,且显微镜下观察显示β-catenin多表达于细胞核内。经丹蛭降糖胶囊含药血清干预后,细胞增殖数量增加,凋亡数量减少,细胞表型蛋白及β-catenin蛋白表达水平降低。在丹蛭降糖胶囊干预的基础上,给予β-catenin蛋白激动剂LiCL干预48 h,结果显示细胞凋亡数量、钙离子含量、α-SMA、β-catenin、ALP、OPN、BMP2及FZD1表达增加,细胞增殖数量减少,且显微镜下观察显示细胞核内的β-catenin表达量增加。因此,笔者推断丹蛭降糖胶囊具有防治糖尿病下肢EC钙化的作用,其机制可能是通过抑制β-catenin mRNA表达水平,下调β-catenin蛋白合成,降低β-catenin在细胞核中的表达,进而抑制下游细胞表型基因的转录及蛋白合成,达到防治血管钙化的目的。
| [1] |
黄辉. 血管钙化的基础和转化研究的探索[J]. 中山大学学报(医学科学版), 2017, 38(2): 184-188, 214. HUANG H. Basic and translational research of vascular calcification[J]. Journal of Sun Yat-Sen University (Medical Sciences), 2017, 38(2): 184-188, 214. |
| [2] |
ALMAN A C, MAAHS D M, REWERS M J, et al. Ideal cardiovascular health and the prevalence and progression of coronary artery calcification in adults with and without type 1 diabetes[J]. Diabetes Care, 2014, 37(2): 521-528. DOI:10.2337/dc13-0997 |
| [3] |
YAMADA S, GIACHELLI C M. Vascular calcification in CKD-MBD: roles for phosphate, FGF23, and klotho[J]. Bone, 2017, 100(2): 87-93. |
| [4] |
柳诗意, 张宁, 刘世巍, 等. 慢性肾脏病血管钙化机制研究进展及中医药研究概况[J]. 中国中西医结合肾病杂志, 2015, 16(4): 352-356. LIU S Y, ZHANG N, LIU S W, et al. Research progress of vascular calcification mechanism in chronic kidney disease and survey of traditional Chinese medicine[J]. Chinese Journal of Integrated Traditional and Western Nephrology, 2015, 16(4): 352-356. |
| [5] |
倪英群, 谢峰涛, 方朝晖. 基于Wnt/β-链蛋白表达评价丹蛭降糖胶囊对2型糖尿病患者血管的保护作用[J]. 中国临床药理学与治疗学, 2017, 22(5): 531-537. NI Y Q, XIE F T, FANG Z H. Danzhi Jiangtang Capsule protects vasculopathy of T2DM: an evaluation based on the expression of Wnt/β-catenin[J]. Chinese Journal of Clinical Pharmacology and Therapeutics, 2017, 22(5): 531-537. |
| [6] |
施红, 金国琴, 余文珍. 诱导构建最佳类似人类2型糖尿病大鼠的造模方式[J]. 中国临床康复, 2005, 9(39): 69-71. SHI H, JIN G Q, YU W Z. Establishing methods for constructing rat models of type 2 diabetes mellitus which are the most similar to human beings[J]. Chinese Journal of Clinical Rehabilitation, 2005, 9(39): 69-71. |
| [7] |
KRAMER C K, ZINMAN B, GROSS J L, et al. Coronary artery calcium score prediction of all cause mortality and cardiovascular events in people with type 2 diabetes: systematic review and meta-analysis[J]. BMJ, 2013, 34(6): f1654. |
| [8] |
COX A J, HSU F C, AGARWAL S, et al. Prediction of mortality using a multi-bed vascular calcification score in the diabetes heart study[J]. Cardiovascular Diabetology, 2014, 13(2): 160. |
| [9] |
FADINI G P, RATTAZZI M, MATSUMOTO T, et al. Emerging role of circulating calcifying cells in the bone-vascular axis[J]. Circulation, 2012, 125(22): 2772-2781. |
| [10] |
YANG W H. Calcium concentration response to uterine ischemia: a comparison of uterine fibroid cells and adjacent normal myometrial cells[J]. European Journal of Obstetrics&Gynecology and Reproductive Biology, 2014, 174(4): 123-127. |
| [11] |
LEJAY A. A new murine model of sustainable and durable chronic critical limb ischemia fairly mimicking human pathology[J]. European Journal of Vascular and Endovascular Surgery, 2015, 49(2): 205-212. |
| [12] |
GOLLEDGE J. Abdominal aortic calcification: clinical significance, mechanisms and therapies[J]. Current Pharmaceutical Design, 2014, 20(37): 5834-5838. |
| [13] |
颜建云, 周芹, 于汇民, 等. 高糖激活WNT信号通路促进血管平滑肌细胞钙化[J]. 南方医科大学学报, 2015, 35(1): 29-33. YAN J Y, ZHOU Q, YU H M, et al. High glucose promotes vascular smooth muscle cell calcification by activating WNT signaling pathway[J]. Journal of Southern Medical University, 2015, 35(1): 29-33. |
| [14] |
KAVANAGH D H, SAVAGE D A, PATTERSON C C, et al. Haplotype association analysis of genes within the WNT signalling pathways in diabetic nephropathy[J]. BMC Neph-rology, 2013, 14(3): 126. |
| [15] |
方朝晖, 赵进东, 范青云, 等. 挖掘新安医学消渴文献, 丰富糖尿病文献研究[J]. 中华中医药杂志, 2013, 28(11): 3339-3341. FANG Z H, ZHAO J D, FAN Q Y, et al. Dredge up Xin'an medicine Xiaoke disease literature, in order to abundance diabetes mellitus literature study[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2013, 28(11): 3339-3341. |
| [16] |
方朝晖, 赵进东. 新安医学与消渴浅析[J]. 中国中医基础医学杂志, 2012, 18(11): 1187-1188. FANG Z H, ZHAO J D. Analysis of Xin'an medicine and diabetes[J]. Chinese Journal of Basic Medicine in Traditional Chinese Medicine, 2012, 18(11): 1187-1188. |
| [17] |
尤良震, 于东东, 黄万秋, 等. 基于microRNAs与炎症因子相关性探讨丹蛭降糖胶囊对GK大鼠糖尿病大血管病变治疗作用机制[J]. 中国中药杂志, 2019, 44(20): 4519-4528. YOU L Z, YU D D, HUANG W Q, et al. Mechanism of Danzhi Jiangtang Capsules in treatment of diabetic macrovascular disease in GK rats based on correlation between microRNAs and inflammatory factors[J]. China Journal of Chinese Materia Medica, 2019, 44(20): 4519-4528. |
| [18] |
施慧, 王靓, 方朝晖, 等. 丹蛭降糖胶囊干预糖尿病心肌损伤作用及机制的实验研究[J]. 中国中药杂志, 2019, 44(23): 5159-5165. SHI H, WANG L, FANG Z H, et al. Experimental study on effect and mechanism of Danzhi Jiangtang Capsules on diabetic myocardial injury[J]. China Journal of Chinese Materia Medica, 2019, 44(23): 5159-5165. |
| [19] |
倪英群, 方朝晖, 施慧. 丹蛭降糖胶囊调控VEGF信号通路促糖尿病大鼠血管新生的作用机制[J]. 北京中医药大学学报, 2020, 43(2): 141-147. NI Y Q, FANG Z H, SHI H. Effect and mechanism of Danzhi Jiangtang Capsule on diabetic angiogenesis through regulatingVEGF signaling pathway[J]. Journal of Beijing University of Traditional Chinese Medicine, 2020, 43(2): 141-147. |
| [20] |
刘小锋, 何菂, 蔡嫣, 等. 高血磷诱导慢性肾衰患者血管钙化作用机制[J]. 生理科学进展, 2014, 45(1): 21-26. LIU X F, HE D, CAI Y, et al. The mechanisms of high-phosphate-induced vascular calcification in patients with chronic kidney disease[J]. Progress in Physiological Sciences, 2014, 45(1): 21-26. |
| [21] |
KENDRICK J. The role of phosphorus in the development and progression of vascular calcification[J]. American Journal of Kidney Diseases, 2011, 58(5): 826-834. |
 2023, Vol. 42
2023, Vol. 42