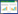文章信息
- 王继林, 冯晓姣, 党文利, 李紫微, 刘志东, 皮佳鑫
- WANG Jilin, FENG Xiaojiao, DANG Wenli, LI Ziwei, LIU Zhidong, PI Jiaxin
- 黄芩苷-小檗碱复合物及纳米晶在Caco-2细胞单层模型的吸收特性研究
- Absorption properties of baicalin-berberine complex and nanocrystals in Caco-2 monolayer model
- 天津中医药大学学报, 2023, 42(1): 87-94
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(1): 87-94
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.01.17
-
文章历史
收稿日期: 2022-09-17
2. 天津中医药大学现代中药发现与制剂技术教育部工程中心, 天津 301617
2. Engineering Research Center of Modern Chinese Medicine Discovery and Preparation Technique, Ministry of Education, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
近年来,在中药复方研究中,其有效成分的相互作用备受关注,其中自沉淀现象较为常见[1]。黄芩和黄连是临床常用药对,常见于黄连解毒汤[2]、葛根芩连汤[3]等方剂。在煎煮过程中苷类[黄芩苷(BA)]与生物碱类[小檗碱(BBR)]成分具有自沉淀现象[4]。研究表明,BA中羧酸阴离子与BBR中季铵阳离子之间易发生相互作用,复合成盐,即BA-BBR复合物(图 1)[5-6]。BA-BBR复合物溶解度、油水分配系数、熔点和紫外吸收光谱与原药存在显著差异,可能影响其在体内的胃肠道吸收行为[7-8]。同时,在药效学方面,BA-BBR复合物在抗菌和治疗腹泻型肠易激综合征方面具有显著的协同作用[6, 9]。
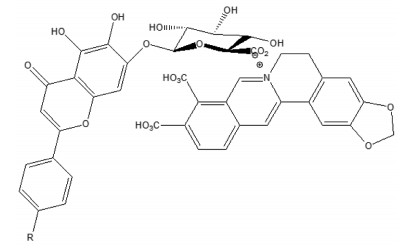
|
| 图 1 BA和BBR形成的BA-BBR复合物结构 |
纳米晶可以被定义为纳米级药物颗粒的胶体分散体,与较大尺寸的材料相比,其具有更大的表面积和更高的表观溶解度。由于没有载体材料,纳米晶的载药量高达50%~100%,显著高于传统纳米制剂,在口服给药中具有提高溶解度、溶解速率以及对生物表面的强黏附性等独特优势[10-12]。人体吸收药物的主要场所是小肠,人结肠腺癌细胞系(Caco-2)在一定的培养条件下,可以在体外分化为连续的细胞单层,表达各种标志酶,模拟小肠对药物的摄取、代谢、排放及跨细胞转运等过程,已广泛应用于各种纳米体系口服吸收及跨膜转运的体外筛选[13-14]。
本课题组前期研究发现纳米晶技术可显著提高BA-BBR复合物的生物利用度。为进一步解释其口服吸收特性和跨膜转运机制,深入了解该复合物纳米微粒在细胞层面的吸收特性,本实验构建Caco-2细胞单层模型,考察BA-BBR复合物及纳米晶在肠上皮细胞摄取转运差异及P-糖蛋白(P-gp)抑制剂维拉帕米(Ver)对其转运的影响,初步阐释纳米晶技术提高BA-BBR肠吸收原因,以期为BA-BBR体内吸收研究提供理论依据,从而更好地理解中药多成分纳米混悬体系的口服吸收过程。
1 材料与仪器 1.1 细胞Caco-2细胞株(SCSP-5027)购自中国科学院干细胞库,本实验所用细胞为45~50代。
1.2 仪器十万分之一天平(XP205,瑞士Mettler Toledo公司);膜电位仪(EVOM2,美国WPI公司);酶标仪(Spark,瑞士帝肯公司);高压均质机(AH00D,奥地利ATS工业系统有限公司);粒度与电位分析仪(Nano-ZS,英国Marlvern公司);高速搅拌仪(RW20,德国IKA集团);生物安全柜(美国THERMO FISHER公司);倒置显微镜(DMIL,德国LEICA公司);二氧化碳(CO2)培养箱(Heracell BIOS 160i,美国THERMO公司);高效液相色谱仪(日本岛津公司,包括SPD-20A紫外监测器,LC-20AT泵)。
1.3 实验材料与试剂MEM培养基(不含谷氨酰酸,美国Gibco公司),磷酸缓冲盐溶液(PBS,北京索莱宝科技有限公司),胎牛血清(FBS,美国Gibco公司),乙二胺四乙酸(EDTA,美国Gibco公司),非必需氨基酸(NEAA,美国Gibco公司),谷氨酰胺替代物(Glutamax,美国Gibco公司),丙酮酸钠(美国Gibco公司),青霉素和链霉素(双抗,美国Gibco公司),Cell Counting Kit-8(CCK-8,东仁化学科技有限公司),黄芩苷对照品(含量95.4%,中国食品药品检定研究院),小檗碱对照品(含量98.0%,中国食品药品检定研究院),黄芩苷原料药(南京泽郎生物科技有限公司),盐酸小檗碱原料药(南京泽郎生物科技有限公司),泊洛沙姆188(P188,德国BASF股份公司),Ver盐酸盐(上海源叶生物科技有限公司),维生素C、氯化钾(KCl)、无水氯化钠(NaCl)、氯化钙(CaCl2)、七水硫酸镁(MgSO4·7H2O)、十二水磷酸二氢钠(Na2HPO4·12H2O)、碳酸氢钠(NaHCO3)、磷酸二氢钾(KH2PO4)、葡萄糖均为分析纯。细胞培养瓶、96孔细胞培养板、24孔Transwell细胞培养板均为美国Corning公司。
2 实验方法 2.1 BA-BBR复合物制备参照文献[7],并优化其反应条件。精密称取摩尔比为1∶1的BA、BBR原料药,置于圆底烧杯中加入适量去离子水,于60 ℃微沸回流1 h,抽滤,滤饼减压干燥后加入甲醇溶液,加热至全部溶解,静置挥发溶剂,干燥即得复合物。
2.2 BA-BBR纳米晶的制备纳米晶制备方法参考文献[15],并在其基础上进行优化。称取适量BA-BBR复合物于0.2%P188水溶液中,超声预分散,转移至高压均质机中,300 bar全循环5次,再1 000 bar全循环25次,即得纳米晶混悬液。将纳米晶混悬液以50 nm微孔滤膜过滤,以去离子水洗涤,抽滤,即得BA-BBR纳米晶。
2.3 供试溶液的配置 2.3.1 Hank’s平衡溶液(HBSS溶液)分别称取NaCl 8.00 g、KCl 0.40 g、CaCl2 0.14 g、MgSO4·7H2O 0.20 g、Na2HPO4·12H2O 0.06 g、NaHCO3 0.35 g、葡萄糖1.00 g、KH2PO4 0.06 g于1 L容量瓶中,加适量超纯水溶解,定容至刻度线。以维生素C调节pH至6.8,即得,4 ℃冰箱保存备用。
2.3.2 BA供试液和BBR供试液精密称取BA原料药5.00 mg,加入适量HBSS溶液,溶解并稀释至15 μg/mL,即得。同法制备15 μg/mL的BBR供试液。
2.3.3 BA、BBR物理混合物供试液精密称取摩尔比为1∶1的BA与BBR原料药共5.00 mg,用HBSS溶液稀释至BA、BBR浓度均为15 μg/mL的溶液作为物理混合物供试液。
2.3.4 BA-BBR复合物供试液精密称取适量复合物,用MEM稀释至1 000、500、250、100、50、25、10、5、1 μg/mL作为供试液,用于给药浓度筛选。
2.3.5 BA-BBR纳米晶供试液将“2.2”项下制备的纳米晶用MEM稀释至1 000、500、250、100、50、25、10、5、1 μg/mL作为供试液,用于筛选给药浓度。
2.3.6 对照品溶液的制备精密称取BA、BBR对照品各5 mg,分别置于25 mL容量瓶中并加入甲醇定容作为对照品贮备溶液。取上述对照品贮备溶液各1 mL,以HBSS溶液稀释,制备得到BA、BBR浓度分别为20.56 μg/mL与20.44 μg/mL的混合对照品溶液。
2.4 分析方法的建立与方法学考察 2.4.1 分析方法1)色谱柱。Inertsil ODS-3 C18柱(4.6 mm×150 mm,5 μm)。2)流动相。A:0.2%甲酸水-B:乙腈。3)浓度梯度。0~5 min,B:20%~40%;5~10 min,B:40%~60%;10~12 min,B:60%~20%;12~15 min,B:20%。4)检测波长。280 nm。5)柱温。25 ℃。6)流速。1 mL/min。7)进样量。20 μL。
2.4.2 专属性分别取HBSS溶液、HBSS+对照品混合溶液、实测样品溶液进样考察专属性。
2.4.3 线性吸取混合对照品溶液适量,以HBSS缓冲液依次稀释浓度梯度为2.500、1.250、0.625、0.125、0.025、0.005 μg/mL,进样,以待测物峰面积为纵坐标,待测物浓度为横坐标,进行线性回归,计算相关系数。
2.4.4 精密度取混合对照品溶液,按照色谱条件连续进样测定6次,计算日内精密度;后连续测定3 d,计算日间精密度。
2.4.5 重复性取同一样品供试液6份,按照色谱条件进行测定,考察重复性。
2.4.6 稳定性取样品供试液,进样室放置12 h后,按照色谱条件进样测定,考察稳定性。
2.4.7 回收率取“2.3.6”项下对照品溶液10 μL,加入至200 μL的空白细胞接收液中。按照“2.4.1”项下色谱条件进样测定,以所测值与真实值之比计算回收率。
2.5 Caco-2细胞培养Caco-2培养在含1%非必需氨基酸、1%谷氨酰胺替代物、1%丙酮酸钠、1%青霉素和链霉素以及20%胎牛血清的MEM培养基中。置于37 ℃,5%CO2,每隔4 d传代1次,传代48 h内不能换液,隔日换液。当细胞生长至面积占约80%时,用胰酶消化并传代。
2.6 给药浓度筛选取47~49代Caco-2细胞,以7×104/mL的密度将Caco-2细胞种于96孔板上,每孔100 μL,于37 ℃培养箱中培养,细胞贴壁后,每块板分别加入100 μL用含血清的MEM稀释的BA-BBR复合物及纳米晶,浓度分别为1 000、500、250、100、50、25、10、5、1 μg/mL,每个浓度设置6个复孔。孵育24 h后,取出每孔药物,加入用MEM稀释10倍的CCK-8溶液100 μL,置于37 ℃培养箱中孵育45 min,用酶标仪在450 nm波长下检测吸光度(A)值,并计算细胞存活率。
|
取1×105/mL的细胞悬液接种在24孔transwell小室中,顶端侧(AP)加入0.2 mL培养基,基底侧(BL)加入1.3 mL培养基。前7 d隔日换液,后14 d每日换液,培养至21 d。期间每隔3 d利用EVOM2型膜电位仪检测两侧培养液的跨膜电阻值,查看膜的完整性和致密性。
2.8 Caco-2细胞转运实验 2.8.1 BA-BBR复合物及纳米晶的转运特性取“2.7”项下满足条件的细胞模型用于实验。实验前用预热至37 ℃、pH=6.8的HBSS溶液润洗AP侧和BL侧各2次,置于培养箱中平衡30 min,弃培养液。分别在AP侧加入用pH=6.8的HBSS溶液稀释的BA、BBR原料药溶液、物理混合溶液、BA-BBR复合物溶液以及BA-BBR纳米晶混悬液,溶液浓度均为30 μg/mL,BL侧加入空白HBSS溶液1.3 mL作为接收池。以上处理后将24孔transwell板置于细胞培养箱中,分别于30、60、90、120、150、180 min从接收池内取样200 μL,并补足同体积空白HBSS溶液。取出的样品离心后取上清液,高效液相色谱(HPLC)法测定BA和BBR含量,计算累积透过量(ΔQ)和表观渗透系数(Papp)[16]。

|
其中CN为第N个时间点所取样品的浓度(μg/mL),∑M=1N-1为第1个至第n-1个时间点所取样品浓度之和(μg/mL),C0为药物初始浓度(μg/mL),V1为药物接收端的体积(mL),V2为各时间点的取样体积(mL),ΔQ为药物在Δt时间段内透过的量(μg),Papp的单位常用cm/s表示,A为细胞表面积,在本模型中支持膜面积(0.33 cm2)。
2.8.2 P-gp蛋白对BA-BBR复合物及纳米晶的转运影响取符合转运条件且生长良好的transwell单层细胞,实验前用预热至37 ℃、pH=6.8的HBSS溶液(含Ver 100 μmol/L)润洗AP侧和BL侧各2次,置于培养箱中平衡30 min,弃培养液。分别在AP侧加入用pH=6.8的HBSS溶液(含Ver 100 μmol/L)配置的浓度为30 μg/mL BA-BBR复合物溶液以及纳米晶溶液,BL侧加入空白HBSS溶液1.3 mL作为接收池。以上处理后将24孔transwell板置于细胞培养箱中,分别于30、60、90、120、150、180 min从接收池内取样200 μL,并补足同体积空白的HBSS溶液(含Ver 100 μmol/L)。其他操作步骤同前。
2.9 统计学分析采用SPSS 25.0统计软件对实验结果进行分析处理,实验结果以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两两比较采用两独立样本t检验,P < 0.05表示差异有统计学意义。
3 结果 3.1 分析方法的建立与方法学考察 3.1.1 专属性专属性结果表明HBSS溶液对BA、BBR的测定无干扰。见图 2。
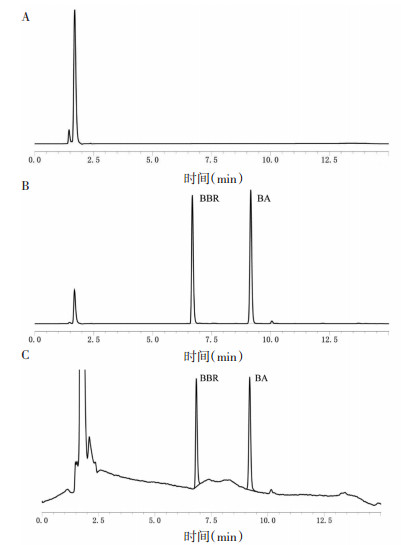
|
| 注:A.HBSS溶液;B.HBSS+BA、BBR对照品溶液;C.接收液。 图 2 专属性图谱 |
以待测物峰面积为纵坐标,待测物浓度为横坐标,进行线性回归,得到BA、BBR在HBSS缓冲液中的标准曲线。线性方程和回归系数提示线性关系良好。见表 1。
日间和日内精密度RSD均小于3%,表明仪器精密度良好;重复性RSD小于3%,表明该方法重复性良好;稳定性RSD小于3%,表明供试品溶液在24 h内基本稳定;BA和BBR回收率在98.08%~100.77%,且RSD小于3%,表明该定量方法较好,可用于化合物BA和BBR含量测定。见表 2。
经粒度与电位分析仪检测,BA-BBR纳米晶混悬液的粒径为(295.4±0.9)nm,PDI为(0.208±0.1),Zeta电位为(-10.3±0.2)mV,与其他文献研究报道所需粒径大小范围相近[17]。见图 3。
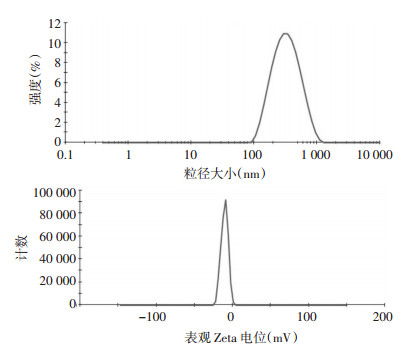
|
| 注:A为Zeta强度分布,B为Zeta电位分布。 图 3 BA-BBR纳米晶粒径和Zeta电位 |
CCK-8法检测BA-BBR复合物及纳米晶对Caco-2细胞的毒性。BA-BBR复合物及纳米晶浓度在100~1 000 μg/mL时,细胞存活率与空白组相比,差异有统计学意义,无法作为给药浓度。随着药物浓度的降低,在1~50 μg/mL时,孵育24 h后细胞存活率均大于95%,故选择BA-BBR复合物及纳米晶的安全浓度范围是1~50 μg/mL。见图 4。
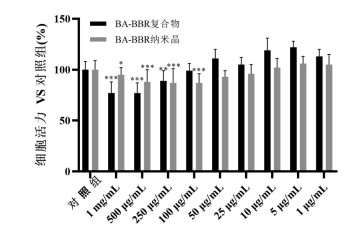
|
| 图 4 BA-BBR复合物及纳米晶混悬液对Caco-2细胞毒性的影响(x±s,n=6) |
当跨膜电阻值(TEER)大于500 Ω·cm2时[18],Caco-2细胞单层膜致密性完整,可以用于跨膜转运实验研究。本实验中Caco-2细胞单层膜TEER随着培养时间的增长而增高,到第21天时,平均TEER为(597.56±96.06)Ω·cm2,符合Caco-2细胞单层模型。见图 5。
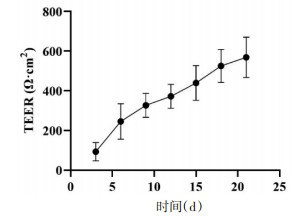
|
| 图 5 TEER随培养时间增加的变化趋势(x±s,n=12) |
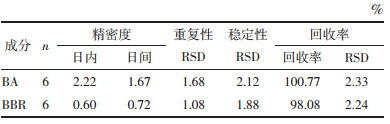
BA-BBR复合物及其纳米晶在Caco-2细胞模型上的累积转运量见图 6,表观渗透系数见表 3。对比BA、BBR单体化合物和物理混合物结果,各自累积转运量和Papp值无显著差异,表明物理混合过程对BA和BBR渗透特性和跨膜运输能力无显著影响。
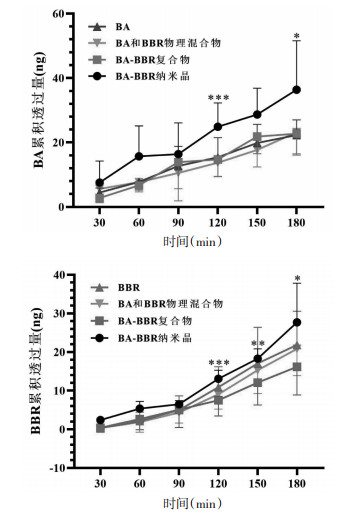
|
| 注:与BA-BBR复合物比较,*P < 0.05,**P < 0.01,***P < 0.001。 图 6 BA-BBR复合物及纳米晶在Caco-2细胞模型转运的累积转运量(x±s) |
而与物理混合物相比,BA-BBR复合物组中BA的累积转运量无显著变化,表明复合物的形成对BA成分在Caco-2上的吸收特性无显著影响;BBR累积转运量在90 min后略低于物理混合物组,表明复合物的形成降低了BBR在Caco-2细胞上的被动扩散能力。同时结合表 3可知,与物理混合物组相比,BA-BBR复合物组Papp值均有所下降,其中BBR的Papp值显著降低,表明BA-BBR复合物不同于简单的两种成分物理混合,其具有自身渗透属性,在细胞层面表现出了低渗透性和低转运量。
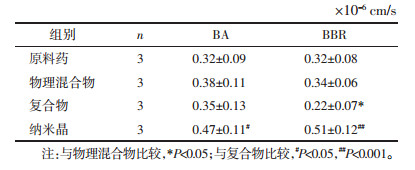
3.5.2 纳米晶技术对BA-BBR复合物的改善作用与BA-BBR复合物组相比,纳米晶组中BA累积转运量在120 min和180 min时均显著提高;BBR累积转运量在90 min之后显著提高。表 3结果显示,与复合物组相比,纳米晶组BA和BBR的Papp值均显著提高:BA的Papp值从(0.35±0.13)cm/s提升至(0.47±0.11)cm/s,提高约1.3倍;BBR的Papp值从(0.22±0.07)cm/s提升至(0.51±0.12)cm/s,提高约2.3倍。结果表明,纳米晶技术可以改善BA-BBR复合物的渗透性和跨膜转运能力,这可能与纳米晶技术能够通过减小药物粒径来增加药物溶解度[19]以及纳米尺度药物微粒具有“整体转运”特性有关[20]。
3.5.3 P-gp蛋白对BA-BBR复合物及纳米晶的转运影响Ver对BA-BBR复合物及纳米晶细胞转运作用结果见表 4。加入P-gp抑制剂Ver后,BA-BBR复合物中BA和BBR的Papp值均显著增加,分别从(0.35±0.13)cm/s和(0.22±0.07)cm/s提高至(0.53±0.09)cm/s和(0.45±0.09)cm/s,分别提高了约1.5倍和2.0倍。同时,纳米晶组中BA和BBR在Ver的影响下Papp值略有增加,但无统计学差异。结果表明,BA-BBR复合物的转运过程受到P-gp外排作用的影响,而药物纳米化后可以部分减弱P-gp的外排作用[21]。
本实验采用Caco-2细胞单层模型模拟小肠上皮细胞研究BA-BBR复合物及纳米晶的肠转运情况,从药物跨膜方面阐释纳米晶技术提高BA-BBR复合物口服吸收的原因。BA和BBR是黄芩与黄连中主要活性成分,两者在Caco-2上均以被动扩散为主要转运方式[22-23]。BA的极性限制了被动扩散的能力,同时载体介导的转运也是限制BA吸收的重要原因之一[24]。BBR从底部到顶端的转运量多于从顶端到底部,表明介导蛋白也是限制BBR在胃肠道吸收的重要原因之一[25]。表观渗透系数常用于评价药物在体内的吸收率,一般认为Papp < 1×10-6 cm/s,药物吸收不良,在体内吸收率 < 20%[26]。而BA-BBR复合物中BA和BBR的Papp值均 < 1×10-6 cm/s,表明BA-BBR复合物为小肠吸收不良的药物,可能是因为BA和BBR的亲水性羧基和季铵碱存在于复合物的内侧,使BA和BBR的疏水性面向复合物的外侧,导致溶解度降低,影响肠道吸收[7],与其他文献报道的BA和BBR单体均为吸收不良药物相符[27-28]。
纳米晶技术在口服难溶性药物方面表现出较多优势,包括改善口服吸收、提高生物利用度、快速起效等[10]。此外,纳米尺度药物微粒具有“整体转运”特性,可被消化道上皮细胞通过主动转运摄取[20]。针对BA-BBR复合物,可通过减小药物的粒径,增强药物在Caco-2细胞单层模型上的接触面积,进而增强其被动扩散和跨膜运输能力。加入Ver后,BA-BBR复合物外排作用减弱,说明外排作用进一步降低了复合物的渗透性。同时Ver对于BA-BBR纳米晶组的Papp值有提升趋势,但无统计学意义,推测纳米晶技术可通过增强药物的被动扩散能力,减弱外排作用,进而增加BA-BBR复合物跨膜转运量。
本研究结果显示,BA-BBR复合物纳米晶的Papp值相较于复合物,虽有显著提高,但仍属于低渗透性范围。限于细胞模型的局限性,仍需要开展组织和整体动物实验,采用多种研究模型从不同角度评价和阐释纳米晶对于提高药物渗透能力、增强药物吸收的积极作用。
| [1] |
田学浩, 张昊, 李桐, 等. 中药配伍理论科学内涵的外在表象: 复方水煎自沉淀[J]. 中草药, 2017, 48(22): 4778-4783. TIAN X H, ZHANG H, LI T, et al. New strategy on scientific connotation of Chinese materia medica compatibility enlightened by precipitation from Chinese materia medica formula decoction[J]. Chinese Traditional and Herbal Drugs, 2017, 48(22): 4778-4783. DOI:10.7501/j.issn.0253-2670.2017.22.029 |
| [2] |
潘林梅, 傅佳, 朱华旭, 等. 黄连解毒汤提取动态过程及沉淀产生机制的初步研究[J]. 中国中药杂志, 2010, 35(1): 40-43. PAN L M, FU J, ZHU H X, et al. Preliminary study to investigate dynamic extract process of Huanglian Jiedu Tang and the mechanism of subsidence produce[J]. China Journal of Chinese Materia Medica, 2010, 35(1): 40-43. |
| [3] |
陈丽红, 王强. 葛根芩连汤不同配伍对黄芩苷、小檗碱含量的影响[J]. 西北药学杂志, 2005, 20(4): 147-149. CHEN L H, WANG Q. Influence of various compatibilities on the content of baicalin and berberine in Gegen Qinlian Decoction[J]. Northwest Pharmaceutical Journal, 2005, 20(4): 147-149. DOI:10.3969/j.issn.1004-2407.2005.04.001 |
| [4] |
张晓雷, 周明眉, 贾伟, 等. 黄连、黄芩及其配伍药对的现代研究概况[J]. 吉林中医药, 2010, 30(2): 163-166. ZHANG X L, ZHOU M M, JIA W, et al. A survey of modern research on coptis chinensis, scutellaria baicalensis and their compatible drug pairs[J]. Jilin Journal of Traditional Chinese Medicine, 2010, 30(2): 163-166. DOI:10.3969/j.issn.1003-5699.2010.02.042 |
| [5] |
WANG J R, TANAKA T, ZHANG H, et al. Formation and conformation of baicalin-berberine and wogonoside-berberine complexes[J]. Chemical & Pharmaceutical Bulletin, 2012, 60(6): 706-711. |
| [6] |
LI T, WANG P L, GUO W B, et al. Natural berberine-based Chinese herb medicine assembled nanostructures with modified antibacterial application[J]. ACS Nano, 2019, 13(6): 6770-6781. DOI:10.1021/acsnano.9b01346 |
| [7] |
孙磊, 冯军, 雷艳丽, 等. 黄芩苷-盐酸小檗碱复合物的溶解度与油水分配系数测定[J]. 中国实验方剂学杂志, 2017, 23(21): 35-38. SUN L, FENG J, LEI Y L, et al. Determination of equilibrium solubility and oil-water partition coefficient of baicalin-berberine hydrochloride complex[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2017, 23(21): 35-38. |
| [8] |
ZHANG C Z, ZHAO R, YAN W Q, et al. Compositions, formation mechanism, and neuroprotective effect of compound precipitation from the traditional Chinese prescription Huang-Lian-Jie-du-Tang[J]. Molecules, 2016, 21(8): 1094. DOI:10.3390/molecules21081094 |
| [9] |
LI L, CUI H R, LI T, et al. Synergistic effect of berberine-based Chinese medicine assembled nanostructures on diarrhea-predominant irritable bowel syndrome in vivo[J]. Frontiers in Pharmacology, 2020, 11(11): 1210. |
| [10] |
GAO L, LIU G Y, MA J L, et al. Application of drug nanocrystal technologies on oral drug delivery of poorly soluble drugs[J]. Pharmaceutical Research, 2013, 30(2): 307-324. DOI:10.1007/s11095-012-0889-z |
| [11] |
SHI T T, LYU Y J, HUANG W Z, et al. Enhanced transdermal delivery of curcumin nanosuspensions: a mechanistic study based on co-localization of particle and drug signals[J]. International Journal of Pharmaceutics, 2020, 588(2): 119-127. |
| [12] |
LEI Y Y, KONG Y D, SUI H, et al. Enhanced oral bioavailability of glycyrrhetinic acid via nanocrystal formulation[J]. Drug Delivery and Translational Research, 2016, 6(5): 519-525. |
| [13] |
孙敏捷, 盛星, 胡一桥. Caco-2细胞单层模型的建立与验证[J]. 中国药学杂志, 2006, 41(18): 1431-1434. SUN M J, SHENG X, HU Y Q. Establishment and validation of caco-2 cell lines for lntestinal epithelial permeability[J]. Chinese Pharmaceutical Journal, 2006, 41(18): 1431-1434. |
| [14] |
蔡润兰, 王敏, 齐云, 等. Caco-2细胞模型验证指标的选择与评判[J]. 中国药学杂志, 2008, 43(24): 1871-1875. CAI R L, WANG M, QI Y, et al. Selection and utilization on the evaluation criterions of Caco-2 cell model[J]. Chinese Pharmaceutical Journal, 2008, 43(24): 1871-1875. |
| [15] |
GUO M R, WEI M D, LI W, et al. Impacts of particle shapes on the oral delivery of drug nanocrystals: mucus permeation, transepithelial transport and bioavailability[J]. Journal of Controlled Release: Official Journal of the Controlled Release Society, 2019, 30(7): 64-75. |
| [16] |
LI Y J, HU X B, LU X L, et al. Nanoemulsion-based delivery system for enhanced oral bioavailability and Caco-2 cell monolayers permeability of berberine hydrochloride[J]. Drug Delivery, 2017, 24(1): 1868-1873. |
| [17] |
XIE Y K, SHI B K, XIA F, et al. Epithelia transmembrane transport of orally administered ultrafine drug particles evidenced by environment sensitive fluorophores in cellular and animal studies[J]. Journal of Controlled Release: Official Journal of the Controlled Release Society, 2018, 270(1): 65-75. |
| [18] |
HU X W, FAN W F, YU Z, et al. Evidence does not support absorption of intact solid lipid nanoparticles via oral delivery[J]. Nanoscale, 2016, 8(13): 7024-7035. |
| [19] |
ZHANG J J, LYU H X, JIANG K, et al. Enhanced bioavailability after oral and pulmonary administration of baicalein nanocrystal[J]. International Journal of Pharmaceutics, 2011, 420(1): 180-188. |
| [20] |
SHEN C Y, YANG Y Q, SHEN B D, et al. Self-discriminating fluorescent hybrid nanocrystals: efficient and accurate tracking of translocation via oral delivery[J]. Nanoscale, 2017, 10(1): 436-450. |
| [21] |
刘倩. 纳米晶技术增加难溶性药物的透膜性和跨膜转运的机理研究[D]. 北京: 军事科学院, 2019. LIU Q. Study on the mechanism of nanocrystal technology to increase the permeability and transmembrane transport of insoluble drugs[D]. Beijing: Military Academy of Sciences, 2019. |
| [22] |
李楠, 杜青青, 蒋学华. 黄芩苷磷脂复合物在Caco-2细胞模型中的吸收机制[J]. 华西药学杂志, 2013, 28(1): 58-59. LI N, DU Q Q, JIANG X H. Absorption mechanism of baicalin phospholipid complex in across Caco-2 monolayer model[J]. West China Journal of Pharmaceutical Sciences, 2013, 28(1): 58-59. |
| [23] |
陈健龙, 张玉玲, 董宇, 等. 小檗碱在Caco-2细胞单层模型中吸收和外排机制的研究[J]. 中成药, 2014, 36(4): 719-723. CHEN J L, ZHANG Y L, DONG Y, et al. Mechanism of absorption and efflux of berberine in Caco-2 cell monolayer[J]. Chinese Traditional Patent Medicine, 2014, 36(4): 719-723. |
| [24] |
ZHANG Y Q. Elevated system exposures of baicalin after combinatory oral administration of Rhein and baicalin: mainly related to breast cancer resistance protein, not UDP-glucuronosyltransferases[J]. Journal of Ethnopharmacology, 2020, 250(2): 112-115. |
| [25] |
KWON M, LIM D Y, LEE C H, et al. Enhanced intestinal absorption and pharmacokinetic modulation of berberine and its metabolites through the inhibition of P-glycoprotein and intestinal metabolism in rats using a berberine mixed micelle formulation[J]. Pharmaceutics, 2020, 12(9): 882. |
| [26] |
马博, 孙桂波, 杨志宏, 等. 肠上皮细胞模型不同培养条件的优化及适应性研究[J]. 中国实验方剂学杂志, 2011, 17(11): 205-210. MA B, SUN G B, YANG Z H, et al. Comparative study on different culture conditions for caco-2 cell model[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2011, 17(11): 205-210. |
| [27] |
徐倩, 欧阳怡, 吴鸿飞. 黄芩苷及其固体脂质纳米粒在Caco-2细胞上的吸收机制研究[J]. 中国药学杂志, 2019, 54(12): 1000-1006. XU Q, OUYANG Y, WU H F. Absorption mechanism of baicalin and its solid lipid nanoparticles on caco-2 cells[J]. Chinese Pharmaceutical Journal, 2019, 54(12): 1000-1006. |
| [28] |
袁秀妍, 徐慧慧, 邵福平, 等. 壳聚糖纳米粒对小檗碱经Caco-2细胞单层膜转运的影响研究[J]. 中国新药杂志, 2018, 27(6): 708-713. YUAN X Y, XU H H, SHAO F P, et al. Influences of chitosan nanoparticles on the berberine transport through Caco-2 cell monolayer[J]. Chinese Journal of New Drugs, 2018, 27(6): 708-713. |
 2023, Vol. 42
2023, Vol. 42