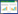文章信息
- 徐一方, 李志鹏, 曹世杰, 康宁
- XU Yifang, LI Zhipeng, CAO Shijie, KANG Ning
- 基于IRS-1/PI3K/AKT/GLUT4通路探讨二苯乙烯类化合物改善胰岛素抵抗作用机制
- Mechanism of stilbene compounds on the improvement of insulin resistance by IRS-1/PI3K/AKT/GLUT4 pathway
- 天津中医药大学学报, 2023, 42(1): 95-102
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(1): 95-102
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.01.18
-
文章历史
收稿日期: 2022-10-27
2. 天津中医药大学组分中药国家重点实验室, 天津 301617
2. State Key Laboratory of Component-based Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
2型糖尿病(T2DM)是一种常见的代谢性疾病,胰岛素抵抗(IR)是其主要的发病机制[1]。临床常用降糖药物如二甲双胍可通过缓解脂肪组织IR治疗T2DM[2]。因此,增加脂肪组织胰岛素敏感性的化合物具有开发成为降糖药物的潜力。
脂肪组织是胰岛素的重要靶器官,可以分泌炎症因子。炎症因子增多能够降低脂肪组织的葡萄糖摄取和胰岛素敏感性,与IR的发生发展密切相关[3]。肿瘤坏死因子-α(TNF-α)是一种炎症因子,其刺激3T3-L1脂肪细胞建立IR模型已经被应用于多种潜在降糖药物的评价工作中[4]。
胰岛素受体底物-1(IRS-1)/磷脂酰肌醇-3激酶(PI3K)/蛋白激酶B(AKT)途径是经典的胰岛素信号传导通路,激活这一途径能够促进胰岛素信号的传导,增加胰岛素敏感性[5],而AKT磷酸化后可影响其下游蛋白葡萄糖转运体4(GLUT4)的表达和膜转位,抑制细胞内葡萄糖向细胞外转运过程,从而发挥降糖作用[6]。因此,检测胰岛素信号通路及葡萄糖转运相关蛋白的变化能够反映药物改善IR的作用。
中医临床上常使用药味配伍治疗糖尿病,其中甘味药和苦味药使用频率较高,含有二苯乙烯类成分的虎杖、桑白皮、何首乌均属于这两类中药[7]。虎杖取自中药虎杖的根和根茎,其药性苦寒,具有清热解毒、祛风利湿等功效。桑白皮是桑科植物桑的干燥根皮,味甘性寒,因其善消水肿,常用作治疗消渴尿多。何首乌来源于何首乌的根块,味苦、甘、涩,微温,为补益良药[8]。这3种中药均含有大量二苯乙烯类化合物,如白藜芦醇(RES)具有经典的二苯乙烯结构,而虎杖苷(PD)又名白藜芦醇苷,两者均是虎杖的指标性成分之一[9]。此外,桑皮苷A(Mul A)及2,3,5,4’-四羟基二苯乙烯-2-O-β-D-葡糖糖苷(THSG)则是分别来源于桑白皮与何首乌中含量最大的二苯乙烯类化合物[10]。值得关注的是,上述二苯乙烯类化合物被报道具有良好的降糖活性[11-12],但其降糖作用机制尚未完全阐明。因此本研究采用TNF-α诱导建立3T3-L1脂肪细胞IR模型,考察虎杖、桑白皮、何首乌中具有代表性的二苯乙烯类化合物改善IR的作用及相关机制。
1 材料 1.1 细胞小鼠前脂肪细胞3T3-L1购于中国科学院干细胞库。
1.2 试剂DMEM培养基(Gibco,货号:12800-017);青链霉素混合液(Solarbio,货号:P1400);胰蛋白酶(Solarbio,货号:9002-07-7);新生牛血清(四季青,货号:22011-8612);胎牛血清(TBD,货号:TBD21HY);牛血清白蛋白(Sigma,货号:9048-46-8);1-甲基-3-异丁基-黄嘌呤(Sigma,货号:28822-58-4);胰岛素(丹麦诺和诺德公司,货号:114441);地塞米松(Sigma,货号:50-02-2);罗格列酮(Sigma,货号:122320-73-4);TNF-α(Proteintech,货号:315-01A);葡萄糖氧化酶试剂盒(北京普利莱公司,货号:E1010);RIPA裂解液(Solarbio,货号:P0013C);二喹啉甲酸(BCA)试剂盒(Solarbio,货号:PC0020);抗-IRS-1抗体(Proteintech,货号:17509-1-AP);抗-磷酸化IRS-1(p-IRS-1)抗体(CST,货号:2381T);抗-PI3K抗体(Bioss,货号:60225-1-Ig);抗-磷酸化PI3K(p-PI3K)抗体(Bioss,货号:bs3332R);抗-AKT抗体(Santa,货号:sc-5298);抗-磷酸化AKT(p-AKT)抗体(Santa,货号:sc-293125);抗-GLUT4抗体(SAB,货号:21619);抗-caveolin抗体(Proteintech,货号:16447-1-AP);辣根过氧化物酶标记山羊抗鼠免疫球蛋白G(IgG,中杉金桥公司,货号:ZB2305)及山羊抗兔IgG(中杉金桥公司,货号:ZB2301);吡格列酮(PGZ,Sigma,货号:111025-46-8);RES、PD、THSG(上海源叶试剂公司,货号:501-36-0、27208-80-6、82373-94-2);Mul A由本课题组制备,具体制备方法详见参考文献[10],其为黄色粉末状固体,经高效液相色谱(HPLC)法鉴定纯度≥96%。二苯乙烯类化合物均用二甲基亚砜(DMSO)在无菌环境中溶解,于-20 ℃储存。
1.3 仪器二氧化碳(CO2)培养箱(上海力申有限公司);酶标仪(美国BioTek);倒置显微镜(尼康);全自动化学发光分析系统(Tanon);电泳仪及转膜仪(Bio-Rad Laboratories);台式离心机(Eppendorf);聚合酶链反应(PCR)仪(Thermo Fisher);RNA定量仪器(Tanon)。
2 方法 2.1 3T3-L1前脂肪细胞的培养和诱导分化当3T3-L1前脂肪细胞贴壁生长至铺满培养瓶底部时,使细胞接触抑制48 h后进行诱导分化,将细胞培养液更换为含有0.5 mmol/L 3-异丁基-1-甲基黄嘌呤、1 μmol/L地塞米松、10 μg/mL胰岛素、3 μmol/L罗格列酮和10%胎牛血清的DMEM高糖培养基,孵育48 h后将培养液更换成含有10 μg/mL胰岛素、3 μmol/L罗格列酮和10%胎牛血清的DMEM高糖培养基孵育48 h,每48 h换液1次,直至80%以上的细胞分化成熟。
2.2 油红O染色法鉴定脂肪细胞将诱导分化成熟的脂肪细胞用磷酸缓冲盐溶液(PBS)洗3次,然后用10%的甲醛溶液室温固定1 h,移去固定液后用PBS洗3次,晾干细胞。加入3 mg/mL油红O染液,室温染色10 min,用双蒸水(ddH2O)洗去残渣和细胞缝隙中的染料,在倒置显微镜下观察并拍照。
2.3 TNF-α诱导脂肪细胞IR取诱导分化成熟的3T3-L1脂肪细胞,以5×104个/孔接种于96孔培养板中,待细胞贴壁后,将培养液更换为含有0.5%牛血清白蛋白的无血清DMEM高糖培养基,于5%的CO2培养箱37 ℃孵育8 h,然后将空白对照组的培养液更换为含有10%胎牛血清的DMEM高糖培养基,模型组换为加入10 ng/mL TNF-α并含有10%胎牛血清的DMEM高糖培养基,期间各组的培养基每24 h更换1次,作用96 h后检测葡萄糖消耗。
2.4 二苯乙烯类化合物对IR-3T3-L1脂肪细胞葡萄糖消耗的影响取诱导分化成熟的3T3-L1脂肪细胞,以5×104个/孔接种于96孔培养板中,按空白对照组、模型组、二苯乙烯类化合物组分组并造模,在TNF-α作用72 h后加入待测化合物,作用24 h后检测葡萄糖消耗。
2.5 葡萄糖氧化酶法检测细胞葡萄糖消耗将待测组弃掉上清液,用PBS洗2遍,按照组别要求加入无血清低糖DMEM培养基或含有100 nmol/L胰岛素的无血清低糖DMEM培养基,15 min后吸取上清液,用葡萄糖氧化酶试剂盒检测上清液中的葡萄糖含量。
2.6 噻唑蓝(MTT)法检测细胞生存率将各组剩余上清液弃掉,每孔加入100 μL的5 mg/mL MTT溶液,在5%的CO2培养箱37 ℃孵育2.5 h后,加入150 μL DMSO溶解,震荡10 min,于490 nm处测定吸光值。
2.7 蛋白免疫印迹(Western Blot)法检测蛋白表达取诱导分化好的细胞,以1.2×106个/孔接种于6孔板中,TNF-α作用72 h后加入待测化合物继续作用24 h后分别收集上清液并收集细胞,加入100 μL RIPA裂解,用BCA蛋白浓度测定试剂盒检测样品的蛋白浓度。依据蛋白浓度在相应样品中加入对应5×上样缓冲液,沸水浴使蛋白变性,待样品降至常温后将其储存于-20 ℃保存。实验时,经过电泳、转膜及封闭等处理,使用相关一抗4 ℃孵育过夜后,用辣根过氧化物酶标记的相应二抗常温孵育1 h,洗条带时用TBST漂洗10 min,重复3次。结束上述操作后,最后将条带放入电化学发光(ECL)显影仪显影曝光。实验所得条带用Tanon Gel Imaging System进行定量分析。
2.8 实时荧光定量PCR(RT-PCR)法检测GLUT4的mRNA表达收集细胞后采用Trizol法提取RNA,将总RNA逆转录为cDNA,以cDNA产物作为定量PCR扩增的模板,进行PCR扩增反应。数据采用2-ΔΔCt相对定量法分析。引物序列见表 1。
采用SPSS 21.0统计学软件进行分析,所有实验独立重复操作至少3次,实验结果以均数±标准差(x±s)表示,组间比较采用单因素方差分析,P < 0.05为差异具有统计学意义。
3 结果 3.1 脂肪细胞形态学变化油红O作为脂肪特异性染色剂能够与中性脂肪结合,使成熟脂肪细胞中的脂滴着色,从而观察细胞中的脂肪含量。从油红O染色结果可以看出,80%以上的细胞出现较大脂滴,呈现脂肪细胞表型,证明本研究采用的诱导分化方法切实可行。见图 1。

|
| 图 1 3T3-L1脂肪细胞油红O染色图(×200) |
10 ng/mL的TNF-α作用于3T3-L1脂肪细胞96 h后,采用MTT法测定细胞存活率,发现其对细胞存活率无影响。进一步再用100 nmol/L胰岛素刺激细胞15 min,采用葡萄糖氧化酶试剂盒检测细胞葡萄糖消耗量,与未加胰岛素的空白对照组比较,加胰岛素的空白对照组细胞对葡萄糖的消耗显著增加。然而,与加胰岛素的空白对照组相比,胰岛素刺激后,TNF-α作用96 h能够显著降低细胞对葡萄糖的消耗。加胰岛素与不加胰岛素的模型组之间葡萄糖消耗无明显差异。以上结果表明,10 ng/mL的TNF-α作用3T3-L1细胞96 h可诱导脂肪细胞产生明显的IR。见图 2。
|
| 注:与TNF-α(-)胰岛素(-)比较,*P < 0.01;与TNF-α(-)胰岛素(+)比较,#P < 0.01。 图 2 TNF-α对3T3-L1脂肪细胞存活率及葡萄糖消耗的影响(x±s,n=6) |
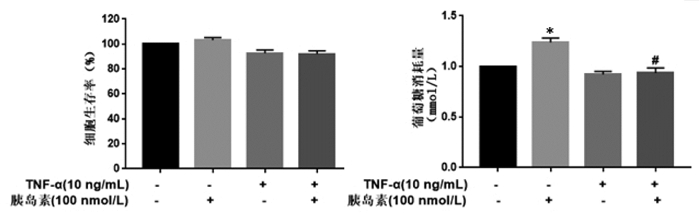
分别采用2.5、5、10 μmol/L阳性药PGZ作用于IR-3T3-L1细胞24 h,采用MTT法检测细胞存活率,葡萄糖氧化酶法检测细胞葡萄糖消耗。与对照组相比,3个剂量的PGZ对IR-3T3-L1细胞生存率均无明显的抑制作用,且细胞存活率均大于90%。葡萄糖消耗结果显示,与空白对照组相比,模型组葡萄糖消耗量显著降低;与模型组相比,10 μmol/L PGZ可以显著促进葡萄糖消耗。以上结果说明,10 μmol/L PGZ具有较强的降糖活性。结合阳性药的作用剂量及相关文献[13-15],后续二苯乙烯类化合物降糖活性筛选实验将采用10 μmol/L的剂量。见图 3。
|
| 注:与TNF-α(-)胰岛素(+)比较,*P < 0.01;与TNF-α(+)胰岛素(+)比较,#P < 0.05。 图 3 不同浓度PGZ对IR-3T3-L1脂肪细胞存活率和葡萄糖消耗量的影响(x±s,n=6) |
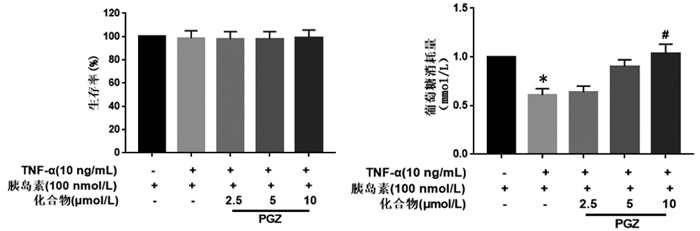
MTT法结果表明,10 μmol/L二苯乙烯类化合物对IR-3T3-L1脂肪细胞无明显细胞毒性,且细胞生存率均大于90%。葡萄糖消耗结果显示,与加胰岛素的空白对照组比较,模型组的葡萄糖消耗量显著降低;与模型组相比,10 μmol/L的RES、Mul A和THSG可以显著促进细胞中葡萄糖的消耗,而10 μmol/L的PD对细胞葡萄糖消耗无影响。以上结果表明,RES、Mul A、THSG具有明显的降糖活性,而PD则无降糖活性。见图 4。
|
| 注:与TNF-α(-)胰岛素(+)比较,*P < 0.01;与TNF-α(+)胰岛素(+)比较,#P < 0.05,##P < 0.01。 图 4 二苯乙烯类化合物对IR-3T3-L1细胞存活率和葡萄糖消耗量的影响(x±s,n=6) |
Western Blot法检测IRS、p-IRS-1(Ser307)、PI3K、p-PI3K、AKT、p-AKT(Ser473)的蛋白表达。结果显示,与空白组相比,10 ng/mL TNF-α显著上调了细胞内p-IRS-1(Ser307)的表达,下调了p-PI3K、p-AKT(Ser473)的表达;与模型组相比,RES、Mul A、THSG显著下调p-IRS-1(Ser307)的表达,Mul A、THSG显著上调p-PI3K、p-AKT(Ser473)的表达。以上结果表明,Mul A、THSG能够通过IRS-1/PI3K/AKT信号通路改善IR,而RES则通过激活IRS-1,但不通过PI3K/AKT途径发挥改善IR的作用。见图 5。
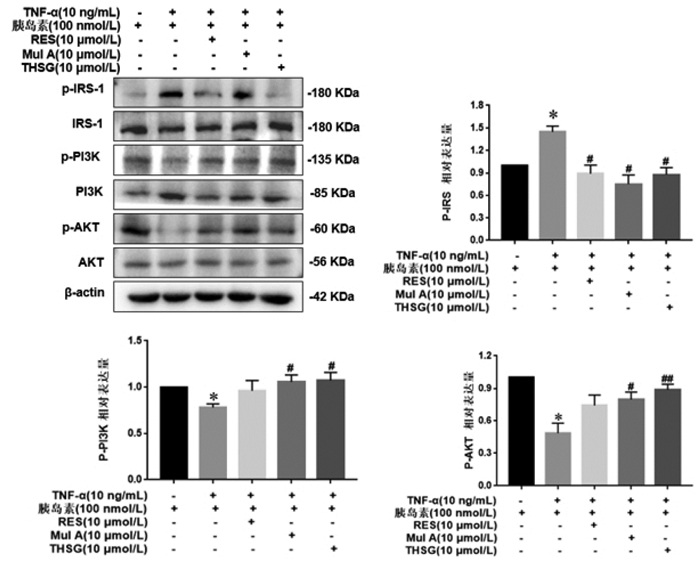
|
| 注:与TNF-α(-)胰岛素(+)比较,*P < 0.01;与TNF-α(+)胰岛素(+)比较,#P < 0.05,##P < 0.01。 图 5 二苯乙烯类化合物对IR-3T3-L1细胞IRS-1/PI3K/AKT信号通路的影响(x±s,n=6) |
Western Blot法检测GLUT4的蛋白表达。结果显示,与空白组相比,10 ng/mL的TNF-α显著下调了细胞内GLUT4的蛋白表达;与模型组相比,RES、Mul A、THSG显著上调GLUT4的蛋白表达。
RT-PCR法检测GLUT4的mRNA表达,结果显示,与空白组相比,10 ng/mL的TNF-α显著下调了细胞内GLUT4的mRNA表达;与模型组相比,THSG显著上调GLUT4的mRNA表达。见图 6。
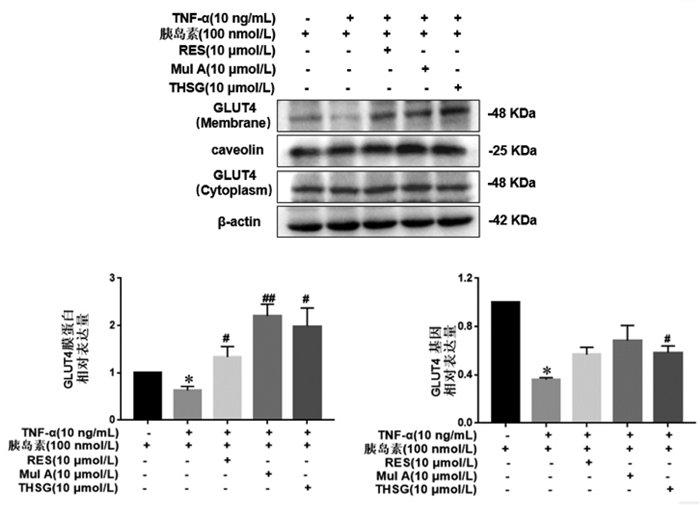
|
| 注:与TNF-α(-)胰岛素(+)比较,*P < 0.01;与TNF-α(+)胰岛素(+)比较,#P < 0.05,##P < 0.01。 图 6 二苯乙烯类化合物对IR-3T3-L1细胞GLUT4蛋白及mRNA的影响(x±s,n=6) |
糖尿病在中医属于“消渴”范畴,中医运用中药治疗糖尿病历史悠久[16]。中药成分复杂,其中的二苯乙烯类成分被报道具有良好的降糖活性[17]。研究表明,虎杖中的RES能够增加C2C12细胞的葡萄糖摄取,增加胰岛素敏感性[11]。另据报道,桑白皮中的Mul A作用24 h能够呈现剂量依赖性地缓解四氧嘧啶诱发的血糖升高[12]。何首乌中的THSG能够降低糖尿病大鼠的血糖及IR指数(HOMA-IR)。与文献报道结果相一致,本实验发现RES、Mul A、THSG显著增加了IR-3T3-L1脂肪细胞中葡萄糖的消耗,说明此3种二苯乙烯类化合物具有潜在的降糖活性。另据报道,PD预处理能够降低高脂饮食诱导糖尿病小鼠的空腹血糖水平,并增加肝脏中的糖原含量,改善了糖尿病小鼠的肝脏葡萄糖代谢。在棕榈酸(PA)或胰岛素诱导的IR HepG2细胞模型中,PD显著增加了葡萄糖消耗[18-19]。然而,在本研究体系下(IR-3T3-L1)PD无降糖活性,可能与药物对不同靶器官的降糖作用存在较大差异有关。
IRS-1/PI3K/AKT是经典的胰岛素信号传导通路,IR会导致胰岛素信号传导障碍[20]。据报道,在TNF-α引起的IR-3T3-L1脂肪细胞中,p-IRS1(Ser307)磷酸化增加,p-PI3K和p-AKT(Ser473)的磷酸化会减少,导致胰岛素信号通路受到损伤[21]。本研究结果也表明,在TNF-α刺激的IR-3T3-L1细胞中,p-IRS-1(Ser307)蛋白表达增加,p-PI3K和p-AKT(Ser473)的蛋白表达下降,胰岛素信号传导减少。研究指出,RES能够抑制链脲佐菌素(STZ)诱导的糖尿病大鼠血管平滑肌细胞中p-PI3K/PI3K和p-AKT/AKT比例的下降,从而起到抑制糖尿病平滑肌细胞凋亡的作用[22],提示RES能够调节PI3K/AKT信号通路。然而,本研究结果显示,RES给药后无法逆转由于TNF-α导致的IR-3T3-L1细胞中p-PI3K和p-AKT(Ser473)的表达降低,但能够逆转PI3K上游蛋白IRS-1的磷酸化形式表达增加,提示RES改善脂肪细胞IR的作用可能是通过激活IRS-1下游其他信号通路而非PI3K/AKT信号通路。值得注意的是,本研究首次发现Mul A和THSG显著减少p-IRS-1(Ser307)的蛋白表达,增加p-PI3K和p-AKT(Ser473)的蛋白表达。以上结果说明Mul A和THSG改善脂肪细胞IR的作用可能与激活IRS-1/PI3K/AKT信号通路有关。
AKT磷酸化能够影响其下游蛋白GLUT4的表达和膜转位。IR使AKT的磷酸化下降,导致GLUT4从细胞浆转移到细胞膜的过程受到阻滞,无法继续发挥转运葡萄糖的作用,最终导致血糖升高。在TNF-α刺激的IR-3T3-L1细胞中,GLUT4蛋白表达显著降低,而本研究首次发现Mul A和THSG能够增加GLUT4的蛋白表达。据报道,RES能够增加糖尿病小鼠骨骼肌中GLUT4的表达,改善小鼠的血糖控制[23],提示RES能够通过调节GLUT4改善细胞葡萄糖代谢。本研究也发现RES能够显著增加IR-3T3-L1细胞中GLUT4的蛋白表达。以上结果说明,RES、Mul A、THSG能够调节GLUT4发挥改善IR的作用。
综上所述,二苯乙烯类化合物Mul A、THSG能够通过IRS-1/PI3K/AKT/GLUT4通路改善脂肪细胞IR,而RES可能通过影响IRS-1、GLUT4发挥抗IR的作用,见图 7。本研究初步揭示了3种中药来源的二苯乙烯类化合物在降糖方面的作用机制,未来将进一步深入研究其改善IR的机制,以期为其临床应用于降糖提供更丰富的实验依据。
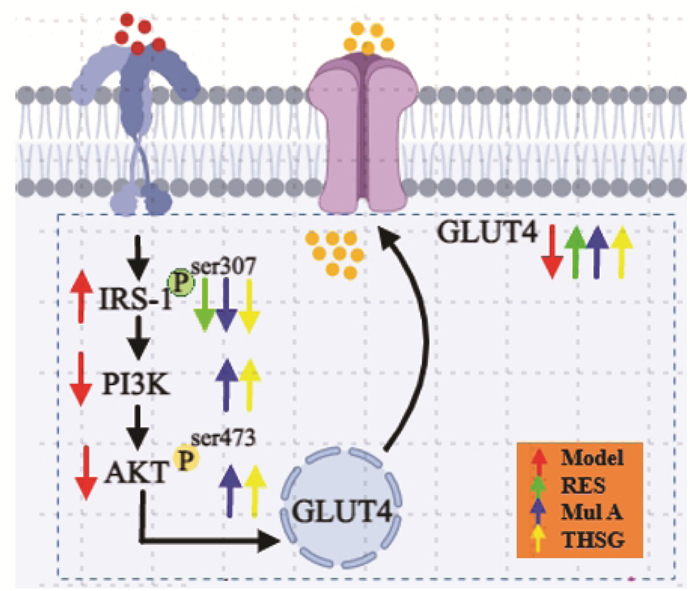
|
| 图 7 二苯乙烯类化合物通过 IRS-1/PI3K/AKT/GLUT4途径改善脂肪细胞IR的机制 |
| [1] |
XU L N. Natural products for the treatment of type 2 diabetes mellitus: pharmacology and mechanisms[J]. Pharmacological Research, 2018, 130(2): 451-465. |
| [2] |
GIANNARELLI R, ARAGONA M, COPPELLI A, et al. Reducing insulin resistance with metformin: the evidence today[J]. Diabetes & Metabolism, 2003, 29(42): 628-635. |
| [3] |
WU H Z, BALLANTYNE C M. Metabolic inflammation and insulin resistance in obesity[J]. Circulation Research, 2020, 126(11): 1549-1564. DOI:10.1161/CIRCRESAHA.119.315896 |
| [4] |
TSAI C W, LIU K L, LIN Y R, et al. The mechanisms of carnosic acid attenuates tumor necrosis factor-α-mediated inflammation and insulin resistance in 3T3-L1 adipocytes[J]. Molecular Nutrition & Food Research, 2014, 58(4): 654-664. |
| [5] |
HUANG X J, LIU G H, GUO J, et al. The PI3K/AKT pathway in obesity and type 2 diabetes[J]. International Journal of Biological Sciences, 2018, 14(11): 1483-1496. DOI:10.7150/ijbs.27173 |
| [6] |
KHAN S, KAMAL M A. Wogonin alleviates hyperglycemia through increased glucose entry into cells via AKT/GLUT4 pathway[J]. Current Pharmaceutical Design, 2019, 25(23): 2602-2606. DOI:10.2174/1381612825666190722115410 |
| [7] |
国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2020: 33. National Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China[M]. Beijing: China Medical Science and Technology Press, 2020: 33. |
| [8] |
崔真真, 王海凌, 张冰, 等. 何首乌研究进展[J]. 辽宁中医药大学学报, 2019, 21(1): 172-174. CUI Z Z, WANG H L, ZHANG B, et al. Application research of Polygonum multiflori[J]. Journal of Liaoning University of Traditional Chinese Medicine, 2019, 21(1): 172-174. |
| [9] |
王敏, 王晶, 杨娜, 等. UPLC-Q/TOF-MS法测定虎杖中虎杖苷、白藜芦醇、大黄素在高脂血症鼠体内的药代动力学[J]. 药学与临床研究, 2021, 29(6): 438-443. WANG M, WANG J, YANG N, et al. Pharmacokintic study of polydatin, resveratrol and emodin from polygonum cuspidatum in hyperlipidemic hamsters based on ultra-performance liquid chromatography-quadrupole/time-of-flight mass spectrometry[J]. Pharmaceutical and Clinical Research, 2021, 29(6): 438-443. |
| [10] |
朴淑娟. 桑白皮化学成分及不同来源桑白皮中二苯乙烯苷类化合物含量测定的研究[D]. 沈阳: 沈阳药科大学, 2005. PIAO S J. Studies on the chemical constituents and quantitative analyses of stilbene glycosides in cortex mori[D]. Shenyang: Shenyang Pharmaceutical University, 2005. |
| [11] |
PARK C E, KIM M J, LEE J H, et al. Resveratrol stimulates glucose transport in C2C12 myotubes by activating AMP-activated protein kinase[J]. Experimental & Molecular Medi-cine, 2007, 39(2): 222-229. |
| [12] |
候宝林, 施洋, 赵俊芳, 等. 桑白皮化学成分及药理作用研究进展[J]. 辽宁中医杂志, 2020, 47(8): 212-214. HOU B L, SHI Y, ZHAO J F, et al. Research progress of chemical compounds and pharmacological effects of Sangbaipi (cortex mori)[J]. Liaoning Journal of Traditional Chinese Medicine, 2020, 47(8): 212-214. |
| [13] |
LU C P, XING H Y, YANG L Q, et al. Resveratrol ameliorates high-fat-diet-induced abnormalities in hepatic glucose metabolism in mice via the AMP-activated protein kinase pathway[J]. Evidence-Based Complementary and Alternative Medicine, 2021, 20(21): 661-669. |
| [14] |
黎玉华, 江洁, 陈鹏飞, 等. 桑皮苷A逆转K562/阿霉素耐药细胞化疗多药耐药的研究[J]. 中国临床药理学杂志, 2022, 38(10): 1064-1068. LI Y H, JIANG J, CHEN P F, et al. Reversal effect of mulberroside A on the multidrug resistance in K562/adriamycin-resistant cells[J]. The Chinese Journal of Clinical Pharmacology, 2022, 38(10): 1064-1068. |
| [15] |
贾敏. 何首乌中二苯乙烯苷对Hcy诱导的血管舒缩功能障碍的拮抗作用及其机制研究[D]. 西安: 中国人民解放军空军军医大学, 2019. JIA M. The mechanism of tetrahydroxystilbene glucoside in vasomotor dysfunction induced by homocysteine[D]. Xi'an: Chinese People's Liberation Army Air Force Military Medical University, 2019. |
| [16] |
叶明玉, 丁舸, 肖辉, 等. 消渴病历代组方配伍特点探析[J]. 光明中医, 2020, 35(24): 3841-3845. YE M Y, DING G, XIAO H, et al. Analysis on the compatibility of prescriptions and medications for treating consumptive thirst disease in different periods[J]. Guangming Journal of Chinese Medicine, 2020, 35(24): 3841-3845. |
| [17] |
SHAZMEEN, HAQ I U, RAJOKA M S R, et al. Role of stilbenes against insulin resistance: a review[J]. Food Science & Nutrition, 2021, 9(11): 6389-6405. |
| [18] |
HAO J, HUANG K P, CHEN C, et al. Polydatin improves glucose and lipid metabolisms in insulin-resistant HepG2 cells through the AMPK pathway[J]. Biological & Pharmaceutical Bulletin, 2018, 41(6): 891-898. |
| [19] |
HAO J, CHEN C, HUANG K P, et al. Polydatin improves glucose and lipid metabolism in experimental diabetes through activating the Akt signaling pathway[J]. European Journal of Pharmacology, 2014, 745(11): 152-165. |
| [20] |
ZHONG X Z, KE C F, CAI Z X, et al. LNK deficiency decreases obesity-induced insulin resistance by regulating GLUT4 through the PI3K-Akt-AS160 pathway in adipose tissue[J]. Aging, 2020, 12(17): 17150-17166. |
| [21] |
DAI S S, HONG Y L, XU J, et al. Ginsenoside Rb2 promotes glucose metabolism and attenuates fat accumulation via AKT-dependent mechanisms[J]. Biomedecine & Pharmacotherapie, 2018, 100(7): 93-100. |
| [22] |
李燕, 白立炜, 王涛, 等. 白藜芦醇对糖尿病大鼠血管平滑肌细胞凋亡的影响及其机制研究[J]. 中国免疫学杂志, 2018, 34(6): 866-871. LI Y, BAI L W, WANG T, et al. Effects and mechanism of resveratrol on apoptosis of vascular smooth muscle cell in diabetic rats[J]. Chinese Journal of Immunology, 2018, 34(6): 866-871. |
| [23] |
YONAMINE C Y, PINHEIRO-MACHADO E, MICHALANI M L, et al. Resveratrol improves glycemic control in type 2 diabetic obese mice by regulating glucose transporter expression in skeletal muscle and liver[J]. Molecules, 2017, 22(7): 1180. |
 2023, Vol. 42
2023, Vol. 42