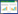文章信息
- 黄飞, 李灵云, 于卉娟, 王跃飞, 崔英, 柴欣
- HUANG Fei, LI Lingyun, YU Huijuan, WANG Yuefei, CUI Ying, CHAI Xin
- 气相色谱法快速测定水蛭中短链脂肪酸含量
- Rapid determination of short chain fatty acids in leech by gas chromatography
- 天津中医药大学学报, 2023, 42(1): 103-107
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(1): 103-107
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.01.19
-
文章历史
收稿日期: 2022-09-11
水蛭为水蛭科动物蚂蟥(Whitmaniapigra Whitman)、水蛭(Hirudonipponica Whitman)或柳叶蚂蟥(Whitmaniaacranulata Whitman)的干燥全体,始载于《神农本草经》:“性平,味咸,苦,归于肝经,主逐恶血,瘀血,经闭,破血瘕积聚,无子,利水道。”[1]具有破血通经、逐瘀消瘕等功效[2]。现代药理学研究表明水蛭具有抗凝、抗血栓、抗肿瘤、抗炎等多种活性[3-6],常用于心脑血管疾病的治疗[7-8]。水蛭化学成分主要包括水蛭素等多肽类成分及碟啶、糖脂、不饱和脂肪酸、甾体、氨基酸等小分子成分[9-12];水蛭素是具有良好抗凝活性的多肽大分子,但多肽分子经口服给药后在胃肠道中被降解,且在炮制过程中易被破坏[13]。因此,关于水蛭活性成分的研究仍是该领域的热点问题[14-15]。
短链脂肪酸是一类由1~6个碳原子组成的饱和脂肪酸,主要包括甲酸、乙酸、丙酸、丁酸、戊酸、己酸、异丁酸、异戊酸[16]。人体中的短链脂肪酸主要是由未消化的膳食纤维、蛋白质及碳水化合物经肠道微生物代谢生成,其中乙酸、丙酸、丁酸约占总量的95%[17]。短链脂肪酸具有抗炎、降低血压、调节免疫等作用,与心血管疾病、糖尿病、慢性肾脏病的发生和发展关系密切[18-19]。水蛭中的肠道微生物也可以代谢未消化的食物生成短链脂肪酸[20],但目前对于水蛭中的短链脂肪酸研究较少。
本研究基于气相色谱法建立了一种可以同时测定水蛭中7种短链脂肪酸含量的方法,并将该方法应用于18批水蛭样品中短链脂肪酸的分析,有助于揭示水蛭短链脂肪酸的分布规律,为水蛭的质量控制提供方法学支撑及研究数据。
1 仪器与材料GC-7890B气相色谱仪(美国Agilent公司);DB-FFAP毛细管柱(30 m×0.25 mm×0.25 μm,美国Agilent公司);XS205十万分之一电子天平、AL204万分之一电子天平(瑞士METTLER TOLEDO公司);SB25-12DTN超声波清洗器(宁波新芝科技有限公司);Milli-Q超纯水系统(美国Millipore公司)。
无水乙醇、浓盐酸(天津大茂化学试剂厂);超纯水(自制);乙酸(批号:BCBL0846V)、丙酸(批号:BCBK8610V)、异丁酸(批号:MKBG7913V)、丁酸(批号:BCBH0489V)、异戊酸(批号:MKBP6045V)、戊酸(批号:MHBM7442V)、己酸(批号:BCBJ3105V)、2-乙基丁酸(批号:STBD2230V)、2-乙基己酸(批号:MKBH9137V)均购自于美国Sigma-Aldrich公司,纯度均大于99%。水蛭样品S1~S7购自河北安国药材交易市场,S8-s、S9-s、S10-s、S11-s、S18-s采购于各水蛭养殖基地并加工干燥而成,S12~S17由牡丹江友博药业股份有限公司提供。所有水蛭药材由天津中医药大学李天祥教授鉴定,均来源于蚂蟥(Whitmaniapigra Whitman)。
2 方法 2.1 对照品溶液的制备取乙酸、丙酸对照品适量,精密称定,分别置于10 mL容量瓶中,加25%乙醇溶液(V/V)定容;取异丁酸、丁酸、异戊酸、戊酸、己酸对照品适量,精密称定,分别置于10 mL容量瓶中,加乙醇定容,得到对照品储备液;浓度分别为乙酸10.383 mg/mL、丙酸9.161 mg/mL、异丁酸1.077 mg/mL、丁酸6.948 mg/mL、异戊酸2.905 mg/mL、戊酸0.796 mg/mL、己酸0.792 mg/mL;取2-乙基丁酸、2-乙基己酸对照品适量,精密称定,分别置于100 mL容量瓶中,以75%乙醇溶液定容,得浓度为2-乙基丁酸933.2 μg/mL、2-乙基己酸192.7 μg/mL的内标物储备液,置于4 ℃冰箱中备用。
分别取各对照品及内标物储备液适量于10 mL容量瓶中,加浓盐酸100 μL,以25%乙醇溶液定容,即得浓度为乙酸1 038.3 μg/mL、丙酸916.1 μg/mL、异丁酸107.7 μg/mL、丁酸694.8 μg/mL、异戊酸290.5 μg/mL、戊酸79.6 μg/mL、己酸79.2 μg/mL、2-乙基丁酸46.3 μg/mL、2-乙基己酸2.4 μg/mL的混合对照品溶液,并以25%乙醇溶液(含1%盐酸、2-乙基丁酸46.3 μg/mL、2-乙基己酸2.4 μg/mL)1∶1逐级稀释成一系列不同浓度的混合对照品溶液。
2.2 供试品溶液的制备取水蛭样品粉末0.2 g置于10 mL容量瓶中,加入25%乙醇溶液(含1%盐酸、2-乙基丁酸46.3 μg/mL、2-乙基己酸2.4 μg/mL)冰浴超声10 min,定容,摇匀,14 000 r/min离心10 min(离心半径为8.4 cm),取上清液,即得供试品溶液。
2.3 色谱条件色谱柱:DB-FFAP弹性石英毛细管柱;升温程序:初始温度50 ℃保持1 min,以50 ℃/min升至120 ℃,以5 ℃/min升至165 ℃,以100 ℃/min升至240 ℃后保持13 min;进样口温度:240 ℃;检测器(FID)温度:240 ℃;进样体积:3 μL;分流比10∶1;载气:高纯氮气,纯度>99.999%,流速1.0 mL/min;尾吹气:高纯氮气,纯度>99.999%,流速25 mL/min;氢气流速30 mL/min;空气流速400 mL/min。
3 结果 3.1 方法学验证取“2.1”项下配制的一系列不同混合对照品溶液,按照“2.3”项下色谱条件进行分析,以对照品浓度x(μg/mL)为横坐标,以各化合物峰面积(ASA)与内标物峰面积(AIS)比值(ASA/AIS,乙酸、丙酸、丁酸以2-乙基丁酸为内标物,异丁酸、异戊酸、戊酸、己酸以2-乙基己酸为内标物)y为纵坐标,绘制各对照品的标准曲线,计算出标准曲线的回归方程和相关系数(r2);以信噪比S/N=3为检测限(LOD)、S/N=10为定量限(LOQ),实验结果见表 1。各成分在相应的浓度范围内线性关系良好,r2值均大于0.999 9。
按照“2.2”项下的方法制备水蛭供试品溶液,进行日内精密度、日间精密度(每日分别制备供试品溶液)、稳定性、重复性实验。各化合物日内精密度与日间精密度RSD值均小于3.3%;各成分重复性实验RSD值均小于3.2%;各成分在冰浴条件下9 h内稳定性良好,RSD值均小于3.6%。实验结果见表 1。
在此基础上,开展水蛭样品中各短链脂肪酸的加样回收率实验,取水蛭样品粉末0.1 g,置于10 mL容量瓶中,准确加入与样品中各成分质量相当的混合对照品溶液5 mL(乙酸175.69 μg/mL、丙酸100.77 μg/mL、异丁酸6.89 μg/mL、丁酸84.77 μg/mL、异戊酸12.78 μg/mL、戊酸2.55 μg/mL),按“2.2”项下方法平行制备6份供试品溶液。计算各成分的加样回收率和RSD值,结果见表 1。各成分平均加样回收率为92.52%~100.8%,RSD值均小于2.8%。
3.2 不同来源水蛭中短链脂肪酸含量测定采用建立的气相色谱方法分析水蛭中7种短链脂肪酸的含量,气相色谱图见图 1,结果显示各短链脂肪酸分离度良好,空白溶剂和内标物化合物对短链脂肪酸分析无影响。
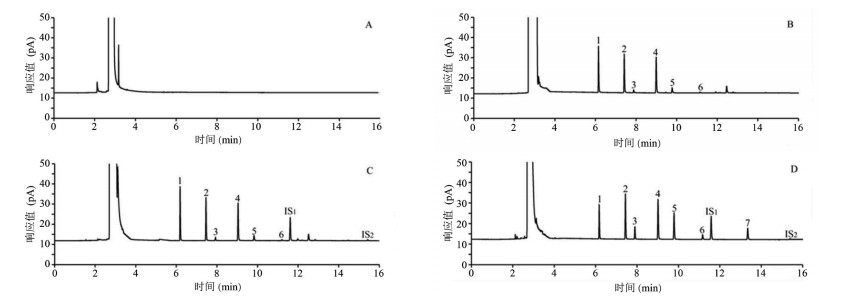
|
| 注:A:空白溶剂,B:水蛭样品-无内标物,C:水蛭样品-含内标物,D:混合对照品溶液;1:乙酸,2:丙酸,3:异丁酸,4:丁酸,5:异戊酸,6:戊酸,7:己酸,IS1:2-乙基丁酸,IS2:2-乙基己酸。 图 1 短链脂肪酸含量气相色谱图 |
采用构建的方法对18批水蛭样品中7种短链脂肪酸进行含量测定,为了更加直观地观察不同批次水蛭中短链脂肪酸的差异,绘制了水蛭中短链脂肪酸总含量柱状图,并以水蛭样品中短链脂肪酸含量最大值为参照计算水蛭中各短链脂肪酸的相对含量,绘制各短链脂肪酸的相对含量热图,结果见图 2。结果表明18批水蛭样品中短链脂肪酸总含量在1 101~8 571 μg/g;不同批次水蛭样品中各成分含量差异较大,其中乙酸、丙酸的相对含量较高,含量范围分别为783.0~3 479 μg/g和246.7~5 166 μg/g。水蛭样品中其他短链脂肪酸含量较低,仅在S2中检测到丁酸,其含量为73.02 μg/g;在S2、S8-s、S9-s、S17、S18-s中检测到异丁酸含量为36.83~87.73 μg/g,其他样品未检测到异丁酸;18批水蛭样品中均未检测到戊酸;在13批水蛭样品中检测到异戊酸含量为5.117~112.8 μg/g,其他样品未检测到异戊酸;仅在S1和S17中检测到己酸,其含量分别为65.65 μg/g和44.11 μg/g。
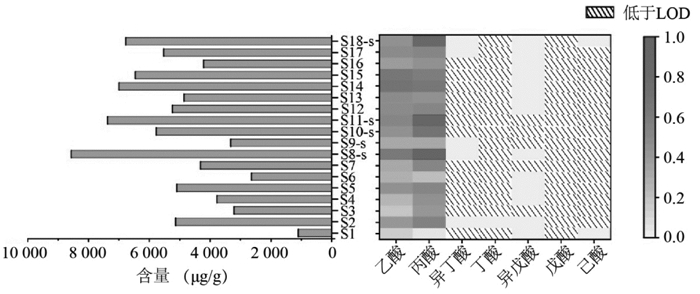
|
| 图 2 不同批次水蛭中短链脂肪酸总含量柱状图与短链脂肪酸相对含量热图 |
优选水蛭样品供试品溶液的制备方法,考察了水蛭样品与提取溶剂料液比(0.2:10、0.2:25、0.2:50 g/mL)、不同浓度乙醇溶液(25%、50%、75%、100%)、不同超声时间(0、5、10、20 min)对于水蛭样品中各指标成分的影响,结果显示采用25%乙醇作为提取溶剂,以料液比0.2∶10超声提取10 min时各指标成分提取效率最高,色谱峰峰形较好。
4.2 水蛭中短链脂肪酸的合成及在心血管疾病治疗中的意义在测定不同水蛭样品中的短链脂肪酸时,发现水蛭中乙酸与丙酸的含量较高,而其他短链脂肪酸含量较低。肠道微生物的组成影响短链脂肪酸的类型与数量。文献报道水蛭肠道中主要包括类理研菌、气单胞菌,此外还有少量的拟杆菌[21],类理研菌可将黏蛋白多糖分解为乙酸[20],拟杆菌可以通过琥珀酸途径生成丙酸,推测水蛭中的丙酸主要由拟杆菌产生[22]。研究表明短链脂肪酸在心血管疾病的预防与治疗中发挥重要作用,其中乙酸可以维持肠黏膜的完整性而减少外周血管中脂多糖的浓度,并能抑制心脏纤维化从而改善心脏功能[23];丙酸盐可以减小动脉粥样硬化斑块,还能激活肾脏和血管平滑肌中的G蛋白偶联受体41(Gpr41)发挥降压作用[24]。此外,丁酸等其他短链脂肪酸具有抗炎、降压、调节免疫的作用。通过饮食补充乙酸、丙酸、丁酸可以减缓高血压病、心肌肥厚纤维化的发展[25]。综上所述,水蛭中以乙酸、丙酸为主的短链脂肪酸可能是治疗心血管疾病重要的药效物质。
本研究基于气相色谱法建立了快速、稳定、重复性良好的水蛭中短链脂肪酸的含量测定方法,为进一步研究水蛭的药效物质基础以及全面控制水蛭质量提供数据支撑。
| [1] |
顾观光. 神农本草经[M]. 杨鹏举, 校注. 北京: 学苑出版社, 2007. GU G G. Shennong's herbal classic[M]. YANG P J, edit. Beijing: academy press, 2007. |
| [2] |
国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2020. National Pharmacopoeia Committee. Pharmacopoeia of the People's Republic of China[M]. Beijing: China Science and Technology Press, 2020. |
| [3] |
SCHORN T, DRAGO F, TETTAMANTI G, et al. Homolog of allograft inflammatory factor-1 induces macrophage migration during innate immune response in leech[J]. Cell and Tissue Research, 2015, 359(3): 853-864. DOI:10.1007/s00441-014-2058-7 |
| [4] |
KVIST S, MANZANO-MARÍN A, DE CARLE D, et al. Draft genome of the European medicinal leech Hirudo medicinalis (Annelida, Clitellata, Hirudiniformes) with emphasis on anticoagulants[J]. Scientific Reports, 2020, 10(1): 9885. DOI:10.1038/s41598-020-66749-5 |
| [5] |
LIU X, WANG C, DING X, et al. A novel selective inhibitor to thrombinÍinduced platelet aggregation purified from the leech Whitmania pigra[J]. Biochemical and Biophysical Research Communications, 2016, 473(1): 349-354. DOI:10.1016/j.bbrc.2016.03.117 |
| [6] |
郭永良, 田雪飞, 肖竺. 水蛭提取物对人肝癌HepG2细胞体外抑制作用研究[J]. 中国中医药信息杂志, 2009, 16(8): 30-31. GUO Y L, TIAN X F, XIAO Z. Study on inhibition effects of freeze-thawing leech extract on HepG2 cells[J]. Chinese Journal of Information on Traditional Chinese Medicine, 2009, 16(8): 30-31. DOI:10.3969/j.issn.1005-5304.2009.08.013 |
| [7] |
黄秋阳, 冷静, 甘奇超, 等. 水蛭及其制剂在心脑血管疾病中的应用[J]. 中成药, 2019, 41(8): 1915-1920. HUANG Q Y, LENG J, GAN Q C, et al. Application of leech and its preparation in cardiovascular and cerebrovascular diseases[J]. Chinese Traditional Patent Medicine, 2019, 41(8): 1915-1920. DOI:10.3969/j.issn.1001-1528.2019.08.033 |
| [8] |
韩文博, 孙爱军, 孟丽君, 等. 水蛭抗动脉粥样硬化作用研究进展[J]. 天津中医药, 2019, 36(7): 724-727. HAN W B, SUN A J, MENG L J, et al. Research progress in effect of anti-atherosclerosis with leeches[J]. Tianjin Journal of Traditional Chinese Medicine, 2019, 36(7): 724-727. |
| [9] |
REN Y, YANG Y J, WU W J, et al. Identification and characterization of novel anticoagulant peptide with thrombolytic effect and nutrient oligopeptides with high branched chain amino acid from Whitmania pigra protein[J]. Amino Acids, 2016, 48(11): 2657-2670. DOI:10.1007/s00726-016-2299-8 |
| [10] |
ZHENG X B, LI J, CHEN Z W, et al. Purification and characterization of an anticoagulant oligopeptide from whitmania pigra Whitman[J]. Pharmacognosy Magazine, 2015, 11(43): 444-448. DOI:10.4103/0973-1296.160446 |
| [11] |
荆文光, 符江, 刘玉梅, 等. 水蛭的化学成分[J]. 中国实验方剂学杂志, 2014, 20(19): 120-123. JING W G, FU J, LIU Y M, et al. Chemical constituents of Hirudo[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2014, 20(19): 120-123. |
| [12] |
李友宾, 相宇, 黄卫华, 等. 日本医蛭化学成分研究[J]. 海峡药学, 2009, 21(5): 75-77. LI Y B, XIANG Y, HUANG W H, et al. Chemical constituents from Hirudo nipponica Whitman[J]. Strait Pharmaceutical Journal, 2009, 21(5): 75-77. |
| [13] |
马莉, 马琳, 王曙宾, 等. 动物药水蛭高温炮制的科学合理性[J]. 中国中药杂志, 2015, 40(19): 3894-3898. MA L, MA L, WANG S B, et al. Review on scientific connotation of leech processed under high temperature[J]. China Journal of Chinese Materia Medica, 2015, 40(19): 3894-3898. |
| [14] |
沈仕伟, 邸莎, 韦宇, 等. 水蛭临床应用及其用量[J]. 吉林中医药, 2019, 39(3): 313-316. SHEN S W, DI S, WEI Y, et al. Exploration about the clinical application and dosage of leech[J]. Jilin Journal of Chinese Medicine, 2019, 39(3): 313-316. |
| [15] |
JIANG Q, WANG L N, HU J H, et al. Oral administration of leeches (Shuizhi): a review of the mechanisms of action on antiplatelet aggregation[J]. Journal of Ethnopharmacology, 2019, 232(10): 103-109. |
| [16] |
LOURENCO C, KELLY D, CANTILLON J, et al. Monitoring type 2 diabetes from volatile faecal metabolome in Cushing's syndrome and single Afmid mouse models via a longitudinal study[J]. Scientific Reports, 2019, 9(1): 18779. |
| [17] |
PRASAD K N, et al. Dietary fibers and their fermented short-chain fatty acids in prevention of human diseases[J]. Bioactive Carbohydrates and Dietary Fibre, 2019, 17(6): 100-107. |
| [18] |
PENG J T. Interaction between gut microbiome and cardiovascular disease[J]. Life Sciences, 2018, 214(11): 153-157. |
| [19] |
GONZLEZ-BOSCH C, BOORMAN E, ZUNSZAIN P A, et al. Short-chain fatty acids as modulators of redox signaling in health and disease[J]. Redox Biology, 2021, 47(7): 102-105. |
| [20] |
BOMAR L, MALTZ M, COLSTON S, et al. Directed culturing of microorganisms using metatranscriptomics[J]. mBio, 2011, 2(2): 12-19. |
| [21] |
MALTZ M A, BOMAR L, LAPIERRE P, et al. Metagenomic analysis of the medicinal leech gut microbiota[J]. Frontiers in Microbiology, 2014, 11(5): 151. |
| [22] |
LOUIS P, FLINT H J. Formation of propionate and butyrate by the human colonic microbiota[J]. Environmental Microbiology, 2017, 19(1): 29-41. |
| [23] |
MARIÁO E, RICHARDS J L, MCLEOD K H, et al. Erratum: gut microbial metabolites limit the frequency of autoimmune T cells and protect against type 1 diabetes[J]. Nature Immunology, 2017, 18(11): 1271. |
| [24] |
FELIZARDO R J F, WATANABE I K M, DARDI P, et al. The interplay among gut microbiota, hypertension and kidney diseases: the role of short-chain fatty acids[J]. Pharmacological Research, 2019, 141(3): 366-377. |
| [25] |
KAYE D M, SHIHATA W A, JAMA H A, et al. Deficiency of prebiotic fiber and insufficient signaling through gut metabolite-sensing receptors leads to cardiovascular disease[J]. Circulation, 2020, 141(17): 1393-1403. |
 2023, Vol. 42
2023, Vol. 42