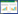文章信息
- 韩玉, 张婧, 赵晰, 王耀光, 马雷雷
- HAN Yu, ZHANG Jing, ZHAO Xi, WANG Yaoguang, MA Leilei
- 加味防己黄芪汤对UUO大鼠纤维化干预作用及对JAK2/STAT3信号通路影响
- Intervention effect of Jiawei Fangji Huangqi Decoction on fibrosis and JAK2/STAT3 signal pathway in UUO rats
- 天津中医药大学学报, 2023, 42(2): 197-205
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(2): 197-205
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.02.13
-
文章历史
收稿日期: 2022-11-30
慢性肾脏病(CKD)是一种威胁生命的全球性健康问题,患病率逐年增加,且易合并并发症严重影响患者生存质量。CKD的主要病理变化以进行性肾脏炎症和肾间质纤维化(RIF)为特征,而肾间质纤维化的程度和病变速度,则是CKD进展为终末期肾病的关键因素。RIF发展过程中,伴随持续的细胞死亡和炎性细胞浸润,病变过程会促进细胞增殖,同时炎症细胞产生的自由基还通过诱导上皮间质转化(EMT)促进纤维化的发展[1-4]。因此,寻找能够有效控制肾脏炎症反应、减缓EMT发生发展的药物具有重要的现实意义。近年来中医药在防治RIF方面具有着一定的优势,中药方剂多靶点的作用方式,能够更好的兼顾抗炎及抗纤维的作用,本研究中的加味防己黄芪汤化裁于《金匮要略》,为王耀光教授治疗CKD的核心处方,为明确其是否能够对于RIF起到延缓作用进而发挥保护残余肾功能的作用,本研究设计动物实验利用大鼠单侧输愕管梗阻(UUO)模型进行验证。
1 实验材料及方法 1.1 实验动物SPF级雄性SD大鼠共60只,体质量(180±20)g,由易生源基因科技(天津)有限公司提供,许可证号SYXK(津)2021-0003。饲养于天津易生源动物房,实验期间饮用水为清洁自来水、自由摄食,实验室自然光照,室温20~24 ℃左右,通风湿度良好,隔2日更换一次垫料,大鼠适应性喂养1周状态良好后进行实验。
1.2 药物、试剂及仪器 1.2.1 药物制备加味防己黄芪汤组成:生黄芪30 g,防己10 g,生白术10 g,地龙10 g,赤芍10 g,以上药材由天津中医药大学第一附属医院提供,并对药物进行煎煮浓缩。按照成人体质量70 kg,每日服用药物生黄芪30 g,防己10 g,生白术10 g,地龙10 g,赤芍10 g,总计每日总生药量70 g计算,参考《药理实验方法学》通过人与大鼠间体表面积法进行换算,按照大鼠平均体质量200 g,每日最大灌胃量2 mL,体表系数0.018计算,换算大鼠每日用药等效剂量为70 g×0.018/2 mL=0.63 g/mL(即每日生药量1.26 g),以等效剂量作为中药灌胃中剂量0.63 g/mL,1/2等效剂量作为低剂量0.315 g/mL,2倍等效剂量作为高剂量1.26 g/mL,将每付药液浓度浓缩至高剂量1.26 g/mL,4 ℃保存,灌胃依照不同剂量稀释。缬沙坦片(浙江华海药业,批号H20183126)成人有效剂量为80 mg/d,将缬沙坦片用蒸馏水溶解,每日现配现用,配制为0.72 mg/mL浓度溶液,4 ℃保存,灌胃时稀释使用。
1.2.2 主要试剂及仪器1)主要试剂:Jak2兔多克隆抗体(品牌:武汉三鹰,货号:17670-1-AP)、STAT3兔多克隆抗体(品牌:武汉三鹰,货号:10253-2-AP)、GAPDH兔多克隆抗体(品牌:武汉三鹰,货号:10494-1-AP)、α-SMA兔多克隆抗体(品牌:Affinity,货号:AF1032)、E-CAD兔多克隆抗体(品牌:Affinity,货号:AF0131)、磷酸化JAK2兔多克隆抗体(品牌:万类生物,货号:WL02997)、磷酸化STAT3兔多克隆抗体(品牌:万类生物,货号:WLP2412)、山羊抗兔IgG抗体(品牌:Affinity,货号:S0001)。
2)主要仪器:伯乐小型电泳仪(美国BIO-RAD公司,164-5050)、多功能酶标仪(美国Thermo公司,Varioskan LUX)、冷冻高速离心机(美国Thermo Fisher公司,75002445)、梯度PCR仪(美国ABI ProFlex公司,4484073)、荧光定量PCR仪(瑞士Roche公司,LightCycler 96)、凝胶成像仪(德国耶拿公司,ChemStudio)、正置光学显微镜(日本OLYMPUS公司,OLYMPUS CK31)等。
1.3 实验方法 1.3.1 大鼠UUO模型构建将60只大鼠依次编号,用随机数字表法分为6组,假手术组、模型组、中药低剂量组、中药中剂量组、中药高剂量组、缬沙坦组,每组10只。术前禁食不禁水12 h,予戊巴比妥钠50 mg/kg剂量麻醉大鼠[5],假手术组仅钝性剥离左侧输尿管,不予结扎;其余各组大鼠分别结扎左侧输尿管近肾盂段及输尿管远端,术后3 d予剂量为8万IU/鼠的青霉素腹腔注射防止感染。于术后第7天,采用随机数字表法,每组抽取3只大鼠进行肾脏取材,以肾脏病理马松染色法(Masson)结果,作为纤维化模型构造成功的评价标准[6-8]。
1.3.2 给药方法各组大鼠于术后1 d开始灌胃,每次灌胃前称重大鼠体质量按照1 mL/100 g计量进行灌胃,共灌胃14 d。假手术组予生理盐水;中药低剂量组予汤剂0.32 g/(mL·d);中药中剂量组予汤剂0.63 g/(mL·d);中药高剂量组予汤剂1.26 g/(mL·d);缬沙坦组予等效缬沙坦水溶液0.72 mg/(mL·d)。
1.3.3 样本收集方法于灌胃第13天时,禁食不禁水12 h,将60只大鼠分装至代谢笼中,收集24 h尿液样本。予戊巴比妥钠50 mg/kg剂量麻醉大鼠后固定,腹主动脉采血,抗凝管收集,室温静置1 h,3 000 rpm离心15 min,离心半径为144 mm;分离上层血清,-80 ℃冰箱保存。迅速切除左侧肾脏,除去包膜、多余脂肪组织,排空肾内积水,生理盐水冲洗称质量,取部分肾组织置于4%多聚甲醛中固定;另一部分置于液氮,后放入-80 ℃保存。
1.4 检测指标及方法 1.4.1 大鼠肾脏脏器系数、生化指标检测称质量各组大鼠左肾质量,并计算肾脏脏器系数,肾脏脏器系数=左侧肾质量/大鼠体质量×100%。利用南京建成生化试剂盒检测测各组大鼠血肌酐(Scr)、尿素氮(BUN)、24 h尿蛋白定量(24 h-UP)。
1.4.2 肾脏病理学检测取4%多聚甲醛固定的肾脏标本,脱水、石蜡包埋4 μm切片,采用苏木精-伊红染色法(HE)以及Masson染色进行病理切片染色。在显微镜下观测肾脏纤维化程度。
1.4.3 聚合酶链式反应(PCR)利用柱式法提取大鼠肾脏组织总RNA,利用分光光度仪测定RNA浓度。HiFiScript cDNA Synthesis Kit进行逆转录,配置20 μL体系进行cDNA逆转录,使用UltraSYBR Mixturet进行扩增,设置20 μL反应体系PCR检测。RT-PCR反应,反应体系:95 ℃预变形10 min,热启动40个循环(95 ℃变性15 s、60 ℃退火1 min、72 ℃延展1 min)。PCR通过计算基因的相对表达量(2-ΔΔCt)分析结果:以GAPDH为内参基因,计算方法为:ΔΔCt=ΔCt实验组(目的基因Ct值-内参基因Ct值)-ΔCt对照组(目的基因Ct值-内参基因Ct值)。引物由上海生工生物工程公司设计合成,引物序列见表 1。
称取大鼠肾脏组织30 mg进行液氮研磨,RIPA裂解液裂解组织提取蛋白,BCA法测定蛋白浓度。取10 μL蛋白样品、4 μL彩色预染蛋白标准品在10%SDS-PAGE胶中上样,设定100 V电压进行电泳,溴酚蓝至凝胶底部停止电泳。湿式电转膜法转移至PVDF膜上,400 mA恒定电流转膜30 min。快速封闭液室温下封闭30 min。JAK2、STAT3、p-JAK2、p-STAT3、E-cadherin、α-SMA以1∶1 000比例稀释抗体,GAPDH以1∶5 000比例稀释抗体,4 ℃孵育过夜。1xTBST洗膜3遍,Goat Anti-Rabbit IgG(1∶5 000)室温孵育1 h,再次1xTBST洗膜3遍,特超敏ECL化学发光试剂盒显影,凝胶成像仪检测。GAPDH为内参蛋白,Image J软件分析条带,以目的蛋白与内参蛋白比值为相对表达量。
1.5 统计学方法利用SPSS 25.0统计分析软件进行分析,计量资料以均数±标准差(x±s)表示,各组数据比较前先进行正态性及方差齐性检验。组间差异比较采用单因素方差分析(One-Way ANOVA),符合正态分布且方差齐时采用SNK检验,方差不齐时采用Dunnett’s检验;不符合正态分布时使用非参数检验。以P < 0.05为差异具有统计学意义。
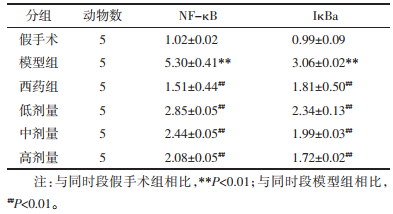
2 结果 2.1 大鼠UUO模型构建结果术后第7天,Masson染色结果显示,模型组及药物干预组大鼠出现明显的胶原沉积及肾小管扩张等间质纤维化表现,与假手术组相比差异显著(P<0.01),证实UUO模型构建成功,见图 1。实验过程中各组大鼠生命体征正常,未出现死亡病例,模型验证成功后每组各有7只大鼠入组实验观察过程。
|
| 注:与同时段模型组相比,**P<0.01;与同时段假后术组相比,##P<0.01。 图 1 术后第7天各组大鼠Masson染色情况(bar=20 μm,×400) |
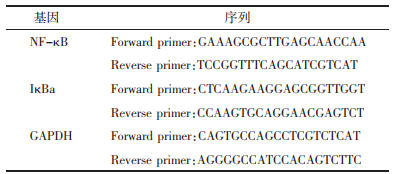
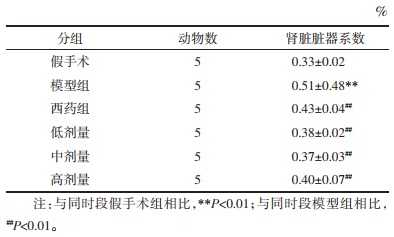
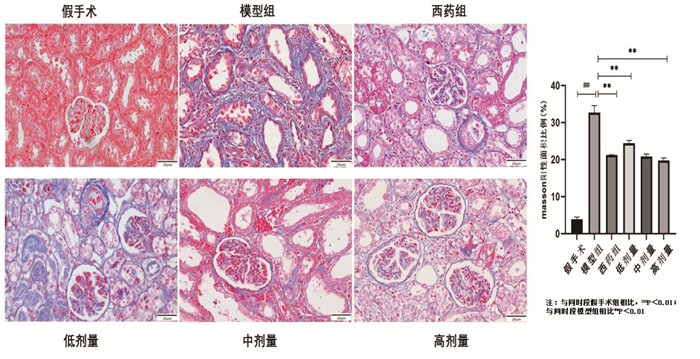
各组大鼠肾脏脏器系数比较,UUO模型构造14 d后,模型组明显出现了肾脏脏器系数异常,模型组较假手术组比较肾脏脏器系数明显升高(P<0.01);药物干预组肾脏脏器系数较模型组明显抑制(P<0.05),见表 2。各组大鼠术后14 d出现了明显的血肌酐、尿素氮、24 h尿蛋白定量的升高(P<0.01),而药物干预组较模型组明显下降(P<0.01),且中剂量、高剂量组整体改善较为明显,见表 3、图 2。
|
| 注:A. 24 h-UP;B.血肌酐;C.尿素氮;与同时段模型组相比,**P<0.01;与同时段假手术组相比,##P<0.01。 图 2 各组大鼠生化指标改善情况 |
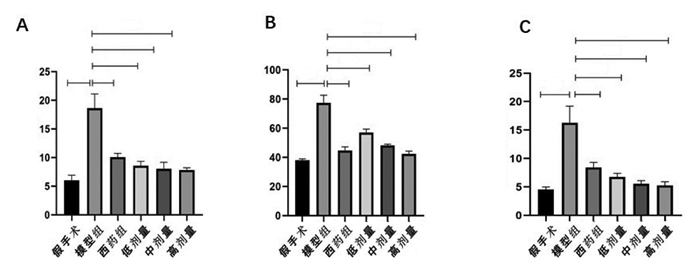
HE染色结果显示,假手术组肾脏组织结构清晰,肾小球大小适中,形态完整,毛细血管袢壁薄,分界清晰。内皮和系膜细胞数量正常,未见基质增生情况;肾小管结构正常,未见小管扩张、萎缩,小管细胞无空泡形成,无刷状缘脱落;肾间质正常,未见明显炎症细胞浸润。与同期假手术组相比模型组出现明显的炎症细胞浸润、肾小球结构破坏、肾小管扩张刷状缘脱落、间质增宽且伴随炎症浸润,并伴有纤维化样变,同时段的药物干预组则较模型组有不同程度的改善,其中,西药组、中剂量、高剂量改善情况较为明显,见图 3。
|
| 图 3 各组大鼠HE染色情况(bar=20 μm,×400) |
Masson染色结果显示,假手术组的胶原纤维主要出现在基底膜和系膜区,而与假手术组比较,模型组大鼠可见大量蓝色胶原纤维沉积,充斥于肾间质区域。治疗组大鼠肾间质内的蓝色胶原较模型组减少。模型组大鼠出现明显的胶原沉积,与假手术组相比差异显著(P<0.01)。药物干预组相比于模型组,胶原沉积均有不同程度的减轻,中剂量及高剂量组效果较为明显(P<0.01),见图 4。
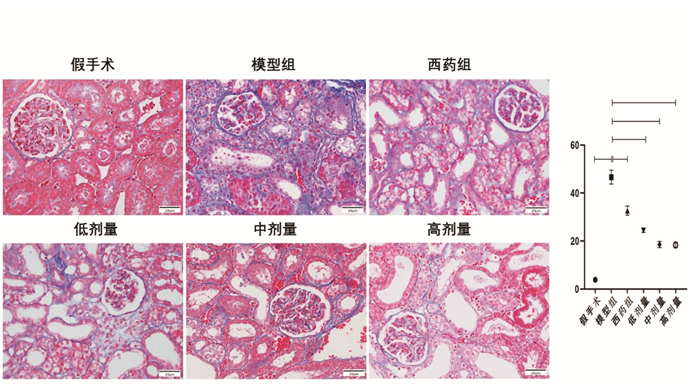
|
| 注:与同时段模型组相比,**P<0.01;与同时段假后术组相比,##P<0.01。 图 4 各组大鼠Masson染色情况(bar=20 μm,×400) |
同假手术组相比,模型组术后NF-κB、IκBa表达水平明显上升(P<0.01)。药物干预组同模型组相比,NF-κB、IκBa表达水平明显下降(P<0.01)。其中NF-κB表达水平,药物干预组同模型组相比表达水平均显著下降(P<0.01),西药效果优于中药干预组,(P<0.05),中药低、中、高剂量之间无显著差异(P>0.05)。IκBa表达水平,西药组、中剂量、高剂量组较模型组表达水平显著下降(P<0.01),中药低剂量组较模型组下降(P<0.01),中药低剂量组同其他药物干预组之间相比无显著差异(P>0.05),见表 4。
检测各组大鼠肾脏组织中RIF表型指标E-钙黏蛋白(E-cad)、α-平滑肌肌动特异性蛋白(α-SMA)表达情况。结果显示,E-cad蛋白表达情况,模型组同假手术组相比明显上升(P<0.01),中剂量组表达水平较模型明显下降(P<0.01)、高剂量组较模型下降(P<0.05)、西药组及低剂量组较模型组表达水平变化无统计学意义(P>0.05),且中药中剂量、高剂量表达水平变化同低剂量相比明显下降(P<0.05)。α-SMA蛋白表达模型组同假手术组相比明显上升(P<0.01),药物干预组出现明显下调,中剂量及高剂量组下降明显(P<0.01),且同西药组及中药低剂量组相比具有统计学意义(P<0.05),见图 5。
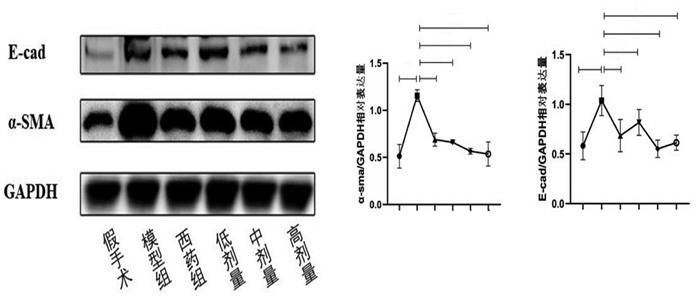
|
| 注:与同时段假后术组相比,##P<0.01;与同时段模型组相比,*P<0.05,**P<0.01。1.假手术组;2.模型组;3.西药组;4.低剂量组;5.中剂量组;6.高剂量组。 图 5 E-cad、α-SMA蛋白表达情况(x±s,n=3) |
Jak2/Stat3信号通路关键蛋白,p-Jak2、p-Stat3模型组同假手术组相比具有明显的上升(P<0.01)。p-Jak2蛋白表达,中药低剂量、中剂量、高剂量组较模型组具有明显的下调(P<0.05),西药组虽然具有下降趋势但不具备统计学差异(P>0.05)。p-Stat3蛋白表达中药中剂量、高剂量同模型组相比具有明显的下降(P<0.01),而中药低剂量及西药组虽然能够下调p-Stat3蛋白表达,但下降水平不具备统计学意义(P>0.05),见图 6。
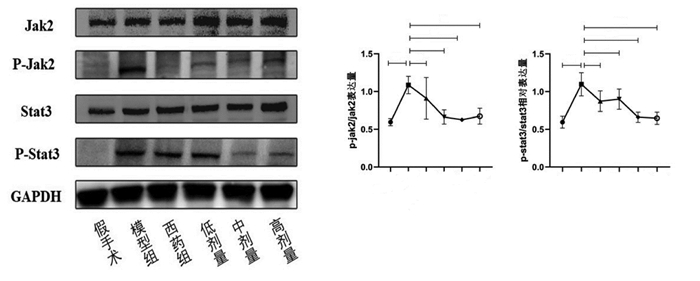
|
| 注:与同时段假后术组相比,##P<0.01;与同时段模型组相比,*P<0.05,**P<0.01。1.假手术组;2.模型组;3.西药组;4.低剂量组;5.中剂量组;6.高剂量组。 图 6 p-Jak2、p-Stat3蛋白表达情况(x±s,n=3) |
RIF是实质内瘢痕的累积,它代表了几乎所有慢性和进行性肾病的共同最终途径[9-10]。EMT是RIF的核心机制,EMT赋予细胞转移和入侵的能力,包括减少细胞凋亡与衰老、促进免疫抑制能力和一定的干细胞特征,对生长发育起着至关重要的作用。但在CKD慢性损伤过程中发生的EMT,常伴随着大量的炎症反应,诸如白细胞介素-6(IL-6)、NF-κB、肿瘤坏死因子-α(TNF-α)等炎症炎症因子的激活,降低了肾组织自我修复的能力,最终破坏肾脏结构,导致肾衰竭[11-12]。
JAK/ STAT信号转导的关键生物学功能可分为两大类:对正常细胞和器官发育必不可少的功能和适应性应激反应激活的功能。然而,持续或失调的JAK/STAT信号转导,会导致许多疾病,包括以慢性炎症和纤维化为特征的疾病,以及癌症。该信号通路控制对细胞稳态至关重要的多个细胞过程,而其中Jak2/Stat3占主导地位,在肝脏以及肺间质疾病中均具有诱发炎症及纤维化的作用[13-16]。Jak2/Stat3信号通路是一条以磷酸化为主要作用方式的信号通路,是参与炎症反应的关键信号通路。该信号通路以关键元件命名,其作用方式通过JAK2磷酸化STAT3,STAT3进一步形成二聚体,转移进细胞核,参与调控基因的表达。Jak/Stat信号通路可以响应多种细胞因子信号,如白介素、干扰素、促红细胞生成素等,研究证实该条信号通路同炎症反应、纤维化进程密切相关[17-19]。现有研究结果表明;JAK2/STAT3通路在特发性肺纤维化中被激活,并且STAT3能够参与肿瘤EMT过程以及肝纤维化进程,在多种疾病过程中表现出相同的致纤维化能力[20-22]。在CKD过程中炎症浸润是导致RIF的关键机制,STAT3作为下游信号分子,在诱导和维持炎症微环境中起关键作用,可以通过crosstalk直接或者诱导NF-κB损伤机制,例如,p65可以与STAT3竞争结合,从而覆盖相应的结合位点,从而抑制IL-6诱导的γ-纤维蛋白原表达;IL -1可以诱导p65/STAT3蛋白复合物,虽然NF-κB/STAT3之间的直接作用关系目前尚未得到明确的证实,但在UUO模型中是参与炎症反应的活跃因子,表现出NF-κB、p-STAT3的高表达[23-26]。
研究结果显示,UUO术后大鼠肾脏出现明显的损伤,血肌酐、尿素氮、24小时尿蛋白定量数值成倍增长,HE、Masson染色结果同样证实了RIF的产生,而中药中剂量、高剂量组对于生化指标的改善整体较为明显;同时对肾小管扩张、间质炎症浸润具有一定的缓解作用。Western Blot检测中,E-cad、α-SMA是上皮的标志物蛋白,观察E-cad、α-SMA的前后变化可以评价肾小管细胞EMT的程度。p-Jak2、p-Stat3则是信号通路的关键分子,通过检测磷酸化蛋白同总蛋白的比值的变化,能够反应出信号通路的激活情况,NF-κB、IκBa是重要的炎症因子,利用qPCR技术对其定量分析,能够从一定程度上证明炎症反应的程度。结果显示,中剂量和高剂量组能够下调标志性蛋白E-cad、α-SMA,且对于p-Jak2、p-Stat3、NF-κB、IκBa也同样具有下调作用。
王耀光教授认为,CKD的病机总体以脾肾虚为本、湿浊瘀血为标,RIF的本质在中医理论的认识中,属于肾脏微癥瘕的形成[27-30]。其中湿浊与瘀血贯穿CKD病程始终,是微癥瘕形成的关键致病因素。肾脏本身为“先天之本”,能够藏精泄浊,贮藏精微物质,肾脏贮藏失司造成CKD过程中蛋白尿的产生,肾的疏泄失调则会产生水液的潴留造成CKD的水肿。同时“肾者作强之官,伎巧出焉”,即强于作用、选化形容,其意义在于肾内寄元阳,具有蒸腾阳气的功能,全身津液的运行依赖于阳气的蒸化,肾间动气为三焦之本是经脉生化之源。因此在治疗上不应当局限于益肾填精、滋腻厚重之品,应使用温利之法,温和通利调节气化为主。通过健脾益气的方式“以通为补”,气壮则湿化、得温则血行,调节周身气机的运转的方式,调动机体的代谢功能。
本研究所使用的加味防己黄芪汤,由《金匮要略》防己黄芪汤化裁而来,原方主治湿病,风湿在表兼气虚之证,为微汗法代表方,全方意在益气固表、祛风除湿。加味防己黄芪汤由生黄芪、生白术、防己、赤芍、地龙5味药组成,去掉原方甘草的甘缓调和之力,生黄芪的用量30 g君药,配合防己祛风除湿而不伤表;白术生用,健运肺脾升清阳之气;加赤芍入血分、散恶血、利小便;地龙咸寒下行、搜剔经络、祛瘀生新,全方扶正祛邪兼顾固表、燥湿、通经、和血四个方面。中医理论认为“正气存内则邪不可干”,加味防己黄芪汤治疗上采取扶正祛邪的方式,本质上是通过理法方药的组合,调节机体自身的免疫功能、调动机体的自我修复能力,达到抗炎、抗氧化、免疫调节等目的。相较于单一使用缬沙坦中药复方效果更具有优势,原因可能在于中药具有多靶点的作用方式,现代药理研究表明[31-34]:白术内酯I以及黄芪甲苷能够显著降低phospho-JAK2和phospho-STAT3的蛋白表达水平;黄芪甲苷、芍药苷,能够同与JAK2/STAT3通路相关蛋白之间通过分子对接的相互作用,从而减轻炎症反应以及氧化应激损伤。而应用针对性的药物赤芍与地龙,则可有目的性的增强对于肾脏微癥瘕的干预作用,药理研究也表明:赤芍、地龙具有抗炎、抗纤维化、抗氧化等作用[35-37]。结合本研究结果,从一定程度上能够证实加味防己黄芪汤对于RIF具有改善作用且具有抗炎作用。
综上,加味防己黄芪汤能够改善UUO大鼠的血肌酐、尿素氮、24 h尿蛋白、减轻UUO大鼠的病理损伤、下调UUO大鼠E-cad、α-SMA、p-Jak2、p-Stat3、NF-κB、IκBa的蛋白表达,从一定程度上能够证实加味防己黄芪汤能够干预JAK2/STAT3信号通路起到抗炎、抗纤维化的作用,对于RIF具有延缓作用。
| [1] |
BÜLOW R D, BOOR P. Extracellular matrix in kidney fibrosis: more than just a scaffold[J]. The Journal of Histochemistry and Cytochemistry: Official Journal of the Histochemistry Society, 2019, 67(9): 643-661. DOI:10.1369/0022155419849388 |
| [2] |
LV J C, ZHANG L X. Prevalence and disease burden of chronic kidney disease[J]. Advances in Experimental Medi- cine and Biology, 2019, 1165(12): 3-15. |
| [3] |
MACK M. Inflammation and fibrosis[J]. Matrix Biology, 2018, 68(6): 106-121. |
| [4] |
SALMINEN A. Increased immunosuppression impairs tissue homeostasis with aging and age-related diseases[J]. Journal of Molecular Medicine (Berlin, Germany), 2021, 99(1): 1-20. DOI:10.1007/s00109-020-01988-7 |
| [5] |
LEARY S U W, ANTHONY R. AVMA Guidelines for the euthanasia of animals: 2020 Edition[M]. Schaumburg: American Veterinary Medical Association, 2020.
|
| [6] |
ARANDA-RIVERA A K, CRUZ-GREGORIO A, APARICIO-TREJO O E, et al. Redox signaling pathways in unilateral ureteral obstruction (UUO)-induced renal fibrosis[J]. Free Radical Biology & Medicine, 2021, 172(7): 65-81. |
| [7] |
CHEVALIER R L, FORBES M S, THORNHILL B A. Ureteral obstruction as a model of renal interstitial fibrosis and obstructive nephropathy[J]. Kidney International, 2009, 75(11): 1145-1152. DOI:10.1038/ki.2009.86 |
| [8] |
MARTÍNEZ-KLIMOVA E, APARICIO-TREJO O E, TAPIA E, et al. Unilateral ureteral obstruction as a model to investigate fibrosis-attenuating treatments[J]. Biomolecules, 2019, 9(4): 141. DOI:10.3390/biom9040141 |
| [9] |
FENG Y L, WANG W B, NING Y, et al. Small molecules against the origin and activation of myofibroblast for renal interstitial fibrosis therapy[J]. Biomedecine & Pharmacotherapie, 2021, 139(7): 11-12. |
| [10] |
HUMPHREYS B D. Mechanisms of renal fibrosis[J]. Annual Review of Physiology, 2018, 32(5): 309-326. |
| [11] |
KALLURI R, WEINBERG R A. The basics of epithelial-mesenchymal transition[J]. The Journal of Clinical Investigation, 2009, 119(6): 1420-1428. DOI:10.1172/JCI39104 |
| [12] |
ACLOQUE H, ADAMS M S, FISHWICK K, et al. Epithelial-mesenchymal transitions: the importance of changing cell state in development and disease[J]. The Journal of Clinical Investigation, 2009, 119(6): 1438-1449. DOI:10.1172/JCI38019 |
| [13] |
BHARADWAJ U, KASEMBELI M M, ROBINSON P, et al. Targeting Janus kinases and signal transducer and activator of transcription 3 to treat inflammation, fibrosis, and cancer: rationale, progress, and caution[J]. Pharmacological Reviews, 2020, 72(2): 486-526. DOI:10.1124/pr.119.018440 |
| [14] |
MONTERO P, MILARA J, ROGER I, et al. Role of JAK/STAT in interstitial lung diseases; molecular and cellular mechanisms[J]. International Journal of Molecular Sciences, 2021, 22(12): 6211. DOI:10.3390/ijms22126211 |
| [15] |
TANG G Y, LI S, ZHANG C, et al. Clinical efficacies, underlying mechanisms and molecular targets of Chinese medicines for diabetic nephropathy treatment and management[J]. Acta Pharmaceutica Sinica B, 2021, 11(9): 2749-2767. DOI:10.1016/j.apsb.2020.12.020 |
| [16] |
ZHAO J, QI Y F, YU Y R. STAT3:A key regulator in liver fibrosis[J]. Annals of Hepatology, 2021, 21(3): 10-12. |
| [17] |
LI R Q, SUN N, CHEN X, et al. JAK2V617F mutation promoted IL-6 production and glycolysis via mediating PKM1 stabilization in macrophages[J]. Frontiers in Immunology, 2020, 11(2): 58-59. |
| [18] |
LI Y F, GUO F, HUANG R S, et al. Natural flavonoid pectolinarigenin alleviated kidney fibrosis via inhibiting the activation of TGFβ/SMAD3 and JAK2/STAT3 signaling[J]. International Immunopharmacology, 2021, 91(7): 72-79. |
| [19] |
LU R, ZHANG Y G, SUN J. STAT3 activation in infection and infection-associated cancer[J]. Molecular and Cellular Endocrinology, 2017, 451(14): 80-87. |
| [20] |
MILARA J, HERNANDEZ G, BALLESTER B, et al. The JAK2 pathway is activated in idiopathic pulmonary fibrosis[J]. Respiratory Research, 2018, 19(1): 24. DOI:10.1186/s12931-018-0728-9 |
| [21] |
WANG B, LIU T, WU J C, et al. STAT3 aggravates TGF-β1-induced hepatic epithelial-to-mesenchymal transition and migration[J]. Biomedecine & Pharmacotherapie, 2018, 98(6): 214-221. |
| [22] |
WU W J, FU J Y, GU Y J, et al. JAK2/STAT3 regulates estrogen-related senescence of bone marrow stem cells[J]. The Journal of Endocrinology, 2020, 245(1): 141-153. DOI:10.1530/JOE-19-0518 |
| [23] |
WANG J Y, GE S K, WANG Y Q, et al. Puerarin alleviates UUO-induced inflammation and fibrosis by regulating the NF-κB P65/STAT3 and TGFβ1/smads signaling pathways[J]. Drug Design, Development and Therapy, 2021, 15(6): 3697-3708. |
| [24] |
AKANDA M R, NAM H H, TIAN W S, et al. Regulation of JAK2/STAT3 and NF-κB signal transduction pathways; veronica polita alleviates dextran sulfate sodium-induced murine colitis[J]. Biomedecine & Pharmacotherapie, 2018, 100: 296-303. |
| [25] |
BAI Y, WANG W, YIN P, et al. Ruxolitinib alleviates renal interstitial fibrosis in UUO mice[J]. International Journal of Biological Sciences, 2020, 16(2): 194-203. DOI:10.7150/ijbs.39024 |
| [26] |
CHEN W D, ZHANG J L, WANG X Y, et al. The JAK2/STAT3 signaling pathway is required for inflammation and cell death induced by cerulein in AR42J cells[J]. European Review for Medical and Pharmacological Sciences, 2019, 23(4): 1770-1777. |
| [27] |
冯慧, 王建康, 蒋雪定. 基于《内经》肾风理论探讨慢性肾脏病从风论治[J]. 浙江中医杂志, 2022, 57(4): 245-246. FENG H, WANG J K, JIANG X D. Discussion on the treatment of chronic kidney disease from wind based on the theory of kidney wind in Neijing[J]. Zhejiang Journal of Traditional Chinese Medicine, 2022, 57(4): 245-246. |
| [28] |
邵建彬, 张玉倩, 刘孟瑞, 等. 赵玉庸运用"通肾络八法"治疗慢性肾脏病经验[J]. 中医杂志, 2022, 63(8): 714-719. SHAO J B, ZHANG Y Q, LIU M R, et al. ZHAO yuyong's experience in treating chronic kidney disease with "eight methods of unblocking kidney collaterals"[J]. Journal of Tradi- tional Chinese Medicine, 2022, 63(8): 714-719. |
| [29] |
王英明, 李建省, 冯月阳, 等. 基于"虚实辨证"探析慢性肾脏病的治疗[J]. 中医临床研究, 2022, 14(2): 31-34. WANG Y M, LI J S, FENG Y Y, et al. An analysis of the treatment of chronic kidney disease based on syndrome differentiation of deficiency and excess[J]. Clinical Journal of Chinese Medicine, 2022, 14(2): 31-34. |
| [30] |
徐飞鹏, 张亚君, 沈沛成, 等. 基于伏邪理论探讨肠-肾轴对慢性肾脏病的影响[J]. 上海中医药杂志, 2022, 56(5): 36-38. XU F P, ZHANG Y J, SHEN P C, et al. To explore effect of intestine-kidney axis on chronic kidney disease based on theory of hidden pathogen[J]. Shanghai Journal of Traditional Chinese Medicine, 2022, 56(5): 36-38. |
| [31] |
FU X Y, SUN Z J, LONG Q Y, et al. Glycosides from Buyang Huanwu Decoction inhibit atherosclerotic inflammation via JAK/STAT signaling pathway[J]. Phytomedicine, 2022, 105(7): 154385. |
| [32] |
LI B, YU J J, LIU P P, et al. Astragaloside IV protects cardiomyocytes against hypoxia injury via HIF-1α and the JAK2/STAT3 pathway[J]. Annals of Translational Medicine, 2021, 9(18): 1435. |
| [33] |
WANG S G, XU Y, CHEN J D, et al. Astragaloside IV stimulates angiogenesis and increases nitric oxide accumulation via JAK2/STAT3 and ERK1/2 pathway[J]. Molecules, 2013, 18(10): 12809-12819. |
| [34] |
FU X Q, CHOU J Y, LI T, et al. The JAK2/STAT3 pathway is involved in the anti-melanoma effects of atractylenolide I[J]. Experimental Dermatology, 2018, 27(2): 201-204. |
| [35] |
陈宏, 张伟, 郭建波, 等. 地龙提取物抗肺纤维化的有效成分分析[J]. 中医药信息, 2020, 37(3): 14-16. CHEN H, ZHANG W, GUO J B, et al. Effective components of earthworm extract against pulmonary fibrosis[J]. Information on Traditional Chinese Medicine, 2020, 37(3): 14-16. |
| [36] |
陈林明, 林晓坤, 王智民, 等. 两广地区地龙中22种无机元素量变规律研究[J]. 中南药学, 2021, 19(12): 2622-2627. CHEN L M, LIN X K, WANG Z M, et al. Quantitative variation of 22 inorganic elements in pheretima from Guangdong and Guangxi[J]. Central South Pharmacy, 2021, 19(12): 2622-2627. |
| [37] |
韩宇博, 冯天甜, 田苗, 等. 地龙有效成分对高糖下HMC细胞炎症因子分泌影响[J]. 辽宁中医药大学学报, 2021, 23(2): 25-28. HAN Y B, FENG T T, TIAN M, et al. Effect of effective components of Dilong (Pheretima) on secretion of inflammatory factors in human mesangial cell under high glucose[J]. Journal of Liaoning University of Traditional Chinese Medicine, 2021, 23(2): 25-28. |
 2023, Vol. 42
2023, Vol. 42