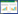文章信息
- 王仁兴, 张奎斌, 王敏, 胡远康, 刘志东
- WANG Renxing, ZHANG Kuibin, WANG Min, HU Yuankang, LIU Zhidong
- 三七总皂苷眼用凝胶在兔眼部的组织分布研究
- Study on the tissue distribution of Panax notoginseng saponins ophthalmic gel in rabbit eyes
- 天津中医药大学学报, 2023, 42(2): 230-235
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(2): 230-235
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.02.18
-
文章历史
收稿日期: 2022-08-20
2. 天津中医药大学现代中药发现与制剂技术教育部工程中心, 天津 301617
2. Modern Chinese Medicine Discovery and Preparation Technology Engineering Center of the Ministry of Education, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
三七总皂苷是传统名贵中药材三七(Radix Notoginseng)中的活性成分,三七总皂苷包含多种单体皂苷,代表性皂苷为三七皂苷R1、人参皂苷Rg1及人参皂苷Rb1,具有抗炎、抗癌、降血脂及抗氧化等作用[1-4]。有研究表明,糖尿病小鼠口服三七皂苷R1可减轻小鼠视网膜血管变性,减少视网膜厚度和减轻视网膜功能受损[5]。人参皂苷Rg1对2型糖尿病性视网膜病变具有保护作用,它能降低2型糖尿病小鼠视网膜神经节细胞、外网状层和中网状层的血管内皮生长因子(VEGF)以及核苷酸结合寡聚化结构域样受体3的表达,同时也能降低2型糖尿病小鼠视网膜炎症因子白细胞介素-1β(1L-1β)、视网膜核因子-κB(NF-κB)的表达[6]。人参皂苷Rb1能够显著抑制高糖诱导的视网膜血管内皮细胞氧化应激,抑制细胞凋亡和脱氧核糖核酸(DNA)损伤,并提高内皮细胞的抗氧化能力[7]。此外,人参皂苷Rb1还能抑制糖尿病大鼠视网膜丙二醛(MDA)含量的增加和谷胱甘肽(GSH)水平含量,减弱糖尿病引起的视网膜血管直径的增加[8]。由此可知三七总皂苷对糖尿病性视网膜病变具有治疗作用。
药物在靶部位达到一定的分布浓度是产生药理效应的基础。在一定范围内,药物的效应与靶部位的浓度存在着量效关系。然而,目前对于三七总皂苷在兔眼部的组织分布研究鲜有报道。因此,在课题组前期研究基础上,以三七总皂苷药物为研究对象,将其制备成凝胶后,探索其在兔眼部组织的药物分布规律,为三七总皂苷的相关药理作用研究提供参考[9]。
1 实验材料 1.1 仪器液质联用仪(美国Agilent公司,包括1290型高效液相色谱仪、6460型三重四级杆质谱仪,MassHunter工作站),FA124万分之一天平(上海舜宇恒平科学仪器有限公司),AX205十万分之一电子天平(瑞士METTLER TOLEDO),DELTTA320 pH计(METTLER TOLEDO,瑞士),Milli Q超纯水系统(美国Millipore公司),KQ-400KDE型高功率数控超声波清洗器(昆山市超声仪器有限公司),SZCL-4B智能磁力加热搅拌器(巩义市予华仪器有限责任公司)。
1.2 试剂人参皂苷Rg1对照品(源叶,批号:C27N11Q132589,含量≥98%),三七皂苷R1对照品(源叶,批号:G09D10Y104881,含量≥98%),淫羊藿苷对照品(源叶,批号:T11A11B111118,含量≥98%),三七总皂苷原料药(其中含三七皂苷R1 8.45%,人参皂苷Rg1 44.16%,人参皂苷Rb1 34.66%,楚雄云植药业有限公司,批号:HB20201021),甲醇(色谱纯,美国Fisher公司),去离子水(由Milli-Q超纯水机制备),乙腈(色谱纯,美国Fisher公司),羟丙基甲基纤维素E4M(美国Colorcon公司),卡波姆940(武汉拉那白医药化工有限公司),乙二胺四乙酸二钠(上海源叶生物科技有限公司),氢氧化钠(天津市津科精细化工研究所),生理盐水(石家庄四药有限公司)。
1.3 动物新西兰大白兔,雄性,体质量2.0~2.5 kg,由北京维通利华实验动物技术有限公司提供,动物合格证号:SCXK(津)2016-0001。相关研究遵照动物实验原则进行。
2 实验方法 2.1 三七总皂苷眼用凝胶的制备将2%(W/V)三七总皂苷和0.05%(W/V)EDTA-2Na溶解在一定体积的去离子水中,然后将其加热至70 ℃,在搅拌条件下加入准确称量的羟丙基甲基纤维素(HPMC),分散均匀后在冷却条件下搅拌至澄清。另将准确称量的高分子材料卡波姆在高速搅拌下缓缓加入一定体积的去离子水中,分散均匀后,将其放入4 ℃的冰箱中存放12 h以上,至聚合物溶胀完全得到澄明溶液。最后将两者搅拌混匀,加入适量的0.5 mol/L氢氧化钠溶液调节pH至5.0左右,补水至处方量,即得。
2.2 给药及样品采集方法新西兰大白兔,体质量2.0~2.5 kg,雄性,随机分成0.5、1、1.5、2 h 4个时间组(n=3),给药时,将兔子固定在兔箱内,轻轻拉开眼睑使与眼球呈袋状,双眼各给予100 μL眼用凝胶,再轻轻放下眼睑,使药物不会溢出,给药后,于不同时间耳缘静脉空气栓塞处死家兔,迅速摘除眼球,生理盐水充分清洗,抽取房水,切除角膜,收集玻璃体和晶状体,滤纸吸干固体组织表面水分,并精密称重,所有组织于-80 ℃冷藏。
2.3 样品测定条件 2.3.1 色谱条件色谱柱:Waters HSS T3 1.8 μm色谱柱(2.1 mm×100 mm);柱温:40 ℃;流速:0.3 mL/min;进样量:5 μL;流动相:水(A)-乙腈(B);梯度洗脱:0~2 min,25%→25%B;2-5 min,25%→40%B;5~8 min,40%→25%;8~10 min,25%→25%B。
2.3.2 质谱条件电喷雾离子源(ESI源),扫描方式:正离子检测;检测方式:多反应离子监测(MRM);电喷雾电压:4 kV;雾化气体:N2;喷雾气流速:40 psi;干燥气温度:300 ℃,详细参数见表 1。
分别精密称取三七皂苷R1对照品6.29 mg、人参皂苷Rg1对照品8.30 mg,置于25 mL容量瓶中,甲醇溶解并稀释至刻度,摇匀,得浓度分别为三七皂苷R1 0.25 mg/mL和人参皂苷Rg1 0.33 mg/mL的混合对照品储备液,4 ℃冷藏保存。另外取1 mL混合对照品储备液于100 mL容量瓶中,甲醇稀释至刻度线,得浓度分别为三七皂苷R1 2.46 μg/mL和人参皂苷Rg1 3.25 μg/mL的混合对照品储备液,4 ℃冷藏保存。
2.3.4 内标溶液配制精密称取淫羊藿苷对照品6.76 mg,置于25 mL容量瓶中,甲醇溶解并稀释至刻度,摇匀,得浓度为0.27 mg/mL的淫羊藿苷对照品溶液,4 ℃冷藏保存。另外取1 mL对照品储备液于100 mL容量瓶中,甲醇稀释至刻度线,得浓度为2.70 μg/mL的淫羊藿苷对照品溶液,4 ℃冷藏保存。
2.4 样品处理方法液体组织(房水和玻璃体):取0.1 mL房水或玻璃体置于1.5 mL离心试管中,加入0.3 mL甲醇,0.01 mL淫羊藿苷内标溶液(浓度为2.70 μg/mL),涡旋3 min,12 000 r/min,离心10 min,离心半径为16.8 cm,取上清液氮吹,吹干,加0.1 mL 50%甲醇复溶,12 000 r/min,离心10 min。按“2.3”项下方法进样。
固体组织(角膜和晶状体):取角膜或晶状体剪碎,称质量,按1∶40(g/mL)比例加入生理盐水,12 000 r/min,离心10 min,离心半径为16.8 cm,取上清液作为组织匀浆液,储存于-80 ℃冰箱中。检测时将其室温融化,取0.1 mL组织匀浆液,加入0.3 mL甲醇,0.01 mL淫羊藿苷内标溶液(浓度为2.70 μg/mL),涡旋3 min,12 000 r/min,离心10 min,离心半径为16.8 cm,取上清液氮吹,吹干,加0.1 mL 50%甲醇复溶,12 000 r/min,离心10 min,离心半径为16.8 cm。按“2.3”项下方法进样。
2.5 方法学验证 2.5.1 专属性分别测定空白角膜、空白房水、空白玻璃体、空白晶状体、三七皂苷R1和人参皂苷Rg1的混合对照品溶液、三七皂苷R1、人参皂苷Rg1和淫羊藿苷的混合对照品溶液加入各样品溶液的色谱图。结果表明,在该色谱条件下,空白角膜、房水、玻璃体和晶状体中的内源性物质不干扰三七皂苷R1和人参皂苷Rg1的含量测定,且淫羊藿苷与三七皂苷R1和人参皂苷Rg1互不干扰,三七皂苷R1、人参皂苷Rg1和淫羊藿苷的保留时间分别为2.9、3.8和5.5 min。图 1为不同晶状体标本的色谱图,专属性符合生物制品的测定要求。

|
| 注:1.三七皂苷R1;2.人参皂苷Rg1;3.淫羊藿苷(内标);a.空白晶状体匀浆液;b.样品溶液;c.含标准品的晶状体溶液。 图 1 专属性色谱图 |
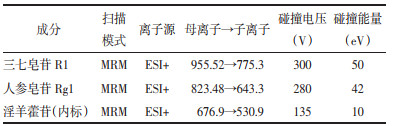
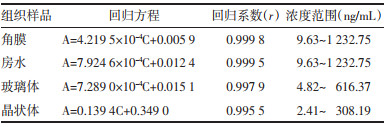
精密吸取0.1 mL空白角膜匀浆液、混合对照品储备液,配制成含三七皂苷R1浓度为9.63、19.26、38.52、77.05、154.09、308.19、616.38、1232.75 ng/mL的角膜样品溶液,含人参皂苷Rg1浓度为12.70、25.41、50.83、101.67、203.35、406.70、813.40、1626.8 ng/mL的角膜样品溶液,按“2.4”项下操作,进样,记录色谱图。以三七皂苷R1或人参皂苷Rg1峰面积与内标峰面积的比值A对角膜质量浓度C为横坐标进行线性回归。使用加权(1/x)最小二乘线性回归分析,得到各待测化合物标准曲线的回归系数r > 0.998,线性范围良好,结果见表 2和表 3。
精密吸取0.1 mL空白房水、分别加入混合对照品储备液,配制成三七皂苷R1浓度为9.63、19.26、38.52、77.05、154.09、308.19、616.38、1232.75 ng/mL的房水样品溶液,含人参皂苷Rg1浓度为12.70、25.41、50.83、101.67、203.35、406.70、813.40、1 626.8 ng/mL的房水样品溶液,按“2.4”项下操作,进样,记录色谱图。分别以三七皂苷R1或人参皂苷Rg1峰面积与内标峰面积的比值A对房水质量浓度C进行线性回归。使用加权(1/x)最小二乘线性回归分析,得到各待测化合物标准曲线的回归系数r > 0.998,线性范围良好,结果见表 2和表 3。
2.5.2.3 玻璃体中各待测物的标准曲线精密吸取0.1 mL空白玻璃体、混合对照品储备液,配制成含三七皂苷R1浓度为9.63、19.26、38.52、77.05、154.09、308.19、616.38 ng/mL的玻璃体样品溶液,含人参皂苷Rg1浓度为12.70、25.41、50.83、101.67、203.35、406.70、813.40 ng/mL的玻璃体样品溶液,按“2.4”项下操作,进样,记录色谱图。以三七皂苷R1或人参皂苷Rg1峰面积与内标峰面积的比值A对玻璃体质量浓度C为横坐标进行线性回归。使用加权(1/x)最小二乘线性回归分析,得到各待测化合物标准曲线的回归系数r > 0.995,线性范围良好,结果见表 2和表 3。
2.5.2.4 晶状体中各待测物的标准曲线精密吸取0.1 mL空白晶状体匀浆液、混合对照品储备液,配制成含三七皂苷R1浓度2.41、4.82、9.63、19.26、38.52、77.05、154.09、308.19 ng/mL的晶状体样品溶液,含人参皂苷Rg1浓度3.18、6.35、12.70、25.41、50.83、101.67、203.35、406.70 ng/mL的晶状体样品溶液,按“2.4”项下操作,进样,记录色谱图。以三七皂苷R1或人参皂苷Rg1峰面积与内标峰面积的比值A对晶状体质量浓度C为横坐标进行线性回归。使用加权(1/x)最小二乘线性回归分析,得到各待测化合物标准曲线的回归系数r > 0.995,线性范围良好,结果见表 2和表 3。
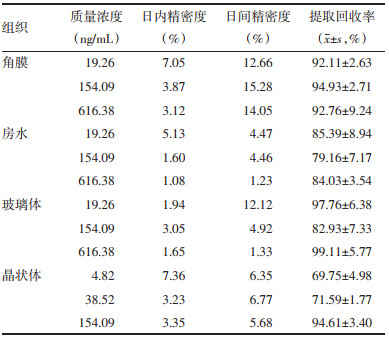
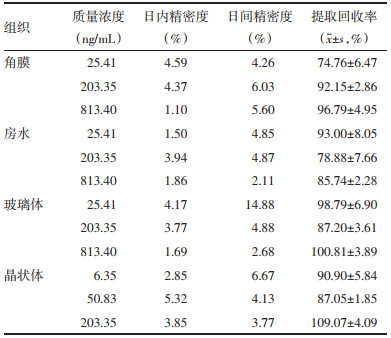
2.5.3 精密度取空白角膜、空白房水、空白玻璃体及空白晶状体匀浆液0.1 mL,加入“2.5.2”项下各组织3种低、中、高浓度的对照品混合储备液,按上述“2.4”项下制备含三七皂苷R1或人参皂苷Rg1质量浓度的质量控制(QC)样品,重复进样6次。连续测定3 d。计算三七皂苷R1和人参皂苷Rg1的日内精密度和日间精密度。三七皂苷R1和人参皂苷Rg1的日内精密度RSD小于8%,日间精密度RSD小于16%,表明精密度良好。具体结果见表 4和表 5。
分别取空白角膜匀浆液、空白房水、空白玻璃体、空白晶状体匀浆液各0.1 mL,配制“2.5.2”项下低、中、高3个不同浓度含药角膜质控样品,按上述“2.4”项下操作后进样分析,以角膜、房水、玻璃体、晶状体中三七皂苷R1、人参皂苷Rg1的峰面积与相应质量浓度对照品溶液中三七皂苷R1、人参皂苷Rg1峰面积的比值计算出上述3种质量浓度的提取回收率,每个浓度平行做6份。经UPLC-MS测定后,在各眼组织中三七皂苷R1和人参皂苷Rg1的低、中、高三种浓度的提取回收率均高于69%。具体结果见表 4和表 5。
2.5.5 稳定性分别取空白房水、玻璃体、角膜及晶状体匀浆液0.1 mL,配制“2.5.2”下低、中、高3个不同浓度含药房水、玻璃体、角膜及晶状体质控样品,按上述“2.4”项下操作方法处理样品。考察含药房水、玻璃体、角膜及晶状体样品处理好后溶液中分析物在室温放置6 h、结果表明,经处理后的房水、玻璃体、角膜及晶状体样品室温放置6 h后三七皂苷R1、人参皂苷Rg1低、中、高3个不同质量浓度的RSD均小于10%。
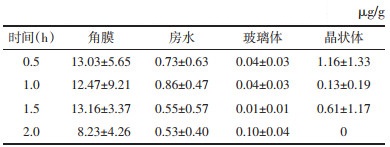
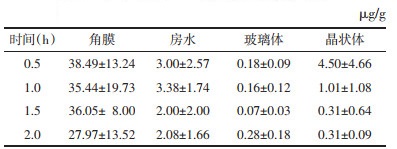
3 实验结果100 μL三七总皂苷眼用凝胶单次滴兔眼后,不同时间点三七皂苷R1和人参皂苷Rg1在角膜、房水、玻璃体和晶状体中的药物含量见表 6和表 7。
由表 6、表 7、图 2和图 3可知,2% PNS眼用凝胶滴到兔眼后,人参皂苷Rg1和三七皂苷R1可迅速地透过角膜分散到各眼组织中,0~2 h内在各眼组织中的浓度由高到低依次为:角膜、晶状体、房水、玻璃体,结果表明三七皂苷R1和人参皂苷Rg1可透过角膜,到达眼后部组织,且药物在2 h时各眼部组织含量依然较高,在眼组织保留时间长。
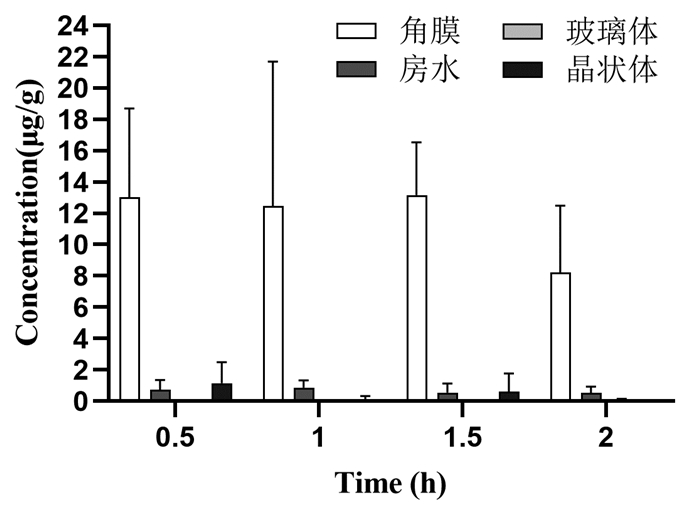
|
| 图 2 三七皂苷R1在不同时间点眼组织中的含量 |
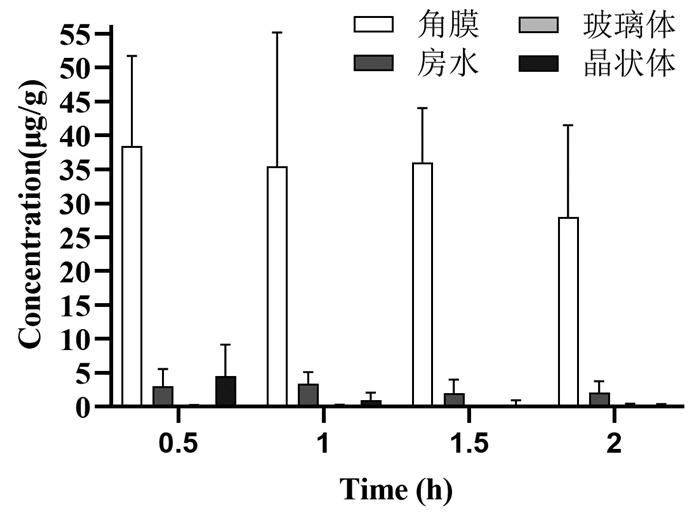
|
| 图 3 人参皂苷Rg1在不同时间点眼组织中的含量 |
本实验采用UPLC-MS技术建立了三七皂苷R1和人参皂苷Rg1在兔眼组织的分析方法,本方法专属性好、灵敏度高及重现性好;在体内分析方法建立过程中,人参皂苷Rb1在以生理盐水为介质的溶液中,质谱检测结果极不稳定,推测原因可能与人参皂苷Rb1的离子化程度和钠加合离子有关[10-12]。组织分布研究结果表明,三七皂苷R1和人参皂苷Rg1易于穿过角膜,迅速分散在各眼组织中,且在角膜中的含量最高,其次是晶状体、房水及玻璃体,由此可知三七皂苷R1和人参皂苷Rg1可能通过眼前段组织,进入眼后段组织从而发挥治疗眼后段疾病的作用。
| [1] |
梁晓莲, 刘纤纤, 李文莉, 等. 三七总皂苷药理作用及临床应用研究进展[J]. 湖北农业科学, 2021, 60(6): 15-19. LIANG X L, LIU Q Q, LI W L, et al. Research progress in pharmacological effects and clinical applications of Panax notoginseng saponins[J]. Hubei Agricultural Sciences, 2021, 60(6): 15-19. |
| [2] |
孙丽艳, 张默涵, 张红丹. 三七总皂苷的药理作用研究进展[J]. 世界最新医学信息文摘, 2016, 16(82): 29-30. SUN L Y, ZHANG M H, ZHANG H D. Research progress on pharmacological effects of panax notoginseng saponins[J]. World Latest Medicine Information, 2016, 16(82): 29-30. |
| [3] |
张赛. 从调节RIG-I信号通路角度解析三七总皂苷在脑缺血中抗炎的分子机制[D]. 北京: 北京中医药大学, 2016. ZHANG S. Molecular mechanism of anti-inflammation of panax notoginseng saponins in cerebral ischemia from the perspective of regulating RIG-I signal pathway[D]. Beijing: Beijing University of Chinese Medicine, 2016. |
| [4] |
尹文洁, 梁月琴, 卿晨. 羟基红花黄色素A和三七总皂苷对高脂血症的影响与机制研究[J]. 中国药物评价, 2018, 35(1): 30-33. YIN W J, LIANG Y Q, QING C. Effect of hydroxysafflor yellow A and Panax notoginseng saponins on the high risk factor for atherosclerosis and mechanism[J]. Chinese Journal of Drug Evaluation, 2018, 35(1): 30-33. DOI:10.3969/j.issn.2095-3593.2018.01.010 |
| [5] |
ZHOU P, XIE W J, MENG X B, et al. Notoginsenoside R1 ameliorates diabetic retinopathy through PINK1-dependent activation of mitophagy[J]. Cells, 2019, 8(3): 213. DOI:10.3390/cells8030213 |
| [6] |
李彬, 张大传, 李学望, 等. 人参皂苷Rg1抑制NLRP3炎症小体对2型糖尿病小鼠视网膜病变的保护作用[J]. 中国中药杂志, 2022, 47(2): 476-483. LI B, ZHANG D C, LI X W, et al. Protective effect of ginsenoside Rg1 aganist diabetic retinopathy by inhibiting NLRP3 inflammasome in type 2 diabetic mice[J]. China Journal of Chinese Materia Medica, 2022, 47(2): 476-483. |
| [7] |
FAN C L, MA Q, XU M, et al. Ginsenoside Rb1 attenuates high glucose-induced oxidative injury via the NAD-PARP-SIRT axis in rat retinal capillary endothelial cells[J]. International Journal of Molecular Sciences, 2019, 20(19): 4936. DOI:10.3390/ijms20194936 |
| [8] |
DONG C X, LIU P, WANG H Z, et al. Ginsenoside Rb1 attenuates diabetic retinopathy in streptozotocin-induced diabetic rats1[J]. Acta Cirurgica Brasileira, 2019, 34(2): e201900201. DOI:10.1590/s0102-8650201900201 |
| [9] |
LU P, WANG R X, XING Y, et al. Development and evaluation of Panax notoginseng saponins contained in an in situ pH-triggered gelling system for sustained ocular posterior segment drug delivery[J]. Acupuncture and Herbal Medicine, 2021, 1(2): 107-121. DOI:10.1097/HM9.0000000000000020 |
| [10] |
GUO Z L, LI Y, LIU X W, et al. Sodium tanshinone ⅡA silate alleviates high glucose induced barrier impairment of human retinal pigment epithelium through the reduction of NF-κB activation via the AMPK/p300 pathway[J]. Current Eye Research, 2020, 45(2): 177-183. |
| [11] |
FAN K S, LI S Y, LIU G Q, et al. Tanshinone ⅡA inhibits high glucose induced proliferation, migration and vascularization of human retinal endothelial cells[J]. Molecular Medicine Reports, 2017, 16(6): 9023-9028. |
| [12] |
QIAN S H, QIAN Y J, HUO D X, et al. Tanshinone Ⅱa protects retinal endothelial cells against mitochondrial fission induced by methylglyoxal through glyoxalase 1[J]. European Journal of Pharmacology, 2019, 857: 172419. |
 2023, Vol. 42
2023, Vol. 42