文章信息
- 朱利婉, 周利, 李翔, 李伟, 黄胜, 康利平
- ZHU Liwan, ZHOU Li, LI Xiang, LI Wei, HUANG Sheng, KANG Li-ping
- 紫珠属药用植物研究进展及质量标志物预测分析
- Research progress of the Callicarpa L. and predictive analysis on its quality marker
- 天津中医药大学学报, 2023, 42(2): 243-256
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(2): 243-256
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.02.20
-
文章历史
收稿日期: 2022-10-15
2. 中国中医科学院中药资源中心道地药材国家重点实验室培育基地, 北京 100700;
3. 海南九芝堂药业有限公司, 海口 570311;
4. 九芝堂股份有限公司, 长沙 410205
2. State Key Laboratory Breeding Base of Dao-di Herbs, National Resource Center for Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China;
3. Hainan Jiuzhitang Pharmaceutical Co., Ltd., Haikou 570311, China;
4. Jiuzhitang Co., Ltd., Changsha 410205, China
中药紫珠最早记载于《本草拾遗》,为马鞭草科(Verbenaceae)紫珠属(Callicarpa L.)植物,该属植物药用历史悠久,有30多种可以作为药用,其中裸花紫珠,广东紫珠,大叶紫珠和紫珠叶即杜虹花被2020版药典收载[1]。紫珠属在全世界有190余种,中国有46种,其中31种为国内特有植物,主要分布于长江以南地区,裸花紫珠主要分布于海南、广东、广西及福建等地,广东紫珠主要分布于浙江、江西、福建等地;大叶紫珠主要分布于广东、广西、贵州等地,资源较为丰富[2-4]。四种中药均具有抗菌止血,消炎解毒之功效,主要用于治疗化脓性炎症、急性传染性肝炎、呼吸道及消化道出血、创伤出血等疾病,外用治烧、烫伤及外伤出血等症[1],在三七血伤宁胶囊、抗宫炎片、妇炎灵胶囊、痔炎消颗粒、裸花紫珠片等多种中成药中使用,具有良好的社会和市场价值。紫珠属药用植物的研究也越来越受到重视[2, 4-6],但近几年报导的化合物结构和药理作用缺乏系统综述,也未见关于其质量标志物(Q-Marker)预测的研究。该文章在系统总结了近5年药用紫珠属植物尤其是4种药典收录紫珠的化学成分、药效成分、药理作用的基础上,并根据中药Q-Marker特有性、有效性、可测性、传递性和中医药理论关联性的五原则,对其Q-Marker进行预测分析,以期为紫珠属药用植物的深入系统研究以及质量控制和综合利用开发提供科学依据。
1 化学成分中药紫珠属植物含有多种化学成分,包括黄酮类、苯丙素类、苯乙醇苷类、环烯醚萜苷、萜类、酚酸类等,至今共报道了近490个化合物,其中苯乙醇苷类、黄酮类成分含量较高且具有良好的药效活性。
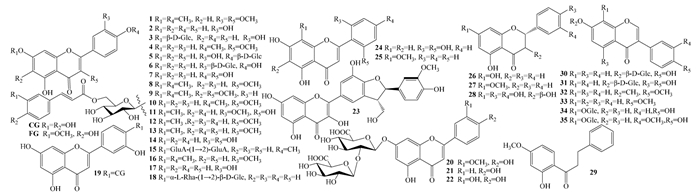
1.1 黄酮类成分黄酮类主要包括黄酮及黄酮醇类(1-25),二氢黄酮及二氢黄酮醇类(27-28),二氢查尔酮类(29)和异黄酮类(30-35)化合物,见表 1和图 1。二氢查尔酮为首次从紫珠属植物中发现。
|
| 图 1 紫珠中黄酮类成分结构式 |
近3年药用紫珠中报道的新化合物、首次报道的化合物或未见综述过的化合物;# 药效成分;Glc:glucuronopyranosyl;下表相同。
1.2 苯乙醇苷类化合物苯乙醇苷(36-53)是紫珠属植物中含量最高的一类成分,也是目前报道的主要的止血抑菌活性成分,其结构多是通过中心葡萄糖和苯丙素类基团组合形成不同化合物。53为罕见的不含4-羟基官能团的苯乙醇苷类新化合物。具体见表 2,图 2。

|
| 图 2 紫珠中苯乙醇苷类成分环烯醚萜苷类成分结构式 |
环烯醚萜苷(54-59)在药用紫珠中也具有一定的含量,见表 3,图 3。
|
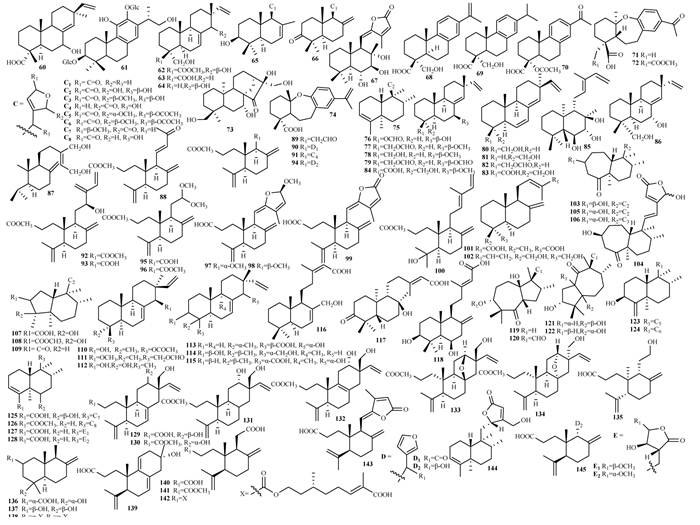
| 图 3 紫珠中二萜类成分结构式 |
二萜类成分是近3年紫珠属植物中新化合物的主要类型,其中半日花烷型和松香烷型居多。71-72,74是新型醚化的松香烷化合物。103-106为特殊的7元环与6元环稠和的二萜类新化合物,107-109为特殊的5元环与6元环稠和的二萜类新化合物,119和120具有特殊的反式7/5环系结构,而121和122具有反式5/7环系结构。123-128为带有五元内酯环的新型克罗烷型化合物。129-133为新型3,4裂环-异右松脂烷型新化合物,134则为新型3,4-裂环-右松脂烷型二萜化合物。136-138具有3,4裂环,并通过C2-C18形成新的环己烷部分。139为罕见的C13-C17环化的3,4-seco-15,16-norlabdane新型化合物。144为具有良好抗炎作用的新型克罗烷型化合物。具体见表 3,图 3。
1.5 三萜类化合物紫珠属植物中共分离了60种三萜类化合物[4-6],其中最近5年报道的新化合物有13(146-158)种,见表 4,图 4。158为首次从紫珠属中分离得到的E环开裂的三萜类化合物,并有显著抗炎活性。
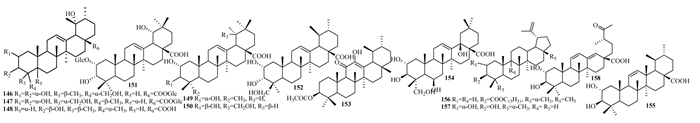
|
| 图 4 紫珠中三萜类成分结构式 |
苯丙素类化合物主要有苯丙酸类(159-168),木脂素类(169-173)和香豆素类(174)。具体见表 5,图 5。
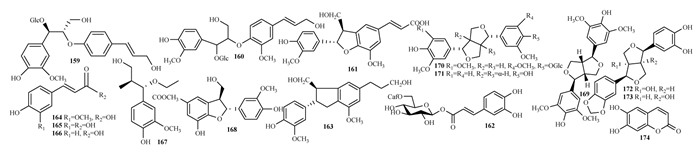
|
| 图 5 紫珠中苯丙素类成分结构式 |
药用紫珠属中还有酚酸类化合物(175-179),含氮化合物(180-181),甾醇类化合物(183-184)及其他类(185-190),见表 6,图 6。182为新型苯甲醇类化合物。紫珠属中还报道挥发油类成分173个[8],未见其活性报道,本文不再赘述。
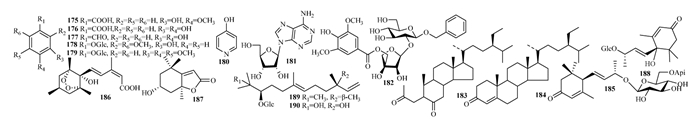
|
| 图 6 紫珠中酚类及其他类成分结构式 |
现代药理研究表明,紫珠属植物具有止血,抗炎,抑菌,抗氧化,抗肿瘤,改善学习记忆等多种药理作用。
2.1 止血作用裸花紫珠的乙醇洗脱部位能显著缩短出血时间,可能通过影响内源性途径发挥止血作用[48]。裸花紫珠正丁醇和乙酸乙酯提取物止血活性的作用机制可能与促进血小板磷酯酰激醇3-激酶(PI3K)/丝氨酸苏氨酸蛋白激酶(Akt)信号和血小板二磷酸腺苷受体亚基12(P2Y12)受体所介导的信号转导有关[49-50]。大叶紫珠水煎液通过升高血浆血栓素B2(TXB2)、降低6-酮-前列腺素F1α(6-ketoPGF1α)水平影响内源性和外源性凝血途径实现止血作用[51]。大叶紫珠总黄酮能显著缩短凝血时间,抑制纤溶系统发挥止血作用[52]。槲皮素能增加腺苷二磷酸(ADP)诱导的血小板聚集,其半最大效应浓度(EC50)为37.66 mg/mL[53]。5-hydroxy-3,7,3’,4’-tetramethoxyflavone,147,毛蕊花糖苷和Samioside能显著缩短活化部分凝血活酶时间(APTT),Samioside能显著延长凝血酶时间(TT),鼠李秦素能显著增加纤维蛋白原(FIB)含量,其中毛蕊花糖苷和Samioside含量较高可能是裸花紫珠止血作用的主要活性物质[46]。
2.2 抑菌作用广东紫珠70%乙醇提取物对金黄色葡萄球菌、大肠杆菌、奇异变形杆菌、甲型副伤寒沙门氏菌、乙型溶血性链球菌有抑制作用[54],毛蕊花糖苷、连翘酯苷B、Alyssonoside、金石蚕苷对金黄色葡萄球菌、大肠杆菌和绿脓杆菌具有一定程度的抑制活性,其中Alyssonoside的活性最佳[55]。裸花紫珠50%乙醇提取物对金黄色葡萄球菌、大肠杆菌和铜绿假单胞杆菌,白色念珠菌有较好的杀灭效果[56],谱效关系显示其主要抗菌活性成分为苯乙醇苷类成分,其次为黄酮类成分,其中木犀草苷,槲皮素,毛蕊花糖苷,异毛蕊花糖苷和2'-acetylacteoside对感染金黄色葡萄球菌的小鼠保护作用显著,梓醇对感染肺炎双球菌的小鼠具有保护作用[20]。151,152和154对耐甲氧西林金黄色葡萄球菌(MRSA)和甲氧西林敏感的金黄色葡萄球菌(MSSA)的参考菌株和临床菌株表现出抗菌活性,最低抑菌浓度为(2-512)μg/mL[57]。
2.3 抗炎作用裸花紫珠有显著的抗宫颈炎症作用,Callicarpicacid A和145在体外能显著抑制NOD样受体热蛋白结构域相关蛋白3(NLRP3)的表达[42]。Callicapenes M3-M5,Nudiflopenes A-I,cathayanalactones A-C[27, 35, 40],Callnudoids A-E,H[43]和Nudiflopenes J-M[19]分别通过抑制脂多糖(LPS)诱导的小鼠单核巨噬细胞(RAW264.7)和小鼠小胶质细胞BV-2中一氧化氮(NO)的生成发挥抗炎作用。毛蕊花糖苷、连翘酯苷B、Alyssonoside、金石蚕苷和49-50可激活RAW 264.7细胞中的Kelch-样ECH相关蛋白1(Keap1)/核因子E2相关因子2(Nrf2)/血红素加氧酶-1(HO-1)信号通路抵抗炎症级联损伤[21]。Cintelactone A通过促进肿瘤坏死因子受体相关因子6(TRAF6)泛素化和蛋白酶体降解来抑制内毒素诱导的炎症[44]。20-22对环氧化酶-1(COX-1)和环氧化酶-2(COX-2)有抑制活性[14]。Randainins D对超氧阴离子的半抑制浓度(IC50值)为(21.5±2.5)μmol/L[39]。
2.4 抗氧化广东紫珠中总酚与总黄酮含量与DPPH自由基清除,ABTS+清除,O2-清除,Cu2+螯合活性成正相关,苯乙醇苷类成分也可能是广东紫珠中主要抗氧化活性成分,鼠李秦素,37-40,江藤苷和他们的衍生物可作为抗氧化剂[58-59]。裸花紫珠中的172-173具有抗氧化活性,EC50值分别为18.5和8.3 μmol/L[47]。木犀草素,木犀草苷,juncein,dracocephaloside和毛蕊花糖苷协同发挥抗氧化作用,可能与羟基官能团可与氧自由基结合有关[60]。
2.5 抗肿瘤裸花紫珠水提物能抑制结肠癌细胞增殖,促进结肠癌细胞凋亡,其作用机制与激活白细胞介素-6(IL-6)和信号转导与转录活化因子3(STAT3)蛋白通路,干预抑制凋亡相关蛋白B淋巴瘤细胞2(Bcl-2)和耐药相关蛋白血清热休克蛋白27(HSP27)基因的表达[61],和激活Wnt/β-catenin信号通路有关[62]。裸花紫珠乙酸乙酯提取物能抑制体内、外抗乳腺癌细胞转移,其作用机制可能与其抑制肿瘤细胞内转录因子的磷酸化,从而调控下游相关靶基因表达有关[63]。7α-Hydroxysandaracopimaric acid,Callicapene M2,callicapoic acids M1和14α-hydroxyisopimaric acid具有潜在的抗肿瘤活性,对嗜淋巴细胞病毒早期抗原(EBV-EA)诱导表现出强烈的抑制作用[64]。
2.6 改善记忆紫珠属植物具有抗老年痴呆作用,机制可能与其能够抑制磷酸二酯酶4(PED4)靶标有关[65]。裸花紫珠可以减少记忆障碍小鼠胆碱能神经递质失活,对小鼠脑部神经元具有保护作用,作用机制可能与抗炎,抗氧化有关[66]。苯乙醇苷类成分可能通过降低脑组织乙酰胆碱酯酶活性,降低脑组织中丙二醛和单胺氧化酶活力等发挥改善记忆损失,增强学习记忆的功能[67]。
2.7 心血管活性近年来药用紫珠的心血管活性被较多报道:广东紫珠的总苯乙醇苷对异丙肾上腺素(ISO)诱导的心肌缺血损伤(MI)具有心脏保护作用,可抑制线粒体Na+-K+-ATP酶(NKA)及细胞外信号调节激酶1/2(ERK1/2)表达,抑制氧化应激和炎症介导的心肌细胞凋亡[68]。连翘苷B通过下调转化生长因子-β1(TGF-β1)/Smad信号通路抑制心肌纤维化,保护心肌免受缺血再灌注损伤[69]。callicarpanoside B具有NKA活性抑制作用,作用机制与callicarpanoside B与NKA结合,促进类固醇受体辅助活化因子(Src)磷酸化激活NKA/Src信号通路,增强NKA-α-1信号的生理过程有关[70]。木犀草素,异鼠李秦素能抑制ADP诱导的血小板聚集,其EC50分别为0.77、0.89 mg/mL[60]。juncein和1,6-di-O-caffeoyl-β-D-glucopyranoside有抑制ADP诱导的血小板聚集,减少心血管疾病发生的作用,作用机制可能与其对P2Y12和血栓素A2(TP)双受体抑制有关[71-72]。
3 Q-Marker预测分析2020版中华人民共和国药典规定裸花紫珠中木犀草苷和毛蕊花糖苷的含量分别不少于0.05%和0.80%,大叶紫珠和紫珠叶中毛蕊花糖苷的含量分别不少于0.15%于0.50%,广东紫珠含连翘脂苷B和金石蚕苷的总量不少于0.50%[1]。1~2种成分的含量测定并不能真正反应中药的质量。中药Q-Marker是基于质量传递与溯源、特有、有效、可测和复方配伍的“五原则”,选择能体现药材有效性和可控性的Q-Marker进行中药的质量控制。
3.1 基于植物亲缘学和化学成分特有性证据的Q-Marker预测分析马鞭草科植物作为中药药用的植物有14属67种,有牡荆属,紫珠属,大青属等[73-76]。基于ITS2序列的聚类树表明紫珠属和牡荆属亲缘关系较近,与大青属亲缘关系较远[73]。药用紫珠中主要有黄酮,苯乙醇苷,苯丙素,萜类等,其中黄酮类,苯乙醇苷类含量较高,且具有较强的生物活性[6]。牡荆属植物主要含有萜类,黄酮类和苯丙素类成分,定量测定以牡荆素和蔓荆子素等为主[77]。牡荆属植物中不含药用紫珠中的苯乙醇苷类成分,木犀草苷、槲皮素,鼠李秦素,芹菜素等成分在。因此,可选毛蕊花糖苷,异毛蕊花糖苷,金石蚕苷,连翘酯苷B,木犀草苷,芹菜素,鼠李秦素,槲皮素等作为紫珠属植物的Q-Marker。
3.2 基于药效的Q-Marker预测分析《本草拾遗》记载紫珠味苦,寒,具有收敛止血,清热解毒之功效[6]。紫珠属中的黄酮类成分槲皮素,鼠李秦素具有止血作用,而异鼠李秦素,木犀草素具有凝血作用,苯乙醇苷类成分毛蕊花糖苷,Samioside有显著的止血作用[46, 53]。木犀草苷,槲皮素,毛蕊花糖苷,异毛蕊花糖苷等对金黄色葡萄球菌等有抑制作用[20]。Callicarpicacid A等对宫颈炎有良好的治疗效果,Callicapene M2等对嗜淋巴细胞病毒有抑制作用[42, 27]。上述药理作用与紫珠的药效一致,因此毛蕊花糖苷,异毛蕊花糖苷,木犀草苷,鼠李秦素,槲皮素,Samioside等可作为紫珠药材Q-Marker的重要选择。
3.3 基于化学成分可测性的Q-Marker预测分析通过指纹图谱表征、含量测定等分析可知,四种药用紫珠中含量较高的是苯乙醇苷类,其次是黄酮类成分。裸花紫珠中鉴定的17个化合物主要为苯乙醇苷类[78],广东紫珠中鉴定的124个化合物为20个苯乙醇苷类、31个黄酮类、36个有机酸类、26个萜类和11个酚类[79]。通过总黄酮,总酚酸及总皂苷含量评价裸花紫珠的最佳提取工艺[80]。指纹图谱方法可区分广东紫珠疑似品和正品,正品中17个共有峰为黄酮和苯乙醇苷类[81]。通过指纹图谱结合毛蕊花糖苷,咖啡酸,异毛蕊花糖苷,木犀草苷,连翘酯苷B等10种成分含量测定可区分裸花紫珠,杜虹花,尖尾枫,大叶紫珠和广东紫珠[82]。可见,黄酮类和苯乙醇苷类既是主要成分又是有效成分,并易于通过液相色谱进行含量测定,适合作为紫珠属植物的Q-Marker,如毛蕊花糖苷,异毛蕊花糖苷,木犀草素,木犀草苷,连翘脂苷B,2'-乙酰基金石蚕苷,2'-乙酰基连翘酯苷B等。此外,金石蚕苷主要存在于广东紫珠中,其他紫珠基本不含[83],金石蚕苷尤其适合作为广东紫珠的Q-Marker。
3.4 基于质量传递与溯源的Q-Marker预测分析中药质量会受到产地、采收加工等因素的影响,因此要注重质量传递与溯源过程的质量控制,保证中药质量安全有效。5省15批广东紫珠质量综合评价结果显示湖南会同、广西桂林、江西武宁、南昌、萍乡、宜春质量情况较好[84]。海南全省9市采集的裸花紫珠中均为毛蕊花糖苷含量最高,其次为异毛蕊花糖苷、连翘酯苷B、木犀草苷,而芹菜素糖苷、木犀草素、咖啡酸含量较低;不同产地间化合物含量存在显著差异,其中毛蕊花糖苷的含量,既有报道五指山和白沙两地最高[85],也有报道海口最高[86],可能和采收时间不同等因素相关,根据整体含量分为海南中南部和海南北部。裸花紫珠叶、嫩叶及嫩枝中毛蕊花糖苷,木犀草苷,异毛蕊花糖苷、芹菜素糖苷等含量具有差异,以裸花紫珠座果前期即植株枝头出现小青果,并且还有少量花朵时采收较为适宜[87-88]。广东紫珠中金石蚕苷和连翘酯苷B以10月含量最高[89]。不同干燥方式对药材中主要化学成分的影响较大,尤其是苯乙醇苷类化合物。自然晒干、35 ℃、50 ℃和65 ℃烘干,以及通过蒸汽杀青再不同温度干燥后的裸花紫珠,发现蒸汽杀青后木犀草素、木犀草苷、连翘酯苷B,毛蕊花糖苷、咖啡酸和芹菜素糖苷含量较不杀青的含量高,杀青后连翘酯苷B,毛蕊花糖苷、异毛蕊花糖苷、木犀草苷在55~60 ℃烘干含量较高;直接干燥木犀草素,芹菜素,原儿茶酸,咖啡酸、齐墩果酸和熊果酸含量在阴干、自然晒干和35 ℃烘干较高,槲皮素在65 ℃烘干后含量最高[87, 90-91]。因此,可将毛蕊花糖苷,异毛蕊花糖苷,连翘酯苷B,木犀草素,木犀草苷,咖啡酸等作为Q-Marker评价紫珠属植物药用价值和确定紫珠药材的最佳采收期,产地和最适宜加工方式的依据。
3.5 基于入血成分的Q-Marker预测分析口服广东紫珠50%乙醇提取物的大鼠血浆中verbascoside,连翘酯苷B和金石蚕苷3种止血活性成分的最大血药浓度Cmax值分别为(33.23±25.82),(224.67±99.18)和(653.54±311.94)ng/mL[92]。口服裸花紫珠提取物的大鼠血浆中木犀草苷,dracocephaloside,juncein的Cmax分别为(67.55±5.67)、(59.55±7.24)和(52.10±3.07)ng/mL[93]。可见黄酮类,苯乙醇苷类为紫珠类药材的主要入血成分。
综上,从植物亲缘学、中药药效、质量传递、化学成分有效性和可测性及入血成分等方面对药用紫珠的Q-Marker进行了分析,毛蕊花糖苷,异毛蕊花糖苷,连翘脂苷B,木犀草素,木犀草苷,咖啡酸,芹菜素、verbascoside、鼠李秦素等可作为紫珠属植物的潜在Q-Marker。
4 结语紫珠属药材主要作为止血,抑菌,抗炎药物应用于临床,药典对四种紫珠药材的性味功效描述差别较小,但作为中成药使用时不同紫珠在临床上又有差别:裸花紫珠片用于细菌感染引起的炎症,急性传染性肝炎,呼吸道及消化道出血,抗宫炎片(广东紫珠)用于治疗多种妇科慢性疾病,三七血伤宁胶囊(大叶紫珠)主要作为止血剂使用,痔炎消颗粒(杜虹花)主要用于治疗痔疮发炎肿痛。需要进一步研究不同紫珠的药理作用及其药效成分和作用机制的不同,能够有效区分不同紫珠。紫珠药材单体成分的分离鉴定和活性研究越来越多,尤其是二萜类化合物的抗炎作用,但对化合物之间多靶点、多途径的协同机制研究较少。产地、栽培方式、采收期及生长时间等因素对其化学成分影响的结果还不完全一致,可能和采样的代表性及规模等因素相关,应进一步开展系统深入的研究,阐述清楚影响药材质量的关键环节和因素,并结合本文按照中药Q-Marker“五原则”推测的质量标记物,建立一套合理可行的质量评价体系以控制和评价不同紫珠药材,为紫珠属药材产业的高质量发展提供技术保障。
| [1] |
国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2020. Chinese Pharmacopoeia Commission. People's republic of China (PRC) pharmacopoeia[M]. Beijing: China Medical Science Press, 2020. |
| [2] |
孙美, 王立波, 吴立军. 药用紫珠属植物的研究进展[J]. 安徽农业科学, 2015, 43(13): 101-104. SUN M, WANG L B, WU L J. The research progress of medicinal Callicarpa plants[J]. Journal of Anhui Agricultural Sciences, 2015, 43(13): 101-104. DOI:10.3969/j.issn.0517-6611.2015.13.038 |
| [3] |
李梦, 张小波, 景志贤, 等. 裸花紫珠分布区划研究[J]. 中国中药杂志, 2020, 45(15): 3642-3650. LI M, ZHANG X B, JING Z X, et al. Comparative study on distribution of Callicarpa nudiflora by different regionalization methods[J]. China Journal of Chinese Materia Medica, 2020, 45(15): 3642-3650. DOI:10.19540/j.cnki.cjcmm.20200527.101 |
| [4] |
Tu Y, Sun L, Guo M, et al. The medicinal uses of Callicarpa L. in traditional Chinese medicine: an ethnopharmacological, phytochemical and pharmacological review[J]. Journal of Ethnopharmacology, 2013, 146(2): 465-81. DOI:10.1016/j.jep.2012.12.051 |
| [5] |
YANG Y, LI Z Y, SHAO J J, et al. Callicarpa nudiflora Hook. & Arn.: A comprehensive review of its phytochemistry and pharmacology[J]. Journal of Ethnopharmacology, 2021, 264(7): 113123. |
| [6] |
占丽丽, 叶先文, 张敏, 等. 紫珠属植物化学成分及药理活性研究进展[J]. 江西中医药, 2020, 51(8): 66-73. ZHAN L L, YE X W, ZHANG M, et al. Research progress on chemical constituents and pharmacological activities of Callicarpa L[J]. Jiangxi Journal of Traditional Chinese Medicine, 2020, 51(8): 66-73. |
| [7] |
董琳, 刘明生, 王金辉. 裸花紫珠的脂溶性化学成分[J]. 中国药物化学杂志, 2009, 19(5): 371-374. DONG L, LIU M S, WANG J H. Lipophilic compounds of Callicarpa nudiflora hook. et arn[J]. Chinese Journal of Medicinal Chemistry, 2009, 19(5): 371-374. DOI:10.14142/j.cnki.cn21-1313/r.2009.05.007 |
| [8] |
高飞鹏, 汪豪, 叶文才, 等. 裸花紫珠叶的化学成分[J]. 中国药科大学学报, 2010, 41(2): 120-123. GAO F P, WANG H, YE W C, et al. Chemical constituents from the leaves of Callicarpa nudiflora[J]. Journal of China Pharmaceutical University, 2010, 41(2): 120-123. |
| [9] |
毕红玉. 广东紫珠化学成分及毛子草质量标准研究[D]. 南昌: 江西中医药大学, 2019. BI H Y. Studies on the chemical constituents from Callicarpa kwangtungensis Chun and quality control standard of Incarvillea arguta[D]. Nanchang: Jiangxi University of Traditional Chinese Medicine, 2019. |
| [10] |
王祝年, 韩壮, 崔海滨, 等. 裸花紫珠的化学成分[J]. 热带亚热带植物学报, 2007, 15(4): 359-362. WANG Z N, HAN Z, CUI H B, et al. Chemical constituents from Callicarpa nudiflora[J]. Journal of Tropical and Subtropical Botany, 2007, 15(4): 359-362. DOI:10.3969/j.issn.1005-3395.2007.04.014 |
| [11] |
许慧, 牛莉鑫, 姜洁, 等. 大叶紫珠化学成分研究[J]. 中国医药工业杂志, 2017, 48(9): 1313-1317. XU H, NIU L X, JIANG J, et al. Chemical constituents of Callicarpa macrophylla vahl[J]. Chinese Journal of Pharmaceuticals, 2017, 48(9): 1313-1317. DOI:10.16522/j.cnki.cjph.2017.09.012 |
| [12] |
XU Y H, JIANG X Y, XU J, et al. A previously undescribed phenylethanoid glycoside from Callicarpa kwangtungensis Chun acts as an agonist of the Na/K-ATPase signal transduction pathway[J]. Phytochemistry, 2021, 181(13): 112577. |
| [13] |
XIONG L, LU H, HU Y, et al. In vitro anti-motile effects of Rhoifolin, a flavonoid extracted from Callicarpa nudiflora on breast cancer cells via downregulating Podocalyxin-Ezrin interaction during Epithelial Mesenchymal Transition[J]. Phytomedicine: International Journal of Phytotherapy and Phytopharmacology, 2021, 93(7): 153486. |
| [14] |
许慧, 牛莉鑫, 李丽, 等. 广东紫珠中黄酮二葡萄糖醛酸苷类化合物的分离纯化及其抗炎活性[J]. 中国医药工业杂志, 2016, 47(5): 548-552. XU H, NIU L X, LI L, et al. Separation and purification of flavone diglucuronides from Callicarpa kwangtungensis Chun and their anti-inflammatory activities[J]. Chinese Journal of Pharmaceuticals, 2016, 47(5): 548-552. DOI:10.16522/j.cnki.cjph.2016.05.007 |
| [15] |
马文杰, 苏志维, 马仲辉. 全缘叶紫珠化学成分研究[J/OL]. 广西植物: 1-11[2023-01-31]. MA W J, SU Z X, MA Z H. Chemical constituents of Callicarpa integerrima[J/OL], 1-11[2023-01-31]. |
| [16] |
KIM S M, RYU H W, KWON O K, et al. Callicarpa japonica Thunb. ameliorates allergic airway inflammation by suppressing NF-κB activation and upregulating HO-1 expression[J]. Journal of Ethnopharmacology, 2021, 267(13): 113523. |
| [17] |
YUAN J Q, QIU L, ZOU L H, et al. Two new phenylethanoid glycosides fromCallicarpa longissima[J]. Helvetica Chimica Acta, 2015, 98(4): 482-489. DOI:10.1002/hlca.201400206 |
| [18] |
胡晓, 李丽, 杨义芳, 等. 广东紫珠中咖啡酰基苯乙醇苷类化合物[J]. 中国中药杂志, 2014, 39(9): 1630-1634. HU X, LI L, YANG Y F, et al. Caffeoyl phenylethanoid glycosides from Callicarpa kwangtungensis[J]. China Journal of Chinese Materia Medica, 2014, 39(9): 1630-1634. |
| [19] |
NIU C, LI Q, YANG L P, et al. Phenylethanoid glycosides from Callicarpa macrophylla vahl[J]. Phytochemistry Letters, 2020, 38(7): 65-69. |
| [20] |
李亚梅, 杨扬, 杨义芳, 等. 裸花紫珠抗菌作用的谱效学研究[J]. 中国现代应用药学, 2021, 38(11): 1294-1301. LI Y M, YANG Y, YANG Y F, et al. Study on the spectrum effect of antibacterial activity of callicarpae nudiflorae folium[J]. Chinese Journal of Modern Applied Pharmacy, 2021, 38(11): 1294-1301. DOI:10.13748/j.cnki.issn1007-7693.2021.11.003 |
| [21] |
WU A Z, YANG Z Y, HUANG Y M, et al. Natural phenylethanoid glycosides isolated from Callicarpa kwangtungensis suppressed lipopolysaccharide-mediated inflammatory response via activating Keap1/Nrf2/HO-1 pathway in RAW 264.7 macrophages cell[J]. Journal of Ethnopharmacology, 2020, 258(11): 112857. |
| [22] |
WANG J, FU H Z, LUO Y H, et al. Two new iridoid glycosides from the leaves of Callicarpa nudiflora[J]. Journal of Asian Natural Products Research, 2018, 20(3): 242-248. DOI:10.1080/10286020.2017.1323884 |
| [23] |
马燕春, 张旻, 徐文彤, 等. 裸花紫珠化学成分及细胞毒活性研究[J]. 中国中药杂志, 2014, 39(16): 3094-3101. MA Y C, ZHANG M, XU W T, et al. Chemical constituents from Callicarpa nudiflora and their cytotoxic activities[J]. China Journal of Chinese Materia Medica, 2014, 39(16): 3094-3101. |
| [24] |
FU H Z, MA Y Y, MA S C, et al. Two new iridoid glycosides from Callicarpa nudiflora[J]. Journal of Asian Natural Products Research, 2020, 22(3): 264-270. DOI:10.1080/10286020.2018.1557636 |
| [25] |
马员宇, 付辉政, 潘蕾, 等. 裸花紫珠叶中1个新的环烯醚萜苷[J]. 中草药, 2018, 49(8): 1746-1750. MA Y Y, FU H Z, PAN L, et al. A new iridoid glycoside from leaves of Callicarpa nudiflora[J]. Chinese Traditional and Herbal Drugs, 2018, 49(8): 1746-1750. |
| [26] |
董琳, 刘明生, 王金辉, 等. 黎药-裸花紫珠氯仿萃取部位的化学成分[J]. 中国医药导报, 2012, 9(31): 21-22. DONG L, LIU M S, WANG J H, et al. Research on chemical constituents of Chloroform Fraction from Li Nationality medicine Callicarpa nudiflora Hook. Et Arn[J]. China Medical Herald, 2012, 9(31): 21-22. DOI:10.3969/j.issn.1673-7210.2012.31.007 |
| [27] |
WANG Z H, HUANG J, NIU C, et al. Isopimarane-type diterpenoids from Callicarpa macrophylla vahl[J]. Phytochemistry Letters, 2017, 22(2): 224-228. |
| [28] |
WANG Z H, XU H J, ZHAI Y Y, et al. Three new labdane-type diterpenoids from Callicarpa macrophylla vahl[J]. Natural Product Research, 2019, 33(20): 2904-2910. DOI:10.1080/14786419.2018.1509336 |
| [29] |
占丽丽, 黄伟明, 卞玉婷, 等. 裸花紫珠叶中1个新的半日花烷型二萜[J]. 中国中药杂志, 2021, 46(16): 4139-4144. ZHAN L L, HUANG W M, BIAN Y T, et al. A new labdane-type diterpenoids from Callicarpa nudiflora[J]. China Journal of Chinese Materia Medica, 2021, 46(16): 4139-4144. DOI:10.19540/j.cnki.cjcmm.20210429.202 |
| [30] |
GAO J B, ZHANG X J, SHANG K, et al. Anti-NLRP3 inflammasome abietane diterpenoids from Callicarpa bodinieri and their structure elucidation[J]. Chinese Chemical Letters, 2020, 31(2): 427-430. DOI:10.1016/j.cclet.2019.09.020 |
| [31] |
LI S, SUN X C, LI Y, et al. Natural NO inhibitors from the leaves of Callicarpa kwangtungensis: structures, activities, and interactions with iNOS[J]. Bioorganic & Medicinal Chemistry Letters, 2017, 27(3): 670-674. |
| [32] |
DETTWEILER M, MELANDER R J, PORRAS G, et al. A clerodane diterpene from Callicarpa americana resensitizes methicillin-resistant Staphylococcus aureus to β-lactam antibiotics[J]. ACS Infectious Diseases, 2020, 6(7): 1667-1673. DOI:10.1021/acsinfecdis.0c00307 |
| [33] |
LI Q, WU X W, WANG Q, et al. Diterpenoids from Callicarpa rubella and their in vitro anti-NLRP3 inflammasome activity[J]. Fitoterapia, 2020, 147(13): 104774. |
| [34] |
NIU C, LI Q, YANG L P, et al. Potential antitumor-promoting diterpenes from Callicarpa macrophylla vahl[J]. Journal of Molecular Structure, 2020, 1220(11): 128758. |
| [35] |
董琳, 王金辉, 刘明生. 裸花紫珠叶中的酚酸类化学成分[J]. 沈阳药科大学学报, 2010, 27(4): 290-291, 319. DONG L, WANG J H, LIU M S. Phenolic acid constituents of leaves from Callicarpa nudiflora Hook.Et Arn[J]. Journal of Shenyang Pharmaceutical University, 2010, 27(4): 290-291, 319. DOI:10.14066/j.cnki.cn21-1349/r.2010.04.010 |
| [36] |
PU D B, ZHANG X J, BI D W, et al. Callicarpins, two classes of rearranged ent-clerodane diterpenoids from Callicarpa plants blocking NLRP3 inflammasome-induced pyroptosis[J]. Journal of Natural Products, 2020, 83(7): 2191-2199. DOI:10.1021/acs.jnatprod.0c00288 |
| [37] |
WU X W, WANG Q, LI Q, et al. Rubellawus A-D, four new diterpenoids isolated from Callicarpa rubella and their anti-NLRP3 inflammasome effects[J]. Chemistry & Biodiversity, 2020, 17(12): e2000798. |
| [38] |
ZHOU G P, YU Y, YUAN M M, et al. Four new triterpenoids from Callicarpa kwangtungensis[J]. Molecules (Basel, Switzerland), 2015, 20(5): 9071-9083. DOI:10.3390/molecules20059071 |
| [39] |
黄逸敏, 袁欢, 陈萍, 等. 广东紫珠中的萜类化合物及其抗炎活性[J]. 天然产物研究与开发, 2022, 34(1): 50-56. HUANG Y M, YUAN H, CHEN P, et al. Terpenoids from Callicarpa kwangtungensis and their anti-inflammatory activity[J]. Natural Product Research and Development, 2022, 34(1): 50-56. |
| [40] |
WANG Y, LIN J, WANG Q, et al. Clerodane diterpenoids with potential anti-inflammatory activity from the leaves and twigs of Callicarpa cathayana[J]. Chinese Journal of Natural Medicines, 2019, 17(12): 953-962. DOI:10.1016/S1875-5364(19)30118-9 |
| [41] |
HUANG H, TANG C P, KE C Q, et al. 3, 4-seco-isopimarane and 3, 4-seco-pimarane diterpenoids from Callicarpa nudiflora[J]. Chinese Journal of Natural Medicines, 2021, 19(8): 632-640. DOI:10.1016/S1875-5364(21)60063-8 |
| [42] |
LIU T C, WANG R Q, LIU C P, et al. Active substances from Callicarpa nudiflora exert anti-cervicitis effects and regulate NLRP3-associated inflammation[J]. Molecules (Basel, Switzerland), 2021, 26(20): 6217. DOI:10.3390/molecules26206217 |
| [43] |
YU Z X, WANG C H, NONG X H, et al. Callnudoids A-H: Highly modified labdane diterpenoids with anti-inflammation from the leaves of Callicarpa nudiflora[J]. Phytochemistry, 2022, 201(7): 113253. |
| [44] |
DI Q Q, ZHAO X B, ZHANG R H, et al. Novel clerodane-type diterpenoid Cintelactone A suppresses lipopolysaccharide-induced inflammation by promoting ubiquitination, proteasomal degradation of TRAF6[J]. Pharmacological Research, 2021, 164(9): 105386. |
| [45] |
戴冕, 付辉政, 周志强, 等. 广东紫珠化学成分研究[J]. 中草药, 2018, 49(9): 2013-2018. DAI M, FU H Z, ZHOU Z Q, et al. Study on chemical constituents of Callicarpa kwangtungensis[J]. Chinese Traditional and Herbal Drugs, 2018, 49(9): 2013-2018. |
| [46] |
张洁, 李宝泉, 冯锋, 等. 裸花紫珠的化学成分及其止血活性研究[J]. 中国中药杂志, 2010, 35(24): 3297-3301. ZHANG J, LI B Q, FENG F, et al. Chemical constituents from Callicarpa nudiflora and their hemostatic acitivity[J]. China Journal of Chinese Materia Medica, 2010, 35(24): 3297-3301. |
| [47] |
LUO Y H, ZHOU Z Q, MA S C, et al. Three new antioxidant furofuran lignans from Callicarpa nudiflora[J]. Phytochemistry Letters, 2014, 7(1): 194-197. |
| [48] |
易博, 张旻, 林海, 等. 黎药裸花紫珠在小鼠体内止血活性部位的研究[J]. 药学实践杂志, 2015, 33(3): 235-237, 241. YI B, ZHANG M, LIN H, et al. Screening for the hemostatic active extracts of Callicarpa nudiflora, in mice in vivo[J]. Journal of Pharmaceutical Practice, 2015, 33(3): 235-237, 241. |
| [49] |
王杰, 罗晨煖, 王珊, 等. 裸花紫珠正丁醇提取物止血作用及其机制研究[J]. 中药药理与临床, 2016, 32(3): 99-102. WANG J, LUO C X, WANG S, et al. Hemostatic effects of butyl alcohol extracts from Callicarpa nudiflora via stimulating PI3K/Akt activation on platelets[J]. Pharmacology and Clinics of Chinese Materia Medica, 2016, 32(3): 99-102. |
| [50] |
付剑江, 张舟妙, 吕红, 等. 裸花紫珠提取物促血小板活化作用及其机制[J]. 中国实验方剂学杂志, 2017, 23(12): 109-113. FU J J, ZHANG Z M, LYU H, et al. Extracts from Callicarpa nudiflora leaves enhances platelet activation[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2017, 23(12): 109-113. |
| [51] |
鲁合军. 大叶紫珠对大鼠凝血功能及TXB2、6-keto-PGF1a表达的影响[J]. 中医学报, 2017, 32(6): 989-991, 995. LU H J. Effect of callicarlpa macrophylla vahl polysaccharides on rat coagulation function, TXB2 and 6-keto-PGF1a expression[J]. Acta Chinese Medicine, 2017, 32(6): 989-991, 995. |
| [52] |
余行, 徐诗强, 马冬晴, 等. 大叶紫珠总黄酮的提取工艺优选及其抗炎、镇痛及止血作用考察[J]. 中国实验方剂学杂志, 2013, 19(12): 8-11. YU X, XU S Q, MA D Q, et al. Optimization of extraction technology and investigation of anti-inflammatory, antalgic and hemostatic activities of total flavonoids from Callicarpa macrophylla[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2013, 19(12): 8-11. |
| [53] |
周志强. 裸花紫珠化学成分的研究[D]. 南昌: 南昌大学, 2013. ZHOU Z Q. Studies on the chemical constituents from Callicarpa nudiflora hook[D]. Nanchang: Nanchang University, 2013. |
| [54] |
聂韡, 刘易鑫, 房海灵, 等. 广东紫珠抑菌有效部位的筛选[J]. 南方林业科学, 2016, 44(2): 58-61. NIE W, LIU Y X, FANG H L, et al. Screening for bacteriostatic activity of components from Callicarpa kwangtungensis[J]. South China Forestry Science, 2016, 44(2): 58-61. |
| [55] |
杨智颖, 袁欢, 周莹, 等. 广东紫珠中的苯丙素类化合物及其抗菌活性[J]. 天然产物研究与开发, 2019, 31(11): 1928-1933. YANG Z Y, YUAN H, ZHOU Y, et al. Phenylpropanoid compounds isolated from Callicarpa kwangtungensis and antibacterial activity research[J]. Natural Product Research and Development, 2019, 31(11): 1928-1933. |
| [56] |
潘孝妍, 王孟, 王秀海, 等. 新裸花紫珠止血消毒剂的制备及功效研究[J]. 时珍国医国药, 2019, 30(6): 1368-1371. PAN X Y, WANG M, WANG X H, et al. Preparation and Efficacy study of new Callicarpa nudiflora hemostatic disinfectant[J]. Lishizhen Medicine and Materia Medica Research, 2019, 30(6): 1368-1371. |
| [57] |
CHUNG P Y, CHUNG L Y, NAVARATNAM P. Potential targets by pentacyclic triterpenoids from Callicarpa farinosa against methicillin-resistant and sensitive Staphylococcus aureus[J]. Fitoterapia, 2014, 94(12): 48-54. |
| [58] |
CAI H, XIE Z Y, LIU G H, et al. Isolation, identification and activities of natural antioxidants from Callicarpa kwangtungensis Chun[J]. PLoS One, 2014, 9(3): e93000. |
| [59] |
聂韡, 房海灵, 邓绍勇, 等. 不同产地广东紫珠药材苯乙醇苷类成分含量与抗氧化能力的相关性[J]. 江苏农业科学, 2016, 44(3): 273-275. NIE W, FANG H L, DENG S Y, et al. Correlation between the content of phenylethanoid glycosides and antioxidant capacity of Callicarpa kwangtungensis from different habitats[J]. Jiangsu Agricultural Sciences, 2016, 44(3): 273-275. |
| [60] |
潘争红, 黄思思, 黄胜, 等. 裸花紫珠提取物及其主要成分抗氧化活性研究[J]. 广西植物, 2016, 36(9): 1107-1111. PAN Z H, HUANG S S, HUANG S, et al. Antioxidant activities of extracts and their main constituents of Callicarpa nudiflora[J]. Guihaia, 2016, 36(9): 1107-1111. |
| [61] |
陈学武, 姜靖雯, 张永杰. 海南五指山裸花紫珠通过IL-6/STAT3信号通路对结肠癌体外耐药的逆转作用及其机制研究[J]. 中药材, 2020, 43(9): 2269-2273. CHEN X W, JIANG J W, ZHANG Y J. Reversal effect of Callicarpa nudiflora on drug resistance of colon cancer in vitro through IL-6/STAT3 signaling pathway and its mechanism[J]. Journal of Chinese Medicinal Materials, 2020, 43(9): 2269-2273. |
| [62] |
赖志亨, 姜婧雯. Wnt/β-catenin信号通路在海南五指山裸花紫珠抗肠癌中的机制研究[J]. 中国医师进修杂志, 2020, 7(7): 609-614. LAI Z H, JIANG J W. Anti-intestinal cancer effect and mechanism of Wnt/β-catenin signaling pathway in Wuzhishan CallicarpanudifloraHook. etArn in Hainan Province[J]. Chinese Journal of Postgraduates of Medicine, 2020, 7: 609-614. |
| [63] |
陈斌, 罗跃华, 王珊, 等. 裸花紫珠提取物的抗乳腺癌转移作用及其机制[J]. 中国实验方剂学杂志, 2015, 21(18): 94-98. CHEN B, LUO Y H, WANG S, et al. Anti-metastatic effects of extracts from Callicarpa nudiflora via downregulating snail activation on breast cancer cell[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2015, 21(18): 94-98. |
| [64] |
NIU C, LI Q, YANG L P, et al. Potential antitumor-promoting diterpenes from Callicarpa macrophylla vahl[J]. Journal of Molecular Structure, 2020, 1220(13): 128758. |
| [65] |
杨璐, 张天华, 白旭, 等. 14种紫珠属植物醇提取物抑制磷酸二酯酶4活性初探[J]. 广东药学院学报, 2015, 31(3): 328-331. YANG L, ZHANG T H, BAI X, et al. Inhibition of the crude extracts from fourteen species of Callicarpa Linn plants towards Phosphodiesterase-4[J]. Journal of Guangdong Pharmaceutical University, 2015, 31(3): 328-331. |
| [66] |
陈铃, 夏玉英, 林朝展, 等. 裸花紫珠改善小鼠学习记忆障碍作用的研究[J]. 中药材, 2017, 40(4): 909-915. CHEN L, XIA Y Y, LIN C Z, et al. The influence of Callicarpa nudiflora on mice induced with dysmnesia[J]. Journal of Chinese Medicinal Materials, 2017, 40(4): 909-915. |
| [67] |
林朝展, 陈德金, 宁娱, 等. 枇杷叶紫珠苯乙醇苷对学习记忆功能障碍的影响[J]. 中药药理与临床, 2013, 29(1): 72-74. LIN C Z, CHEN D J, NING Y, et al. Research on effects of phenylethanoid glycosides of Callicarpa kochiana on learning and memory function in multiple models[J]. Pharmacology and Clinics of Chinese Materia Medica, 2013, 29(1): 72-74. |
| [68] |
SUN J, CHEN L, JIANG P, et al. Phenylethanoid glycosides of Callicarpa kwangtungensis Chun exert cardioprotective effect by weakening Na+-K+-ATPase/Src/ERK1/2 pathway and inhibiting apoptosis mediated by oxidative stress and inflammation[J]. Journal of Ethnopharmacology, 2020, 258(13): 112881. |
| [69] |
SUN J, ZHU J X, CHEN L, et al. Forsythiaside B inhibits myocardial fibrosis via down regulating TGF-β1/Smad signaling pathway[J]. European Journal of Pharmacology, 2021, 908(14): 174354. |
| [70] |
XU Y H, JIANG X Y, XU J, et al. A previously undescribed phenylethanoid glycoside from Callicarpa kwangtungensis Chun acts as an agonist of the Na/K-ATPase signal transduction pathway[J]. Phytochemistry, 2021, 181(7): 112577. |
| [71] |
FU J J, ZHU X C, WANG W, et al. 1, 6-di-O-caffeoyl-β-D-glucopyranoside, a natural compound from Callicarpa nudiflora Hook impairs P2Y12 and thromboxane A2 receptor-mediated amplification of platelet activation and aggregation[J]. Phytomedicine: International Journal of Phytotherapy and Phytopharmacology, 2017, 36(6): 273-282. |
| [72] |
XU H J, LU H, ZHU X C, et al. Inhibitory effects of luteolin-4'-O-β-D-glucopyranoside on P2Y12 and thromboxane A2 receptor-mediated amplification of platelet activation in vitro[J]. International Journal of Molecular Medicine, 2018, 42(1): 615-624. |
| [73] |
张兵锋. 马鞭草科药用植物的ITS2序列分析与鉴定[J]. 宜春学院学报, 2016, 38(12): 12-17. ZHANG B F. Identification of DNA barcode ITS2 for medicinal plants in Verbenaceae[J]. Journal of Yichun University, 2016, 38(12): 12-17. |
| [74] |
夏振岱. 《中国植物志》: 全世界最大的一部植物志[J]. 中国科学院院刊, 1992, 7(1): 83-84. XIA Z D. Flora of China-the largest flora in the world[J]. Bulletin of the Chinese Academy of Sciences, 1992, 7(1): 83-84. |
| [75] |
焦杨, 邹录惠, 邱莉, 等. 5种马鞭草科药用植物的抗补体活性[J]. 中国药科大学学报, 2016, 47(4): 469-473. JIAO Y, ZOU L H, QIU L, et al. Anticomplementary effects of the extracts of five Verbenaceae herbs in vitro[J]. Journal of China Pharmaceutical University, 2016, 47(4): 469-473. |
| [76] |
邱其才. 福建省尤溪县马鞭草科药用植物种质资源调查[J]. 中国林副特产, 2018(2): 58-62, 64. QIU Q C. The study about germ resources of Verbenaceae medicinal plants in Youxi County, Fujian Province[J]. Forest by-Product and Speciality in China, 2018(2): 58-62, 64. |
| [77] |
林艳英, 麦志雄, 黄罕妮, 等. 牡荆属植物化学成分及质量控制方法的研究进展[J]. 当代医药论丛, 2014, 12(4): 141-143. LIN Y Y, MAI Z X, HUANG H N, et al. Research progress on chemical constituents and quality control methods of Vitex plants[J]. Contemporary Medicine Forum, 2014, 12(4): 141-143. |
| [78] |
李亚梅, 杨扬, 杨义芳, 等. 基于UPLC-Q-TOF MS/MS技术的裸花紫珠不同溶剂提取物的成分分析[J]. 中药材, 2020, 43(11): 2707-2712. LI Y M, YANG Y, YANG Y F, et al. Composition analysis of different solvent extracts of Callicarpa nudiflora based on UPLC-Q-TOF MS/MS technology[J]. Journal of Chinese Medicinal Materials, 2020, 43(11): 2707-2712. |
| [79] |
YANG L P, ZHAI Y Y, CHEN X Y, et al. Rapid identification of chemical compositions in Callicarpa kwangtungensis Chun by ultra-high-performance liquid chromatography with Q Exactive hybrid quadrupole orbitrap high-resolution accurate mass spectrometry[J]. Journal of Separation Science, 2020, 43(12): 2487-2494. |
| [80] |
黄梅, 于福来, 谭湘杰, 等. Box-Behnken响应面法优化裸花紫珠有效成分提取工艺[J]. 福建农业学报, 2018, 33(10): 1119-1124. HUANG M, YU F L, TAN X J, et al. Optimized extraction of functional ingredients fromCallicarpa nudiflora hook.et arn.by box-behnken design[J]. Fujian Journal of Agricultural Sciences, 2018, 33(10): 1119-1124. |
| [81] |
李丽, 杨义芳, 胡晓, 等. 广东紫珠药材的UFLC指纹图谱[J]. 中国医药工业杂志, 2014, 45(4): 330-333. LI L, YANG Y F, HU X, et al. Fingerprint chromatography of Callicarpa kwangtungensis Chun by UFLC[J]. Chinese Journal of Pharmaceuticals, 2014, 45(4): 330-333. |
| [82] |
郑东昆, 陈伟康, 马双成, 等. 裸花紫珠指纹图谱研究及10种成分的含量测定[J]. 中国中药杂志, 2015, 40(9): 1776-1782. ZHENG D K, CHEN W K, MA S C, et al. Study on HPLC fingerprint of Callicarpa nudiflora and determination of ten components[J]. China Journal of Chinese Materia Medica, 2015, 40(9): 1776-1782. |
| [83] |
GONG J, MIAO H, SUN X M, et al. Simultaneous qualitative and quantitative determination of phenylethanoid glycosides and flavanoid compounds in Callicarpa kwangtungensis Chun by HPLC-ESI-IT-TOF-MS/MS coupled with HPLC-DAD[J]. Analytical Methods, 2016, 8(33): 6323-6336. |
| [84] |
聂韡, 朱培林, 房海灵, 等. HPLC指纹图谱结合化学计量学评价不同产地广东紫珠药材的质量[J]. 中草药, 2017, 48(1): 185-191. NIE W, ZHU P L, FANG H L, et al. Quality evaluation of Callicarpa kwangtungensis from different origins by HPLC coupled with chemometrics[J]. Chinese Traditional and Herbal Drugs, 2017, 48(1): 185-191. |
| [85] |
谭湘杰, 于福来, 庞玉新, 等. 海南裸花紫珠药材中7种成分含量分析[J]. 中国现代中药, 2018, 20(2): 173-178. TAN X J, YU F L, PANG Y X, et al. Analysis of seven components in Callicarpa nudiflora from Hainan Province[J]. Modern Chinese Medicine, 2018, 20(2): 173-178. |
| [86] |
于福来, 吴丽芬, 庞玉新, 等. 海南裸花紫珠中毛蕊花糖苷和木犀草苷含量分析[J]. 中国现代中药, 2016, 18(8): 996-1000. YU F L, WU L F, PANG Y X, et al. Simultaneous determination of acteoside and luteoloside in Callicarpa nudiflora from Hainan Province[J]. Modern Chinese Medicine, 2016, 18(8): 996-1000. |
| [87] |
彭云露, 田建平. LC-QTOF MS/MS测定不同生长时期及不同初加工对裸花紫珠7种化学成分影响[J]. 广东化工, 2020, 47(20): 103-105, 117. PENG Y L, TIAN J P. Determination of seven chemical constituents in Callicarpa nudiflora by LC-QTOF MS/MS[J]. Guangdong Chemical Industry, 2020, 47(20): 103-105, 117. |
| [88] |
谭湘杰. 裸花紫珠主要化学成分含量及影响因素分析[D]. 广州: 广东药科大学, 2018. TAN X J. Analysis of main chemical components and influencing factors of Callicarpa nudiflora hook. et arn[D]. Guangzhou: Guangdong Pharmaceutical University, 2018. |
| [89] |
SUN G, YAN C, CHEN W, et al. Study on the optimum picking time of Callicarpa kwangtungensis[J]. Agricultural Science & Technology, 2016, 17(9): 2171-2173, 2182. |
| [90] |
谭湘杰, 于福来, 黄梅, 等. 不同初加工方式对裸花紫珠主要化学成分含量影响[J]. 热带农业科学, 2018, 38(7): 33-39. TAN X J, YU F L, HUANG M, et al. Effects of different primary processing methods on the contents of the main chemical composition of Callicarpa nudiflora hook. et arn[J]. Chinese Journal of Tropical Agriculture, 2018, 38(7): 33-39. |
| [91] |
宋潇, 左美玲, 杨中保. 不同杀青工艺对裸花紫珠主要有效成分的影响[J]. 中国医药导报, 2022, 19(7): 31-34. SONG X, ZUO M L, YANG Z B. Effect of different de-enzyme techniques on main functional components of Callicarpa nudiflora Hook.et Arn[J]. China Medical Herald, 2022, 19(7): 31-34. |
| [92] |
SUN X M, LIAO Q F, LIU G H, et al. Simultaneous determination of three phenylethanoid glycosides from Callicarpae Caulis et Folium in rat plasma by LC-MS/MS and its application to PK study[J]. Bioanalysis, 2013, 5(15): 1883-1895. |
| [93] |
SHAO J, MA S C, ZHENG D K, et al. Simultaneous determination of four active components in rat plasma by ultra-high performance liquid chromatography tandem-mass spectrometry/mass spectrometry and its application to a pharmacokinetic study after oral administration of Callicarpa nudiflora extract[J]. Pharmacognosy Magazine, 2015, 11(43): 509-517. |
 2023, Vol. 42
2023, Vol. 42