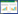文章信息
- 朱丽颖, 张丹丹, 杜宏英, 于明星, 朱彦
- ZHU Liying, ZHANG Dandan, DU Hongying, YU Mingxing, ZHU Yan
- 三维细胞微流控芯片模型的研究现状和在药物毒性评价中的应用进展
- Research status of 3D cell microfluidic chip model and its application in drug toxicity evaluation
- 天津中医药大学学报, 2023, 42(2): 257-263
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(2): 257-263
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.02.21
-
文章历史
收稿日期: 2022-10-22
2. 天津国际生物医药联合研究院中药新药研发中心, 天津 300457
2. Research and Development Center of Chinese Medicine, Tianjin International Joint Academy of Biomedicine, Tianjin 300457, China
在药物发现研究中,由于动物实验涉及到伦理和种属差异问题使其应用受到限制,而二维细胞缺乏长期培养的可能性,缺少细胞-细胞相互作用及细胞-胞外基质相互作用而与人体实际状况存在较大差异[1]。比如在药物诱导的肝毒性研究中,由于二维细胞表达药物代谢酶较少,因此对具有肝毒性的代谢产物敏感性较差。相反二维细胞筛选抑癌药物的敏感性过高,远超药物实际效果。为了弥补这些不足,人源细胞从二维跨越到三维,应运而生了3D细胞、类组织、类器官、类器官微流控芯片一系列越来越接近人体生理状态的研究模型。三维细胞使得细胞与细胞、细胞与胞外基质相互作用成为可能;类组织类器官是多能干细胞分化的各种细胞自组装而成的三维微型组织器官,其功能和结构类似于人体器官;微流控技术的引入,不仅能实现力学微环境,还能模拟人体器官随空间时间变化的生化、结构微环境;生物传感等实时监测技术的引入,可以实现对三维模型的长期无损重复检测,包括生物物理、生物化学信号,pH值和氧水平的测量[2]。在药物发现和毒性筛选方面,目前体外三维模型由于发展水平所限,还不能代替动物实验,但由于其细胞人源性,体外三维模型出现了准确性超越动物实验的案例。比如抗病毒药物非阿尿苷由于在二期临床试验中导致肝衰竭而被叫停,它在动物实验中没有观察到肝脏损伤,但在肝脏芯片中发现其剂量依赖性减少白蛋白分泌[3]。本文综述了三维细胞微流控芯片模型的研究现状,包括芯片制作技术、常用材料、模型细胞来源、模拟器官实例以及其在药物毒性评价中的应用,并总结了所面临的巨大挑战和广阔前景。
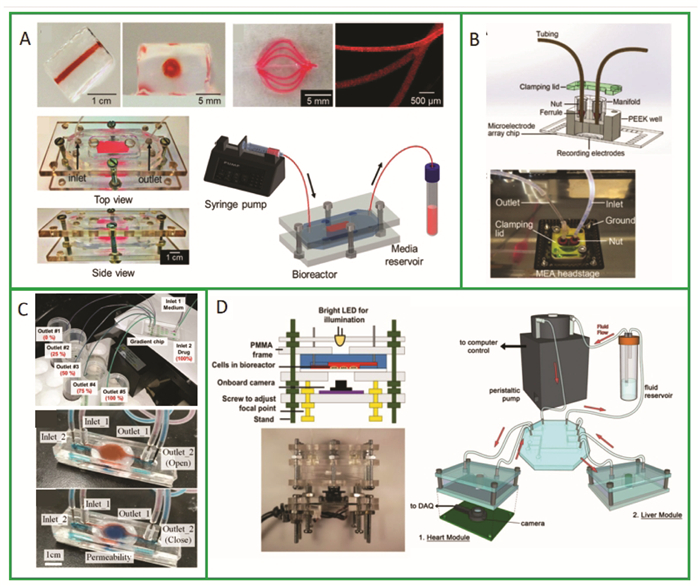
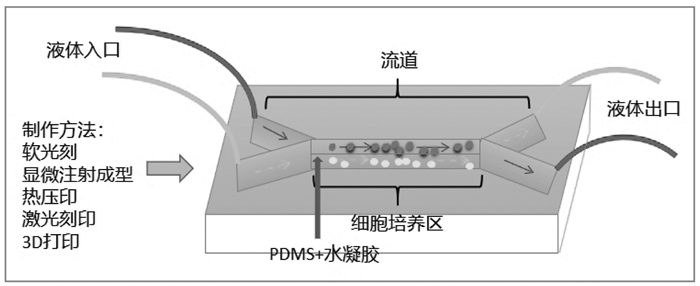
1 三维细胞微流控芯片(3D-CMCs)模型的研究现状3D-CMCs是人体生理学、组织工程、干细胞生物学、微工程、材料学、力学、药学、机械等多学科交叉技术。微流控芯片是指将化学、物理学、生物学相关实验所应具备的基本功能浓缩构建在一块几平方厘米的芯片上,并对流体实行微升级控制[4],3D-CMCs就是在微流控芯片上构建3D细胞模型。目前的微流控芯片共性主要是材料、区域划分和制作技术。理想的生物材料特性包括最小的细胞毒性,最小的生物分子吸收和药物吸收,透明以方便芯片成像,充分的气体通透性以确保细胞的氧气供应,为3D细胞提供结构支持,并促进健康或病变组织的表型和功能。芯片制作材料见表 1[5]。其中聚二甲基硅氧烷(PDMS)细胞毒性小、光学透明度好、透气性佳,被广泛用于3D-CMCs,但是PDMS会从溶液中吸收小的疏水分子或药物[6]。水凝胶作为亲水性生物材料可涂敷在PDMS上使其不吸收药物[7]。因此微流控芯片构建中常见PDMS和水凝胶的组合。微流控芯片的功能区划分基本一致:进出口、流道、细胞培养区。Bhattacharjee[8]比较了软光刻、显微注射成型、热压印、激光刻印和3D打印5种常用的制作微流控芯片的技术,认为3D打印最适合。且在构建3D-CMCs时,3D生物打印既可以打印微流控芯片作为反应容器,也可打印仿生组织作为反应受体。便捷、可定制等优点使其成为一种很有前途的技术。3D生物打印打印水凝胶可定制随时间变化的生化微环境和氧气浓度等因素。基质胶(Matrigel)和甲基丙烯酸明胶(GelMA)经常被用做3D培养胶;3D-CMCs模式图见图 1。多种细胞可用于3D-CMCs模型构建:代表性细胞系,多能干细胞,肿瘤细胞系,原代细胞等[9]。血管网络在3D-CMCs系统中具有重要意义,微血管网络能够提供充足的氧气和营养供应以及对微环境的控制,它可以实现组织的长期培养和功能化。已报道的3D-CMCs多种多样,包括肝、心、血管、肾、血脑屏障、脾、肺、肠、神经,血管与各种组织器官的组合,多器官组合,具体见开放科学(资源服务)标识码(OSID)[10-31]。如Edington等[32]研发的大型多器官组合芯片,包含了肝、肠、肺、子宫内膜、脑、心、胰腺、肌肉、皮肤、肾,用以研究药物代谢动力学和多靶器官毒性药物。3D-CMCs模型可用于药物发现和筛选,器官的生长发育,病变的体外建模研究,再生医学,药物毒性研究等领域[9]。
|
| 图 1 3D-CMCs模型示意图 |
近年来3D-CMCs在中药领域的研究也得到了重视,韩春辉[33]通过3D-CMCs模型研究白花蛇舌草、半枝莲及其药对提取物对人胶质瘤细胞迁移侵袭的影响。孙悦等[34]将微流控模型应用于抗肝癌中药成分药效筛选,探讨复方木鸡颗粒及其各组分对HepG2细胞凋亡的影响。又将肝星状细胞接种在微流控芯片上建模,发现菟丝子黄酮可改善肝脏纤维化[35]。并通过微流控模型进行了中药小蓟诱导肺癌A549细胞凋亡有效药用部位的分析[36]。屠鹏飞等[37]开发的单细胞微流控技术对近200个中药成分,5种瞬时受体电位通道亚型的调控活性进行高通量筛选,从抗炎镇痛中药九里香中发现了4个活性成分。吴建军等[38]对“圣散子方”联合吉非替尼片治疗晚期肺腺癌的临床治疗案例进行分析,此检测通过微流控芯片单细胞分选系统进行数据采集。张潇丹等[39]通过3D-CMCs模型研究了槲皮素、芦丁和山奈酚在HepG2中的活性氧清除能力,说明其抗氧化作用。魏文娟[40]将神经、血管内皮细胞结合构建脑缺氧/复氧损伤3D-CMCs,在此模型上研究地黄的主要有效成分梓醇的脑保护作用。
2 3D-CMCs模型在药物毒性检测中的应用 2.1 3D-CMCs模型在肝毒性检测中的应用药物的肝毒性评价是临床前药物开发的标准化过程,而现有常用模型对药物肝毒性预测有时缺乏灵敏性、准确性,比如曲伐沙星在临床前研究中常用模型未给出肝毒性结论,随后在上市1年后因导致肝衰竭和少数患者死亡而撤市。Nguye和同事将患者来源的肝细胞和非实质细胞共同打印成类肝组织,并利用其检测到曲伐沙星的毒性[41]。利用3D生物打印技术实现肝芯片或肝组织的快速高通量生产,将显著降低生产成本和操作难度。以水凝胶为基础的肝芯片系统已被开发用于生成仿生肝组织,Massa等[42]使用琼脂糖和GelMA牺牲生物打印技术建立微通道网络。将HepG2/C3A细胞封装在GelMA中,将HUVECs细胞植入微通道,构建含血管肝脏模型评估肝毒性(图 2A)。近年来灌注培养技术的创新简化了芯片制作,使其更适合药物毒性测试,出现了弃泵而为灌注芯片添加相位指向或CO2压力驱动固定流向的方法。将类器官培养与微流控芯片相结合,可以更好地控制类器官生长微环境。Bircsak等报道了高通量肝毒性筛查的3D类肝脏微流控OrganoPlate LiverToxTM的开发、自动化和验证。该模型由iPSC诱导的肝细胞的聚集体与内皮细胞和THP-1单核细胞共培养。他们将159种已知肝效应的化合物添加到模型中72 h,计算毒理学级别得分。肝损伤的发生发展是动态过程,不能仅用终点测量来描述,将芯片与生物传感器结合可实现多参数实时监测。Riahi等开发了一种微流控电化学免疫传感器,与肝芯片结合可长期连续测量细胞分泌的生物标志物。蔡乐[43]构建的肝3D-CMCs模型在白蛋白分泌和多药耐药转运蛋白Ⅱ表达上表现出优异性能;将其用于中药肝毒性检测,分别对氧化苦参碱、吴茱萸碱、氯化两面针碱、油酸这些有明确肝毒性或有潜在肝毒性的中药单体进行量-时关系和毒-时关系研究,发现3D-CMCs模型比传统2D细胞模型对中药单体毒性的耐受程度更高。张潇丹等[39]通过HepG2-3D-CMCs检测款冬花乙酸乙酯层提取物、正丁醇层提取物、乙醇层提取物、石油醚层提取物、水层提取物的毒性作用浓度。
目前心脏毒性筛查模型以二维细胞、动物模型和膜片钳技术为主,如前言所述二维细胞和动物模型各有缺点,膜片钳通常需要侵入性细胞操作[2]。所以亟须三维体外模型的介入检测药物的心脏毒性。Weng等[44]在结肠癌和心脏组合芯片上,通过抗癌药物阿霉素和奥沙利铂的IC50检测证明与体内观察结果一致。该平台展示了同时评估药物的心脏毒性和抗肿瘤作用的可行性。Kujala等[45]基于hiPSC-CMs和多阵列构建了微电极阵列芯片。该方法能够构建类似于天然心肌的分层心脏组织,并测量电生理数据。通过测量心毒性前药(特非那定)和非心毒性代谢物(非索非那定)的反应,证明了该3D-CMCs可用于药物心脏毒性筛查(图 2B)。一些公司的3D-CMCs产品(例如,德国Reutlingen的Multi-Channel Systems MCS GmbH,美国Axion Biosystems公司出售的多阵列芯片),可集成到多孔板中定量心脏电生理分析,以筛选药物的潜在心脏毒性[46]。
2.3 3D-CMCs模型在肾毒性检测中的应用Homan等[47]首先开发了将生物打印和3D细胞培养相结合的方案,创建嵌入到细胞外基质中3D可灌注的近端小管。该装置可用于定性和定量评估药物诱导的急性和慢性(细胞存活时间超过65 d)肾毒性。King等[48]利用人原发性肾近端小管上皮细胞、肾成纤维细胞和内皮细胞应用生物打印技术生成了一个功能强大的3D近端小管模型,用该模型测试了肾毒性药物的反应。Lei等[49]研究开发了一种模拟肾脏器官的3D-CMCs装置,该装置包括两部分:微流控药物浓度梯度发生器和肾细胞培养流温控制平台。通过肾近端小管上皮细胞和肾小管周毛细血管内皮细胞的检测评估药物诱导的肾毒性(图 2C)。与平面细胞相比,在细胞生长和药物肾毒性评估方面表现出更高的性能。且在该设备中发现,由于西咪替丁的干预,顺铂诱导的肾毒性显著降低。Vormann和同事开发了一种高通量的3D-CMCs用于检测药物诱导的肾毒性。通过已知肾毒性的4种药物为对照建立了评价方法,并对8种药物进行了测试。检测方法与自动移液系统兼容,有高通量化潜力。
2.4 3D-CMCs模型在多器官联合毒性检测中的应用单器官模型的目标是重建该器官的关键功能单元,而不是整个器官。所以往往无法复制不同组织和器官之间的正常或异常相互作用。多器官联合芯片的优势是能够将药物代谢和药物毒性过程整合到一个设备中,从而方便药物代谢产物的毒性评价。Kamei等报道了一组带有模拟血液循环系统,并连接处于不同培养室的CMs和HepG2细胞的3D-CMCs模型。该系统用于评估阿霉素在肝脏代谢后对心肌细胞的毒性作用。Rajan等报道了一个集成多3D-CMCs系统,该系统能够并行评估药物对多种组织的药效和毒性。首先将肝脏,心脏和肺部结构组成多器官芯片,可高存活率保持21天,通过已知前药卡培他滨到5-氟尿嘧啶的肝脏代谢,观察肺和心脏对代谢物的毒性验证该系统。然后,他们扩展集成系统以容纳肝、心、肺、内皮、脑和睾丸类组织。培养14 d后,通过前药异环磷酰胺肝脏代谢产生氯乙醛诱导下游神经毒性,从而证明多种组织之间的相互作用。Skarda等[50]开发了类肝脏、心脏、肺组织组成的芯片系统,测试了博莱霉素的效果(图 2D)。单个3D-CMCs暴露于博莱霉素没有显著增加肝、肺和心脏类组织的细胞死亡,且心跳保持稳定。然而,在相互连接的3个3D-CMCs系统中,显示类心脏停止跳动,这表明存在次级心脏毒性作用。研究确定这种毒性是由于博莱霉素作用于肺类组织引起的肺部炎症因子白细胞介素(IL)-1β分泌增加引起的。
3 3D-CMCs研究面临的挑战和展望总的来说,3D-CMCs通过准确复制人体生理器官和在不同类组织之间的相互作用提供健康和疾病模型,在药物发现、药物毒性检测和疾病建模方面已经取得了重大进展,但还没有得到广泛应用。主要原因在于高难度的生理模拟、缺乏有效检测手段、通量与生理模拟和精准检测之间的矛盾、学科技术限制、成本高、结果不稳定、工业化限制。生理模拟的高难度可以归因于无法完全复制体内环境和相关复杂性。细胞与胞外基质种类多样,存在时空变化;人体系统的细胞因子在全身分泌迁移,种类繁复动态变化,人工制造的生化微环境距离真实器官较远;人体血管网庞杂,体外研究无法完全复刻实际的力学微环境。目前打印过程、细胞来源和基质材料仍然存在挑战。构建3D-CMCs拟似性和实用性的平衡取决于目的。芯片的高厚度导致难以实现准确的实时成像,成像技术和分析工具的进步是目前的迫切需求,而且增加三维空间会增加图像捕获和计算需求影响通量,目前常用的最大聚焦或强度投影算法减少了数据复杂性,但导致了3D培养的微组织表型复杂性利用不充分。试剂或细胞培养的高成本和低通量实验阻碍了3D-CMCs的普及应用,而且3D细胞实验结果重现性往往存在一定问题。随着系统复杂性提高,确保所开发的平台易于使用、价格低廉、易复制,以促进在研究和工业中广泛采用。
3D-CMCs模型在中药研究上具有独特优势和广阔前景。首先,中医药强调整体观,而3D-CMCs模型在生化微环境、力学微环境、与药物接触方式上均可最大程度模拟人体真实的细胞微环境,可实现多器官串联组合,必然会为具有多组分多靶点多通路的中药药效及机制研究带来新的机遇。其次,中药组分复杂,同一药味或不同药味之间可能存在成分相互作用的情况。3D-CMCs模型代谢能力强,更加贴近人体的真实代谢水平,适合复方中药物-药物相互作用的研究,并可进一步探究相反相畏药味的深层原理。再者,3D-CMCs模型中涉及的微流控技术可对流体实现微升级控制,其与高灵敏度的质谱色谱分析方法结合,将大力推进多组分中药中痕量、微量成分的检测和新结构鉴定。最后,目前3D-CMCs模型已经实现了长期培养,长期重复给药,多表型同步检测,这将为具有蓄积毒性的中药毒性评价提供更合理和有效的工具。尽管3D-CMCs模型的中药研究应用目前尚处于起步阶段,但未来必定大有可为。Nature杂志于2015年发表的综述称,类器官芯片是未来可能替代动物实验的革命性技术[51]。水凝胶的进一步开发应用使四维细胞微流控芯片的构建指日可待。血管在3D-CMCs中的继续整合将推动多器官芯片、人体芯片向前迈进。AI/机器学习结合3D打印应用到3D-CMCs领域的长足发展也必将推进该技术领域的进步。
| [1] |
LIU J, LI R H, XUE R, et al. Drug hepatotoxicity: Liver extracellular matrices bioactivated hepatic spheroids as a model system for drug hepatotoxicity evaluations (adv. biosys. 10/2018)[J]. Advanced Biosystems, 2018, 2(10): 97-106. |
| [2] |
DONOGHUE L, NGUYEN K T, GRAHAM C, et al. Tissue chips and microphysiological systems for disease modeling and drug testing[J]. Micromachines, 2021, 12(2): 139. DOI:10.3390/mi12020139 |
| [3] |
JALILI-FIROOZINEZHAD S, MIRANDA C C, CABRAL J M S. Modeling the human body on microfluidic chips[J]. Trends in Biotechnology, 2021, 39(8): 838-852. DOI:10.1016/j.tibtech.2021.01.004 |
| [4] |
林炳承. 微纳流控芯片实验室[M]. 北京: 科学出版社, 2013: 442. LIN B C. Micro-nano fluidic chip laboratory[M]. Beijing: Science Press, 2013: 442. |
| [5] |
ESCH M B, UENO H, APPLEGATE D R, et al. Modular, pumpless body-on-a-chip platform for the co-culture of GI tract epithelium and 3D primary liver tissue[J]. Lab on a Chip, 2016, 16(14): 2719-2729. DOI:10.1039/C6LC00461J |
| [6] |
张强. PDMS材质微流控芯片的设计制备及其在单细胞分离分析中的应用[D]. 青岛: 青岛大学, 2015. ZHANG Q. Design and preparation of PDMS microfluidic chip and its application in single cell separation and analysis[D]. Qingdao: Qingdao University, 2015. |
| [7] |
TORINO S, CORRADO B, IODICE M, et al. PDMS-based microfluidic devices for cell culture[J]. Inventions, 2018, 3(3): 65. DOI:10.3390/inventions3030065 |
| [8] |
BHATTACHARJEE N, URRIOS A, KANG S, et al. The upcoming 3D-printing revolution in microfluidics[J]. Lab on a Chip, 2016, 16(10): 1720-1742. DOI:10.1039/C6LC00163G |
| [9] |
CLEVERS H. Modeling development and disease with organoids[J]. Cell, 2016, 165(7): 1586-1597. DOI:10.1016/j.cell.2016.05.082 |
| [10] |
WANG Y Q, WANG H, DENG P W, et al. In situ differentiation and generation of functional liver organoids from human iPSCs in a 3D perfusable chip system[J]. Lab on a Chip, 2018, 18(23): 3606-3616. DOI:10.1039/C8LC00869H |
| [11] |
ORTEGA-PRIETO A M, SKELTON J K, WAI S N, et al. 3D microfluidic liver cultures as a physiological preclinical tool for hepatitis B virus infection[J]. Nature Communications, 2018, 9(1): 682. DOI:10.1038/s41467-018-02969-8 |
| [12] |
MENG Q, WANG Y, LI Y J, et al. Hydrogel microfluidic-based liver-on-a-chip: mimicking the mass transfer and structural features of liver[J]. Biotechnology and Bioengineering, 2021, 118(2): 612-621. DOI:10.1002/bit.27589 |
| [13] |
KOLESKY D B, HOMAN K A, SKYLAR-SCOTT M A, et al. Three-dimensional bioprinting of thick vascularized tissues[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(12): 3179-3184. DOI:10.1073/pnas.1521342113 |
| [14] |
LIU M Y, ZHOU Z Z, CHAI Y C, et al. Synthesis of cell composite alginate microfibers by microfluidics with the application potential of small diameter vascular grafts[J]. Biofabrication, 2017, 9(2): 25-30. |
| [15] |
PALIKUQI B, NGUYEN D H T, LI G, et al. Adaptable haemodynamic endothelial cells for organogenesis and tumorigenesis[J]. Nature, 2020, 585(7825): 426-432. DOI:10.1038/s41586-020-2712-z |
| [16] |
KONG M, LEE J M, YAZDI I K, et al. Cardiac fibrotic remodeling on a chip with dynamic mechanical stimulation[J]. Advanced Healthcare Materials, 2019, 8(3): 130-146. |
| [17] |
OH Y, CHO G S, LI Z, et al. Functional coupling with cardiac muscle promotes maturation of hPSC-derived sympathetic neurons[J]. Cell Stem Cell, 2016, 19(1): 95-106. DOI:10.1016/j.stem.2016.05.002 |
| [18] |
ELLIS B W, ACUN A, CAN U I, et al. Human iPSC-derived myocardium-on-chip with capillary-like flow for personalized medicine[J]. Biomicrofluidics, 2017, 11(2): 105-129. |
| [19] |
MUSAH S, MAMMOTO A, FERRANTE T C, et al. Mature induced-pluripotent-stem-cell-derived human podocytes reconstitute kidney glomerular-capillary-wall function on a chip[J]. Nature Biomedical Engineering, 2017, 1: 69-94. DOI:10.1038/s41551-017-0069 |
| [20] |
LIN N Y C, HOMAN K A, ROBINSON S S, et al. Renal reabsorption in 3D vascularized proximal tubule models[J]. Proceedings of the National Academy of Sciences of the United States of America, 2019, 116(12): 5399-5404. DOI:10.1073/pnas.1815208116 |
| [21] |
TRÖNDLE K, RIZZO L, PICHLER R, et al. Scalable fabrication of renal spheroids and nephron-like tubules by bioprinting and controlled self-assembly of epithelial cells[J]. Biofabrication, 2021, 13(3): 18. |
| [22] |
XU C, ZHANG M, CHEN W W, et al. Assessment of air pollutant PM2.5 pulmonary exposure using a 3D lung-on-chip model[J]. ACS Biomaterials Science & Engineering, 2020, 6(5): 3081-3090. |
| [23] |
JALILI-FIROOZINEZHAD S, GAZZANIGA F S, CALAMARI E L, et al. A complex human gut microbiome cultured in an anaerobic intestine-on-a-chip[J]. Nature Biomedical Engineering, 2019, 3(7): 520-531. DOI:10.1038/s41551-019-0397-0 |
| [24] |
SONTHEIMER-PHELPS A, CHOU D B, TOVAGLIERI A, et al. Human colon-on-a-chip enables continuous in vitro analysis of colon mucus layer accumulation and physiology[J]. Cellular and Molecular Gastroenterology and Hepatology, 2020, 9(3): 507-526. DOI:10.1016/j.jcmgh.2019.11.008 |
| [25] |
VATINE G D, BARRILE R, WORKMAN M J, et al. Human iPSC-derived blood-brain barrier chips enable disease modeling and personalized medicine applications[J]. Cell Stem Cell, 2019, 24(6): 995-1005. DOI:10.1016/j.stem.2019.05.011 |
| [26] |
XIE M J, GAO Q, FU J Z, et al. Bioprinting of novel 3D tumor array chip for drug screening[J]. Bio-Design and Manufacturing, 2020, 3(3): 175-188. DOI:10.1007/s42242-020-00078-4 |
| [27] |
WANG N J, WANG J Y, MENG X S, et al. 3D microfluidic in vitro model and bioinformatics integration to study the effects of Spatholobi Caulis tannin in cervical cancer[J]. Scientific Reports, 2018, 8(1): 85-122. DOI:10.1038/s41598-017-18391-x |
| [28] |
WANG N J, WANG J Y, MENG X S, et al. The pharmacological effects of spatholobi caulis tannin in cervical cancer and its precise therapeutic effect on related circRNA[J]. Molecular Therapy Oncolytics, 2019, 14(2): 121-129. |
| [29] |
JEFFRIES G D M, XU S J, LOBOVKINA T, et al. 3D micro-organisation printing of mammalian cells to generate biological tissues[J]. Scientific Reports, 2020, 10(1): 19-29. DOI:10.1038/s41598-019-57005-6 |
| [30] |
LEE D W, HA S K, CHOI I, et al. 3D gut-liver chip with a PK model for prediction of first-pass metabolism[J]. Biomedical Microdevices, 2017, 19(4): 100. DOI:10.1007/s10544-017-0242-8 |
| [31] |
AN F, QU Y Y, LUO Y, et al. A laminated microfluidic device for comprehensive preclinical testing in the drug ADME process[J]. Scientific Reports, 2016, 6(1): 22-25. DOI:10.1038/s41598-016-0030-3 |
| [32] |
EDINGTON C D, CHEN W L K, GEISHECKER E, et al. Interconnected microphysiological systems for quantitative biology and pharmacology studies[J]. Scientific Reports, 2018, 8(1): 4530. DOI:10.1038/s41598-018-22749-0 |
| [33] |
韩春辉. 白花蛇舌草、半枝莲及其药对提取物对人胶质瘤细胞迁移侵袭的影响及作用机制研究[D]. 大连: 大连医科大学, 2019. HAN C H. A study on inhibiting effects and mechanism of the extracts of Oldenlandia diffusa Willd., sculellaria barbata and their herb pair on the migration and invasion of human malignant glioma cells[D]. Dalian: Dalian Medical University, 2019. |
| [34] |
孙悦, 包永睿, 王帅, 等. 基于微流控芯片的复方木鸡颗粒诱导HepG2细胞凋亡作用研究[J]. 中南药学, 2021, 19(2): 177-181. SUN Y, BAO Y R, WANG S, et al. Apoptosis of HepG2 cells induced by Fufang Muji Granules based on microfluidic chip[J]. Central South Pharmacy, 2021, 19(2): 177-181. |
| [35] |
包永睿, 杨欣欣, 王帅, 等. 基于微流控芯片的菟丝子黄酮对大鼠HSC-T6细胞凋亡影响研究[J]. 亚太传统医药, 2019, 15(7): 26-30. BAO Y R, YANG X X, WANG S, et al. Study on the pro-apoptosis effect of Semen cuscutae flavonoids of fufangmuji granule in HSC-T6 cell based on microfluidic technology[J]. Asia-Pacific Traditional Medicine, 2019, 15(7): 26-30. |
| [36] |
王鹤辰, 包永睿, 王帅, 等. 基于微流控芯片技术的中药小蓟诱导肺癌A549细胞凋亡用药部位精准分析[J]. 药物分析杂志, 2019, 39(3): 393-397. WANG H C, BAO Y R, WANG S, et al. Precise analysis of the apoptosis effect of medicinal parts of Cirsium setosum to lung cancer A549 cell based on microfluidic chip[J]. Chinese Journal of Pharmaceutical Analysis, 2019, 39(3): 393-397. DOI:10.16155/j.0254-1793.2019.03.03 |
| [37] |
AI X N, WU Y, LU W B, et al. A precise microfluidic assay in single-cell profile for screening of transient receptor potential channel modulators[J]. Advanced Science (Weinheim, Baden-Wurttemberg, Germany), 2020, 7(11): 2000111. |
| [38] |
吴建军, 宋振玉, 冷宁, 等. "圣散子方"联合伊瑞可(吉非替尼片)治疗晚期肺腺癌临床样品CTC、CSC相关性研究[J]. 世界最新医学信息文摘, 2018, 18(81): 132-133. WU J J, SONG Z Y, LENG N, et al. Study on the correlation between CTC and CSC in clinical samples of "Shengsanzi Decoction" combined with Yi Rui Ke(gefitinib tablets) in the treatment of advanced lung adenocarcinoma[J]. World Latest Medicine Information, 2018, 18(81): 132-133. |
| [39] |
ZHANG X D, XU Y, ZHANG T, et al. Assessing plant antioxidants by cellular antioxidant activity assay based on microfluidic cell chip with arrayed microchannels[J]. Chinese Journal of Analytical Chemistry, 2016, 44(4): 604-609. DOI:10.1016/S1872-2040(16)60924-6 |
| [40] |
魏文娟. 梓醇对基于微流控技术的脑神经-血管单元模型氧糖剥夺/复氧糖损伤的干预研究[D]. 大连: 大连医科大学, 2019. WEI W J. Intervention study of catalpol on oxygen and glucose deprivation/reperfusion injury in A microfluidic-based approach of neurovascular unit model[D]. Dalian: Dalian Medical University, 2019. |
| [41] |
NGUYEN D G, FUNK J, ROBBINS J B, et al. Bioprinted 3D primary liver tissues allow assessment of organ-level response to clinical drug induced toxicity in vitro[J]. PLoS One, 2016, 11(7): e0158674. DOI:10.1371/journal.pone.0158674 |
| [42] |
MASSA S, SAKR M A, SEO J, et al. Bioprinted 3D vascularized tissue model for drug toxicity analysis[J]. Biomicrofluidics, 2017, 11(4): 044109. DOI:10.1063/1.4994708 |
| [43] |
蔡乐. 基于肝器官芯片的中草药成分肝毒性评价[D]. 大连: 大连理工大学, 2019. CAI L. Hepatotoxicity evaluation of traditional Chinese herb components based on the liver-on-a-chip[D]. Dalian: Dalian University of Technology, 2019. |
| [44] |
WENG K C, KUROKAWA Y K, HAJEK B S, et al. Human induced pluripotent stem-cardiac-endothelial-tumor-on-a-chip to assess anticancer efficacy and cardiotoxicity[J]. Tissue Engineering Part C: Methods, 2020, 26(1): 44-55. DOI:10.1089/ten.tec.2019.0248 |
| [45] |
KUJALA V J, PASQUALINI F S, GOSS J A, et al. Laminar ventricular myocardium on a microelectrode array-based chip[J]. Journal of Materials Chemistry B, 2016, 4(20): 3534-3543. DOI:10.1039/C6TB00324A |
| [46] |
SHIRURE V S, LEZIA A, TAO A, et al. Low levels of physiological interstitial flow eliminate morphogen gradients and guide angiogenesis[J]. Angiogenesis, 2017, 20(4): 493-504. DOI:10.1007/s10456-017-9559-4 |
| [47] |
HOMAN K A, KOLESKY D B, SKYLAR-SCOTT M A, et al. Bioprinting of 3D convoluted renal proximal tubules on perfusable chips[J]. Scientific Reports, 2016, 24(6): 34845. |
| [48] |
KING S M, HIGGINS J W, NINO C R, et al. 3D proximal tubule tissues recapitulate key aspects of renal physiology to enable nephrotoxicity testing[J]. Frontiers in Physiology, 2017, 13(8): 123. |
| [49] |
YIN L, DU G, ZHANG B, et al. Efficient drug screening and nephrotoxicity assessment on co-culture microfluidic kidney chip[J]. Sci Rep, 2020, 10(1): 65-68. |
| [50] |
SKARDAL A, MURPHY S V, DEVARASETTY M, et al. Multi-tissue interactions in an integrated three-tissue organ-on-a-chip platform[J]. Sci Rep, 2017, 7(1): 8837. |
| [51] |
REARDON S. 'Organs-on-chips' go mainstream[J]. Nature, 2015, 523(7560): 266. |
 2023, Vol. 42
2023, Vol. 42