文章信息
- 王惠临, 张立平, 卞昊宇, 魏骄阳
- WANG Huilin, ZHANG Liping, BIAN Haoyu, WEI Jiaoyang
- 利胆消石合剂对胆总管结石患者ERCP术后胆汁成分影响的临床研究
- Effect of Lidan Xiaoshi Mixture on bile composition after ERCP in patients with common bile duct stones: a clinical study
- 天津中医药大学学报, 2023, 42(3): 280-285
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(3): 280-285
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.03.02
-
文章历史
收稿日期: 2023-02-12
2. 北京中医药大学,北京 100029
2. Beijing University of Chinese Medicine, Beijing 100029, China
胆总管结石(CBDS)进行内镜下逆行胆胰管造影术(ERCP)取石是目前广泛使用的治疗手段,而取石术后的复发率却居高不下,给广大患者带来了严重的心理负担、健康负担和经济负担。CBDS的成分组成在中国主要是棕色素结石,其复发主要是由于手术损伤Oddi括约肌加重胆道感染的外因[1]和胆汁成分代谢异常的内因[2]相结合而导致的。其中,胆汁成分代谢异常作为CBDS复发的内因从20世纪起就有大量学者进行研究,广泛认为胆汁中非结合胆红素(UCB)含量的异常与胆道局部细菌产生外源性β-葡萄糖苷酶(β-Gase)及胆管细胞产生内源性β-Gase相关[3]。
在此基础上,开展如何使用中医药对术后患者进行有效预防以减少复发的相关研究是非常有意义的。笔者所在团队对临床上行ERCP取石CBDS患者的证候变化规律进行了观察、归纳、总结,发现脾虚证是CBDS患者行ERCP取石术后的一个普遍证型,也是其起病的核心病机[4-5]。在临床中使用健脾益气、疏肝利胆法所拟的利胆消石合剂,能够改善CBDS患者ERCP术后胆汁成分从而降低成石性,现报告如下。
1 资料与方法 1.1 研究方法本研究为临床随机对照研究,采用区组随机化方法进行分组,将入组患者按1∶1的比例随机分入中药组和对照组。将接受ERCP取石术后未口服利胆消石合剂的患者纳入对照组,在对照组基础上口服中药利胆消石合剂的患者纳入中药组。观察术后两组患者近期内的胆汁成分改变。
1.2 研究对象选取2019年10月—2021年12月于北京中医药大学东方医院脾胃肝胆科住院部及胃镜中心诊断为CBDS且行ERCP取石术的患者作为研究对象。
1.2.1 诊断标准参考《内镜下逆行胆胰管造影术(ERCP)诊治指南(2018版)》[6],CBDS的诊断为:有可疑症状或体征的患者,通过一线、二线检查逐步确立诊断,进而制定治疗方案;怀疑CBDS的病例建议采用创伤小且诊断率较高的影像学检查,如磁共振胰胆管成像(MRCP)或超声内镜(EUS),不建议实施诊断性ERCP;如条件许可,建议ERCP前常规接受MRCP检查。
1.2.2 纳入标准1)术前均经行一线检查(实验室检查及B超)及(或)二线检查[电子计算机断层扫描(CT)或MRCP等影像学检查]诊断为CBDS并顺利完成ERCP取石术。2)患者意识清楚,有正常的沟通能力,无精神、神经疾患。3)未合并心、肝等重要脏器严重疾病。4)非妊娠及哺乳期妇女。5)年龄18~90岁,患者本人及家属同意参加研究。6)术前1个月内未服用利胆药物。
1.2.3 排除标准1)非CBDS或取石术不成功者。2)胆管狭窄者。3)沟通能力及依从性差或有精神疾病者。4)过敏体质或对本研究中的药物成分过敏者。5)接受其他药物治疗。
1.2.4 脱落标准1)依从性差的受试者。2)发生严重不良事件、并发症和特殊生理变化不宜继续接受研究的受试者。3)自行退出的受试者。4)未按研究方案规定用药的受试者。5)因各种原因未能留取胆汁标本者。
1.3 治疗方法1)所有患者术前给予肌内注射山莨菪碱10 mg、盐酸哌替啶50 mg、地西泮10 mg,行ERCP联合内镜下取石术及内镜下鼻胆管引流术,术中均采用十二指肠乳头括约肌切开术(EST),根据术中情况选择是否联合内镜下乳头球囊扩张术(EPBD),取石方式使用取石网篮和(或)球形气囊等方法。ERCP取石成功后,通过造影判断无残留结石,将鼻胆管一端于内镜引导下置入胆管内,一端经十二指肠、胃、食管、鼻腔引出体外,末端连接引流袋进行引流。所有患者术后均采取一般维持治疗,即禁食与禁水24 h、头孢唑肟联合左奥硝唑抗感染、补液等对症治疗,抗生素规格、剂量保持一致。2)治疗组:给予利胆消石合剂口服,剂型均为中药颗粒剂,产自北京康仁堂中药厂家。方药组成:柴胡10 g,枳壳10 g,白芍10 g,党参10 g,炒白术10 g,茯苓10 g,焦山楂10 g,茵陈15 g,金钱草30 g,海金沙10 g,郁金10 g,鸡内金10 g。于ERCP术后第2天开水冲服,每日2次,连续服用5 d。3)对照组:采取一般维持治疗,不予口服中药干预。
1.4 标本留取及检测指标 1.4.1 标本留取所有患者均于ERCP术后第1、3、5天上午7∶00—10∶00留取胆汁10 mL。胆汁样本留取方法:用10 mL无菌注射器于鼻胆管引流袋内抽取大约10 mL胆汁,将针头插入真空无抗凝剂的红色采血管内,每管自动吸取5 mL胆汁,共2管,避光转移,将样本管置于4 000 r/min离心机离心10 min(离心半径10 cm)后取上清液,转移至冻存管冻存于-80 ℃冰箱待测。
1.4.2 样本检测1)将样本用蒸馏水按1∶5比例稀释,置于全自动生化分析仪上,使用酶循环法测定总胆汁酸(TBA)浓度,使用重氮法测定总胆红素(TBIL)和结合胆红素(CB)浓度,利用两者差值计算出UCB浓度,UCB与TBIL的比值为UCB%。将样本原液置于全自动生化分析仪上,使用偶氮胂Ⅲ法测定钙离子(Ca2+)浓度。2)使用酶联免疫吸附(ELISA)法检测胆汁样本中糖蛋白、β-Gase、总胆固醇(Cho)浓度。
1.5 统计学分析所有数据采用SPSS 22.0软件进行统计学分析,连续变量描述为均数±标准差(x±s)。对连续性变量符合正态分布的数据使用t检验,不符合正态分布的、标准差<均数1/3的连续性变量,可近似作为正态分布使用t检验,标准差>均数1/3的连续性变量使用非参数检验。P<0.05为差异有统计学意义。
1.6 伦理审查本研究通过北京中医药大学东方医院临床研究伦理委员会伦理审查,伦理审查批件号为JDF-IRB-2020031502。
2 结果 2.1 基本情况及基线对照本研究共纳入病例70例,其中中药组35例,对照组35例。完成术后第5天随访60例(中药组3例和对照组7例因鼻胆管无胆汁流出脱落)。两组患者年龄、性别、发病至取石间隔天数比较,差异无统计学意义(P>0.05),具有可比性。
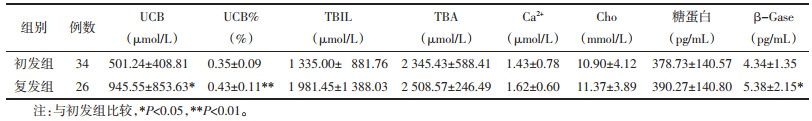
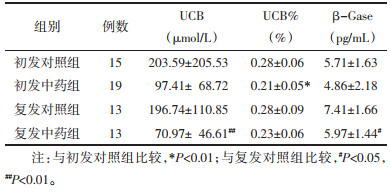
2.2 胆汁成分变化 2.2.1 复发及初发患者胆汁成分比较将收集到的60例患者按照复发型胆总管结石及初发型胆总管结石分为两组,其中复发组26例,初发组34例。比较两组患者术后第1天胆汁中UCB、UCB%、TBIL、TBA、Ca2+、Cho、糖蛋白及β-Gase浓度,结果可见复发组与初发组患者比较,术后第1天胆汁中UCB、UCB%及β-Gase浓度差异有统计学意义(P<0.05),而TBIL、TBA、Ca2+、Cho及糖蛋白浓度比较,差异无统计学意义(P>0.05)。见表 1。
“2.2.1”项提示复发组与初发组患者术后第1天胆汁中UCB、UCB%及β-Gase浓度存在差异,因此将中药组与对照组患者按照复发与初发拆分亚组,TBIL、TBA、Ca2+、Cho及糖蛋白浓度比较,两组患者术后第1天水平无差异,因此不按照复发与初发拆分亚组。
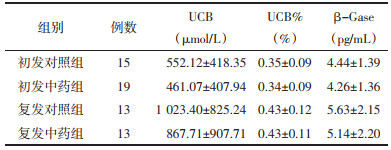
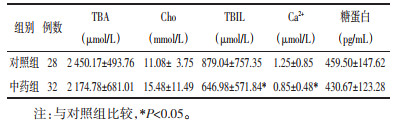
术后第1天,两组患者UCB、UCB%、β-Gase、TBA、Cho、TBIL、Ca2+、糖蛋白浓度差异无统计学意义(P>0.05),具有可比性。见表 2、表 3。
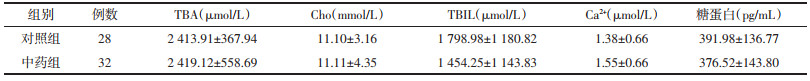
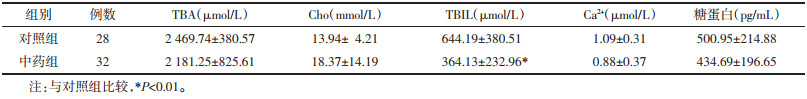
术后第3天,各组间胆汁成分比较,中药组胆汁中TBIL和Ca2+浓度较对照组降低,差异有统计学意义(P<0.05)。两组间UCB、UCB%、β-Gase、TBA、Cho、糖蛋白浓度比较,差异无统计学意义(P>0.05)。见表 4、表 5。
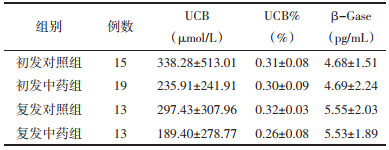
术后第5天,各组患者胆汁成分比较,中药干预降低了复发组患者胆汁中UCB、β-Gase浓度,降低了初发组患者胆汁中UCB%,降低了所有患者胆汁中TBIL浓度,差异具有统计学意义(P<0.05)。同时中药干预具有促进胆汁中Ca2+水平降低的趋势,但差异无统计学意义(P>0.05)。两组患者间TBA、Cho、糖蛋白浓度比较,差异无统计学意义(P>0.05)。见表 6、表 7。
西医认为原发性CBDS的复发主要与肠道菌群逆行的胆道感染、胆汁成分改变和胆道动力学异常有关。胆道中特定的厌氧菌可以产生β-Gase,这种酶将双葡萄糖醛酸胆红素水解成UCB,与游离Ca2+结合从而形成沉淀[7]。正常代谢的肝细胞、胆管上皮和胆囊黏膜也能分泌β-Gase,这些内源性酶同样参与结石形成,胆道中细菌的内毒素通过细胞毒效应或其他机制激活肝细胞和胆管上皮细胞,使内源性的β-Gase释放增加[8]。此外,各种临床研究证实,高龄[1]、胆总管扩张[9]、结石大小和数量[10]、结石性质[11]等因素,均是结石再发的影响因素。ERCP术中的各种操作[EST、EPBD、乳头大气囊扩张术(EPLBD)]及壶腹周围憩室(PAD)等造成的Oddi括约肌压力明显下降,导致胆道动力学改变,加重肠胆反流[12],最终引发或加重胆道感染,使得ERCP术后CBDS的复发问题显著。
CBDS在中医属于“胆胀”范畴,从中医角度结合复发危险因素,诸如高龄、Oddi括约肌损伤、胆道菌群改变和胆汁成分改变来看,该病复发的核心病机有2个:1)脾气虚衰。正所谓“元气者,生身之本也”,气的盛衰、运动变化乃是人体一切生命活动的主宰,聚焦到肝胆系统,气机的充盛推动胆腑中精汁在胆管中的流动,气机的流转控制胆管中精汁的疏泄。衰老必然伴随着脏腑气血功能的衰退,括约肌损伤则是由形及气,损伤元气。《素问·刺法论》有言:“正气存内,邪不可干,邪之所凑,其气必虚。”胆道菌群的定植和改变,反映了病机中虚证的存在。而元气虚衰又以脾气虚弱为主,因脾为后天之本,元气的产生赖于脾胃,又脾胃与肝胆同属中焦,其气相协,是以元气虚衰,主为脾气虚弱。2)肝胆不利。肝气之余化为胆腑精汁,是以胆汁以澄清为性。脾气虚衰则升清降浊功能有损,使肝胆不利,其精汁性也浑浊,日渐郁滞。木气郁而不舒,土气虚而不运,长此以往则湿邪再次凝聚,热、瘀等实邪伴随而生,最终在已然受损的胆道再次形成砂石。
张立平主任医师在临证观察总结中提出,如此病机使患者本身已成“结石体质”,取石术虽消除一时病症,然治标不治本,则病症虽除,复发有时。若想使脾气虚弱、肝胆不利的“结石体质”恢复正常,则要健脾益气:使元气得复,如此胆腑精汁流动顺畅,疏泄有序,正气固本而外邪得退;疏利肝胆:使肝升胆降,如此胆腑精汁清利,郁滞不存而胆石难成。
本研究结果表明,复发患者与初发患者相比,术后第1天胆汁中的UCB含量、UCB%升高,β-Gase含量升高,而CB、TBA、Ca2+、糖蛋白含量没有明显差别。对照组患者术后从第1天至第5天,胆汁中UCB、TBIL浓度及UCB%呈现下降趋势,β-Gase、糖蛋白浓度呈现升高趋势,Ca2+、Cho、TBA浓度保持不变。β-Gase与UCB、UCB%变化趋势相反,推测其原因可能为ERCP手术使胆道与肠道间屏障短期内被破坏,胆道微生物群结构改变,加之局部炎症反应,使外源性及内源性β-Gase均逐步升高,炎症刺激肝细胞、胆管细胞分泌糖蛋白亦随之增加。虽然β-Gase升高加速CB水解为UCB,但胆道梗阻未解除时,胆汁淤积使胆汁中UCB逐步累积升高,随着胆道梗阻的解除,淤积的胆汁正常排出,胆汁停留时间缩短,故CB水解率降低,胆汁中UCB水平逐渐恢复,短期内CB被加速水解的速率还无法达到梗阻时UCB累积的浓度,最终导致术后前5 d的β-Gase与UCB、UCB%出现反向变化。
本研究结果还表明,在胆汁成分变化基础上,使用中药利胆消石合剂进行干预,无论复发或初发患者,术后第5天,中药组TBIL、UCB浓度和UCB%低于对照组,中药加快了术后胆汁中TBIL、UCB浓度和UCB%的下降趋势。在初发患者中,术后第5天中药组与对照组β-Gase浓度无明显差异。在复发患者中,术后第5天中药组与对照组比较,β-Gase浓度降低,这表明中药可以抑制复发患者术后β-Gase的升高趋势。UCB%>0.15的胆汁是易形成色素性结石的病理性胆汁[13]。本研究中无论初发患者或复发患者,其胆汁UCB%均高于0.15,而使用中药利胆消石合剂,加快胆汁UCB%下降,抑制胆汁中β-Gase浓度升高,其机制可能是通过抑制胆道菌群定植、缓解胆管局部炎症,从而降低内源性及外源性β-Gase的产生来实现的。
利胆消石合剂为四君子汤、四逆散组方加减而来。现代药理研究已经证明,四君子汤可以通过调节胃肠激素来调节胃肠道及胆道动力[14],四逆散已被研究证明具有增加胆囊收缩素、促进胆汁分泌、提高胆汁酸含量等功效[15],茵陈、金钱草、郁金、海金沙、鸡内金、焦山楂等也被证实在促进胆汁分泌、促进胃肠道蠕动和抑制胆红素结石形成方面有效[16-21]。胆道菌群的定植和局部炎症的形成,关键在于Oddi括约肌结构和功能的损伤、胆道系统压力的失衡和胆汁流出不畅。疏肝利胆、健脾益气可使肝之疏泄与脾之运化恢复,两者相辅相成,可促进消化道(包括胆道系统)的运动功能,加强胆汁的排泄对胆道天然的冲刷功能。另一方面,脏器结构与功能的关系被描述为“形”与“气”的关系,阳化气,阴成形,阴阳相互转化,互根互生。脾气充盛,气盈则形复,促进Oddi括约肌在取石术后的快速恢复。如此一来,胆道系统与肠道交通的阀门得到修复,局部微环境稳定则炎症消退,内源性、外源性β-Gase的产生均得到抑制。
综上所述,口服利胆消石合剂在ERCP术后短期内,即可通过降低胆汁中β-Gase、UCB的浓度和UCB%降低胆汁成石性,推测若术后长期服用能够降低结石复发率。利胆消石合剂对复发率的具体影响作用,仍需要未来进行长期随访的临床试验来获得可靠结果。
| [1] |
DENG F, ZHOU M, LIU P P, et al. Causes associated with recurrent choledocholithiasis following therapeutic endoscopic retrograde cholangiopancreatography: a large sample sized retrospective study[J]. World Journal of Clinical Cases, 2019, 7(9): 1028-1037. DOI:10.12998/wjcc.v7.i9.1028 |
| [2] |
辜天慧. 242例胆道手术患者胆汁成分与胆石成因研究[J]. 川北医学院学报, 2016, 31(6): 838-840. GU T H. Study of bile composition and causes of gallstone in 242 cases of biliary sur-gery[J]. Journal of North Sichuan Medical College, 2016, 31(6): 838-840. |
| [3] |
陶应田, 孟翔凌, 徐阿曼, 等. β-葡萄糖醛酸酶与两类原发性胆总管结石形成关系的研究[J]. 肝胆外科杂志, 2012, 20(2): 122-126. TAO Y T, MENG X L, XU A M, et al. Study on the role of the activities of β-glucuronidase in the two type of primary cholelithiasis in the common bile duct[J]. Journal of Hepatobiliary Surgery, 2012, 20(2): 122-126. |
| [4] |
卞昊宇. 初发、复发型胆总管结石患者中医证候的比较研究[D]. 北京: 北京中医药大学, 2021. BIAN H Y. Comparative study on traditional Chinese medicine syndromes of patients with primary and recurrent common bile duct stones[D]. Beijing: Beijing University of Chinese Medicine, 2021. |
| [5] |
张立平, 赵玉清. 中医药治疗胆总管结石的研究进展[J]. 中国医药导报, 2019, 16(15): 37-40. ZHANG L P, ZHAO Y Q. Research progress of traditional Chinese medicine in the treatment of choledocholithiasis[J]. China Medical Herald, 2019, 16(15): 37-40. |
| [6] |
李鹏, 王拥军, 王文海. ERCP诊治指南(2018版)[J]. 中国实用内科杂志, 2018, 38(11): 1041-1072. LI P, WANG Y J, WANG W H. Chinese guidelines for ERCP(2018)[J]. Chinese Journal of Practical Internal Medicine, 2018, 38(11): 1041-1072. |
| [7] |
VÍTEK L, CAREY M C. New pathophysiological concepts underlying pathogenesis of pigment gallstones[J]. Clinics and Research in Hepatology and Gastroenterology, 2012, 36(2): 122-129. DOI:10.1016/j.clinre.2011.08.010 |
| [8] |
HO K J. Pathogenesis of the formation of pigment all stones[J]. Med Tbday, 1992, 155(11): 694-697. |
| [9] |
JEON J, LIM S U, PARK C H, et al. Restoration of common bile duct diameter within 2 weeks after endoscopic stone retraction is a preventive factor for stone recurrence[J]. Hepatobiliary & Pancreatic Diseases International, 2018, 17(3): 251-256. |
| [10] |
CHOE J W, KIM S Y, LEE D W, et al. Incidence and risk factors for postoperative common bile duct stones in patients undergoing endoscopic extraction and subsequent cholecystectomy[J]. Gastrointestinal Endoscopy, 2021, 93(3): 608-615. |
| [11] |
FUJIMORI N, IGARASHI H, ASOU A, et al. Endoscopic approach through the minor papilla for the management of pancreatic diseases[J]. World Journal of Gastrointestinal Endoscopy, 2013, 5(3): 81-88. |
| [12] |
ZHANG R C, LUO H, PAN Y L, et al. Rate of duodenal-biliary reflux increases in patients with recurrent common bile duct stones: evidence from barium meal examination[J]. Gastrointestinal Endoscopy, 2015, 82(4): 660-665. |
| [13] |
施维锦. 胆道外科学[M]. 上海: 上海科学技术出版社, 1993: 349-365. SHI W J. Biliary surgery[M]. Shanghai: Shanghai Scientific & Technical Publishers, 1993: 349-365. |
| [14] |
张海燕, 陈君千, 张望, 等. 脾虚证模型大鼠血清中血管活性肠肽和胆囊收缩素的变化及四君子汤的干预作用[J]. 吉林中医药, 2014, 34(6): 609-611. ZHANG H Y, CHEN J Q, ZHANG W, et al. Vasoactive intestinal peptide and cholecystokinin in serum of rat spleen deficiency model and the intervention effect of Sijunzi Decoction[J]. Jilin Journal of Chinese Medicine, 2014, 34(6): 609-611. |
| [15] |
赵莹, 王玉玫, 丁淑霞, 等. 四逆散对大鼠胆汁流量的影响[J]. 中医药信息, 2000, 17(4): 65-66. ZHAO Y, WANG Y M, DING S X, et al. Effect of Sini Powder on bile flow in rats[J]. Information on Traditional Chinese Medicine, 2000, 17(4): 65-66. |
| [16] |
刘玉萍, 邱小玉, 刘烨, 等. 茵陈的药理作用研究进展[J]. 中草药, 2019, 50(9): 2235-2241. LIU Y P, QIU X Y, LIU Y, et al. Research progress on pharmacological effect of Artemisiae Scopariae Herba[J]. Chinese Traditional and Herbal Drugs, 2019, 50(9): 2235-2241. |
| [17] |
黄盼, 周改莲, 周文良, 等. 广金钱草的化学成分、药理作用及质量控制研究进展[J]. 中华中医药学刊, 2021, 39(7): 135-139. HUANG P, ZHOU G L, ZHOU W L, et al. Research progress on chemical constituents, pharmacological effects and quality control of Desmodium styracifolium[J]. Chinese Archives of Traditional Chinese Medicine, 2021, 39(7): 135-139. |
| [18] |
曹凡, 宋忠兴, 胡锦航, 等. 金茵利胆复方制剂化学成分及药理作用的研究进展[J]. 中成药, 2021, 43(5): 1265-1268. CAO F, SONG Z X, HU J H, et al. Research progress on chemical constituents and pharmacological effects of Jinyin Lidan compound preparation[J]. Chinese Traditional Patent Medicine, 2021, 43(5): 1265-1268. |
| [19] |
樊佳, 刘晓谦, 彭博, 等. 中药鸡内金的现代研究进展[J]. 世界中医药, 2021, 16(17): 2542-2547. FAN J, LIU X Q, PENG B, et al. Modern research progress of galli gigerii endothelium corneum[J]. World Chinese Medicine, 2021, 16(17): 2542-2547. |
| [20] |
张祺嘉钰, 赵佩媛, 孙静, 等. 山楂的化学成分及药理作用研究进展[J]. 西北药学杂志, 2021, 36(3): 521-523. ZHANG Q J Y, ZHAO P Y, SUN J, et al. Research progress on chemical constituents and pharmacological action of hawthorn[J]. Northwest Pharmaceutical Journal, 2021, 36(3): 521-523. |
| [21] |
黄亮辉, 苏琪, 赵婷婷, 等. 海金沙的化学成分及药理活性研究进展[J]. 中药材, 2011, 34(1): 150-154. HUANG L H, SU Q, ZHAO T T, et al. Research progress on chemical constituents and pharmacological activities of Lygodium japonicum[J]. Journal of Central University of Finance & Economics, 2011, 34(1): 150-154. |
 2023, Vol. 42
2023, Vol. 42