文章信息
- 韩佳彤, 田菲, 林方圆, 林鹏展
- HAN Jiatong, TIAN Fei, LIN Fangyuan, LIN Pengzhan
- 扶正散结方联合顺铂对腹水瘤小鼠免疫调节作用的研究
- Effect of Fuzheng Sanjie Recipe on H22 liver ascitic tumor mice and its immunological regulation
- 天津中医药大学学报, 2023, 42(3): 334-338
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(3): 334-338
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.03.11
-
文章历史
收稿日期: 2023-02-09
2. 国家中医针灸临床医学研究中心,天津 300381
2. National Clinical Research Center for Chinese Medicine Acupuncture and Moxibustion, Tianjin 300381, China
恶性腹水是肿瘤晚期患者常见并发症,多见于肺癌、乳腺癌、卵巢癌等。腹腔穿刺引流、利尿剂等方法可暂时缓解患者腹胀、腹痛、呼吸困难等症状[1],但对控制恶性腹水的进展疗效不佳。中药防治肿瘤历史悠久,且具有提高生活质量、毒副反应小、成本低等优势,从传统中药入手不失为一个新的突破口[2]。前期研究表明,扶正散结方可以提高荷瘤小鼠的抑瘤率及免疫功能[3-4]。本研究旨在探讨扶正散结方联合顺铂对H22腹水瘤小鼠的治疗效果及免疫调节功能的影响。
1 材料与方法 1.1 动物与细胞实验动物选取SPF级昆明小鼠40只,均为雌性,6~8周龄,体质量18~22 g,购于斯贝福(北京)生物技术有限公司。动物资格许可证号:SCXK(京)2019-0010。肿瘤细胞由H22腹水型肝癌荷瘤小鼠腹水分离而来。
1.2 药物扶正散结方由黄芪、当归、冬虫夏草、白花蛇舌草、龟板、鳖甲组成。处方药材均购自天津市医药公司,经天津中医药大学张建岭教授鉴定,符合《中华人民共和国药典》2010年版标准。顺铂,齐鲁制药有限公司产品,批号:0F0156B02,溶于200 mL生理盐水,制成0.5 g/L溶液,避光保存。
1.3 扶正散结方制剂制备按固定比例称取药物,碾碎后用95%乙醇浸泡48 h,取出晾干后放入60 ℃恒温干燥箱烤12 h,粉碎机粉碎后过60目筛网,得干燥药物粉末。然后用8倍量蒸馏水进行热回流提取2次,每次5 h,过滤,药渣再用95%乙醇进行热回流提取2 h,自然冷却后,将乙醇水溶液倒出,过滤药渣,与水提物合并进行真空减压浓缩干燥得到制备样品,并制备成合剂,浓缩至2 g/mL,于4 ℃冰箱贮存备用。
1.4 小鼠腹水瘤模型制备取稳定传代至第7代的肝癌H22腹水瘤小鼠,无菌抽取腹水6 mL,离心并用生理盐水稀释,调节腹水细胞悬液浓度为2×107个/mL,无菌条件下向小鼠腹腔注射0.2 mL(约含H22细胞4×106个)。接种后观察腹部膨胀程度,注射后约5 d小鼠出现腹部鼓胀,B超检查可见液体暗区,提示腹水形成,腹水模型构建成功。
1.5 分组与给药将40只小鼠随机分为空白对照组、荷瘤对照组、顺铂组、中药联合顺铂组,每组10只。除空白对照组外,其余小鼠均于第0天制作腹水瘤模型。5 d后观察小鼠出现腹水情况,第6天开始药物干预,给药量和给药方法根据“人和动物间体表面积折算的等效剂量比率表”计算得出。空白对照组:生理盐水0.4 mL灌胃,每日1次;荷瘤对照组:生理盐水0.4 mL灌胃,每日1次;顺铂组:一次性腹腔注射顺铂溶液0.2 mL(5 mg/kg),每周3次;中药联合顺铂组:予扶正散结方药0.4 mL(2 g/mL)灌胃,每日1次,同时腹腔注射顺铂溶液0.2 mL(5 mg/kg),每周3次。2周后,采血并处死小鼠。
2 实验观察指标 2.1 小鼠生存状态每日观察各组小鼠的体态、活跃程度、饮食、毛色等变化。
2.2 小鼠体质量及腹围测量每日称量小鼠体质量,测量小鼠腹围。将小鼠水平仰卧位固定放置,测量其髋关节上侧腹部最膨隆部位圆周长,记录体质量及腹围值,绘制小鼠平均体质量、腹围变化曲线。
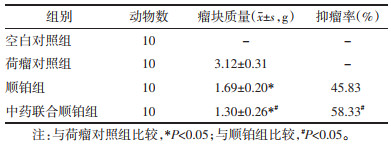
2.3 瘤块质量及抑瘤率的测定末次给药24 h后,取小鼠眼球血备用,后脱颈椎处死小鼠,迅速剥取瘤块标本,称取质量,计算抑瘤率。肿瘤抑制率=(1-药物干预组肿瘤平均质量/荷瘤对照组肿瘤平均质量)×100%。
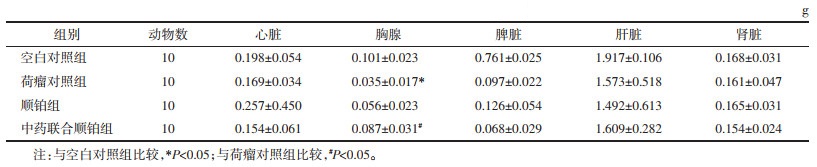
2.4 小鼠脏器质量测量处死小鼠后,迅速剥取心脏、胸腺、脾脏、肝脏、肾脏,称量其净质量。分别根据脾脏及胸腺质量与体质量之比,计算脾脏指数及胸腺指数。
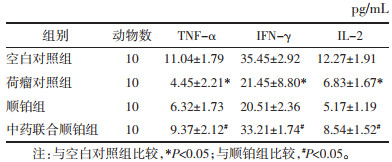
2.5 血清TNF-α、IFN-γ和IL-2水平测定每只取眼球血0.5 mL,EDTA-K2抗凝,置离心机中以3 000 r/min离心20 min(离心半径10 cm),收集上层血清,按ELISA操作试剂盒说明测定血清肿瘤坏死因子-α(TNF-α)、干扰素-γ(IFN-γ)和白细胞介素-2(IL-2)水平。
2.6 统计学方法采用SPSS 26.0软件进行数据分析,所有数据均进行正态性和方差齐性检验,计量资料用均数±标准差(x±s)表示,组间比较采用单因素方差分析。P < 0.05为差异有统计学意义。
3 结果 3.1 各组小鼠生存状态比较接种后第5日,除空白对照组外,其余各组小鼠均出现腹水,荷瘤组与顺铂组逐渐出现毛发稀疏、色暗无光、行动迟缓和进食量减少等现象。中药联合顺铂组小鼠表现为毛亮牢固,活动基本正常。
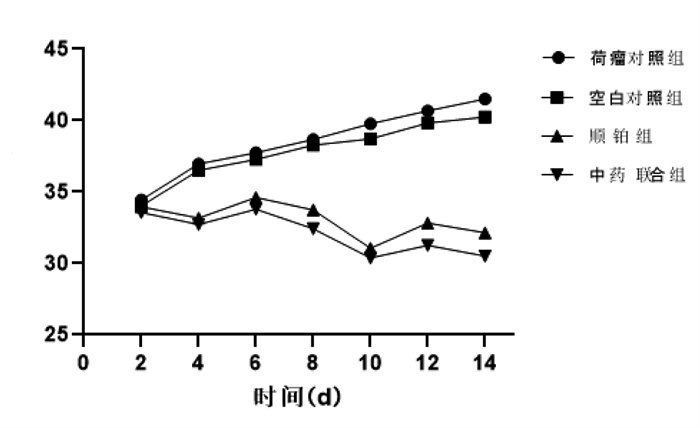
3.2 小鼠体质量及腹围测量与空白对照组比较,荷瘤对照组小鼠体质量增长迅速;与荷瘤对照组比较,顺铂组小鼠注射顺铂后体质量下降明显(P < 0.05);与顺铂组比较,中药联合顺铂组小鼠体质量下降幅度小(P < 0.05),体质量恢复能力较强,见图 1。
|
| 图 1 各组小鼠体质量变化趋势(x±s,n=10) |
与空白对照组比较,荷瘤对照组小鼠于第6天腹围开始迅速增长(P < 0.05)。与荷瘤对照组比较,顺铂组、中药联合顺铂组小鼠均可减缓腹围增长趋势(P < 0.05),见图 2。
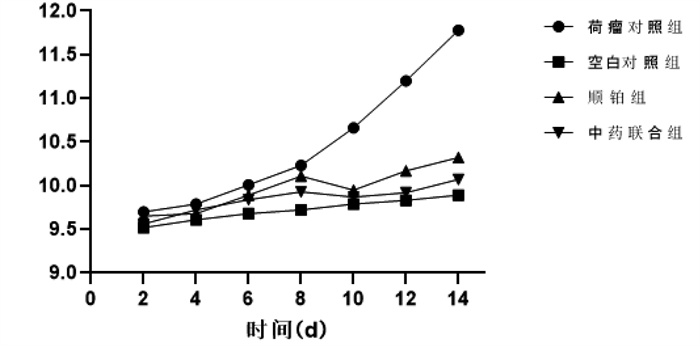
|
| 图 2 各组小鼠腹围变化情况(x±s,n=10) |
顺铂组、中药联合顺铂组均有抑瘤作用,各组平均瘤块质量比较结果为荷瘤对照组 > 顺铂组 > 中药联合顺铂组,抑瘤率表现相反趋势,且中药联合顺铂组的抑瘤率优于顺铂组(P < 0.05),提示扶正散结方具有软坚散结之效,在减轻瘤块质量、提高抑瘤率方面起着积极作用。见表 1。
与空白对照组比较,各组荷瘤小鼠心脏、脾脏、肝脏、肾脏质量未发生明显改变,胸腺质量减轻(P < 0.05)。与顺铂组比较,中药联合顺铂组小鼠胸腺质量增加(P < 0.05),提示荷瘤小鼠的免疫功能在扶正散结方的干预下有了一定改善。见表 2。
荷瘤对照组小鼠血清中TNF-α、IFN-γ、IL-2含量均较空白对照组低,差异有统计学意义(P < 0.05)。与顺铂组比较,中药联合顺铂组小鼠血清中TNF-α、IFN-γ、IL-2水平升高,差异有统计学意义(P < 0.05)。见表 3。
恶性腹水是肿瘤晚期常见并发症,严重影响患者生存质量。中医将恶性腹水归于“鼓胀”范畴,病机为正气亏虚,邪毒犯肺,肺失宣降,气机不畅,气滞血瘀痰凝,阻塞脉络,肺、脾、肾通调运化、开合失司,三焦气化失宣,痰浊积聚而为饮,津液不布而成腹水。古代医籍中多用攻邪逐水法治疗,而肿瘤患者多本虚标实,应扶正祛邪以逐水。扶正散结方是基于“养正积自消”治疗原则下的自拟方剂,治以消癥化积、和解表里、行气活血。扶正散结方中黄芪补气健脾为君药;当归补血活血,冬虫夏草补肾益肺共为臣药;白花蛇舌草清热解毒为佐药;鳖甲、龟板善治开阖失常之病为使药,均有软坚散结、补肾滋阴之效。前期研究提示扶正散结方具有抑瘤、增效减毒作用[3-4]。现代药理学研究表明,黄芪水煎提取物、白花蛇舌草均能提高IL-2水平,提高自然杀伤细胞(NK细胞)活性及杀伤肿瘤细胞的能力,增强机体免疫功能进而发挥抗肿瘤作用[5-10]。
恶性腹水的发生发展与机体免疫功能密切相关,本次实验结果表明:腹水瘤小鼠建模5 d后,腹围及体质量迅速增长,中药联合顺铂组较顺铂组腹围及体质量增长缓慢;各组小鼠生存状态比较,中药联合顺铂组毛亮牢固,活动基本正常,提示此方可改善小鼠的生活状态,对控制小鼠体质量、腹围有着良好的治疗效果;同荷瘤对照组相比,顺铂组、中药联合顺铂组对瘤体生长均有抑制作用,且中药联合顺铂组抑瘤作用优于顺铂组,差异有统计学意义,提示扶正散结方有软坚散结之效,在缩小瘤体、提高抑瘤率方面起着积极作用;称量各脏器净质量发现,各组小鼠心脏、脾脏、肝脏、肾脏净质量比较未见明显差异,各组荷瘤小鼠体质量减轻,中药联合顺铂组小鼠胸腺质量增加,提示此方对免疫器官具有调节作用,脾脏的质量变化不明显,有待扩大实验开展进一步研究。
现代免疫学研究表明,在肿瘤免疫微环境的正性调控中,TNF-α、IFN-γ和IL-2等免疫因子水平与机体免疫能力关系密切。TNF、IL-2等分子通过炎性反应,使血管通透性增强,TNF-α、IL-2通过高渗性血管进入腹腔,使肿瘤患者恶性腹水中TNF-α及IL-2水平异常增高。IL-2可以诱导NK细胞和T细胞产生IFN-γ[11],促进辅助性T细胞(Th1细胞)增殖,提高NK细胞的细胞毒作用,促进细胞毒性T细胞(CTL细胞)的形成[12]。CTL细胞分泌TNF-α、IFN-γ等细胞因子参与免疫调节[13],TNF-α能在不损伤正常细胞前提下,直接杀伤肿瘤细胞,还可以通过刺激T淋巴细胞产生抗体和细胞因子,发挥诱导肿瘤细胞凋亡的作用[14]。作为机体抗肿瘤第1道防线的NK细胞被IL-2、IFN-γ等细胞因子活化后,其抗病毒与抗肿瘤作用显著提高。本次实验结果表明,荷瘤对照组小鼠血清中TNF-α、IFN-γ、IL-2含量均较空白对照组低,中药联合顺铂组较顺铂组TNF-α、IFN-γ、IL-2水平升高(P < 0.05),提示扶正散结方联合顺铂可以提高小鼠血清TNF-α、IFN-γ和IL-2水平,促进肿瘤免疫微环境的正性调控,有助于提高免疫功能以实现抗肿瘤的目的。
综上所述,扶正散结方能够减少肝癌H22腹水瘤小鼠的腹水量,通过上调血清中TNF-α、IFN-γ、IL-2水平来促进肿瘤免疫微环境的正性调控,提高小鼠的免疫功能,有效抑制肿瘤生长。
| [1] |
SMITH E M, JAYSON G C. The Current and future management of malignant ascites[J]. Clinical Oncology, 2003, 15(2): 59-72. DOI:10.1053/clon.2002.0135 |
| [2] |
KATO A, KATAOKA H, YANO S, et al. Maltotriose conjugation to a chlorin derivative enhances the antitumor effects of photodynamic therapy in peritoneal dissemination of pancreatic cancer[J]. Molecular Cancer Therapeutics, 2017, 16(6): 1124-1132. DOI:10.1158/1535-7163.MCT-16-0670 |
| [3] |
黎金华, 田菲, 邱崇笙, 等. 扶正散结方调控Lewis肺癌小鼠TAMs免疫重塑作用的相关研究[J]. 中国中药杂志, 2015, 40(6): 1161-1165. LI J H, TIAN F, QIU C S, et al. Relevant studies on effect of Fuzheng Sanjie Recipe in regulating immune microenvironment remodeling of TAMs in lewis lung cancer mice[J]. China Journal of Chinese Materia Medica, 2015, 40(6): 1161-1165. |
| [4] |
田菲, 贾英杰, 陈军, 等. 扶正液对于肺癌患者的肿瘤标志物CYFRA及免疫功能的影响[J]. 肿瘤研究与临床, 2004, 16(6): 378-379. TIAN F, JIA Y J, CHEN J, et al. Therapeutic effect of CYFRA and immunity with Fuzheng Ye for lung cancer[J]. Cancer Research and Clinic, 2004, 16(6): 378-379. DOI:10.3760/cma.j.issn.1006-9801.2004.06.007 |
| [5] |
QI Y, GAO F, HOU L F, et al. Anti-inflammatory and immunostimulatory activities of astragalosides[J]. The American Journal of Chinese Medicine, 2017, 45(6): 1157-1167. DOI:10.1142/S0192415X1750063X |
| [6] |
姚远, 仝立国, 冯玛莉, 等. 黄芪-莪术不同提取物对小鼠H22荷瘤的抑制作用及免疫调节的影响[J]. 中华临床医师杂志(电子版), 2016, 10(22): 3396-3400. YAO Y, TONG L G, FENG M L, et al. Effects of different extracts of Astragalus and Rhizoma Curcumae on H22 tumor-bearing and immunological regulation[J]. Chinese Journal of Clinicians (Electronic Edition), 2016, 10(22): 3396-3400. DOI:10.3877/cma.j.issn.1674-0785.2016.22.018 |
| [7] |
ZANG W H, BIAN H, HUANG X Z, et al. Traditional Chinese medicine(TCM) Astragalus membranaceus and Curcuma wenyujin promote vascular normalization in tumor-derived endothelial cells of human hepatocellular carcinoma[J]. Anticancer Research, 2019, 39(6): 2739-2747. DOI:10.21873/anticanres.13400 |
| [8] |
LI W F, SONG K D, WANG S P, et al. Anti-tumor potential of astragalus polysaccharides on breast cancer cell line mediated by macrophage activation[J]. Materials Science and Engineering, 2019, 98(7): 685-695. |
| [9] |
马河, 程艳琳, 张金杰, 等. 白花蛇舌草总多糖的分离纯化、结构鉴定及初步免疫活性分析[J]. 中国实验方剂学杂志, 2014, 20(22): 37-40. MA H, CHENG Y L, ZHANG J J, et al. Isolation, purification, structural identification and preliminary immunological activity analysis of total polysaccharides from Hedyotis diffusa[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2014, 20(22): 37-40. |
| [10] |
瞿俊勇, 田梦, 贺建华, 等. 白花蛇舌草多糖对免疫抑制小鼠的免疫调节作用研究[J]. 中药材, 2015, 38(9): 1942-1945. QU J Y, TIAN M, HE J H, et al. Study on immunomodulatory effect of Hedyotis diffusa polysaccharide on immunosuppressed mice[J]. Journal of Chinese Medicinal Materials, 2015, 38(9): 1942-1945. |
| [11] |
TSENG P C, CHEN C L, SHAN Y S, et al. An increase in galectin-3 causes cellular unresponsiveness to IFN-γ-induced signal transduction and growth inhibition in gastric cancer cells[J]. Oncotarget, 2016, 7(12): 15150-15160. DOI:10.18632/oncotarget.7750 |
| [12] |
CHAURASIYA S, HEW P, CROSLEY P, et al. Breast cancer gene therapy using an adenovirus encoding human IL-2 under control of mammaglobin promoter/enhancer sequences[J]. Cancer Gene Therapy, 2016, 23(6): 178-187. DOI:10.1038/cgt.2016.18 |
| [13] |
陈一鸣, 尤胜国. T淋巴细胞识别的肿瘤抗原[J]. 国外医学(输血及血液学分册), 1995, 16(6): 321-324. CHEN Y M, YOU S G. Tumor antigen recognized by T lymphocytes[J]. Foreign Medicine: Blood Transfusion and Hematology Section, 1995, 16(6): 321-324. |
| [14] |
李海霞, 张伟. 红景天多糖对宫颈癌U14模型小鼠的治疗作用及机制的实验研究[J]. 中药材, 2017, 40(6): 1453-1456. LI H X, ZHANG W. Experimental study on therapeutic effect and mechanism of Rhodiola polysaccharide on U14 model mice with cervical cancer[J]. Journal of Chinese Medicinal Materials, 2017, 40(6): 1453-1456. |
 2023, Vol. 42
2023, Vol. 42