文章信息
- 宋旭楠, 闫宏丽, 马喆, 张兵, 张瀛, 秦欢, 张钰坤, 皮佳鑫, 刘志东
- SONG Xunan, YAN Hongli, MA Zhe, ZHANG Bing, ZHANG Ying, QIN Huan, ZHANG Yukun, PI Jiaxin, LIU Zhidong
- 叶酸靶向修饰载新藤黄酸纳米结构脂质载体的研究
- Study on folic acid-modifed nanostructured lipid carriers loaded with gambogenic acid
- 天津中医药大学学报, 2023, 42(3): 347-354
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(3): 347-354
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.03.13
-
文章历史
收稿日期: 2023-02-05
2. 天津中医药大学,现代中药发现与制剂技术教育部工程研究中心,天津 301617
2. Engineering Research Center of Modern Chinese Medicine Discovery and Preparation Technique, Ministry of Education, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
恶性肿瘤作为一种恶性疾病,是世界范围内极其主要的死亡原因之一。乳腺癌是女性中最常诊断的、最常见的浸润性肿瘤,发病率仅次于肺癌[1-2],因此攻克乳腺癌成为保护当代女性身心健康的重要内容。目前发现许多具有抗肿瘤活性的中药单体,如藤黄酸、姜黄素、苦参碱等,与单靶点化学药物相比,中药抗肿瘤成分通过多靶点、多通路的协同调控作用为肿瘤的预防与治疗提供了新思路[3]。新藤黄酸(GNA)是一种从汉藤(Garcinia hanburyi)干燥树脂中分离得到的具有细胞毒性的氧杂蒽酮[4],可以抑制某些肿瘤细胞的增殖和生长,例如结肠癌[5]、乳腺癌[6]和肝癌[7]等,但是溶解度低、半衰期短和较差的肿瘤特异性限制了其临床应用。
纳米结构脂质载体(NLC)是继传统纳米载体(纳米乳、脂质体等)后在固体脂质纳米粒(SLN)基础上开发的最新一代脂质纳米载体[8],表现出了更好的生物相容性。NLC内部是由固体脂质与液体脂质组成的混合物,液体脂质的加入增加了其对药物分子的包容性,显著提高了药物的包封效率和负载能力,且具有更好的稳定性和控释特性。因此,纳米结构脂质载体可运用于特殊领域,如靶向治疗[9-10]。
叶酸受体(FR)是一种糖基磷脂酰肌醇连接蛋白,在许多类型的肿瘤细胞表面高度表达,但在正常组织中表达正常[11]。叶酸(FA)是一种小分子维生素,对FR表现出高度亲和力,并且没有免疫原性[12],研究表明使用FA可以实现肿瘤靶向治疗的潜力[13-14]。
基于此,本实验拟将不溶性抗肿瘤药物GNA包载在NLC中,并用FA加以修饰,赋予其肿瘤靶向性,提高GNA在体内的生物利用度的同时降低全身的毒副作用,并在体内外对该递送系统进行综合评估。
1 仪器与材料 1.1 仪器Agient1260型高效液相(HPLC)色谱仪(VWD检测器,美国安捷伦公司);高速冷冻离心机(ST16R,美国赛默飞世尔科技有限公司);磁力加热搅拌器(EMS-8B,天津欧诺仪器仪表有限责任公司);激光粒度分析仪(Nano ZS型,英国Malvern公司);场发射透射电子显微镜(JEM 1200EX,日本电子株式会社);差示扫描量热仪(Jade DSC,美国Perkin Elmer公司);酶标仪(Infinite F50,瑞士TECAN);二氧化碳(CO2)恒温培养箱(160i,Thermo);高内涵成像仪(In Cell Analysis 2500,GE Healthcare);小动物活体成像系统(IVIS,Kodak In - VivoTX,Kodak)。
1.2 试剂GNA(宝鸡市辰光生物科技有限公司,纯度 > 98%,HN045248198);大豆磷脂(上海艾伟拓医药科技有限公司);聚氧乙烯(40)硬脂酸酯(Myrj 52,美国Sigma公司);酸/癸酸三甘油酯(Miglyol 812,北京凤礼精求商贸有限公司);山嵛酸甘油酯(Compritol 888 ATO,广州市天润药业有限公司);DSPE-PEG2000-FA(上海艾伟拓医药科技有限公司);香豆素-6(美国Sigma公司,S2137139,98%);Hoechst 33342(Solarbio,批号:B8040);RMPI -1640培养基(Corning,10-040-CVR);胎牛血清(FBS,BI,04-001-1ACS);0.25%胰酶+0.02%乙二胺四乙酸二钠(EDTA,Gibco,25200-056);双抗(10 000 U青霉素-10 000 U链霉素,Gibco,15140-122);磷酸缓冲盐溶液(PBS,Corning,21-040-CV);八肽胆囊收缩素(CCK-8)试剂盒(Dojindo Lab,CK04);三氯甲烷(分析纯,天津康科德科技有限公司);乙醇(分析纯,天津康科德科技有限公司);甲醇(色谱纯,Fisher chemical公司);乙腈(色谱纯,Fisher chemical公司)。
1.3 细胞人乳腺癌MDA-MB-231细胞、小鼠乳腺癌4T1细胞均购自ATCC。
1.4 动物BALB/c裸鼠(雌性,6~8周,17~19 g)和BALB/c小鼠(雌性,6~8周,17~19 g)购自北京华阜康生物科技有限公司,许可证号:SCXK(京)2019- 0008。
相关研究遵照动物实验原则进行,并得到天津中医药大学动物研究中心支持,实验操作过程得到天津中医药大学动物伦理委员会认可(伦理编号:TCM-LAEC2020025)。
2 实验方法 2.1 NLC的制备通过乳化蒸发-低温固化法[15]制备新藤黄酸纳米结构脂质载体(GNA-NLC)。制备FA修饰的新藤黄酸纳米结构脂质载体(FA-GNANLC)时,二硬脂酰磷脂酰乙醇胺(DSPE)-聚乙二醇(PEG)2000-FA替代等量的大豆磷脂溶解在油相中,其余过程保持不变。
2.2 FA-GNA-NLC的表征 2.2.1 粒径、Zeta电位、形态及包封率的测定取适量制剂稀释,通过激光粒度分析仪测定FA修饰前后纳米制剂的粒径、粒径分布及Zeta电位,采用透射电子显微镜观察FA修饰前后纳米制剂的形态变化,采用超滤离心-HPLC法测定FA-GNA-NLC的包封率[16]。
2.2.2 差示扫描量热分析(DSC)精密称取GNA对照品、空白NLC冻干粉、GNA-NLC冻干粉、FAGNA-NLC冻干粉、GNA对照品与空白NLC冻干粉的物理混合物(GNA对照品∶空白NLC冻干粉=2∶1)约5 mg,置于铝制样品盘中压制后,在DSC样品室中以空铝钵为参比进行测试。设置仪器参数如下:加热速率为10 ℃/min,扫描范围30~300 ℃,记录数据与图谱。
2.3 肿瘤细胞摄入研究以香豆素-6(Cou-6)为荧光探针,利用高内涵分析系统考察人乳腺癌MDAMB-231细胞和小鼠乳腺癌4T1细胞对Cou-6溶液(Cou-6-Sol)、Cou-6纳米结构脂质载体(Cou-6- NLC)和叶酸修饰的Cou-6纳米结构脂质载体(FACou-6-NLC)的摄入量。将4T1细胞、MDA-MB0231细胞接种在黑色96孔板中,37 ℃、5%CO2条件下孵育24 h。将含有等浓度Cou-6的Cou-6-Sol、Cou-6- NLC和FA -Cou -6 -NLC分别加于4T1细胞和MDA-MB-23细胞中,分别于孵育4、8 h时取出96孔板,加入50 μL Hoechst 33342溶液,继续孵育30 min染色细胞核,然后使用100 μL的PBS洗涤细胞3次,去除游离的探针溶液,利用高内涵分析系统进行定性与定量分析。
2.4 体外抗肿瘤研究以小鼠乳腺癌4T1细胞作为体外肿瘤模型,利用CCK-8法检测各组制剂处理后的细胞活性。将4T1细胞接种到96孔板中孵育24 h,然后分别向每组加入含有0.35~1.42 μg/mL GNA的GNA-Sol、GNA-NLC及FA-GNA-NLC。共同孵育24 h后,吸出培基并加入100 μL 10%的CCK-8溶液,孵育1 h后在450 nm波长下测定吸光度。根据下列公式计算细胞存活率:细胞存活率=([As-Ab)(/ Ac-Ab)]×100%,其中As、Ac、Ab分别指实验组、对照组、空白组的吸光度。
2.5 体内组织分布研究利用小鼠乳腺癌4T1细胞构建乳腺癌裸鼠模型[17],采用小动物活体成像系统(IVIS),以DiR为荧光探针考察DiR-Sol、DiR-NLC和FA-DiR-NLC在荷瘤裸鼠体内的组织分布。将裸鼠随机分为生理盐水组、DiR-Sol组、DiR-NLC组和FA-DiR-NLC组,每组6只,肿瘤体积至200 mm3时,尾静脉注射DiR制剂(0.05 mg/kg)。分别在给药1、4、8、24、36 h时麻醉裸鼠,于IVIS内拍照记录体内的荧光强度。
2.6 体内抗肿瘤研究按“2.5”项的荷瘤方式构建小鼠乳腺癌模型,将小鼠随机分为5组:生理盐水组、顺铂组、GNA-Sol组、GNA-NLC组和FAGNA-NLC组,每组10只。生理盐水组给药剂量为200 μL/次,顺铂组注射剂量为2 mg/kg、200 μL/次,余下3组分别按照GNA给药剂量为2 mg/kg、200 μL/次注射GNA-Sol、GNA-NLC及FA-GNANLC,隔日给药,每次给药前测量肿瘤体积,共给药7次。于最后1次给药24 h后处死小鼠,取出心、肝、脾、肺、肾等主要器官用于组织病理学研究,取出肿瘤组织称取质量,按照下列公式计算肿瘤抑制率:TIR=([MC-MT)/MC]×100%,其中MC、MT分别为模型组、治疗组的平均肿瘤质量。
2.7 统计学分析统计分析及半抑制浓度(IC50)值计算由Origin 2018和GraphPad Prism 8.0完成,P < 0.05为差异有统计学意义。
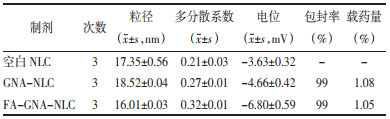
3 实验结果 3.1 粒径、Zeta电位、形态及包封率空白NLC、GNANLC及FA-GNA-NLC平均粒径为(16~19)nm,电位为(-7~-3)mV。制备所得NLC粒径较小,体系稳定,PDI结果表明纳米载体粒径分布均匀。包封率99%表明GNA几乎都被包载在NLC体系中,且FA修饰不影响GNA的包封率。见表 1。
外观形貌可见空白载体(A)呈圆球形,粒径均一,分散性良好,包载GNA后的载体(B)及靶向修饰FA的载体(C)粒径无明显变化,形态圆整,但与GNA-NLC相比,FA修饰载体的粒径稍有下降。见图 1。

|
| 注:A为空白NLC,B为GNA-NLC,C为FA-GNA-NLC。 图 1 空白NLC、GNA-NLC、FA-GNA-NLC的透射电镜图 |
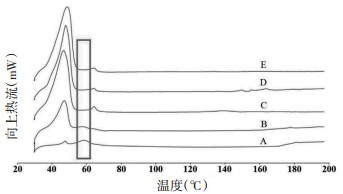
如图 2所示,A为GNA对照品,可见其在58.64 ℃处出现1个吸热峰;C为空白NLC冻干粉,其吸热峰出现在46.58 ℃和64.46 ℃处,这两个吸热峰为脂质材料以及冻干保护剂的吸热峰;B为GNA对照品与空白NLC冻干粉的物理混合物(比例为2∶1),存在GNA对照品和空白NLC冻干粉的特征吸热峰;D、E分别为GNA-NLC冻干粉和FAGNA-NLC冻干粉,其图谱中只存在制剂特征吸热峰,而无GNA特征吸热峰出现,说明GNA以非晶体形式包载在NLC中。
|
| 注:A为GNA,B为物理混合物,C为空白NLC冻干粉,D为GNANLC,E为FA-GNA-NL。 图 2 GNA、物理混合物、空白NLC冻干粉、GNA-NLC、FA-GNA-NL的DSC图 |
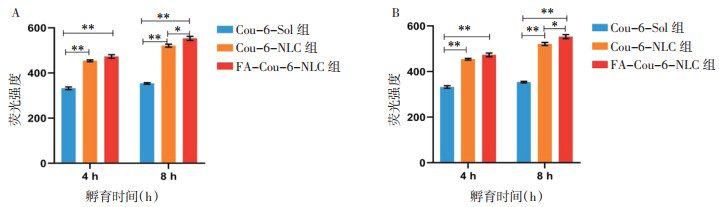
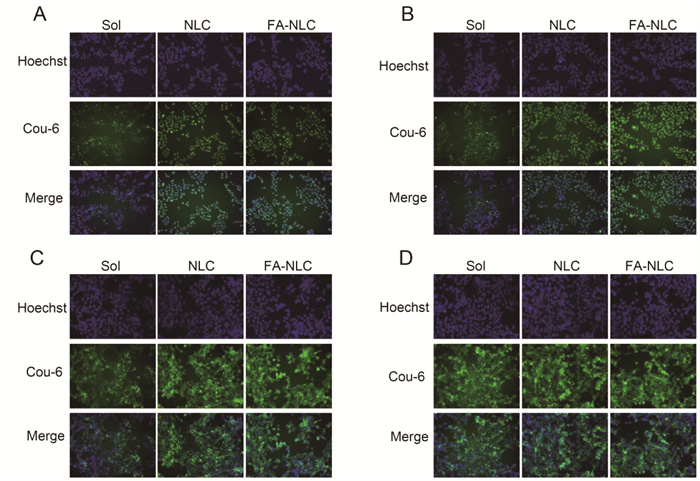
如图 3所示,在MDA-MB-231细胞和4T1细胞中,在相同的孵育时间下,NLC组的摄入量高于Sol组,即荧光强度FA-Cou-6-NLC>Cou-6-NLC>Cou-6-Sol,表明将Cou-6装载到NLC中可以表现出更好的细胞内化,FA修饰能增强NLC进入肿瘤细胞的能力,这可能是由于溶液组通过被动扩散的方式进入细胞,而NLC与FA-NLC通过非特异性内吞及受体介导的特异性内吞作用进入细胞。在孵育4 h时,FA-NLC组与NLC组的摄入无显著差异,这可能是由于孵育时间较短导致的,将孵育时间延长至8 h时,FA-NLC组的摄入明显强于NLC组。见图 4。
|
| 注:A为Cou-6在MDA-MB-231细胞中的摄入结果,B为Cou-6在4T1细胞中的摄入结果;组间比较,*P<0.05,**P<0.001。 图 3 Cou-6制剂的细胞摄入结果(x±s,n=3) |
|
| 注:A为MDA-MB-231细胞4 h摄入图,B为MDA-MB-231细胞8 h摄入图,C为4T1细胞4 h摄入图,D为4T1细胞8 h摄入图。 图 4 Cou-6制剂的细胞摄入图 |
由图 5可知,GNA -Sol、GNA-NLC、FA-GNA-NLC对肿瘤细胞的细胞毒性具有浓度依赖性,随着GNA浓度增大,各组细胞活力不断降低。当GNA浓度相同、孵育时间一致时,4T1细胞存活率表现为GNA-Sol组 > GNA-NLC组 > FA-GNA-NLC组。这表明将GNA包载于NLC中能提高GNA的细胞毒性,FA修饰后增强了4T1细胞的细胞摄取,进一步改善了GNA的细胞毒性,这与细胞摄入的实验结果一致。
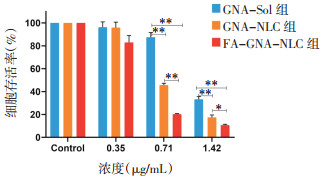
|
| 注:组间比较,*P<0.05,**P<0.001。 图 5 细胞存活率(x±s,n=3) |
由图 6可知,从注射4 h开始,可以清楚地观察到DiR-NLC组和FA-DiR-NLC组的DiR开始在肿瘤组织中大量蓄积,而DiR-Sol组则主要通过血液循环将DiR分布在肝脏组织中。在余下的时间点中,DiR-NLC组和FA-DiR-NLC组裸鼠肿瘤中的荧光强度随时间逐渐增加,FA-DiRNLC组的荧光强度始终大于DiR-NLC组,NLC在肿瘤中的蓄积可能与EPR效应有关,而FA-NLC具有主动靶向的能力,更加有助于将药物递送至肿瘤组织。与DiR-NLC组和FA-DiR-NLC组不同的是,DiR-Sol组在8 h后荧光强度逐渐降低,表明药物包载进NLC后不仅增加其肿瘤靶向性,且能延长其半衰期。
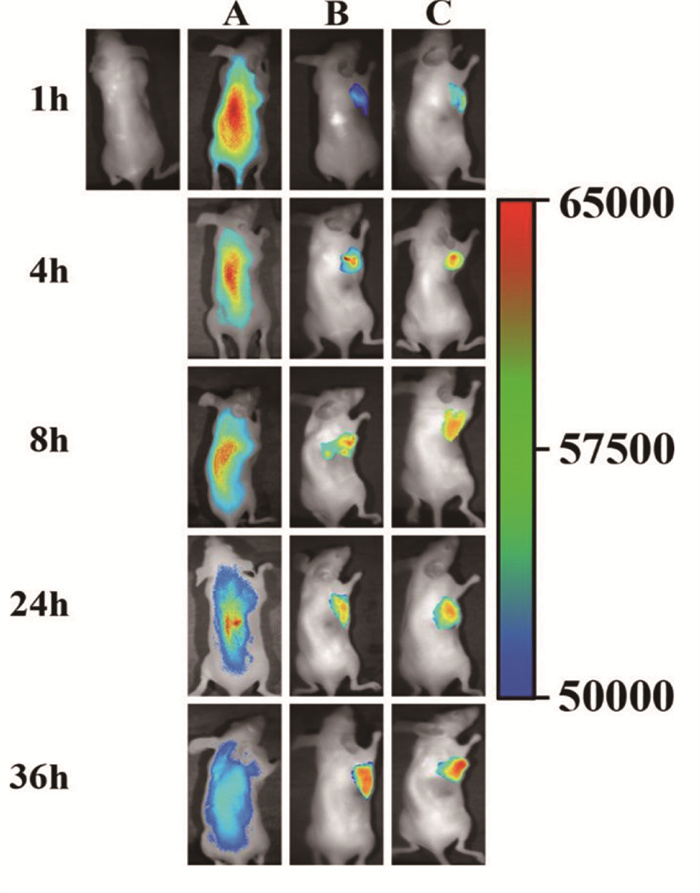
|
| 注:A为DiR-Sol组,B为DiR-NLC组,C为FA-DiR-NLC组。 图 6 DiR在小鼠体内组织分布图 |
本研究将GNA包载在NLC中并加以FA修饰,旨在提高GNA的抗肿瘤效果并减轻治疗过程中的不良反应。给药过程中小鼠肿瘤体积变化及给药结束后离体肿瘤组织如图 7所示,可以看到在生理盐水组中,肿瘤快速生长,而在GNA-Sol组中的生长受到抑制。同时,与GNA-Sol组相比,GNA-NLC组肿瘤生长缓慢,说明纳米载体增强了GNA的抗肿瘤作用,并且FA修饰后进一步增强了纳米载体的抗肿瘤活性。最终顺铂组、FAGNA-NLC组、GNA-NLC组、GNA-Sol组的肿瘤生长抑制率(TIR)分别为84.35%、74.17%、77.13%和34.58%。尽管顺铂组表现出最高的肿瘤抑制率,但从苏木精-伊红(HE)染色结果(图 8)可以看出顺铂不只对肿瘤组织具有损伤作用,对其他脏器均有一定程度损伤,相比之下,FA-GNA-NLC没有引起明显的全身毒性,说明FA修饰后不仅增强了纳米载体的肿瘤靶向性,提高了肿瘤抑制率,并且降低了不良反应。
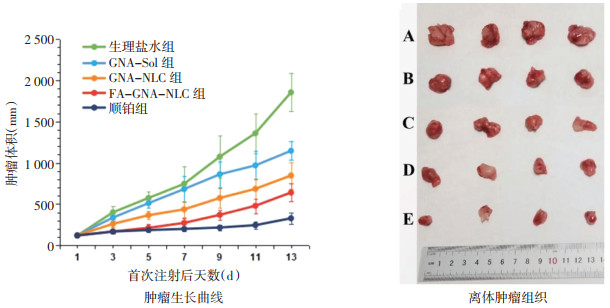
|
| 注:A为生理盐水组,B为GNA-Sol组,C为GNA-NLC组,D为FA-GNA-NLC组,E为顺铂组。 图 7 各组小鼠肿瘤生长曲线和离体肿瘤组织(x±s,n=10) |
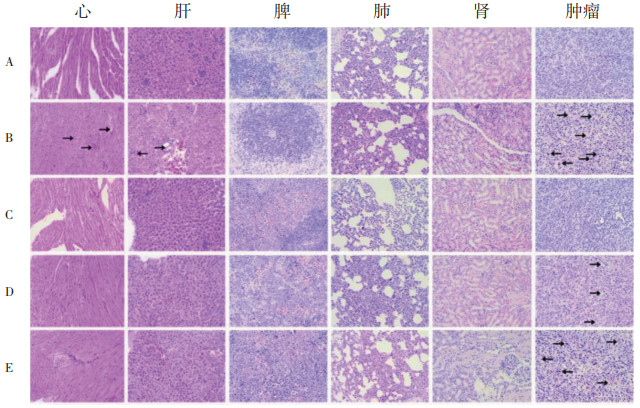
|
| 注:A为生理盐水组,B为GNA-Sol组,C为GNA-NLC组,D为FA-GNA-NLC组,E为顺铂组。 图 8 各组织HE染色结果(×200) |
纳米载体的粒径大小和Zeta电位在生物分布、血液循环和肿瘤细胞摄取等生物学过程中起着至关重要的作用[18-19]。研究显示粒径小的纳米粒比粒径大的纳米粒表现出更强的细胞摄取能力、更高的体外细胞毒性与更多的肿瘤部位蓄积,这些均表明具有较小粒径的纳米颗粒可以改善细胞摄取、肿瘤蓄积以及抗肿瘤功效[20]。纳米载体的表面电荷影响血浆蛋白的吸附,导致其被巨噬细胞识别然后被吞噬、清除,随后影响纳米载体的生物分布。一般认为Zeta电位的绝对值是影响吞噬作用的重要因素,表面电荷的增加会增强巨噬细胞的吞噬作用,Zeta电位绝对值较低的纳米粒子可以有效避免巨噬细胞的摄取,从而延缓血液清除,延长体内循环时间[21-22]。同时Zeta电位影响纳米体系的稳定性,其绝对值越大体系越稳定,本实验制备所得FA-GNANLC的Zeta电位绝对值小于10,但体系仍较为稳定,可能是纳米粒子间的空间位阻效应与静电斥力共同作用的结果[23]。
与GNA-Sol相比,将GNA包载到NLC中可以克服溶解性差、生物利用度低和体内清除速率快等问题,以上几乎归因于纳米载体的被动靶向以及强渗透长滞留(EPR)效应。当纳米载体表面被FA修饰后,FA-GNA-NLC显示出更强的肿瘤细胞生长抑制率、肿瘤靶向性及更长的体内循环时间,这归因于肿瘤细胞中FR的过度表达[24],使FA-NLC通过受体介导的内吞作用增加其在肿瘤组织中的蓄积,从而增强纳米载体的体内生物学过程,增强抗肿瘤作用,降低其他组织损伤。
5 结论本实验构建了FA修饰的靶向治疗乳腺癌的药物递送系统,并装载了难溶性抗肿瘤药物GNA,化学合成FA -PEG2000 -DSPE,使FA通过DSPE - PEG2000锚定在NLC的表面。制备出粒径为(16.01±0.03)nm、电位为(-6.8±0.59)mV、粒径分布均匀、形态圆整、体系稳定的FA-GNA-NLC。经过体外抗肿瘤实验、肿瘤细胞摄取实验、体内靶向性研究及体内药效学研究等一系列的体内与体外评价后可以得出结论:FA-GNA-NLC具有最强的抗肿瘤活性以及最弱的全身毒性。因此,本实验构建的FA-GNA-NLC可以作为GNA的潜在载体,用于提高GNA的生物利用度,增强肿瘤靶向性,改善治疗效果。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: a Cancer Journal for Clinicians, 2018, 68(6): 394-424. |
| [2] |
JUAN A, CIMAS F J, BRAVO I, et al. Antibody conjugation of nanoparticles as therapeutics for breast cancer treatment[J]. International Journal of Molecular Sciences, 2020, 21(17): 6018. |
| [3] |
李小江, 邬明歆, 孔凡铭, 等. 中药有效成分抗肿瘤活性及作用机制研究进展[J]. 中草药, 2020, 51(9): 2587-2592. LI X J, WU M X, KONG F M, et al. Review of anti-tumor activity and mechanism of Chinese materia medica active ingredients[J]. Chinese Traditional and Herbal Drugs, 2020, 51(9): 2587-2592. |
| [4] |
ASANO J, CHIBA K, TADA M, et al. Cytotoxic xanthones from Garcinia hanburyi[J]. Phytochemistry, 1996, 41(3): 815-820. |
| [5] |
ZHAO Q, ZHONG J, BI Y, et al. Gambogenic acid induces Noxa-mediated apoptosis in colorectal cancer through ROS- dependent activation of IRE1α/JNK[J]. Phytomedicine, 2020, 78(2): 153-156. |
| [6] |
WANG B L, YUAN T T, ZHA L Q, et al. Oral delivery of gambogenic acid by functional polydopamine nanoparticles for targeted tumor therapy[J]. Molecular Pharmaceutics, 2021, 18(3): 1470-1479. |
| [7] |
YAN F G, WANG M, LI J M, et al. Gambogenic acid in-duced mitochondrial -dependent apoptosis and referred to phospho -Erk1/2 and phospho -p38 MAPK in human hep- atoma HepG2 cells[J]. Environmental Toxicology and Phar-macology, 2012, 33(2): 181-190. |
| [8] |
BELOQUI A, SOLINÍS M Á, RODRÍGUEZ-GASCÓN A, et al. Nanostructured lipid carriers: promising drug delivery systems for future clinics[J]. Nanomedicine: Nanotechnolo-gy, Biology and Medicine, 2016, 12(1): 143-161. |
| [9] |
MA Z, LI N, ZHANG B, et al. Dual drug-loaded nano-plat-form for targeted cancer therapy: toward clinical therapeutic efficacy of multifunctionality[J]. Journal of Nanobiotechnol-ogy, 2020, 18(1): 123. |
| [10] |
JNAIDI R, ALMEIDA A J, GONSALVES L M. Solid lipid nanoparticles and nanostructured lipid carriers as smart drug delivery systems in the treatment of glioblastoma multiforme[J]. Pharmaceutics, 2020, 12(9): 860. |
| [11] |
XU L Y, BAI Q M, ZHANG X, et al. Folate-mediated chemotherapy and diagnostics: an updated review and out-look[J]. Journal of Controlled Release, 2017, 252(2): 73-82. |
| [12] |
BAKRANIA A K, VARIYA B C, PATEL S S. Novel targets for paclitaxel nano formulations: hopes and hypes in triple negative breast cancer[J]. Pharmacological Research, 2016, 111(7): 577-591. |
| [13] |
JAHANGIRIAN H, KALANTARI K, IZADIYAN Z, et al. A review of small molecules and drug delivery applications using gold and iron nanoparticles[J]. International Journal of Nanomedicine, 2019, 14(11): 1633-1657. |
| [14] |
ZHONG J P, YANG S H, WEN L W, et al. Imaging-guided photoacoustic drug release and synergistic chemo-photoa-coustic therapy with paclitaxel-containing nanoparticles[J]. Journal of Controlled Release: Official Journal of the Con-trolled Release Society, 2016, 226(7): 77-87. |
| [15] |
HUANG R, LI J W, KEBEBE D, et al. Cell penetrating peptides functionalized gambogic acid-nanostructured lipid carrier for cancer treatment[J]. Drug Delivery, 2018, 25(1): 757-765. |
| [16] |
WU Y M, SONG X N, KEBEBE D, et al. Brain targeting of Baicalin and Salvianolic acid B combination by OX26 functionalized nanostructured lipid carriers[J]. International Journal of Pharmaceutics, 2019, 571(2): 118-124. |
| [17] |
KEBEBE D, WU Y M, ZHANG B, et al. Dimeric c (RGD) peptide conjugated nanostructured lipid carriers for efficient delivery of Gambogic acid to breast cancer[J]. International Journal of Nanomedicine, 2019, 14(13): 6179-6195. |
| [18] |
DUAN X P, LI Y P. Physicochemical characteristics of nanoparticles affect circulation, biodistribution, cellular internalization, and trafficking[J]. Small, 2013, 9(9): 1521-1532. |
| [19] |
WU W, LUO L, WANG Y, et al. Endogenous pH-responsive nanoparticles with programmable size changes for targeted tumor therapy and imaging applications[J]. Theranostics, 2018, 8(11): 3038-3058. |
| [20] |
LI C L, GUAN H, LI Z H, et al. Study on different particle sizes of DOX-loaded mixed micelles for cancer therapy[J]. Colloids and Surfaces B, Biointerfaces, 2020, 196(6): 111-123. |
| [21] |
XIAO K, LI Y P, LUO J T, et al. The effect of surface charge on in vivo biodistribution of PEG-oligocholic acid based micellar nanoparticles[J]. Biomaterials, 2011, 32(13): 3435-3446. |
| [22] |
HE C B, HU Y P, YIN L C, et al. Effects of particle size and surface charge on cellular uptake and biodistribution of polymeric nanoparticles[J]. Biomaterials, 2010, 31(13): 3657-3666. |
| [23] |
KHERADMANDNIA S, VASHEGHANI-FARAHANI E, NOSRATI M, et al. Preparation and characterization of keto- profen-loaded solid lipid nanoparticles made from beeswax and carnauba wax[J]. Nanomedicine: Nanotechnology, Biol-ogy, and Medicine, 2010, 6(6): 753-759. |
| [24] |
YAN H J, YOU Y, LI X J, et al. Preparation of RGD pep-tide/folate acid double-targeted mesoporous silica nanopar-ticles and its application in human breast cancer MCF-7 cells[J]. Frontiers in Pharmacology, 2020, 11(2): 898. |
 2023, Vol. 42
2023, Vol. 42