文章信息
- 刘江静, 庄岩, 刘华石, 李梦雪, 霍金海, 王伟明
- LIU Jiangjing, ZHUANG Yan, LIU Huashi, LI Mengxue, HUO Jinhai, WANG Weiming
- 火麻仁生品与炮制品挥发油成分的GC-MS分析
- Analysis of volatile oil from raw and processed hemp seed by GC-MS
- 天津中医药大学学报, 2023, 42(3): 355-359
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(3): 355-359
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.03.14
-
文章历史
收稿日期: 2023-01-19
火麻仁为桑科植物大麻(Cannabis sativa L.)的干燥成熟果实,具有补中益气、润肠去燥的功效,临床上常与其他润下药配合治疗肠燥便秘,其馏油也用于治疗神经性皮炎和慢性湿疹[1]。现代研究表明火麻仁还具有抗炎、抗氧化活性、调节脂质代谢、降低血压,抗衰老、心肌损伤保护等多重药理作用[2]。
炒火麻仁是《中华人民共和国药典》收载的常见炮制品,且临床多以炒火麻仁入药。目前对于火麻仁的炮制机制并不清晰,有学者认为火麻仁炒黄后会降低毒性,增强滋脾润燥的功效[3];也有学者认为火麻仁炒后会使脂肪酸和挥发油消失殆尽,变为香燥之品,不利于治疗便秘[4]。
挥发油是中药中的一类重要活性物质,具有解表、行气、化湿、开窍的作用[5]。但目前对火麻仁炮制后挥发油的成分及药效变化尚不清楚。本实验采用气相色谱-质谱联用(GC-MS)技术对炮制前、后火麻仁挥发油的化学成分进行分析,研究相关成分的量变和质变规律,拟为进一步阐明火麻仁炮制机制、制定炮制标准和指导临床合理用药奠定基础。
1 仪器与药材 1.1 仪器Gas Chromatograph Clarus 680-Mass Spectrometer Clarus SQ 8T型气质联用仪(EI源,美国PE公司),98-1-BN型电子调温电热套(天津市泰斯特仪器有限公司),YP202N型电子天平(上海精密科学仪器有限公司)。
1.2 药材与试剂石油醚60~90 ℃(色谱纯,天津市科密欧化学试剂有限公司),水为超纯水。
火麻仁购自河北安国药材市场,产地为安徽省,经黑龙江省中医药科学院王伟明研究员鉴定为桑科植物大麻(Cannabis sativa L.)的干燥成熟果实。
丁香酚对照品(批号725-200209,中国药品生物制品检定所,纯度≥98.0%)。
2 方法 2.1 样品制备按2020年版《中华人民共和国药典》清炒法(通则0213)将火麻仁炒至微黄,有香气,得炒火麻仁。再将火麻仁生品和炒品研碎,过20目筛,备用。
2.2 挥发油提取取样品粉末100 g,精密称定,置于2 000 mL圆底烧瓶中,加水1 000 mL后放置1 h,按2020年版《中华人民共和国药典》四部通则挥发油测定法(甲法)操作,提取8 h。收集挥发油,称质量,火麻仁生品与炒品各平行测定3次,计算挥发油得率。再转移至10 mL容量瓶中,用石油醚定容至刻度,摇匀,得样品储备液。
2.3 内标溶液制备取丁香酚对照品适量,加石油醚配制成30 μg/mL的内标溶液。
2.4 供试品溶液制备精密量取5 mL样品储备液,置于10 mL容量瓶中,精密加入1 mL内标溶液,用石油醚稀释至刻度,摇匀,过滤,取续滤液,即得。
2.5 测试条件色谱条件:Elite-5MS毛细管色谱柱(0.32 mm×60 m,0.25 μm),载气为氦气,体积流量为1.0 mL/min,进样口温度为220 ℃,进样量为1 μL,分流比为10∶1,程序升温:初始70 ℃,保持3 min,再以3 ℃/min的速度升至180 ℃,最后以7 ℃/min的速度升至220 ℃,保持10 min。
质谱条件:接口温度250 ℃,电离方式为电子轰击电离,电离能量为70 eV,离子源温度为250 ℃,采集方式为MS Scan,扫描质量范围为40~450 m/z,扫描时间为5.80~55.38 min,NIST谱图检索。
2.6 数据处理 2.6.1 化学成分鉴定吸取供试品溶液,按上述“2.5”项条件进行测定,记录色谱图。数据经NIST谱库检索,以正反匹配度大于800为筛选条件并结和文献报道的二级质谱信息,对色谱峰进行定性分析;利用化合物与内标物丁香酚的峰面积之比计算各成分的相对含量。
2.6.2 差异性成分筛选将获得的样品数据导入EZinfo 3.0.3软件进行正交偏最小二乘判别(OPLS-DA)分析,结合变量权重重要性排序(VIP)值>1.0筛选出火麻仁炮制前后的差异化合物;将获得的样品数据导入IBM SPSS Statistics 25.0软件进行配对t检验分析,结合P < 0.05筛选出火麻仁炮制前后含量变化具有统计学意义的化学成分;将上述两者结合筛选出显著性差异化合物。
3 结果 3.1 化学成分鉴定将供试品溶液按“2.5”项下的GC-MS条件进行测定,得到火麻仁炮制前和炮制后挥发油的GC-MS总离子流图。色谱信息经NIST谱库检索和文献检索,从火麻仁生品挥发油中鉴定出40种化合物,从火麻仁炮制品挥发油中鉴定出36种化合物,见表 1及图 1。
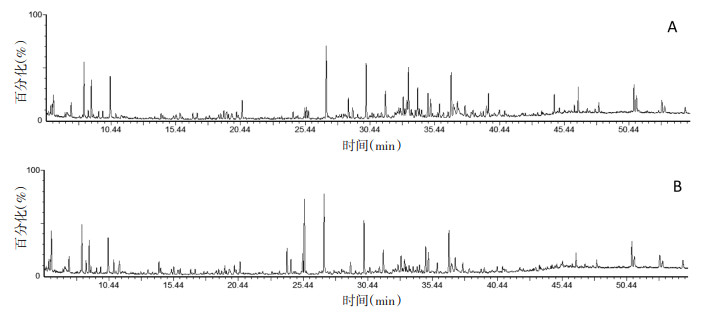
|
| 注:A为火麻仁生品,B为火麻仁炒品。 图 1 火麻仁生品、炒品挥发油的GC-MS总离子流图 |
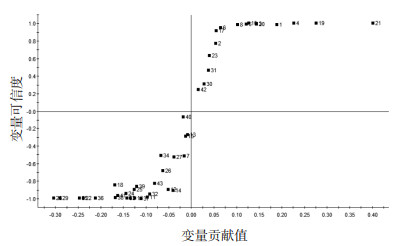
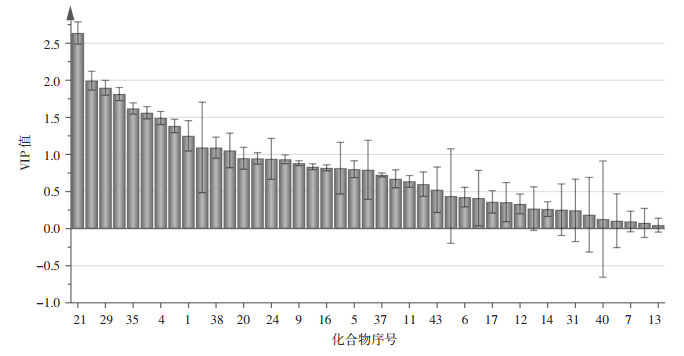
对火麻仁炮制前后的成分信息进行OPLS-DA分析,生成得分(Scores)图、散点(S-Plot)图和VIP图,见图 2、图 3、图 4。

|
| 注:Var_1、Var_2、Var_3为生品;Var_4、Var_5、Var_6为炒品。 图 2 火麻仁生品、炒品挥发油成分的Scores图 |
|
| 图 3 火麻仁生品、炒品挥发油成分的S-Plot图 |
|
| 图 4 火麻仁生品、炒品挥发油成分的VIP值图(x±s) |
Scores图显示生品分布在第二、三象限,炮制品分布在第一、四象限,说明火麻仁生品和炮制品被分为两类,存在明显的质量差异。S-Plot图中X轴表示变量的贡献值,Y轴表示变量的可信度,每个点代表 1个化合物,与原点距离越远的点,所代表的化合物对两组样品间的差异贡献越大。按各成分对样品分类的影响大小进行排序,获得12个VIP值>1.0的化学成分,作为差异性成分。进一步筛选P < 0.05的化学成分,得到11个具有统计学意义的差异性成分,其中正己醛、2-戊基呋喃、茴香脑、反,反-2,4-癸二烯醛的含量在炮制后增加,β-榄香烯、α-法呢烯、Δ-杜松烯、芳姜黄酮、植酮、棕榈酸甲酯、亚麻酸甲酯的含量在炮制后降低。
4 讨论本研究利用GC-MS技术从火麻仁生品挥发油中鉴定出40种成分,从炮制品中鉴定出36种成分。所得数据经进一步的处理与分析,获得正己醛、2-戊基呋喃、茴香脑、反,反-2,4-癸二烯醛、β-榄香烯、α-法呢烯、Δ-杜松烯、芳姜黄酮、植酮、棕榈酸甲酯、亚麻酸甲酯11个显著性差异化合物,其中2-戊基呋喃、茴香脑为清炒后新检测到的化合物,β-榄香烯、Δ-杜松烯、芳姜黄酮、植酮为清炒后消失的化合物。
脂肪酸是火麻仁中的主要成分,易氧化降解生成氢过氧化物和醛类物质。研究表明,亚油酸会自动氧化生成C9-和C13-的氢过氧化物,C13-的氢过氧化物很不稳定,在温度超过150 ℃时易裂解生成己醛;C9-的氢过氧化物则会裂解生成2,4-癸二烯醛[6-7]。火麻仁经炒制后,正己醛、2-戊基呋喃、反,反-2,4-癸二烯醛等脂肪酸氧化降解产物的含量增加。
据报道,本实验获得的显著性差异化合物β-榄香烯和芳姜黄酮具有抗肿瘤活性[8-9],植酮具有清除1,1-二苯基-2-苦味酰基(DPPH)自由基、抗炎等作用[10],需要进一步与药效学实验结合,以探讨火麻仁的炮制机制和炮制标准。
| [1] |
杨素华, 马子牧, 马晓旋. 火麻仁馏油治疗116例神经性皮炎临床观察[J]. 临床皮肤科杂志, 1997, 26(1): 28-29. YANG S H, MA Z M, MA X X. Clinical observation on 116 cases of neurodermatitis treated with distillated oil of Cannais fructus[J]. Journal of Clinical Dermatology, 1997, 26(1): 28-29. |
| [2] |
贺海波, 石孟琼. 火麻仁的化学成分和药理活性研究进展[J]. 中国民族民间医药, 2010, 19(15): 56-57. HE H B, SHI M Q. Research progress in chemical constituents and pharmacological activities of Cannais fructus[J]. Chinese Journal of Ethnomedicine and Ethnopharmacy, 2010, 19(15): 56-57. |
| [3] |
周斌. 中药清炒后的奇功妙效[N]. 上海中医药报, 2013-11-22(003). ZHOU B. The miraculous effect of Chinese medicine after stir-frying[N]. Shanghai Journal of Traditional Chinese Med- icine, 2013-11-22(003). |
| [4] |
马运福. 中药"四子"临床应用是否需炮制[N]. 中国中医药报, 2004-09-30(002). MA Y F. Whether the clinical application of traditional Chinese medicine "Sizi" needs to be processed[N]. Chinese Journal of Traditional Chinese Medicine, 2004-09-30(002). |
| [5] |
王雅琪, 杨园珍, 伍振峰, 等. 中药挥发油传统功效与现代研究进展[J]. 中草药, 2018, 49(2): 455-461. WANG Y Q, YANG Y Z, WU Z F, et al. Traditional function and modern research progress on volatile oil in Chinese materia medica[J]. Chinese Traditional and Herbal Drugs, 2018, 49(2): 455-461. |
| [6] |
刘丽微, 白卫东, 钱敏. 2, 4-癸二烯醛在肉味香精中作用机制的研究进展[J]. 香料香精化妆品, 2011, 39(6): 33-36. LIU L W, BAI W D, QIAN M. The progress on study of the mechanism of 2, 4-decadienal in meat flavor[J]. Flavour Fragrance Cosmetics, 2011, 39(6): 33-36. |
| [7] |
文志勇, 孙宝国, 梁梦兰, 等. 脂质氧化产生香味物质[J]. 中国油脂, 2004, 29(9): 41-44. WEN Z Y, SUN B G, LIANG M L, et al. Flavour compounds from lipid oxidation[J]. China Oils and Fats, 2004, 29(9): 41-44. |
| [8] |
LEE Y. Activation of apoptotic protein in U937 cells by a component of turmeric oil[J]. BMB Reports, 2009, 42(2): 96-100. |
| [9] |
GAN D J, HE W Y, YIN H B, et al. Β-elemene enhances cisplatin-induced apoptosis in bladder cancer cells through the ROS-AMPK signaling pathway[J]. Oncology Letters, 2020, 19(1): 291-300. |
| [10] |
何跃君. 竹叶挥发油化学成分及其生物活性研究[D]. 北京: 中国林业科学研究院, 2009. HE Y J. Chemical components and biological activities of essential oils from the bamboo leaves[D]. Beijing: Chinese Academy of Forestry, 2009. |
 2023, Vol. 42
2023, Vol. 42





