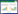文章信息
- 王玉, 李莉莉, 申茜, 郭梦情, 刘璇, 郭虹
- WANG Yu, LI Lili, SHEN Qian, GUO Mengqing, LIU Xuan, GUO Hong
- 杜仲方改善帕金森小鼠的肠道微环境
- Duzhong Formula improves the intestinal microenvironment of Parkinson's mice
- 天津中医药大学学报, 2023, 42(4): 463-469
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(4): 463-469
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.04.11
-
文章历史
收稿日期: 2023-03-06
帕金森病(PD)是世界上第二大神经退行性疾病。临床经常出现静息性震颤、肌肉僵硬、运动障碍等运动性症状,还常伴有胃肠道紊乱、肠道炎症等非运动性症状,严重降低患者的生活质量。虽然PD患者的运动症状和非运动症状之间的关系尚不清楚,但近期有研究报道,非运动症状早于运动症状出现[1]。
胃肠道(GI)功能障碍,是PD患者最常见的非运动性症状之一[2]。目前解释PD从肠道到大脑发病机制的理论是肠-脑轴,它是胃肠道和中枢神经系统之间的双向通信系统[3]。肠道微生物在维持肠道稳态中起着重要作用,胃肠功能障碍会导致肠道菌群的失衡,肠道菌群紊乱可引起肠道屏障及肠粘膜渗透性改变,这一改变不仅可影响胃肠上皮细胞及免疫系统,并可上调肠道局部及系统性炎症反应,通过神经、免疫和内分泌等通路影响肠-脑轴。肠道微环境对内外损伤因素相当敏感,因此可能成为PD早期诊断和治疗的靶点。
现代医家普遍认为:帕金森病发病的基本病因是肝肾阴虚,与肝肾关系密切[4]。杜仲方(DZF)来自《备急千金药方》,由杜仲、石斛、地黄、干姜4味药组成,补益肝肾的同时散寒、滋阴等功效。前期研究发现,杜仲方对亚急性PD小鼠有治疗作用,可以调节小胶质细胞炎性反应,减轻神经炎症,进而改善运动功能[5]。但PD是一种慢性进行性疾病,杜仲方的长期疗效及其对PD肠道微环境的影响尚不清楚。因此,以1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)和丙磺舒联合作用于C57BL/6成年小鼠,建立慢性PD模型。通过对行为学、多巴胺能神经元,以及肠道屏障功能、炎症反应及微生物构成的检测,分析杜仲方对慢性PD小鼠运动协调能力及其肠道微环境的影响,以期为杜仲方临床治疗PD提供实验基础。
1 材料 1.1 动物8周龄雄性C57BL/6小鼠18~22 g,购自北京维通利华实验动物科技有限公司(合格证号:SCXK(Jing)2019-0008)。所有实验程序均经天津中医药大学动物伦理委员会(TCM-LAEC2019075,天津)批准。小鼠饲养于天津中医药大学动物中心,动物房温度(23±2)℃,室内湿度(55±5)%,小鼠可自由饮水和饮食。适应性饲养1周后,开始正式实验。
1.2 药物与试剂杜仲、石斛、干姜、地黄饮片购买于北京同仁堂药店,经鉴定分别为杜仲科杜仲属植物杜仲Eucommia ulmoides Oliv.的干燥树皮、兰科植物石斛Dendrobium nobile Lindl.的新鲜或干燥茎、姜科植物姜Zingiber officinale Rosc.的干燥根茎、玄参科植物地黄Rehmannia glutinosa Libosch.的新鲜或干燥块根。
MPTP(货号:IM0290)、丙磺舒(货号:P8761)购于美国Sigma-Aldrich公司;抗CD13抗体(货号:32720S)、抗TH抗体(货号:2792S)购自美国CST公司;抗Occludin抗体(货号:33-1500)购自美国Thermo Fisher公司;抗MPO抗体(货号:22225-1-AP)购自武汉三鹰生物技术有限公司;辣根过氧化物酶标记山羊抗兔IgG(货号:A0208)、辣根过氧化物酶标记山羊抗小鼠(货号:A0216)二抗购于上海碧云天生物技术研究所。
1.3 仪器转棒式疲劳仪(天津诺雷信达科技有限公司;YLS-4C);电泳和转膜装置(美国Bio-Rad公司);Azure c500型凝胶成像仪(美国Azure Biosystems公司);EG1150C型冰冻机(德国Leica公司)。
2 方法 2.1 制备杜仲方浸膏称取杜仲1 000 g,石斛10 g,干姜15 g,地黄15 g,加入10倍体积的75%乙醇,加热回流提取2 h,抽滤,药渣再加入8倍体积75%乙醇,操作与上述相同,将两次提取液合并,过滤浓缩冻干得到杜仲方干粉(得率约为11%)。
2.2 动物分组及给药将40只小鼠随机分为对照组(Control)、模型组(Model)、杜仲方低剂量组(DZF-10 g/kg)、杜仲方高剂量组(DZF-20 g/kg),每组10只。Model、DZF-10 g/kg、DZF-20 g/kg组腹腔注射丙磺舒溶液(250 mg/kg),1 h后皮下注射MPTP(25 mg/kg),每3.5 d注射1次,共10次,建立小鼠慢性PD模型[6],对照组注射等量生理盐水。造模开始时,DZF-10 g/kg组和DZF-20 g/kg组分别灌胃给予10 g/kg和20 g/kg的杜仲方提取物,每日1次,持续给药至造模后1周,对照组和模型组同时灌胃等量蒸馏水。
2.3 行为学测试 2.3.1 爬杆实验小鼠从长约50 cm,直径1 cm的纱布覆盖的杆子顶部爬下来。记录它从开始向下爬行到后肢触及地面的时间,超过60 s则记为60 s。正式实验前3 d进行适应性训练,测试分别在正式实验前(0周)、实验前期(1周)、实验中期(3周)、实验结束时(6周)进行。
2.3.2 转棒实验转棒仪的转速设置为25 r/min[5],将小鼠置于转棒上,记录小鼠掉落的时间,若5 min后没有掉落,则记为300 s。在正式实验前3 d对小鼠进行训练。测试分别在正式实验前(0周)、实验前期(1周)、实验中期(3周)、实验结束时(6周)进行。
2.4 免疫印迹分析行为学测试后,处死小鼠,取中脑组织,匀浆,离心收集上清。蛋白定量后,加入上样缓冲液并在100 ℃下使蛋白质变性5 min。蛋白样品采用BCA定量法定量。样品经10%Bis-Tris凝胶电泳分离,转入PVDF膜,用5%脱脂奶粉(w/v)封闭1 h,TH(1∶1 000)4 ℃孵育过夜。室温条件下加入山羊抗兔二抗(1∶1 000)孵育,孵育1 h后,ECL化学发光技术进行检测。
2.5 苏木精-伊红(HE)染色各组小鼠结肠组织,置于4%多聚甲醛固定24 h后,行HE染色:石蜡切片脱蜡至水,苏木素染色冲洗后伊红染色。光镜下观察各组小鼠结肠组织病理变化。
2.6 免疫组化染色小鼠处死后,取中脑黑质和结肠组织,置于4%多聚甲醛固定,组织切片。室温下用3%H2O2灭活内源性酶,热修复,血清封闭后,分别滴加TH(1∶400)、Occludin(1∶200)、CD13(1∶1 600)和MPO(1∶400)抗体,4 ℃孵育过夜。分别滴加HRP标记的山羊抗兔二抗(1∶50)和HRP标记的山羊抗小鼠二抗(1∶50),37 ℃孵育30 min。加入DAB显色。梯度脱水后,用中性胶固定载玻片,显微镜下拍照观察。
2.7 肠道菌群结构分析实验结束后,取小鼠新鲜粪便,置于无菌EP管中,-80 ℃保存。16sRNA基因测序采用IlluminaHiSeq测序平台进行处理。对序列进行质控处理,聚类成操作分类单元(OTUs),排列,并计算多样性。对OTU进行多序列比对,并通过主坐标分析(PCoA)等降维分析进行显示,进一步得到不同样品和分组的群落结构差异。
2.8 统计分析采用SPSS 22.0软件进行数据分析。数据以均数±标准差(x±s)表示。多组间比较采用单因素方差分析,组间两两比较时方差齐者采用LSD检验,不齐者采用Dunnet’s T3检验,P < 0.05为差异有统计学意义。
3 结果 3.1 杜仲方改善PD小鼠运动功能障碍行为学结果显示,与Control组相比,Model组在第1、3、6周时,小鼠爬杆时间延长,转棒掉落时间缩短,说明模型小鼠出现PD运动障碍症状。与Model组相比,DZF-20 g/kg组小鼠在第6周时能明显缩短爬杆时间(P < 0.05),延长转棒停留时间(P < 0.05),提示杜仲方对改善慢性PD小鼠的运动功能障碍具有一定作用。

|
| 注:与Control组相比,##P < 0.01,###P < 0.001;与Model组相比,*P < 0.05。 图 1 杜仲方对PD小鼠爬杆实验(A)和转棒实验(B)的影响(x±s,n=10) |
TH是合成DA过程中的限速酶,TH阳性细胞可代表多巴胺能神经元。从图 2A,2B可以看出,与Control组相比,Model组中脑黑质部TH阳性细胞数明显减少(P < 0.05),而给予杜仲方20 g/kg可以明显改善PD小鼠多巴胺能神经元数目减少的现象(P < 0.05)。免疫印迹实验(Western Blot)也得到一致结果(如图 2C,2D)。与Model组相比,杜仲方10 g/kg、20 g/kg均可显著增加PD小鼠中脑组织TH蛋白相对表达量(P < 0.05,P < 0.01)。
|
| 注:1. Control组;2. Model组;3.杜仲方低剂量组;4.杜仲方高剂量组。 图 2 杜仲方对PD小鼠黑质部TH阳性细胞数(A,B)和中脑TH蛋白表达(C,D)的影响(x±s,n=3) |
|
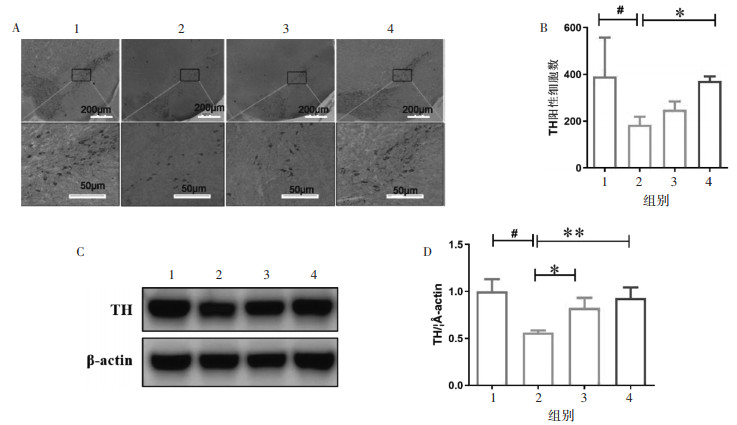
| 注:1. Control组;2. Model组;3.杜仲方低剂量组;4.杜仲方高剂量组。 图 3 各组小鼠肠组织病理(A)、肠道屏障变化(B,C)(x±s,n=4) |
HE染色观察结肠组织的病理形态。如图 4A所示,PD小鼠结肠完整性差,肠上皮杯状细胞数量减少。灌胃杜仲方后,小鼠结肠情况优于PD小鼠,杯状细胞数量增加。
|
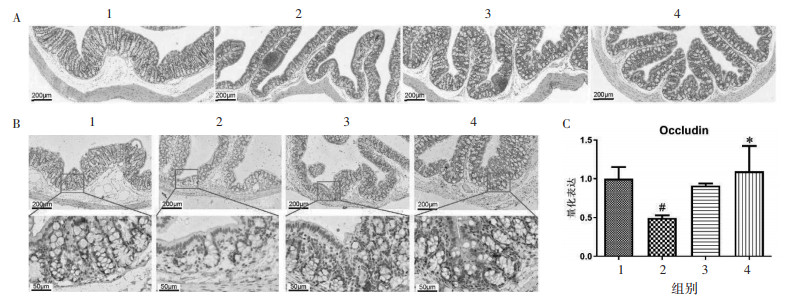
| 注:1. Control组;2. Model组;3.杜仲方低剂量组;4.杜仲方高剂量组。 图 4 各组小鼠肠道炎症MPO(A,B)和CD13(C,D)的变化(x±s,n=4) |
Occludin染色用于指示肠屏障功能。如图 4B和4C所示,与Control组相比,Model组Occludin表达明显降低(P < 0.05)。而给予杜仲方后,DZF-20 g/kg组小鼠肠组织Occludin表达基本恢复到Control组水平(P < 0.05)。
肠道炎症导致一系列有害的连锁反应,从肠道局部开始,最终可能扩散到全身。免疫组化染色检测结肠组织中炎症因子CD13和MPO的表达。结果发现,与Control组相比,Model组结肠组织中CD13和MPO的表达明显升高(P < 0.05,P < 0.05),而DZF-20 g/kg组的CD13和MPO表达均明显低于Model组(P < 0.05,P < 0.05,图 4)。
3.4 杜仲方调节PD小鼠肠道菌群结构 3.4.1 肠道菌群的多样性α-多样性定义为一个样本内生物的多样性,分析指标包括检测物种、Shannon指数、Chao1指数和ACE指数。指数越大,说明菌群多样性越高。如图 5A-D所示,PD小鼠的肠道菌群多样性指数显著高于健康对照组,灌胃杜仲方后,微生物多样性趋于正常。
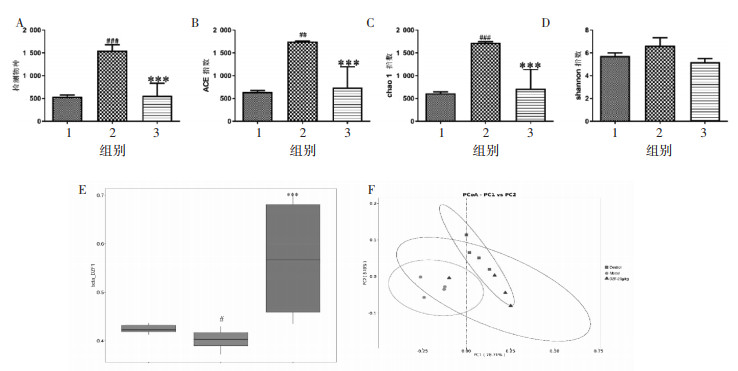
|
| 注:1. Control组;2. Model组;3.杜仲方高剂量组。 图 5 小鼠肠道菌群的α-多样性(A-D)、β-多样性(E)和PCoA图(F)情况(x±s,n=4) |
β-多样性是样本间微生物多样性的差异。如图 5E所示,Control组、DZF-20 g/kg组均与Model组存在差异,且差异趋向一致。在OTU水平对大鼠肠道菌群进行PCoA分析,如图 5F所示Control组、DZF-20 g/kg组均与Model组偏离较大,DZF-20 g/kg组与Control组偏离较小,说明杜仲方干预后PD小鼠肠道菌群结构更趋近于正常,如图 5F所示。
3.4.2 肠道菌群结构在门水平上,与正常小鼠相比,PD小鼠的厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria)丰度增加,杜仲方干预后可降低3种菌群丰度。相反,拟杆菌门(Bacteroidetes)丰度在PD小鼠中有所下降,但经杜仲方处理后得以恢复(图 6A)。同时,杜仲方干预也可显著纠正厚壁菌门/拟杆菌门(Firmicutes/Bacteroidetes,F/B)比例的失衡(图 6B)。
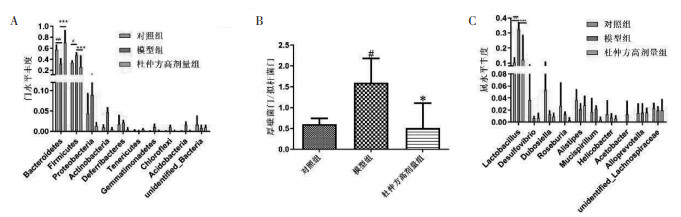
|
| 图 6 肠道菌群TOP10门水平(A)、属水平(C)和厚壁菌门与拟杆菌门比例(B)情况(x±s,n=4) |
属水平上的优势菌种乳酸杆菌(Lactobacillus)丰度在PD小鼠粪便中显著高于正常小鼠,而PD小鼠服用杜仲方后,粪便中乳酸杆菌丰度明显降低(图 6C)。
4 讨论前期采用MPTP腹腔注射建立亚急性PD小鼠模型,证实了杜仲方可以有效改善PD运动障碍[5]。本研究中,又利用MPTP和丙磺舒联用,建立了慢性PD小鼠模型,进一步证实了杜仲方对PD的治疗效果。杜仲方对PD小鼠运动障碍具有改善作用,对多巴胺能神经元有一定保护作用,是临床治疗PD的潜在药物。
PD临床症状不仅包括运动障碍,也包括非运动障碍。近年来,胃肠系统在PD中的作用受到了广泛关注。据报道,高达79%的PD患者有胃肠道功能障碍[7]。基础研究也已证实,PD早期存在肠道病变和肠道菌群失调[8]。胃肠道环境的长期破坏可能促进了PD的发生发展[9]。肠屏障破坏、肠道炎症以及肠道微生物结构的改变都可能与PD发病有关[10]。本研究发现,模型小鼠结肠组织中炎症因子(CD13和MPO)表达显著增加,而给予杜仲方处理后,结肠组织CD13和MPO表达明显降低。同样,灌胃杜仲方后,模型小鼠的肠屏障功能亦得到较好改善。以上结果均表明杜仲方可降低慢性帕金森小鼠的肠屏障破环及肠道炎症。
“肠-脑轴”是目前公认的PD从肠道到大脑的发病机制理论,是大脑和肠道间的双向路径。同时肠道菌群参与并调控这一通路[11]。因此,“肠-脑轴”的概念逐渐扩展为“微生物-肠-脑轴”[12]。本研究中建立了慢性低剂量MPTP致PD的神经毒素模型,结果表明,注射MPTP 1.5个月后小鼠肠道微生物结构被破坏。模型小鼠粪便中菌群α-多样性明显增加,而杜仲方干预后显著降低了α-多样性,即ACE指数和Shannon指数。PD小鼠肠道菌群α-多样性增加,似乎与部分文献报道相矛盾。可能是由于菌群多样性受年龄、性别等多种因素影响的结果[13]。
此外,杜仲方亦可以通过调节肠道菌群β-多样性,即改善肠道菌群结构发挥PD治疗作用。临床研究发现PD患者肠道Lactobacillusaceae(乳酸杆菌科)丰度明显增加[14],同样笔者在小鼠模型也发现Lactobacillus(乳酸杆菌)属水平丰度显著升高,而杜仲方治疗后可显著降低该菌种丰度。此外,杜仲方也调节了模型小鼠粪便中拟杆菌门Bacteroidetes、厚壁菌门Firmicutes、变形菌门Proteobacteria和放线菌门Actinobacteria等菌种的丰度。研究表明,Firmicutes/Bacteroidetes比值升高与几种炎症有关,如肥胖[15]、炎症性肠病[16]。鱼藤酮诱导的小鼠PD模型的肠道失衡也表现为Firmicutes/Bacteroidetes比值升高[17]。在经杜仲方处理后降低了Firmicutes/Bacteroidetes的比值。以上结果表明,杜仲方可能通过调节肠道微生物群落发挥治疗PD的作用[18-20]。
综上所述,PD小鼠存在胃肠功能障碍,肠道微环境被破坏,杜仲方可维持肠屏障功能,改善肠道炎症反应,调节肠道菌群结构,进而延缓脑内多巴胺能神经元损伤,改善PD小鼠的运动功能障碍。提示,杜仲方对PD的保护作用可能是基于调控肠-脑轴,通过改善肠道微环境,进而保护中枢神经系统。而DZF调控肠-脑轴的具体作用机制还需进一步的研究和阐明。
| [1] |
鲍倩, 赵亚伟, 霍晓晓, 等. 中医药治疗帕金森病非运动症状研究进展[J]. 现代中西医结合杂志, 2019, 28(35): 3986-3990. BAO Q, ZHAO Y W, HUO X X, et al. Study progression of the treatment for Parkinson's non-motor symptoms with traditional Chinese medicine[J]. Modern Journal of Integrated Traditional Chinese and Western Medicine, 2019, 28(35): 3986-3990. DOI:10.3969/j.issn.1008-8849.2019.35.029 |
| [2] |
KUAI X Y, YAO X H, XU L J, et al. Evaluation of fecal microbiota transplantation in Parkinson's disease patients with constipation[J]. Microbial Cell Factories, 2021, 20(1): 98. |
| [3] |
KITANI-MORII F, FRIEDLAND R P, YOSHIDA H, et al. Drosophila as a model for microbiota studies of neurodegeneration[J]. Journal of Alzheimer's Disease, 2021, 84(2): 479-490. |
| [4] |
林群英. 基于文献研究的中医药治疗帕金森病证治规律探讨[D]. 南京: 南京中医药大学, 2021. LIN Q Y. Literature review and study on parkinson disease with TCM treatment[D]. Nanjing: Nanjing University of Chinese Medicine, 2021. |
| [5] |
LI L L, FAN S S, ZHANG W Q, et al. Duzhong Fang attenuates the POMC-derived neuroinflammation in parkinsonian mice[J]. Journal of Inflammation Research, 2021, 14: 3261-3276. |
| [6] |
YANG W W, HAO W W, MENG Z, et al. Molecular regulatory mechanism and toxicology of neurodegenerative processes in MPTP/probenecid-induced progressive Parkinson's disease mice model revealed by transcriptome[J]. Molecular Neurobiology, 2021, 58(2): 603-616. |
| [7] |
KNUDSEN K, FEDOROVA T D, BEKKER A C, et al. Objective colonic dysfunction is far more prevalent than subjective constipation in parkinson's disease: a colon transit and volume study[J]. Journal of Parkinson's Disease, 2017, 7(2): 359-367. |
| [8] |
LAI F, JIANG R, XIE W J, et al. Intestinal pathology and gut microbiota alterations in a methyl-4-phenyl-1, 2, 3, 6-tetrahydropyridine(MPTP) mouse model of Parkinson's disease[J]. Neurochemical Research, 2018, 43(10): 1986-1999. |
| [9] |
KENNA J E, BAKEBERG M C, GORECKI A M, et al. Characterization of gastrointestinal symptom type and severity in Parkinson's disease: a case-control study in an Australian cohort[J]. Movement Disorders Clinical Practice, 2021, 8(2): 245-253. |
| [10] |
BRUDEK T. Inflammatory bowel diseases and Parkinson's disease[J]. Journal of Parkinson's Disease, 2019, 9(s2): S331-S344. |
| [11] |
GORECKI A M, DUNLOP S A, RODGER J, et al. The gut-brain axis and gut inflammation in Parkinson's disease: Stopping neurodegeneration at the toll gate[J]. Expert Opinion on Therapeutic Targets, 2020, 24(7): 601-604. DOI:10.1080/14728222.2020.1763956 |
| [12] |
CRYAN J F, O'RIORDAN K J, COWAN C S M, et al. The microbiota-gut-brain axis[J]. Physiological Reviews, 2019, 99(4): 1877-2013. DOI:10.1152/physrev.00018.2018 |
| [13] |
HOPFNER F, KÜNSTNER A, MÜLLER S H, et al. Gut microbiota in Parkinson disease in a northern German cohort[J]. Brain Research, 2017, 1667(3): 41-45. |
| [14] |
CHEN Z J, LIANG C Y, YANG L Q, et al. Association of Parkinson's disease with microbes and microbiological therapy[J]. Frontiers in Cellular and Infection Microbiology, 2021, 11(1): 619354. |
| [15] |
MAGNE F, GOTTELAND M, GAUTHIER L, et al. The firmicutes/bacteroidetes ratio: a relevant marker of gut dysbiosis in obese patients?[J]. Nutrients, 2020, 12(5): 1474. DOI:10.3390/nu12051474 |
| [16] |
STOJANOV S, BERLEC A, TRUKELJ B. The influence of probiotics on the firmicutes/bacteroidetes ratio in the treatment of obesity and inflammatory bowel disease[J]. Microorganisms, 2020, 8(11): 1715. DOI:10.3390/microorganisms8111715 |
| [17] |
YANG X D, QIAN Y W, XU S Q, et al. Longitudinal analysis of fecal microbiome and pathologic processes in a rotenone induced mice model of Parkinson's disease[J]. Frontiers in Aging Neuroscience, 2017, 9(2): 441. |
| [18] |
刘萍, 徐龙进, 霍青, 等. 水木和宁方对鱼藤酮诱导的帕金森模型小鼠自噬功能的影响[J]. 天津中医药大学学报, 2021, 40(2): 235-240. LIU P, XU LJ, HUO Q, et al. Effect of Shuimu Hening Formulation on autophagy function of rotenone-induced Parkinson's model mice[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2021, 40(2): 235-240. |
| [19] |
武燕, 陈菊萍. 滋肾益髓方联合西药治疗帕金森氏病患者非运动症状的疗效观察[J]. 天津中医药大学学报, 2020, 39(2): 183-185. WU Y, CHEN JP. Therapeutic effect of Zishen Yisui Decoction combined with Western medicine on non-motor symptoms of parkinson's disease[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(2): 183-185. |
| [20] |
任静, 吴玉梅, 马丽, 等. 三七总皂苷微乳对帕金森模型小鼠行为学及纹状体多巴胺含量的影响[J]. 天津中医药大学学报, 2018, 37(3): 234-238. REN J, WU YM, MA L, et al. Effects of Panax Notoginseng Saponins microemulsion on behavior and striatal dopamine content in Parkinson's model rats[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2018, 37(3): 234-238. |
 2023, Vol. 42
2023, Vol. 42