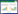文章信息
- 刘静静, 祁东利, 高文远, 刘志东
- LIU Jingjing, QI Dongli, GAO Wenyuan, LIU Zhidong
- 济川煎中4种指标成分同时测定及其物质基准工艺研究
- Study on simultaneous determination of four index components in Jichuan Decoction and it's material standard technology
- 天津中医药大学学报, 2023, 42(4): 470-478
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(4): 470-478
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.04.12
-
文章历史
收稿日期: 2023-03-06
2. 天津中医药大学, 组分中药国家重点实验室, 天津 301617;
3. 天津大学药物科学与技术学院, 天津市现代给药与高效重点实验室, 天津 300072
2. State Key Laboratory of Component-based Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
3. Tianjin Key Laboratory of Modern Drug Delivery and High Efficiency, School of Pharmaceutical Science and Technology, Tianjin University, Tianjin 300072, China
经典名方济川煎出自《景岳全书》卷五十一,全方主要由肉苁蓉、当归、牛膝、泽泻、升麻、枳壳组成;主治肾阳虚弱,精津不足;症见:大便秘结,小便清长,腰膝酸软,头目眩晕,舌淡苔白,脉沉迟。现代药理研究表明:济川煎作为治疗便秘的经验方,具有促进胃肠蠕动[1-3]、提高结肠动力[4-5]、调节胃肠激素[6]、维持肠道菌群稳态[7-8]等药理作用。临床上主要用于老年功能性便秘[9]、慢传输型便秘[10]、功能性出口梗阻型便秘[11-12]、帕金森患者便秘[13-14]、中风恢复期患者便秘[15-16]、阿片类药物所致便秘[17-18]等。但由于其药材来源多样且无质量保证;汤剂口感较差且患者顺应性差;煎煮器具和制备工艺个体差异大;汤液易变质且不易保存及携带等诸多因素限制,济川煎的现代化研究发展缓慢。基于国家对古代经典名方的重视与政策扶持,为推进经典名方现代化、规范化发展,本文基于高效液相色谱(HPLC)建立经典名方济川煎指纹图谱、4种指标成分同时测定方法及物质基准制备工艺研究方法,为经典名方济川煎的科学研究和开发提供参考依据。
1 仪器与材料 1.1 仪器1260型高效液相色谱仪(DAD检测器,美国,安捷伦);XP205型十万分之一电子分析天平(瑞士METTLER TOLEDO公司);FA124型万分之一天平(天津亿诺科学仪器有限公司);FDU-2100型真空冷冻干燥机(日本东京理化股份公司);DW-86L728J型超低温保存箱(青岛海尔特种电器有限公司);N-4000系列型旋转蒸发仪(EYELA);低温冷却液循环泵(天津科诺仪器设备有限公司);煎煮壶(康雅顺电器有限公司);接触式调压器(飘峰电气有限公司)
1.2 材料肉苁蓉(新疆,191002),当归(甘肃,181004),牛膝(河南,B906041-01),枳壳(江西,181104),升麻(内蒙古,190801),泽泻(四川,181105)柚皮苷(wkq20020603,纯度≥98%),异阿魏酸(wkq20052108,纯度≥98%),毛蕊花糖苷(wkq20042004,纯度≥98%),以上对照品均来自于四川省维克奇生物科技有限公司。阿魏酸(凯马特天津化工科技有限公司,DST191112001,纯度≥98%);β-蜕皮甾酮(成都埃法生物科技有限公司,AF9022202,纯度≥98%)。松果菊苷(RP110632,纯度≥98%),新橙皮苷(XN220142,纯度≥98%),以上对照品均来自于中国食品药品检定研究院。磷酸(天津市光复精细化工研究所,色谱级),乙腈(美国Thermo Fisher公司,色谱级),甲醇(天津市康科德科技有限公司,色谱级),去离子水由超纯水机(Millipore-Q)制备。
2 方法与结果 2.1 济川煎中各指标成分同时测定 2.1.1 供试品溶液的制备济川煎物质基准制备方法:精密称取泽泻4.5 g,牛膝6.0 g,肉苁蓉7.5 g,升麻3.0 g,当归12.0 g,枳壳3.0 g于煎锅中,加超纯水300 mL,浸泡45 min,武火沸后文火加盖煎煮至130~140 mL,三层纱布趁热过滤,绞渣,滤液即济川煎物质基准煎煮液,70 ℃减压浓缩,经冷冻干燥,即得济川煎物质基准干膏粉。精密称取0.2 g济川煎干膏粉于三角瓶中,分别精密移取50%甲醇10 mL复溶,摇匀并称质量,400 W、40 kHz超声45 min,每隔10 min摇匀,取出后,于室温放冷,补足失质量,振匀,静置1 h,监测其溶解状态,将上清液过0.22 μm有机微孔滤膜,即得济川煎干膏样品供试品溶液。吸取10 μL进液相色谱仪,分析各指标成分。采用“中药色谱指纹图谱相似度评价系统(2012.130723版本)”软件计算指纹图谱相似度,并进行评价。
2.1.2 标准品溶液的制备精密称取β-蜕皮甾酮、新橙皮苷、松果菊苷、柚皮苷适量,加甲醇制成含53.02 μg/mL松果菊苷、4.69 μg/mLβ-蜕皮甾酮、96.73 μg/mL柚皮苷、53.12 μg/mL新橙皮苷的混合对照品溶液。
2.1.3 色谱条件色谱柱:Agilent ZORBAX SB-C18柱(4.6 mm×250 mm,3.5 μm);流动相:0.1%磷酸水(A)-乙腈(B);检测波长:320 nm和250 nm;(指纹图谱选择320 nm);流速:1.0 mL/min;柱温:30 ℃;进样量:10 μL。梯度洗脱,洗脱程序:0~10 min,5%~11%乙腈;10~30 min,11%~13.5%乙腈;30~40 min,13.5%~16%乙腈;40~45 min,16%~18%乙腈;45~55 min,18%~22%乙腈;55~65 min,22%~23.5%乙腈;65~70 min,23.5%~35%乙腈;70~75 min,35%~80%乙腈;75~80 min,80%乙腈;80~90 min,80%~90%乙腈;90~93 min,90%~5%乙腈。
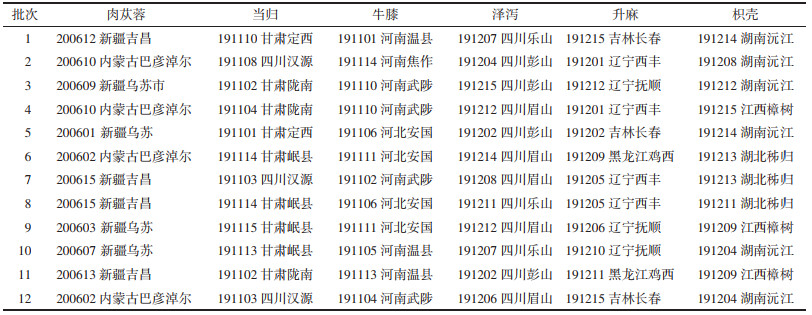
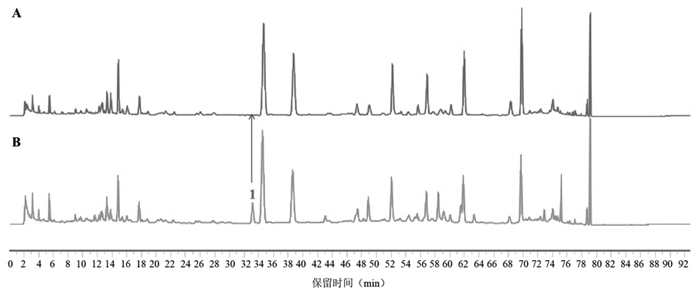
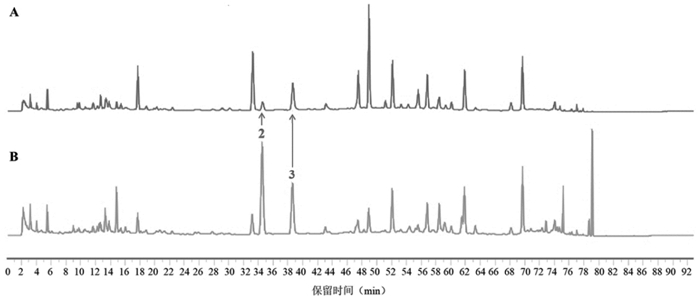
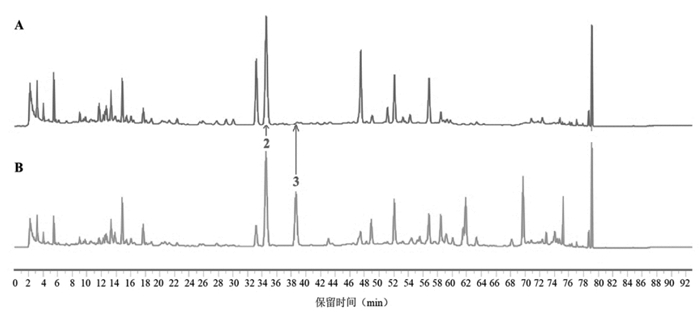
分别称取肉苁蓉阴性、当归阴性、牛膝阴性、泽泻阴性、枳壳阴性及升麻阴性的处方量药材,按“2.1”项下样品制备方法制备供试品溶液并进样分析,记录色谱图,结果见图 1~7。含量测定专属性:指认出肉苁蓉专属性成分为松果菊苷;枳壳的专属性成分为新橙皮苷和柚皮苷;牛膝专属性成分为β-蜕皮甾酮。指纹图谱专属性:以新橙皮苷为参照峰,对指纹图谱中14个共有峰进行化学成分的药味归属及6个化学成分的指认,见表 2、图 7,所建立的指纹图谱共有峰分离度好,特征性强,具有较强的处方代表性。该方法专属性良好。
|
| 注:1号峰为松果菊苷。 图 1 肉苁蓉阴性(A)、济川煎全方供试品(B)的HPLC图谱 |
|
| 注:2号峰为阿魏酸,3号峰为异阿魏酸,2、3号峰为当归、升麻共有成分故不作为济川煎的专属性成分。 图 2 当归阴性(A)、济川煎全方供试品(B)的HPLC图谱 |
|
| 注:2号峰为阿魏酸,3号峰为异阿魏酸。 图 3 升麻阴性(A)、济川煎全方供试品(B)的HPLC图谱 |
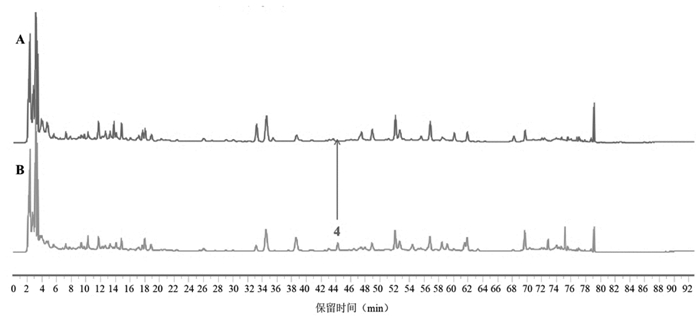
|
| 注:4号峰为β-蜕皮甾酮。 图 4 牛膝阴性(A)、济川煎全方供试品(B)的HPLC图谱 |
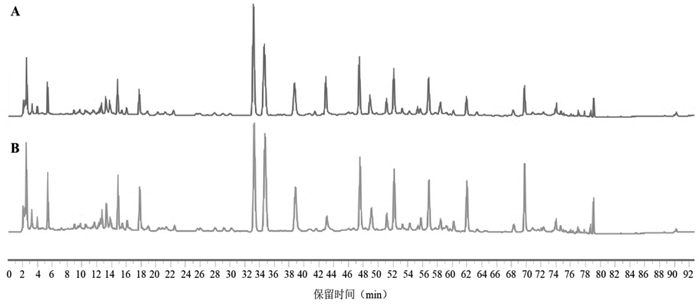
|
| 注:泽泻未出现专属特征峰。 图 5 泽泻阴性(A)、济川煎全方供试品(B)的HPLC图谱 |
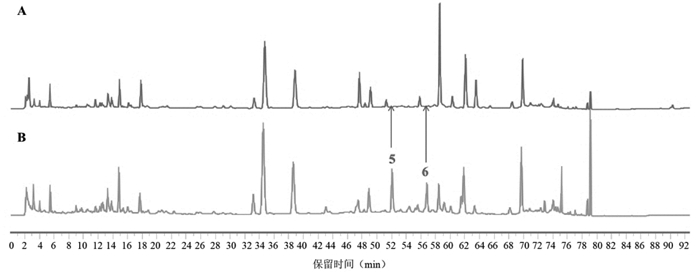
|
| 注:5号峰为柚皮苷,6号峰为新橙皮苷。 图 6 枳壳阴性(A)、济川煎全方供试品(B)的HPLC图谱 |
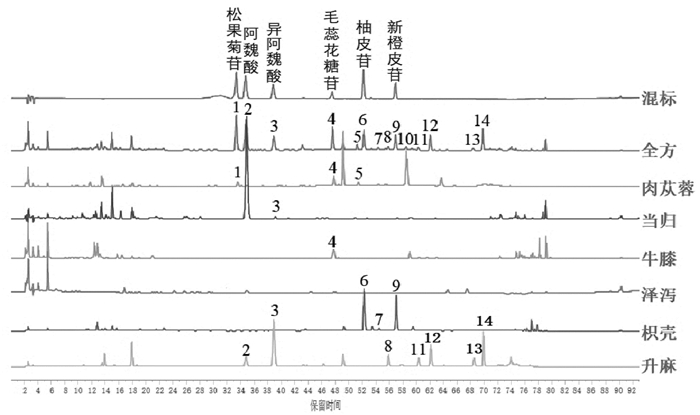
|
| 图 7 济川煎混合对照品、全方、各单味药材HPLC色谱图 |
取松果菊苷,β-蜕皮甾酮,柚皮苷,新橙皮苷对照品溶液,甲醇稀释成系列浓度,按“2.1.3”项下色谱条件测定指标成分,绘制标准曲线,得线性回归方程。结果可知:济川煎对照品松果菊苷,β-蜕皮甾酮,柚皮苷,新橙皮苷在各自浓度范围内线性关系r2≥0.999 8,线性关系良好。
精密吸取一定浓度的混合对照品溶液(指纹图谱选择济川煎样品溶液),按“2.1.3”项下色谱条件进样分析,连续进样6次,记录色谱图,测定指标成分峰面积。含量测定精密度:结果可知,松果菊苷,β-蜕皮甾酮,柚皮苷,新橙皮苷峰面积RSD值分别为0.24%、0.89%、0.50%和0.34%,表明仪器精密度良好。
指纹图谱精密度:结果见表 2,共有峰的相对保留时间RSD≤0.21%,表明该仪器精密度良好。
2.1.7 稳定性考察称取处方量药材,按“2.1.1”项下样品溶液制备方法制备供试品溶液于样品架放置0、2、4、8、12、24、36、48、72 h按“2.1.3”项下色谱条件进样分析,测定指标成分峰面积并计算指标成分含量。含量测定稳定性:新橙皮苷、β-蜕皮甾酮、松果菊苷及柚皮苷的峰面积RSD值分别为0.54%、2.32%、0.22%和0.29%,表明供试品溶液在72 h内稳定。指纹图谱稳定性:结果见表 2,各共有峰供试品溶液在72 h内稳定。
2.1.8 重复性考察取同一批济川煎干膏样品,按“2.1.1”项下供试品溶液制备方法制备供试品溶液,平行6份。按“2.1.3”项下色谱条件进样分析,测定各指标成分峰面积并计算指标成分的含量。含量测定重复性:结果新橙皮苷、β-蜕皮甾酮、松果菊苷及柚皮苷含量的RSD分别为1.03%、1.44%、1.05%和1.27%,表明方法重复性良好。指纹图谱重复性:结果见表 2,该指纹图谱方法重复性良好。
2.1.9 加样回收率考察精密称取已知4种指标成分含量的自制济川煎干浸膏粉6份,每份0.1 g,精密加入近似等含量的4种对照品溶液,按“2.1”项方法制备分析,并计算加样回收率。结果发现:柚皮苷、新橙皮苷、β-蜕皮甾酮、松果菊苷的平均加样回收率分别为(97.38±1.86)%、(102.83±0.91)%、(97.56±1.50)%、(103.35±1.05)%,表明该方法加样回收率良好。
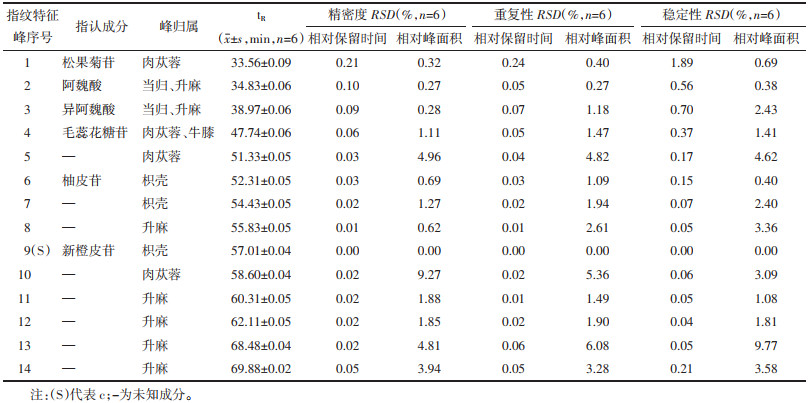
2.2 济川煎物质基准工艺研究 2.2.1 济川煎物质基准工艺考察按“2.1.1”项下供试品制备方法分别制备浸泡30 min、45 min、60 min不同浸泡时间;超纯水、自来水不同煎煮用水;武火,文火,文武火不同煎煮火候;加盖、不加盖;绞渣、不绞渣;200目滤布,倾倒离心,3层纱布不同过滤方式;50、60、70 ℃不同浓缩温度;真空、喷雾、冷冻干燥不同干燥方式的济川煎供试品溶液,在“2.1.3”项色谱条件下测定不同制备工艺对济川煎物质基准相关指标的影响,并计算济川煎物质基准多指标成分含量、出膏率及指纹图谱。
由表 4结果可知,浸泡时间为45 min,煎煮用水为超纯水,煎煮火候为文武火交替,绞渣,3层纱布过滤,70 ℃减压浓缩时松果菊苷,β-蜕皮甾酮,柚皮苷,新橙皮苷各指标成分的含量及出膏率较高;指纹图谱相似度均≥0.950,相似度结果良好。不加盖时,各指标成分含量较高,但煎煮工艺不稳定;因此优选加盖为济川煎物质基准煎煮工艺;而真空、喷雾、冷冻干燥3种干燥方式各指标成分含量差异不明显,考虑到冷冻干燥样品含水量低,易于处理,且低温有利于各化学成分的稳定,因此优选冷冻干燥为济川煎物质基准的干燥方式。
故济川煎物质基准最佳制备工艺为:精密称取泽泻4.5 g,牛膝6.0 g,肉苁蓉7.5 g,升麻3.0 g,当归12.0 g,枳壳3.0 g于煎锅中,加超纯水300 mL,浸泡45 min,武火沸后文火加盖煎煮至130~140 mL,3层纱布趁热过滤,绞渣,滤液即济川煎物质基准煎煮液,70 ℃减压浓缩,经冷冻干燥,得济川煎物质基准干膏粉。
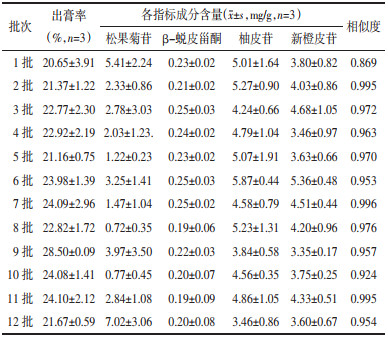
2.2.2 12批物质基准工艺验证经典名方济川煎制备工艺是否稳定可通过出膏率,含量测定及指纹图谱进行验证,而出膏率,含量测定及指纹图谱又受药材种类、制备工艺的影响。故采用“2.2.1”项下优化的制备工艺,制备12批济川煎物质基准干膏粉,每批平行制备3份,按“2.1.1”项供试品制备方法和“2.1.3”项下色谱条件进行测定,计算出膏率,含量测定及指纹图谱相似度。以验证济川煎物质基准制备工艺的稳定性,为济川煎质量控制研究提供工艺依据。由表 5,图8可知:12批济川煎全方出膏率在20.65%~28.50%之间;各指标成分松果菊苷含量在0.72~7.02 mg/g之间,柚皮苷在3.46~5.87 mg/g之间,新橙皮苷在3.35~5.36 mg/g之间,β-蜕皮甾酮在0.19~0.23 mg/g之间;由指纹图谱相似度结果可知:11批济川煎全方的指纹图谱相似度≥0.924,相似度结果良好,表明济川煎物质基准制备工艺和处方整体特征较为稳定。图8见开放科学(资源服务)标识码(OSID)。
在济川煎指标成分选择中由于阿魏酸、异阿魏酸、毛蕊花糖苷有干扰峰,故不作为指标性成分,因此选择既质量可控,又具专属性,既可溯源,又兼顾“君臣佐使”的松果菊苷、β-蜕皮甾酮、柚皮苷、新橙皮苷为济川煎物质基准质量控制的指标性成分,其中β-蜕皮甾酮首次作为济川煎指标性成分进行研究。在济川煎指纹图谱研究中,筛选出了14个共有特征峰并进行了药味归属及6个化学成分的指认,各特征峰分离度好、特征性强、具有较好的处方代表性[19]。在相似度评价中,第1批样品相似度较低,分析原因可能是,济川煎为多味药材共同煎煮,其中部分药材形状不规则,易黏附泥沙、非药用部位等,相同质量下出膏率低,使得某些化学成分含量出现差异;另外各单味药材产地、药用部位、饮片规格等也可能存在一定差异。济川煎物质基准工艺的研究以出膏率、多指标成分含量、指纹图谱相似度等关键质量属性及操作过程的可行性为评价指标,进行最佳研究工艺的筛选。由于药材饮片加水浸泡适宜的时间后,饮片膨胀疏松,有效成分更容易被煎出,因此根据药材吸水曲线和“煎药规范”进行济川煎饮片浸泡时间的参数考察[20]。中药煎煮后需过滤药渣,为避免汤剂放冷后可能造成部分有效成分凝结析出而使有效成分减少,因此在过滤时多采用趁热过滤,本研究采用三层纱布趁热过滤,简便、快捷,且能达到分离汤剂中杂质的目的。减压蒸发使溶液沸点降低,能防止或减少热敏成分的分解,且因密闭环境能减少污染,提高效率,故适用于工业扩大化生产[21],因此选择减压浓缩进行济川煎物质基准浓缩温度的考察。浓缩流浸膏在短时间内易发霉且不易保存,因此,对干燥方式进行了研究,优选出冷冻干燥作为济川煎物质基准的干燥方式。
本研究还给出了济川煎各指标成分不同产地批次的含量范围,为济川煎质量标准的制定提供一定的数据参考。因济川煎全方中当归、枳壳等药材含有挥发性成分,故后期应对济川煎单味药材、全方水煎液、物质基准复溶液的挥发性成分进行考察,以保证济川煎指标成分研究的完整性。研究建立的济川煎物质基准多成分含量测定方法,指纹图谱研究方法及物质基准工艺方法,较系统地反映了济川煎物质基准整体特征,为后续经典名方质量控制和物质基准的研究提供详实的参考依据。
| [1] |
顾尽晖, 何羽, 汤灵娇, 等. 济川煎对结肠慢传输型便秘模型大鼠血浆SP、肠组织ICC与肠推动力等因素影响的研究[J]. 北京中医药, 2018, 37(5): 410-414. GU J H, HE Y, TANG L J, et al. Study of effects of Jichuan Decoction on plasma SP, ICC of intestinal tissue and intestinal motility of model rats with colon slow transit constipation[J]. Beijing Journal of Traditional Chinese Medicine, 2018, 37(5): 410-414. |
| [2] |
陈桂芬, 王英豪, 林燕婷. 基于析因设计解析济川煎对小鼠肠蠕动主效应研究[J]. 辽宁中医药大学学报, 2017, 19(5): 56-59. CHEN G F, WANG Y H, LIN Y T. Study on the main effects of Jichuan Jian on intestinal peristalsis of mice based on factorial design[J]. Journal of Liaoning University of Traditional Chinese Medicine, 2017, 19(5): 56-59. |
| [3] |
李亚南, 许二平. 当归入胃经探讨[J]. 中国中医基础医学杂志, 2017, 23(6): 866-867. LI Y N, XU E P. Study on the theory of Angelica going into stomach meridian[J]. Chinese Journal of Basic Medicine in Traditional Chinese Medicine, 2017, 23(6): 866-867. |
| [4] |
霍明东, 张波, 陈玉根. 济川煎对"泻剂结肠"大鼠的治疗效果及作用机制研究[J]. 中国全科医学, 2016, 19(13): 1598-1601. HUO M D, ZHANG B, CHEN Y G. Therapeutic effect of Jichuan Decoction on rats with cathartic colon and its mechanism[J]. Chinese General Practice, 2016, 19(13): 1598-1601. DOI:10.3969/j.issn.1007-9572.2016.13.028 |
| [5] |
张喻然, 王波. 济川煎加味联合腹针对慢传输型便秘(脾肾阳虚型)疗效及对血清SP和NO水平的干预影响[J]. 中国中西医结合消化杂志, 2018, 26(3): 238-242. ZHANG Y R, WANG B. Clinical effect of Modified Jichuanjian combined with abdominal acupuncture in the treatment of slow transit constipation (deficiency of spleen and kidney yang type) and its influence on serum SP and NO[J]. Chinese Journal of Integrated Traditional and Western Medicine on Digestion, 2018, 26(3): 238-242. |
| [6] |
杜秋, 吴震. 基于阳虚便秘模型的肉苁蓉通便作用的量效关系及机制研究[J]. 中南药学, 2016, 14(1): 23-27. DU Q, WU Z. Mechanism and dosage-effect relationship of Cistanche on yang deficiency constipation model[J]. Central South Pharmacy, 2016, 14(1): 23-27. |
| [7] |
张双喜, 张相安, 安永康. 济川煎对老年慢性功能性便秘患者胃肠功能、血清肠神经递质及肠道菌群的影响[J]. 中国实验方剂学杂志, 2018, 24(22): 169-174. ZHANG S X, ZHANG X A, AN Y K. Effect of Iichuan Decoction on gastrointestinal function, serum intestinal neurotransmitters and intestinal flora in elderly with chronic functional constipation[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2018, 24(22): 169-174. |
| [8] |
徐小妹, 林文津, 张亚敏, 等. 泽泻汤降脂作用与肠道微生态的相关性探讨[J]. 中国实验方剂学杂志, 2017, 23(3): 116-121. XU X M, LIN W J, ZHANG Y M, et al. Hypolipidemic effect of Zexie Decoction and correlation with intestinal microflora[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2017, 23(3): 116-121. |
| [9] |
岳奇. 阳虚便秘动物模型的建立及济川煎治疗作用研究[D]. 太原: 山西省中医药研究院, 2017. YUE Q. The establishment of animal model with yang-deficiency and constipation and study on the therapeutic effect of ferry brew[D]. Taiyuan: Shanxi Provincial Institute of Traditional Chinese Medicine, 2017. |
| [10] |
付皓, 王晓林. 济川煎益火补土法治疗慢传输型便秘临床观察[J]. 四川中医, 2016, 34(8): 197-198. FU H, WANG X L. Clinical observation on the treatment of slow transit constipation by Jichuan Decoction Yi Huo Bu Tu method[J]. Journal of Sichuan of Traditional Chinese Medicine, 2016, 34(8): 197-198. |
| [11] |
冯福明, 李椿莹, 付军, 等. 济川煎加减结合生物反馈治疗出口梗阻型便秘的临床观察[J]. 安徽医药, 2019, 23(1): 160-163. FENG F M, LI C Y, FU J, et al. Clinical observation of Jichuan Decoction combined with biofeedback in treatment of outlet obstructive constipation[J]. Anhui Medical and Pharmaceutical Journal, 2019, 23(1): 160-163. |
| [12] |
包晗. 济川煎加减治疗直肠内脱垂(肾阳虚型)的临床研究[D]. 长春: 长春中医药大学, 2016. BAO H. Jichuanjian add and subtract in the treatment of rectum prolapse(kidney yang deficiency type) of clinical research[D]. Changchun: Changchun University of Chinese Medicine, 2016. |
| [13] |
陆燕虹. 自制润肠通便茶辅助治疗帕金森病伴便秘效果观察[J]. 中国乡村医药, 2016, 23(13): 34. LU Y H. Observation on the effect of self-made Runchang Tongbian tea in adjuvant treatment of Parkinson's disease with constipation[J]. Chinese Journal of Rural Medicine and Pharmacy, 2016, 23(13): 34. |
| [14] |
陈大超. 济川煎加味治疗帕金森病患者便秘的临床疗效[J]. 系统医学, 2019, 4(4): 1-2, 8. CHEN D C. Clinical curative effect of Jiawei Jichuan Decoction in treatment of constipation of patients with Parkinson's disease[J]. Systems Medicine, 2019, 4(4): 1-2, 8. |
| [15] |
何义川. 脑卒中后便秘的预见性早期护理干预效果观察[J]. 中国伤残医学, 2013, 21(1): 156-157. HE Y C. Predictive effect of early nursing intervention on constipation after stroke[J]. Chinese Journal of Trauma and Disability Medicine, 2013, 21(1): 156-157. |
| [16] |
姜楠, 孟湧生. 济川煎治疗缺血性中风恢复期便秘的疗效研究[J]. 光明中医, 2016, 31(9): 1267-1269. JIANG N, MENG Y S. Clinical investigation on the effect of Jichuan Decoction in treating convalescence constipation of ischemic stroke[J]. Guangming Journal of Chinese Medicine, 2016, 31(9): 1267-1269. |
| [17] |
孙燕, 顾慰萍. 癌症三阶梯止痛指导原则[M]. 北京: 北京医科大学出版社, 2002: 63-64. SUN Y, GU W P. Guideline for who cancer pain relief[M]. Beijing: Peking University Medical Press, 2002: 63-64. |
| [18] |
赵常国, 刘颖, 石颖, 等. 加味济川煎治疗阿片性便秘(阳虚型)45例临床观察[J]. 云南中医中药杂志, 2016, 37(5): 29-30. ZHAO C G, LIU Y, SHI Y, et al. Clinical observation on 45 cases of opioid constipation(yang deficiency type) treated by Jiawei Jichuan Decoction[J]. Yunnan Journal of Traditional Chinese Medicine and Materia Medica, 2016, 37(5): 29-30. |
| [19] |
施崇精, 李希, 冯建安, 等. 古代经典名方济川煎物质基准HPLC特征指纹图谱研究[J]. 中草药, 2020, 51(15): 3930-3936. SHI C J, LI X, FENG J A, et al. Study on HPLC characteristic fingerprint of substance benchmark of classical famous prescription of Jichuan Decoction[J]. Chinese Traditional and Herbal Drugs, 2020, 51(15): 3930-3936. |
| [20] |
曹宁宁. 济川煎物质基准的研究[D]. 天津: 天津中医药大学, 2020. CAO N N. Study on substance benchmark of Jichuan Decoction[D]. Tianjin: Tianjin University of Traditional Chinese Medicine, 2020. |
| [21] |
李舒艺, 伍振峰, 岳鹏飞, 等. 中药提取液浓缩工艺和设备现状及问题分析[J]. 世界科学技术-中医药现代化, 2016, 18(10): 1782-1787. LI S Y, WU Z F, YUE P F, et al. Analysis of current situation and problems in technologies and equipments for the concentration of liquid extraction of Chinese materia Medica(CMM)[J]. Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology, 2016, 18(10): 1782-1787. |
 2023, Vol. 42
2023, Vol. 42