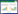文章信息
- 谢尔婷, 黄白兰, 李文龙, 李晓宇
- XIE Erting, HUANG Bailan, LI Wenlong, LI Xiaoyu
- 淫羊藿苷对人根尖牙乳头干细胞增殖及其骨向分化的影响
- Investigate the effect of icariin on proliferation and osteogenic differentiation of human apical papillary stem cells
- 天津中医药大学学报, 2023, 42(4): 486-490
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(4): 486-490
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.04.14
-
文章历史
收稿日期: 2023-03-08
2. 深圳市龙华区人民医院牙周病科, 深圳 518109;
3. 深圳市龙华区人民医院口腔颌面外科, 深圳 518109
2. Department of Periodontology, Shenzhen Longhua District People's Hospital, Shenzhen 518109, China;
3. Department of Oral and Maxillofacial Surgery, Shenzhen Longhua District People's Hospital, Shenzhen 518109, China
人根尖乳头干细胞(hSCAPs)是一种新的骨髓间充质干细胞群体,位于未成熟恒牙根尖乳头中[1]。hSCAPs具有自我更新、增殖、分化等干细胞特性,并具有向成骨、成脂分化的潜能,可用于免疫治疗和牙组织、骨、神经及血管组织的再生[1]。核因子-κB受体活化因子(RANK)、核因子-κB受体活化因子配体(RANKL)、骨保护素(OPG)是骨重塑的重要信号因子。其中,RANKL通常以同型三聚体的形式定位在成骨细胞和活化T细胞的细胞膜上,但部分也以分泌蛋白的形式存在;RANKL可与破骨细胞前体细胞膜上受体RANK相结合,使前体细胞在诱导后分化成破骨细胞,成熟后的破骨细胞在骨表面黏附,通过酸与溶解酶的不断分泌促进骨吸收[2];OPG在成骨细胞与骨髓基质细胞中呈高表达,并与RANKL有较好亲和力,可竞争性地阻止RANK与RANKL的结合,抑制破骨细胞的生成[3]。现有研究发现,淫羊藿苷(ICA)作为黄酮苷类提取物,其补骨效应不仅可以拮抗骨质疏松症,还能通过调节RANKL与OPG表达,影响成骨细胞增殖、分化[4]。但目前ICA对hSCAPs的影响与作用机制并不清楚。因此,本实验检测了ICA对hSCAPs增殖和骨向分化相关蛋白(OPG、RANKL)表达的影响及作用机制,现报道如下。
1 材料与方法 1.1 主要材料青-链霉素混合液、MEM培养基(生产企业:深圳市安培生物科技有限公司);ICA、胎牛血清(生产企业:武汉普诺赛生命科技有限公司);胶原酶I、胰蛋白酶、CD31、CD90、CD146抗体等(生产企业:赛默飞世尔科技公司);CCK-8试剂盒、SYBR Green Realtime PCR试剂、RIPA裂解液及高纯总RNA快速提取试剂盒(生产企业:广州吉赛生物科技有限公司)。本实验已通过深圳市龙华区人民医院伦理委员会的审批。
1.2 方法 1.2.1 hSCAPs的分离、体外培养和鉴定收集年轻患者(18~20岁)的第三磨牙,磷酸盐缓冲溶液(PBS)冲洗,无菌条件下用手术剪剪下根尖乳头,并将其彻底剪碎,然后在室温下以1 000 r/min的转速离心5 min,离心半径为9.8 cm收集沉淀,37 ℃下以胶原酶I(3 mg/mL消化1 h后,收集未消化的沉淀。将沉淀悬浮在4 mL含20%胎牛血清+1%青-链霉素混合的MEM完全培养基中,于37 ℃,5%CO2培养箱中培养5 d。于显微镜下观察细胞每日的生长情况,每3 d换1次培养基,直至细胞覆盖面积在80%左右。通过胰蛋白酶将细胞消解、洗涤、传代、扩大培养,最终获得hSCAPs[5]。
1.2.2 hSCAPs的鉴定将hSCAPs按5×103个细胞/孔接种于6孔细胞培养板中进行培养,直至覆盖率达到50%~60%。1)成骨诱导:以10 mmol/L甘油酸钠+50 g/ml抗坏血酸+0.1 mol/L地塞米松+MEM完全培养基配制成骨培养液,将hSCAPs置于其中进行3周的培养,培养期间隔3 d换1次培养液。收集的细胞经茜素红染色后于镜下观察是否有矿化结节形成。2)成脂诱导:以0.5 mmol/L IBMX+60 mol/L吲哚美辛+10 g/ml胰岛素+0.5 mol/L氢化可的松+MEM完全培养基配制成脂培养液,将hSCAPs置于其中进行2周的培养,培养期间隔3天换一次培养液。收集的细胞经油红O染色后于镜下观察hSCAPs成脂能力。3)免疫表型检测:hSCAPs和FITC偶联的CD31,CD90或CD146在4 ℃、避光条件下温育30 min,用流式细胞仪和FlowJo软件进行检测分析。
1.2.3 hSCAPs增殖实验在体外培养至第三代的hSCAPs,以2×103个细胞/孔的初始浓度加入96孔板,设置温度37 ℃,CO2浓度5%,进行24 h培养。然后弃去培养液,以随机法均分为5组,分别加入MEM培养基或不同浓度的ICA培养1、3、5、7 d,细胞收集后以CCK-8法检测增殖状态。
1.2.4 ICA对OPG和RANKL表达调控的检测体外培养至第3代的hSCAPs细胞在体外与不同浓度的ICA温育48 h后,收集细胞,并用PBS清洗。然后用Trizol提取总RNA。通过cDNA逆转录试剂盒,将mRNA逆转录成cDNA,并以此为模板,通过iQ SYBR Green Supermix试剂盒对骨向分化因子OPG和RANKL的表达进行qRT-PCR检测。GAPDH设为对照。检测所使用的引物见表 1。
hSCAPs和不同浓度的ICA温育48 h后,在RIPA裂解液中进行裂解。收集裂解的上清液,通过15% SDS-PAGE将上清液中的蛋白进行电泳分离,然后转至PVDF膜上,通过封闭、一抗杂交、二抗孵育,然后用化学发光法检测杂交所形成的复合物。GAPDH作为对照。
1.3 统计学分析数据用SPSS 24.0软件处理,计量资料用均数±标准差(x±s)表述,以单因素方差分析,P<0.05表示有统计学差异。
2 结果 2.1 hSCAPs分离培养和形态观察人磨牙的根尖乳头部分如图 1A示,粉红色,呈肾形。从根尖乳头分离出的hSCAPs在体外培养8 d后,形成菌落,大部分细胞呈纺锤形如图 1B所示。体外培养18~20 d后,培养瓶瓶底大约70%~80%被细胞所覆盖。
|
| 图 1 hSCAPs体外培养形态观察(×100倍) |
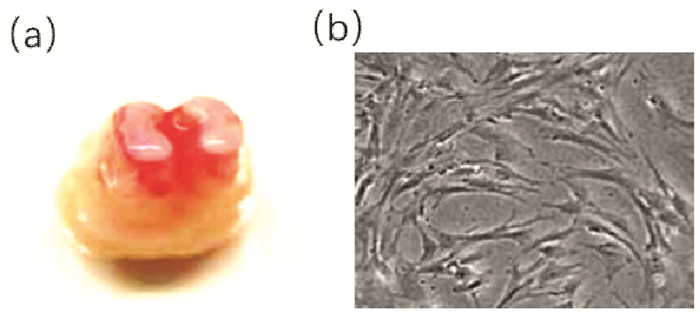
hSCAPs经过成骨诱导培养21 d后,使用茜素红染色,镜下清楚可见褐红色块状矿化结节,如图 2A所示。hSCAPs经过成脂诱导培养14 d,进行油红O染色后,镜下清楚可见红色脂滴,如图 2B。
|
| 图 2 hSCAPs成骨、成脂诱导后镜下观察(×400) |
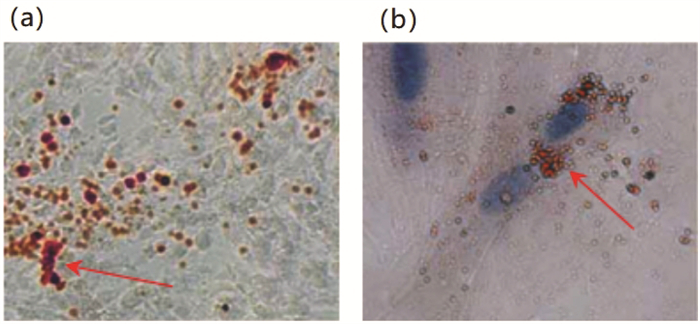
通过流式染色技术检查hSCAPs表面蛋白表达情况,结果显示,CD31、CD90和CD146细胞表达率分别为4.03%、96.18%和95.42%。见图 3。
|
| 图 3 hSCAPs表面蛋白表达 |
通过CCK-8检测体外培养的第3代hSCAPs,在与不同浓度的ICA温育后,不同温育时间下的增殖情况。第1天各组细胞的增殖能力无明显差异(P > 0.05);第3天,ICA显著促进了hSCAPs的增殖(P < 0.05)。当ICA浓度为0.1 μmol/L时,其对hSCAPs的增殖促进作用最强,但这种促进作用并未随着ICA浓度的增加而增强。第5天,ICA仍能促进hSCAPs的增殖(P < 0.05)。见图 4。
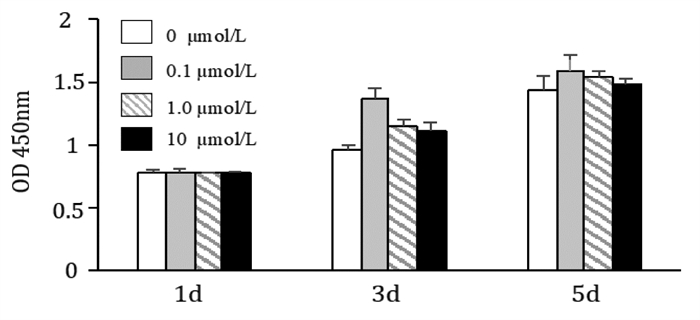
|
| 注:与对照组比较,*P<0.05,**P<0.01。 图 4 不同温育时间ICA促进hSCAPs的增殖情况 |
体外培养的第3代hSCAPs与不同浓度ICA温育48 h后。与对照组比较,ICA促进了OPG的mRNA转录和翻译以及蛋白表达,但降低了RANKL的基因表达和蛋白表达水平(P < 0.05)。见图 5。
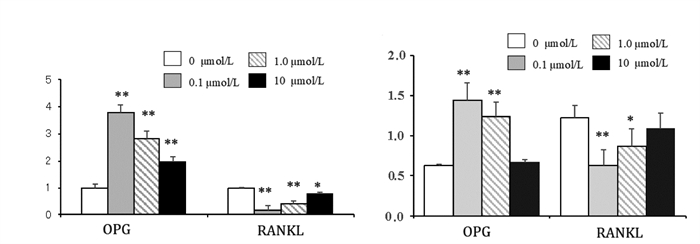
|
| 注:A. mRNA水平;B.蛋白水平;与对照组比较,*P<0.05,**P<0.01。 图 5 ICA调控hSCAPs中OPG和RANKL的表达 |
ICA降低了hSCAPs中的OPG/RANKL比值(图 6A)。当ICA浓度为0.1 μmol/L时,OPG/RANKL比值最大(图 6A-B)。
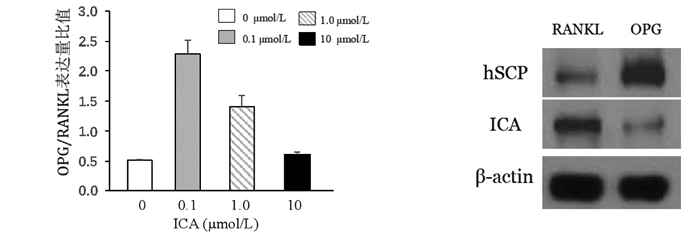
|
| 注:A. OPG/RANKL比值统计学分析;B. hSCAPs和0.1 μmol/L ICA温育48 h后OPG和RANKL蛋白表达。 图 6 ICA对OPG/RANKL比值的影响 |
hSCAPs是人根尖牙乳头的多潜能间充质干细胞,能够向成骨细胞、成牙本质细胞、脂肪细胞及成软骨细胞方向分化[6]。从顶端乳头分离的间充质细胞在体外诱导后形成显著的茜素红染色阳性矿化结节和油红O染色阳性脂滴。这些分离的细胞呈现典型的hSCAPs表型:CD31+、CD90+、CD146+[6]。CD90和CD146是间充质干细胞标记蛋白,而CD31则是内皮细胞的标记蛋白[7]。本次研究中,成功分离了hSCAPs,并在体外培养过程中保持了hSCAPs的干细胞特性。还有研究指出,OPG/RANKL信号通路对破骨细胞分化有着重要影响[2]。RANKL与RANK的结合,使核因子-κB(NF-κB)等信号通路被激活,进一步促进了破骨细胞的形成与分化。而OPG作为RANKL的拮抗物,能竞争性地结合RANKL,通过抑制RANK-RANKL信号的传递达到影响hSCAPs骨向分化的作用。
ICA是淫羊藿的主要活性成分,研究表明,在大鼠正畸牙根吸收模型中,ICA的局部使用减少了磨牙在矫治力作用下的移动,从而起到治疗的效果[8]。此外,ICA还可通过调控RANKL表达,抑制牙周炎牙槽骨吸收[9]。然而,ICA对于牙干细胞的作用尚不清楚。本研究检查了ICA对hSCAPs骨向分化的影响。qRT-PCR结果显示在转录水平上,ICA上调了hSCAPs的OPG表达,抑制了RANKL的表达[10]。鉴于OPG和RANKL在干细胞骨向分化中的作用,ICA可能通过调节hSCAPs细胞中OPG/RANKL比值来影响hSCAPs的分化。qRT-PCR数据还显示,ICA浓度为0.1 μmol/L时,其对OPG和RANKL的mRNA调节作用最强。当ICA浓度增加到1 μmol/L或10 μmol/L时,这种调控作用反而下降。类似的调控模式在ICA对hSCAPs中OPG和RANKL的蛋白表达调控中也被观察到。需要指出的是,ICA对OPG和RANKL在蛋白水平的影响弱于在mRNA水平上的调控,说明OPG和RANKL在蛋白翻译过程中可能还存在其他调控机制。
OPG/RANKL比值是骨吸收的决定性因素。不论是OPG低表达还是RANKL过表达,都有可能引起骨质流失[11-12]。本研究结果显示,ICA的刺激导致hSCAPs中OPG/RANKL比值上升,说明ICA促进了hSCAPs的骨向分化。尤其当ICA浓度为0.1 μmol/L时,OPG/RANKL比值达到最高。然而,ICA浓度和hSCAPs骨化程度之间的关系需要更多的研究来解析。
本研究还检测了ICA对hSCAPs增殖的影响。结果表明不同浓度ICA刺激3天后,hSCAPs呈现不同程度的增殖,且均明显高于未接受ICA刺激的hSCAPs的增殖(P < 0.05)。ICA刺激5天后,hSCAPs仍保持增殖能力,但增殖的速度明显慢于前3 d的速度。与其他浓度相比,当ICA浓度为0.1 μmol/L时,hSCAPs的增殖能力最强,这个结果和ICA诱导后的hSCAPs中OPG/RANKL比值变化的趋势一致,说明ICA诱导hSCAPs增殖的同时,可能影响随后的骨向分化过程。
综上所述,本研究证明从人根尖乳头分离的骨髓间充质的干细胞在体外培养后仍可保持其多向分化的潜能,合理诱导后,均获得成骨及成脂能力。在ICA的刺激下,hSCAPs的增殖能力提高,在mRNA和蛋白水平上促进了OPG的表达,抑制了RANKL的表达。本研究为体外调节hSCAPs的骨向分化以及hSCAPs在临床牙疾病治疗上的应用提供了理论指导和数据支持。
| [1] |
SANZ J L, FORNER L, ALMUDÉVER A, et al. Viability and stimulation of human stem cells from the apical papilla (hSCAPs) induced by silicate-based materials for their potential use in regenerative endodontics: a systematic review[J]. Materials, 2020, 13(4): 974. DOI:10.3390/ma13040974 |
| [2] |
LIU Y, XU Z J, WANG Q Q, et al. Selective regulation of RANKL/RANK/OPG pathway by heparan sulfate through the binding with estrogen receptor β in MC3T3-E1 cells[J]. International Journal of Biological Macromolecules, 2020, 161(6): 1526-1534. |
| [3] |
王德欣, 许战武, 裴国献. 骨髓间充质干细胞在淫羊藿苷/羟基磷灰石/聚乳酸-羟基乙酸共聚物支架上的成骨[J]. 中国组织工程研究, 2020, 24(25): 3974-3980. WANG D X, XU Z W, PEI G X. Osteogenesis of bone marrow mesenchymal stem cells on hydroxyapatite/icariin/poly(lactic-co-glycolic acid) scaffolds[J]. Chinese Journal of Tissue Engineering Research, 2020, 24(25): 3974-3980. |
| [4] |
章晓云, 李华南, 陈跃平. 淫羊藿苷防治股骨头坏死分子机制研究进展[J]. 中国骨质疏松杂志, 2020, 26(11): 1694-1699. ZHANG X Y, LI H N, CHEN Y P. Research progress of molecular mechanism of icariin in the prevention and treatment of femoral head necrosis[J]. Chinese Journal of Osteoporosis, 2020, 26(11): 1694-1699. DOI:10.3969/j.issn.1006-7108.2020.11.025 |
| [5] |
ZHOU C C, ZHANG D M, ZOU J, et al. Substrate compliance directs the osteogenic lineages of stem cells from the human apical papilla via the processes of mechanosensing and mechanotransduction[J]. ACS Applied Materials & Interfaces, 2019, 11(29): 26448-26459. |
| [6] |
闫丽萍, 钱长鑫, 马骋, 等. 电针对神经病理性痛大鼠脊髓环磷酸腺苷、蛋白激酶A以及环磷酸腺苷反应元件结合蛋白通路的影响[J]. 针刺研究, 2018, 43(12): 788-792. YAN L P, QIAN C X, MA C, et al. Effect of electroacupuncture of "Weizhong" (BL 40)and "Huantiao" (GB 30) on cAMP-PKA-CREB signaling of spinal cord in rats with neuropathic pain[J]. Acupuncture Research, 2018, 43(12): 788-792. |
| [7] |
李雪健, 王忠山, 刘茜, 等. 釉基质衍生物改性后的牙本质表面对人牙周膜干细胞的影响[J]. 实用口腔医学杂志, 2019, 35(3): 330-334. LI X J, WANG Z S, LIU Q, et al. The biological effects of enamel matrix derivative modified dentin matrix on human periodontal stem cells[J]. Journal of Practical Stomatology, 2019, 35(3): 330-334. |
| [8] |
ZHANG X L, HAN N N, LI G Q, et al. Local icariin application enhanced periodontal tissue regeneration and relieved local inflammation in a minipig model of periodontitis[J]. International Journal of Oral Science, 2018, 10(2): 19. DOI:10.1038/s41368-018-0020-3 |
| [9] |
王兰珠, 韩博, 于淑婷, 等. 淫羊藿苷对正畸牙齿移动及牙周组织改建的影响[J]. 空军医学杂志, 2018, 34(3): 189-191, 195. WANG L Z, HAN B, YU S T, et al. Effect of icariin on orthodontic tooth movement and periodontal tissue remodeling[J]. Medical Journal of Air Force, 2018, 34(3): 189-191, 195. |
| [10] |
农冬梅, 覃雅庆, 周华, 等. 白细胞介素17通过激活p38MAPK信号通路调控人牙周膜成纤维细胞RANKL和OPG的表达[J]. 细胞与分子免疫学杂志, 2019, 35(6): 545-551. NONG D M, QIN Y Q, ZHOU H, et al. IL-17 regulates the expression of RANKL and OPG in human periodontal ligament fibroblasts by activating p38MAPK signaling pathway[J]. Chinese Journal of Cellular and Molecular Immunology, 2019, 35(6): 545-551. |
| [11] |
钱康, 范永升. 左归丸联合温和灸调节骨质疏松症模型大鼠OPG/RANKL轴的作用研究[J]. 中华中医药杂志, 2018, 33(3): 881-885. QIAN K, FAN Y S. Effects of Zuogui Pills combining mild-warm moxibustion on OPG/RANKL of osteoporosis model rats[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2018, 33(3): 881-885. |
| [12] |
韩克光, 申勇涛, 原恺, 等. 钙螯合羊骨胶原多肽抑制骨质疏松发生的RANK/RANKL/OPG信号机制[J]. 畜牧兽医学报, 2018, 49(5): 1047-1053. HAN K G, SHEN Y T, YUAN K, et al. Regulation of RANK/RANKL/OPG signal pathway by calcium chelated sheep bone collagen peptide in inhibiting the occurrence of osteoporosis[J]. Chinese Journal of Animal and Veterinary Sciences, 2018, 49(5): 1047-1053. |
 2023, Vol. 42
2023, Vol. 42