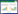文章信息
- 郭红磊, 赵克勤, 宋彦奇, 王爱迪, 刘宝山
- GUO Honglei, ZHAO Keqin, SONG Yanqi, WANG Aidi, LIU Baoshan
- 基于网络药理学与分子对接技术探讨散偏汤治疗偏头痛的作用靶点与分子机制
- Exploring the targets and molecular mechanisms of San Miguel Tang in the treatment of migraine based on network pharmacology and molecular docking techniques
- 天津中医药大学学报, 2023, 42(4): 506-514
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(4): 506-514
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.04.17
-
文章历史
收稿日期: 2023-03-08
2. 河北省中医院, 石家庄 050000;
3. 天津医科大学总医院, 天津 300052
2. Hebei Provincial Hospital of Traditional Chinese Medicine, Shijiazhuang 050000, China;
3. General Hospital of Tianjin Medical University, Tianjin 300052, China
偏头痛,又称原发性血管性头痛,是反复发作、单侧或双侧的搏动性剧烈头痛,常合并畏光、畏声、恶心等自主神经系统功能障碍症状[1],女性发病率较高,急性期偏头痛发病率女性约为17.4%,男性约为5.7%[2]。研究表明[3]约38%的偏头痛患者需要进行预防性治疗,但实际治疗中却无法实现。
偏头属于中医“头风”“脑风”“首风”的范畴。《素问·风论》:“风气循风府而上,则为脑风”,认为风邪是发病基础,在内外因作用下,邪实伤正,气血瘀滞,脑络不通,发为头痛。散偏汤出自清代陈世铎编著的《辨证录》,主要用于治疗头痛发作或左或有,时轻时重,悠悠不已,经久不愈。本方不良反应少,耐受性好,疗效显著,临床应用广泛[4],但其成分复杂,作用通路众多,药效机制不明。网络药理学与分子对接技术基于“疾病-药物-基因-靶点”相互作用,可整体、系统地对中药组方与疾病之间进行多成分、多靶点、多途径分析,是明确中药药理作用的重要手段之一,在预测中药潜在活性成分、作用靶点与通路中得到广泛应用[5]。
1 材料与方法 1.1 散偏汤活性成分的筛选利用中药系统药理学数据库与分析平台(TCMSP,https://tcmsp-e.com/),分别以川芎、白芷、白芍、白芥子、香附、柴胡、郁李仁、甘草为关键词进行检索,以口服生物利用度(OB)≥30%和类药性(DL)≥0.18[6]为筛选条件,获得药物活性成分。
1.2 散偏汤蛋白互作网络构建将药物活性成分导入STRING数据库(https://www.string-db.org/)构建蛋白质-蛋白质相互作用网络(protein protein interaction network,PPI network),并得到药物成分对应的相关靶点,分析药物关键成分与作用靶点的关系。
1.3 偏头痛相关靶点筛选通过GeneCards数据库(https://www.genecards.org/)、OMIM数据库(https://omim.org/)[7],以“migraine”为检索词,将所得基因合并后删除重复值,得到偏头痛的疾病靶点基因。
1.4 GO生物学过程富集分析和KEGG通路富集分析应用Rx64 4.1.1软件将药物靶点和疾病靶点取交集,得到散偏汤治疗偏头痛的潜在作用靶点,绘制韦恩图,并进行GO富集分析和KEGG信号通路富集分析,将分析结果进行可视化处理,制作气泡图。
1.5 “药物-成分-靶点-通路”网络构建运用CytoScape 3.7.1软件构建“中药-成分-靶点-通路”网络,并进行网络拓扑学参数分析。
1.6 分子对接验证选取药物核心成分与疾病关键靶点基因,应用蛋白质数据库(Protein Data Bank,PDB,)下载核心靶点蛋白的3D结构,利用PyMOL、AutoDockTools对主要蛋白进行去水、删除原配体、加氢、计算电荷等操作后保存,作为蛋白受体,通过相关文献查阅,设置Grid Box格点中心位置坐标,定义盒子大小;从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)中下载主要成分的sdf格式文件,利用Chem3D对其进行优化后,载入AutoDockTools添加原子电荷,设置可旋转键,作为对接配体。通过PyMOL对结合能最低的组合进行相互作用模式分析及结合位点可视化。
2 结果 2.1 散偏汤活性成分的筛选结果通过TCMSP数据库查找和文献查询,按条件进行筛选后,共得到156个活性成分表 1见开放科学(资源服务)标识码(OSID),获得对应靶点228个。
将散偏汤的活性成分及对应靶点导入Cytoscape 3.7.1软件,构建“中药-成分-靶点”网络图,图 1见OSID。网络由372个节点和3 035条边组成。预测槲皮素、山奈酚、异鼠李素、β-谷甾醇为散偏汤治疗偏头痛的主要活性成分,其次为麦芽糖醇、8-异戊烯基-莰菲醇、木犀草苷、7-甲氧基-2-甲基异黄酮、芒柄花黄素、柚皮苷、美迪紫檀素、甘草查尔酮A、四氢帕马汀、维斯体素、刺果甘草查耳酮等,见表 2。
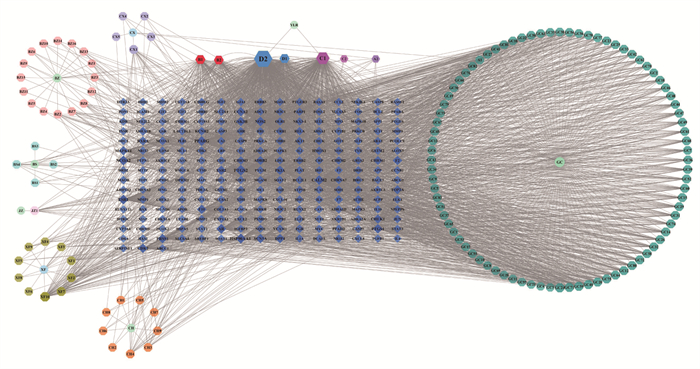
|
| 图 1 |
通过GeneCards和OMIM数据库检索,收集到与偏头痛相关的已知靶点3 199个,应用Rx64 4.1.1软件将散偏汤靶点基因与偏头痛靶点基因取交集,绘制韦恩图,得到141共有靶点,见图 2。表明药物配伍使用,能够协同作用于共同靶点,提高疗效。共同靶点基因主要包括胱天蛋白酶3(CASP3)、白介素-1β(IL-1β)、前列腺素G/H合酶2(PTGS2)激素受体,基质金属蛋白酶9(MMP9)、丝裂原活化蛋白激酶3(MAPK3)等。
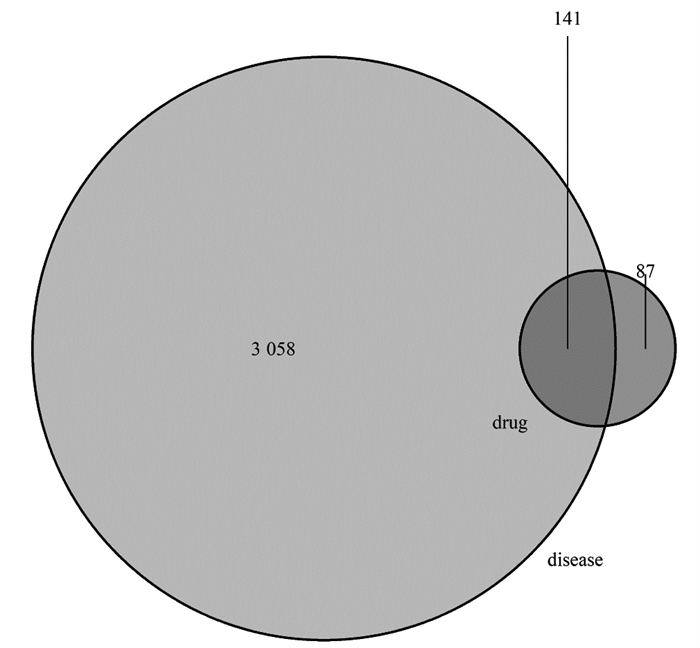
|
| 图 2 散偏汤与偏头痛共同靶点韦恩图 |
构建散偏汤对偏头痛的体内反应网络,进行可视化处理,见图 3。该网络包含141个节点,2 475种相互作用关系,平均节点度为35.1,平均局部聚类系数为0.631,边缘预期数量774条。表明散偏汤的活性成分对应的多个靶点之间联系密切,发挥协同治疗作用。
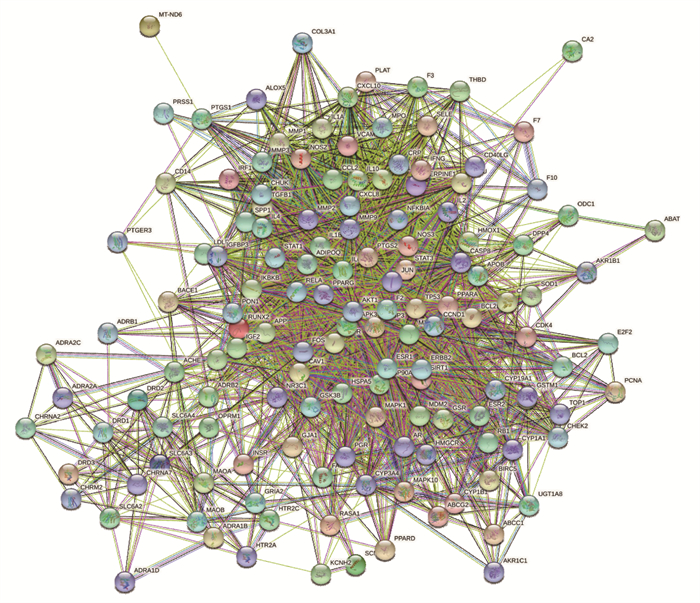
|
| 图 3 散偏汤“药物-疾病”共同靶点PPI数据网络 |
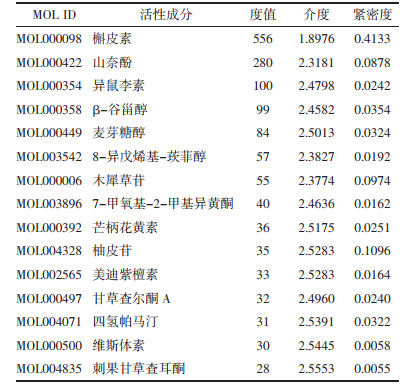
利用Cytoscape 3.2.1软选取节点自由度(Degree)在中位数2倍以上、Betweenness Centrality>0.01、Clustering Coefficient>0.45的标准进行筛选,得到15个核心基因进行靶点网络拓扑分析(表 3)。越靠近网络的核心位置,在蛋白互作网络中发挥更关键调控作用,CASP3、IL-1B、JUN、PTGS2、MMP-9、MAPK3这6个靶点位于网络的核心位置,在蛋白互作网络中发挥关键调控作用。
将141个“药物-疾病”交集靶点进行GO和KEGG通路富集分析,见图 4。GO富集分析选择生物学过程(Biological process,BP)、细胞组成(Cellular compo- nent,CC)和分子功能(Molecular function,MF)3个模块进行功能注释。其中BP分析富集条目2 263个、CC分析中富集条目75个、MF分析中富集条目163个。BP方面主要与涉及对异物刺激的反应、细胞对异物刺激的反应、对脂多糖的反应、对细菌来源的分子的反应、对辐射的反应等;CC方面涉及薄膜筏子、膜微域、质膜的外侧、内质网腔体、内细胞囊泡等;MF方面,主要涉及DNA结合转录因子结合、信号受体激活剂的活性、细胞因子受体结合、RNA聚合酶Ⅱ特异性DNA结合转录因子结合、泛素类蛋白连接酶的结合等。
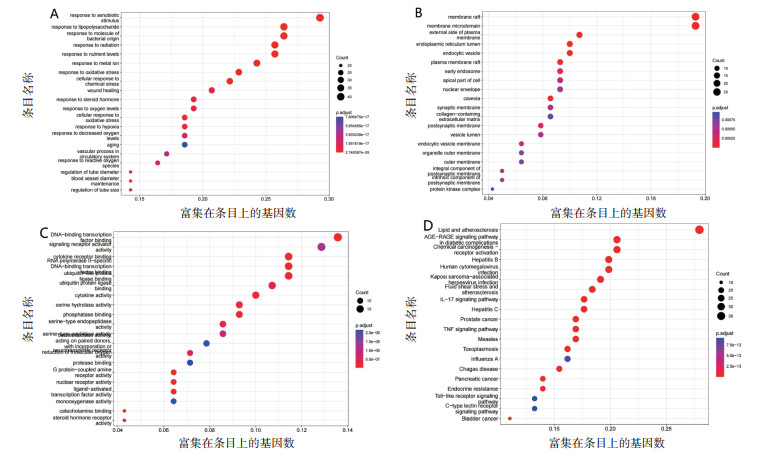
|
| 注:A. GO生物过程;B. GO细胞组成;C. GO分子功能;D. KEGG信号通路富集。 图 4 “药物-疾病靶点”交集基因GO、KEGG富集图 |
通过对141个靶点进行KEGG通路富集分析,共得到KEGG富集结果168条,根据P值选取排名前20的结果绘制高级气泡图,散偏汤治疗偏头痛主要涉及脂质和动脉硬化、AGE-RAGE信号通路、IL-17信号传导途径、MAPK信号传导途径、TNF信号传导途径、内分泌抵抗等,见表 4,发现偏头痛的发病机制与调节炎症因子、激素水平、中枢神经功能、维持血管稳态、免疫功能状态等有关。
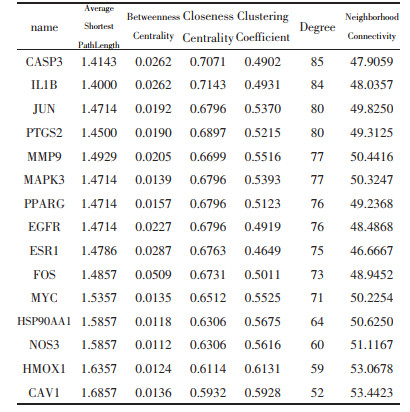
构建“中药-成分-潜在靶点-通路”网络,见图 5,并进行网络拓扑学参数分析,见表 5。该网络包括446个节点(8个药物、130个化合物、141个靶点、167条通路)和3 621条边。经网络拓扑学分析,化合物的平均度值为11.53,高于该均值的化合物有59个;靶点的平均度值为24.62,高于该均值的靶点有47个;通路的平均度值为12.72,高于该均值的靶点有76个。
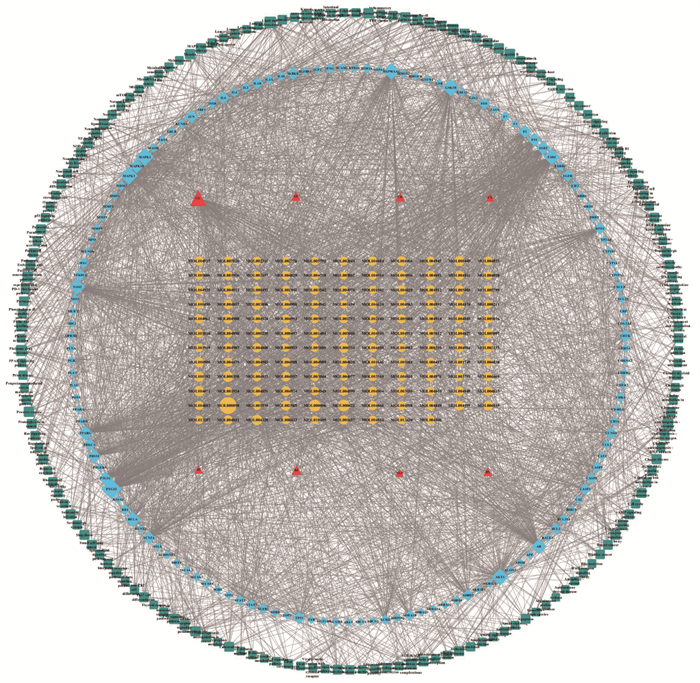
|
| 图 5 “药物-成分-靶点-通路”网络 |
根据以上靶点蛋白互作网络Degree值分析结果,选取主要活性成分槲皮素、木犀草苷和山奈酚,核心靶点PTGS2、MAPK1和MAPK3进行分子对接。结合能与结合活性呈反比,结合能越低,结合活性越强,结构越稳定,结合能<-5.0 kcal/mol可认为分子之间结合活性较强[8],可成为活性成分配体与核心蛋白受体期契合较好的筛选标准。通过PyMOL分别对结合能最低的组合进行相互作用模式分析及结合位点可视化,并进行3D图结果展示,见图 6-8,靶蛋白以蓝绿色表示,主要成分槲皮素以红色表示、木犀草苷以黄色表示,山奈酚以绿色表示。结果显示,各化合物与蛋白对接的结合能均小于-8.0 kcal/mol,说明槲皮素、木犀草苷、山奈酚与PTGS2、MAPK1、MAPK3结合力较好,发生相互作用的可能性较高,见表 6。
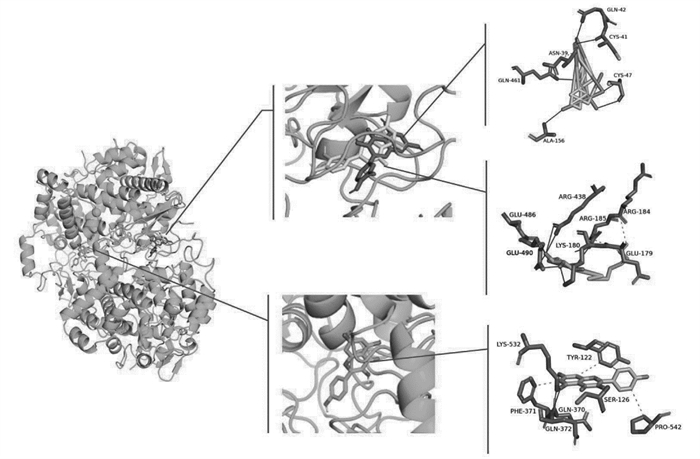
|
| 图 6 槲皮素、木犀草苷、山奈酚与PTGS2的分子对接模式图和结合位点示意图 |
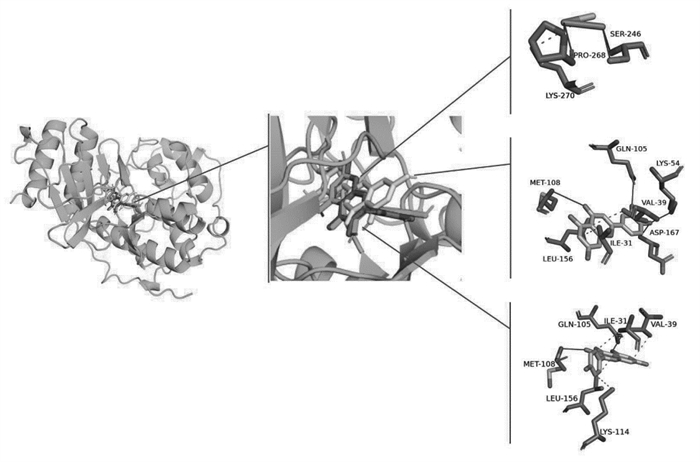
|
| 图 7 槲皮素、木犀草苷、山奈酚与MAPK1的分子对接模式图和结合位点示意图 |
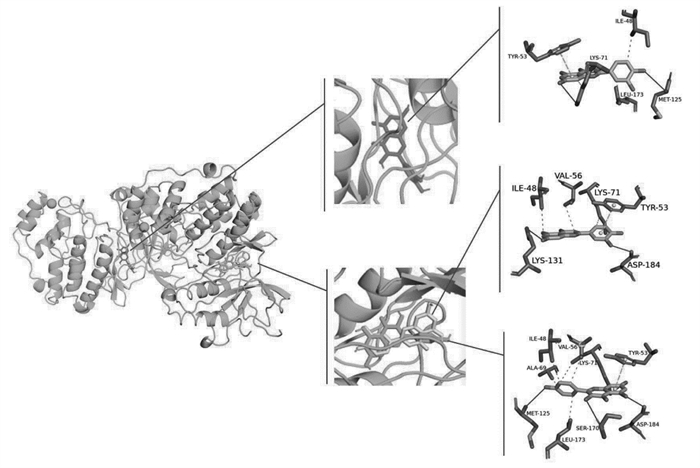
|
| 图 8 槲皮素、木犀草苷、山奈酚与MAPK3的分子对接模式图和结合位点示意图 |
中医偏头痛辨证应分虚实,实证主要由风、火、痰、瘀为主;虚症由气虚、血虚、肾虚、阴虚所致。患者感受外邪,侵犯少阳经脉,导致气血运行不畅,风、火、痰、瘀相互为患,头痛在侧,为少阳经过之地,厥阴与少阳表里相合,肝木乘脾,气机不畅,痰湿内生,瘀阻血脉,发为头痛,日久由实转虚,缠绵难遇。发病阶段,以“肝胆气郁,瘀阻脑络”为病机之根本,清代医家陈士铎《辨证录》中云:“虽风入于少阳之胆,似乎解郁宜解其胆,然而胆与肝为表里,治胆者必须治肝。况郁气先伤肝而后伤胆,肝舒而胆亦舒也,方用散偏汤”。散偏汤由川芎、白芷、白芍、白芥子、香附、柴胡、郁李仁、甘草组成,以“疏调气机,通络止痛”为治疗原则。本方重用川芎上行头目,下达气海,为血中气药,尤善治少阳、厥阴经头痛,香附为气中血药,入血分助川芎祛瘀通络止痛,白芷袪风散寒止痛,郁李仁理气解郁,柴胡入肝胆经,载药上行,直达头面,白芥子引药深入,直达病所,兼豁痰利气之功,白芍防诸药辛散太过,耗伤阴液,甘草既可与白芍相合,酸甘化阴,缓急止痛,又兼调和诸药。诸药合用,行气解郁兼通络之功,调达气血寓祛痰之用,见图 9。
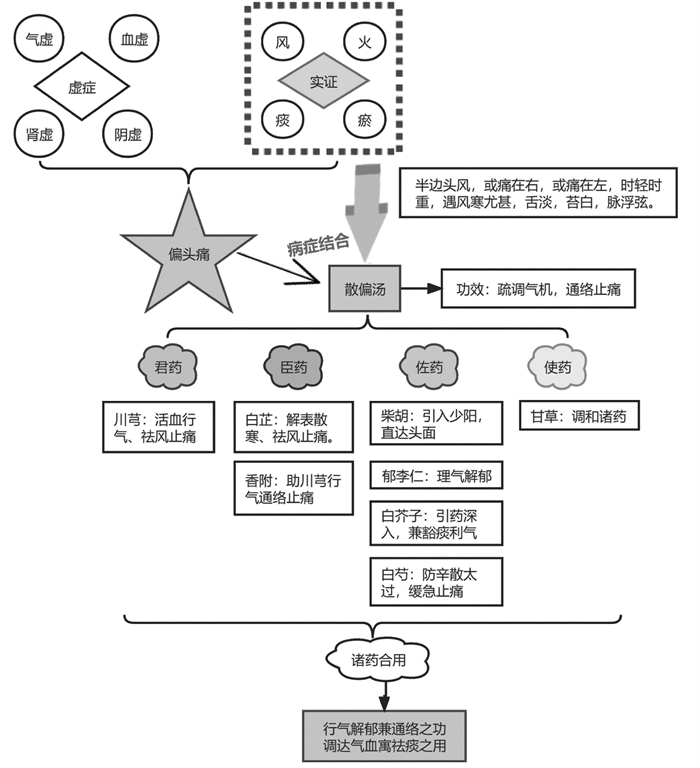
|
| 图 9 散偏汤治疗偏头痛的作用机制 |
偏头痛发病机制复杂,目前公认发病的机制包括血管学说、神经元学说、炎证介质学说、中枢神经系统学说及基因遗传学说等[9]。主要临床用药主要包括曲坦类、非甾体抗炎药、β受体阻滞剂、抗癫痫药物及降钙素基因相关肽(CGRP)受体拮抗剂等[10-11],非药物治疗包括无创脑刺激包括经皮磁刺激和经皮直流电刺激等[12],但这些治疗均存在不同程度的不良反应与长期治疗的副作用。本病在炎症、神经血管异常、遗传、环境等多重影响下,单一靶点的药物疗效有限,故对药物进行多成分、多靶点、多通路研究已成为趋势。
目前多数学者认为神经源性炎症为偏头痛发生的关键环节。通过分析本研究结果发现,散偏汤作为防治偏头痛的经典中药复方之一,槲皮素、木犀草素、山奈酚、β-谷甾醇等为本方主要有效成分,通过与PTGS2、MAPK1、MAPK3、GSK3B、AKT1等相结合,作用于脂质和动脉硬化、AGE-RAGE、PI3K-Akt、IL-17、TNF、MAPK等信号通路,调节相关炎症因子水平,以抗炎、抗氧化、抗病毒、参与调节细胞增殖与凋亡的方式达到对偏头痛的治疗作用。
槲皮素主要存在于柴胡、甘草、香附、郁李仁中。研究发现,槲皮素可通过激活AMPK通路,抑制MAPK通路及其下游靶点p-38、p-ERK和p- JNK,减轻神经痛症状[13]。从香附中分离到的木犀草素[14]为其主要的抗氧化活性成分之一,可通过调节sirt1/FOXO1信号通路,降低神经病理性疼痛改善的痛觉敏化[15-16],且醋炙后可加强有效成分的溶出,提高药效水平。柴胡、白芍、白芷等药物中包含的山奈酚与β-谷甾醇,可以通过活化MAPK信号通路的活化降低Caspase 6、IL-1β、TNF-α和IL-6等炎症因子的表达水平改善疼痛症状,起到抗炎、抗氧化、调节免疫等多重功效[17-18]。
本研究发现PTGS2为多个本病相关信号通路中的关键激酶。PTGS2能抑制促炎因子及趋化因子的产生,促进抗炎因子的合成,通过EP受体引起神经递质谷氨酸等的释放,引起神经源性炎症,导致中枢敏化[19]。通过分子对接研究结果发现,散偏汤中槲皮素、木犀草苷、山奈酚与靶点蛋白PTGS2有较强的结合力,反向验证了这三种成分在本病的治疗中发挥了关键作用。MAPK1、MAPK3是MAPK信号通路中的关键激酶,能将细胞外各种信号传递至细胞内,以发挥生物学活性。研究发现,山柰酚可通过降低MAKP信号通路活性抑制IL-6、IL-10的表达水平,改善组织损伤。本研究结果中显示,山奈酚与靶点蛋白MAPK1、MAPK3能形成结合能较低的稳定构象,结合力强,与目前文献报道中结论一致。IL-17家族信号通过相应受体激活下游通路(NF-κB、MAPKS、趋化因子等)的表达,通过刺激T细胞活化,促进炎性细胞因子释放,诱导和调节机体的多种免疫应答反应,在保护宿主免受细胞外病原体侵袭、调节急性和慢性炎症反应有重要作用[20]。本研究结果发现,IL-17信号通路、AGE-RAGE信号通路、TNF信号通路等一系列以抗炎、抗氧化为主要作用的信号通路在散偏汤治疗偏头痛的过程中处于关键地位,故认为散偏汤在偏头痛神经源性炎症的治疗中可能将取得更好疗效。
中药方剂成分多样,机制复杂,网络药理学通过对成分-靶点-通路的多层次整合,对全面、系统探索中药药效与机制有重要意义[21-22]。本研究采用网络药理学的方法,系统阐述了散偏汤治疗偏头痛的药效物质基础,结果表明散偏汤治疗偏头痛的主要成分可能是槲皮素度、木犀草素、山奈酚,作用靶点可能是PTGS2、MAPK1、MAPK3、GSK3β、AKT1、HSP90AA1、ESR1,其作用通路可能与脂质和动脉硬化、AGE-RAGE信号通路、PI3K-Akt信号通路、IL-17信号通路、TNF信号通路、MAPK信号通路相关。进一步应用分子生物学技术初步阐明了散偏汤治疗偏头痛的主要分子机制。预测散偏汤可通过调节炎症因子、维持血管稳态、调节免疫功能与激素水平等多种途径,对神经源炎性偏头痛、血管神经性头痛等起到治疗作用,为后续临床应用与实验研究提供理论依据。
| [1] |
中华医学会疼痛学分会头面痛学组, 中国医师协会神经内科医师分会疼痛和感觉障碍专委会. 中国偏头痛防治指南[J]. 中国疼痛医学杂志, 2016, 22(10): 721-727. Head and Face Pain Group of the Chinese Medical Association, Pain and Sensory Disorders Committee of the Neurologist Branch of the Chinese Medical Association. Guidelines for prevention and treatment of migraine in China[J]. Chinese Journal of Pain Medicine, 2016, 22(10): 721-727. DOI:10.3969/j.issn.1006-9852.2016.10.001 |
| [2] |
BURCH R C, BUSE D C, LIPTON R B. Migraine: Epidemiology, burden, and comorbidity[J]. Neurologic Clinics, 2019, 37(4): 631-649. DOI:10.1016/j.ncl.2019.06.001 |
| [3] |
GOADSBY P J, HOLLAND P R. Migraine therapy: Current approaches and new horizons[J]. Neurotherapeutics, 2018, 15(2): 271-273. DOI:10.1007/s13311-018-0626-3 |
| [4] |
WU B X, RAO H Y, YANG S B, et al. Efficacy and safety of the classic Chinese herbal prescription Sanpian Decoction on migraine: a meta-analysis[J]. Explore, 2020, 16(5): 318-327. DOI:10.1016/j.explore.2020.05.006 |
| [5] |
解静, 高杉, 李琳, 等. 网络药理学在中药领域中的研究进展与应用策略[J]. 中草药, 2019, 50(10): 2257-2265. XIE J, GAO S, LI L, et al. Research progress and application strategy on network pharmacology in Chinese materia medica[J]. Chinese Traditional and Herbal Drugs, 2019, 50(10): 2257-2265. DOI:10.7501/j.issn.0253-2670.2019.10.001 |
| [6] |
LI J S, ZHAO P, LI Y, et al. Systems pharmacology-based dissection of mechanisms of Chinese medicinal formula Bufei Yishen as an effective treatment for chronic obstructive pulmonary disease[J]. Scientific Reports, 2015, 23(5): 15290. |
| [7] |
WISHART D S, FEUNANG Y D, GUO A C, et al. DrugBank 5.0:A major update to the DrugBank database for 2018[J]. Nucleic Acids Research, 2018, 46(D1): D1074-D1082. DOI:10.1093/nar/gkx1037 |
| [8] |
HSIN K Y, GHOSH S, KITANO H. Combining machine learning systems and multiple docking simulation packages to improve docking prediction reliability for network pharmacology[J]. PLoS One, 2013, 8(12): e83922. DOI:10.1371/journal.pone.0083922 |
| [9] |
叶深琼, 王相明, 张月辉. 偏头痛发病机制的研究进展[J]. 医学综述, 2020, 26(6): 1086-1091. YE S Q, WANG X M, ZHANG Y H. Research progress in pathogenesis of migraine[J]. Medical Recapitulate, 2020, 26(6): 1086-1091. |
| [10] |
魏竞竞, 梁晓, 付国静, 等. 全球药物治疗成人偏头痛指南的系统评价[J]. 中国循证医学杂志, 2020, 20(11): 1316-1325. WEI J J, LIANG X, FU G J, et al. Guidelines concerning pharmacological intervention for migraine in adults: a systematic review[J]. Chinese Journal of Evidence-Based Med- icine, 2020, 20(11): 1316-1325. |
| [11] |
BURCH R. Preventive migraine treatment[J]. Continuum, 2021, 27(3): 613-632. |
| [12] |
杨心怡, 张菁, 李南洋, 等. 偏头痛药物预防及治疗新进展[J]. 中国临床药理学与治疗学, 2020, 25(12): 1429-1435. YANG X Y, ZHANG J, LI N Y, et al. Progress in drug prevention and treatment of migraine[J]. Chinese Journal of Clinical Pharmacology and Therapeutics, 2020, 25(12): 1429-1435. DOI:10.12092/j.issn.1009-2501.2020.12.016 |
| [13] |
YE G Y, LIN C Y, ZHANG Y, et al. Quercetin alleviates neuropathic pain in the rat CCI model by mediating AMPK/MAPK pathway[J]. Journal of Pain Research, 2021, 14: 1289-1301. DOI:10.2147/JPR.S298727 |
| [14] |
李英霞, 陆永辉, 冯文, 等. HPLC测定不同产地香附及醋炙香附中木犀草素的含量[J]. 中国实验方剂学杂志, 2011, 17(1): 56-58. LI Y X, LU Y H, FENG W, et al. Determination of luteolin in cyperi rhizoma and cyperi rhizoma fried with vinegar by high-performance liquid chromatography[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2011, 17(1): 56-58. |
| [15] |
FAN X Y, DU K X, LI N, et al. Evaluation of anti-nociceptive and anti-inflammatory effect of luteolin in mice[J]. Journal of Environmental Pathology, Toxicology and Oncology: Official Organ of the International Society for Environmental Toxicology and Cancer, 2018, 37(4): 351-364. DOI:10.1615/JEnvironPatholToxicolOncol.2018027666 |
| [16] |
华汤锋, 金红芳, 吕晨, 等. 腹腔注射木犀草素调控sirt1/FOXO1通路对慢性坐骨神经结扎大鼠痛觉敏化的影响[J]. 浙江医学, 2021, 43(14): 1489-1493, 1512. HUA T F, JIN H F, LYU C, et al. Effect of luteolin intraperitoneal injection on hyperalgesia in rats with chronic sciatic nerve constriction injury by regulating sirt1/FOXO1 pathway[J]. Zhejiang Medical Journal, 2021, 43(14): 1489-1493, 1512. |
| [17] |
JABBARI S, BANANEJ M, ZAREI M, et al. Effects of intrathecal and intracerebroventricular microinjection of kaempferol on pain: possible mechanisms of action[J]. Research in Pharmaceutical Sciences, 2021, 16(2): 203-216. DOI:10.4103/1735-5362.310527 |
| [18] |
陈元堃, 曾奥, 罗振辉, 等. β-谷甾醇药理作用研究进展[J]. 广东药科大学学报, 2021, 37(1): 148-153. CHEN Y K, ZENG A, LUO Z H, et al. Advances on pharmacology of β-sitosterol[J]. Journal of Guangdong Pharmaceutical University, 2021, 37(1): 148-153. |
| [19] |
RAUSCH S M, GONZALEZ B D, CLARK M M, et al. SNPs in PTGS2 and LTA predict pain and quality of life in long term lung cancer survivors[J]. Lung Cancer, 2012, 77(1): 217-223. |
| [20] |
洪梦琴, 杨敏, 范星宇. IL-17与RANKL/RANK/OPG通路在类风湿性关节炎发病机制中的研究进展[J]. 世界最新医学信息文摘, 2018, 18(98): 90-92, 95. HONG M Q, YANG M, FAN X Y. Research progress of IL-17 and RANKL/RANK/OPG pathway in the pathogenesis of rheumatoid arthritis[J]. World Latest Medicine Information, 2018, 18(98): 90-92, 95. |
| [21] |
任建勋, 郭浩, 李磊, 等. 以功效为基础的中药复方毒性研究思路与方法探索[J]. 中国实验方剂学杂志, 2017, 23(4): 203-207. REN J X, GUO H, LI L, et al. Research thoughts and approaches of toxicity based on efficacy of Chinese herbal compound[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2017, 23(4): 203-207. |
| [22] |
任艳, 邓燕君, 马焓彬, 等. 网络药理学在中药领域的研究进展及面临的挑战[J]. 中草药, 2020, 51(18): 4789-4797. REN Y, DENG Y J, MA H B, et al. Research progress and challenges of network pharmacology in field of traditional Chinese medicine[J]. Chinese Traditional and Herbal Drugs, 2020, 51(18): 4789-4797. |
 2023, Vol. 42
2023, Vol. 42