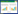文章信息
- 王馨悦, 翁志军, 刘慧荣, 吴璐一, 韩冬, 柴菁, 彭洋, 马金丹, 吴焕淦, 张方
- WANG Xinyue, WENG Zhijun, LIU Huirong, WU Luyi, HAN Dong, CHAI Jing, PENG Yang, MA Jindan, WU Huangan, ZHANG Fang
- vlPAG中GABA能神经元参与电针缓解IBS小鼠内脏痛的机制研究
- GABAergic neurons in vlPAG downregulates visceral hypersensitivity by electroacupuncture in IBS mice
- 天津中医药大学学报, 2023, 42(5): 594-599
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(5): 594-599
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.05.09
-
文章历史
收稿日期: 2023-06-30
2. 上海市针灸经络研究所, 上海 200030
2. Shanghai Research Institute of Acupuncure and Meridian, Shanghai 200030, China
光遗传技术作为一种新兴技术,融合了光学、遗传学和分子生物学技术的优势,能够将光敏感蛋白表达在某个特定的神经元中,通过不同波长和频率的光刺激来改变蛋白功能,实现兴奋或抑制神经元活动的目的[1-2]。光遗传技术广泛用于中枢神经环路研究[3],通过操控脑内神经环路的方式实现对个体行为影响,该方法极大地推动了神经科学研究的发展。近年来,光遗传技术逐渐获得疼痛领域研究者的关注,Chen等[4]利用光遗传技术发现,臂旁核中存在谷氨酸能和γ-氨基丁酸(GABA)能神经纤维能够直接投射至延髓头端腹内侧区(RVM)的神经元,调控伤害性刺激信息,对生理和病理情况下的疼痛进行调节。王若曦[5]使用含DTA元件病毒,利用光遗传技术特异性地损毁了Gper1-Cre小鼠RVM的ON细胞,通过抑制下行易化系统从而抑制了慢性炎性痛、热痛和内脏痛。
肠易激综合征(IBS)作为一种功能性胃肠病,主要症状为反复发作的腹痛,并伴有粪便性状或排便习惯的改变,在全球人口中的发病率为11.2%,其发病机制尚不明确[6]。目前普遍认为内脏高敏感是IBS的主要生理病理机制之一[7],并与IBS患者腹痛症状密切相关[8]。中脑导水管周围灰质(PAG)是内脏疼痛调节神经环路的一个关键部位[9],共分为4区,分别是背内侧区(dmPAG)、背外侧区(dlPAG)、外侧区(lPAG)和腹外侧区(vlPAG)。肖智[10]研究表明,lPAG神经元上的P2X3受体在脊髓上中枢对疼痛的调节方面起抑制作用,电针“足三里”穴位通过上调lPAG中P2X3受体表达缓解慢性坐骨神经结扎模型(CCI)大鼠的神经痛症状。lPAG中P2X3受体介导了电针镇痛的脊髓上调节机制。以vlPAG为核心的痛觉下行抑制系统近年来被认为和电针镇痛密切相关[11],本课题组前期研究发现电针能够缓解IBS大鼠肠道内脏痛,为了进一步研究vlPAG中GABA能神经元是否参与电针缓解IBS小鼠内脏痛的机制,本研究利用光遗传技术对IBS内脏痛小鼠的vlPAG脑区的GABA能神经元进行激活/抑制调控,探讨vlPAG中GABA能神经元在电针缓解IBS小鼠内脏痛中的作用。
1 材料与方法 1.1 实验动物本研究选用雄性Vgat-Cre小鼠30只,体质量(20±2)g,由上海南方模式生物科技股份有限公司提供[动物许可证号:SCKX(沪)2019-0002],饲养于上海中医药大学附属岳阳中西医结合医院实验动物中心,已通过动物实验伦理审批(编号YYLAC-2021-143-2),饲养环境:12 h昼夜节律交替,饲养室温度(20±2)℃,相对湿度50%~70%。适应性饲养1周后开始实验,实验过程中对实验动物的所有操作均符合动物福利的基本要求。
1.2 试剂与仪器戊巴比妥钠(Sigma,美国);2,4,6-三硝基苯磺酸(TNBS,Sigma,美国);矿物油(M5310,Sigma,美国);液体石蜡、生理盐水、无水乙醇(国药集团化学试剂有限公司,中国);韩式经穴刺激仪(济生医疗有限公司,中国)、rAAV2/9-EF1α-DIO-hChR2(H134R)-EGFP、rAAV2/9-EF1α-DIO-eNpHR3.0-EGFP(和元生物技术有限公司,中国);医用眼膏(上海通用药业,中国);异氟烷、移动式小动物麻醉机、颅钻、冷光源、微量注射泵、玻璃电极、小鼠适配器、桌面数显脑立体定位仪(深圳瑞沃德生命科技有限公司,中国);有线光遗传系统(荧博杭州科技有限公司,中国);陶瓷插芯、陶瓷套管(千奥星科南京生物科技有限公司,中国);电极拉制仪P-1000(Sutter Instruments,美国);体式显微镜(Olympus,日本)。
1.3 IBS动物模型制备根据随机数字表法,将Vgat-Cre小鼠分为正常组(n=6)和造模组(n=24)。造模组小鼠采用TNBS灌肠法制备IBS内脏痛模型,具体操作参考Hughes等[12]方法:采用130 μg/mL的TNBS溶液0.1 mL灌肠制备IBS内脏痛模型。实验动物模型制备前禁食24 h,不禁水。
1.4 分组与干预将造模组小鼠随机分为模型组、模型+eNpHR组、模型+ChR2组、电针组,同时设立正常组,每组6只。各组将进行以下处理:1)正常组。不进行模型制备,在电针组治疗同时每次给予同电针组相同的抓取与固定,连续干预7 d。2)模型组。模型制备21 d后,在电针组治疗过程中每次给予同电针组相同的抓取与固定,连续干预7 d。3)电针组。模型制备21 d后,进行电针治疗。取穴:双侧“足三里”穴[13],针刺深度为3~4 mm。韩式经穴刺激仪参数:疏密波,频率2/100 Hz,电流1mA,每次30 min,每日1次,连续电针7 d。4)模型+eNpHR组。模型制备7 d后,脑立体定位注射rAAV2/9-EF1α-DIO-eNpHR3.0-EGFP病毒;病毒注射21 d后给予持续黄光刺激(20 Hz,5 ms,4 mW)[14]。5)模型+ChR2组。模型制备7 d后,脑立体定位注射rAAV2/9-EF1α-DIO-hChR2-EGFP病毒;病毒注射21 d后给予特定程序蓝光刺激(20 Hz,5 ms,4 mW)[15]。
1.5 动物手术 1.5.1 麻醉及术前准备在小鼠立体定位仪底板上放置加热垫,温度保持在(37±1)℃,使小鼠在手术中维持体温恒定。采用电极拉制仪拉制玻璃电极,吸入约300 nL病毒后将电极夹持在脑立体定位仪上。将氧气浓度调节至0.8%~1.0%,异氟烷浓度调节至1.2%~1.5%,将小鼠放入诱导盒中,待小鼠呼吸频率变慢、呼吸平稳、夹尾反应和翻身反应消失后认为此次诱导麻醉成功,将小鼠置于加热垫上,调整鼻夹并固定耳杆使小鼠头部固定且不影响其正常呼吸。打开冷光源,小鼠双眼均匀涂抹医用眼膏,保持小鼠双眼全程湿润。
1.5.2 脑立体定位、病毒注射剃去小鼠颅骨上方毛发,清除小鼠头部皮下组织和筋膜,暴露颅骨表面骨缝、前囟(Bregma)点、人字缝尖(Lambda)点。在体式显微镜下用脑立体定位仪将颅骨前、后、左、右4个方位精确调平在同一水平面上,随后移动电极至小鼠颅骨表面,根据vlPAG的坐标:Bregma点向后4.8 mm,中线旁开-0.6 mm,颅骨表面朝腹侧向下2.8 mm,用颅骨钻轻旋磨出颅窗,暴露脑组织,用眼科镊轻轻夹除脑组织上方的硬脑膜。最后,移动玻璃电极使其匀速缓慢下降,以每10 nL/min的速率缓慢将病毒注入vlPAG脑区,每只小鼠注射300 nL,在注射过程中时刻观察,防止病毒溢出和注入空气。注射完成后将玻璃电极尖端在脑组织中停留10 min后缓慢出针,防止病毒随电极尖端溢出。
1.5.3 陶瓷插芯植入固定病毒注射完成后,在脑立体定位仪上固定陶瓷插芯,将光纤缓慢植入小鼠vlPAG脑区。用牙科水泥将陶瓷插芯和颅骨黏合,21 d后进行后续实验。术后每只小鼠单笼饲养1周,并密切观察小鼠排尿、排便是否正常,手术部位有无出血、感染,陶瓷插芯是否掉落。同时保持环境温度适宜,垫料干净、干燥。
1.5.4 腹壁撤回反射(AWR)评分造模后第21天对正常组和模型组小鼠进行AWR评分,鉴定模型制备是否成功。造模后第28天对模型+eNpHR组、模型+ChR2组给光前后进行AWR评分,鉴定光遗传技术激活/抑制GABA能神经元是否成功;对模型组、电针组小鼠进行AWR评分,观察电针对IBS内脏痛小鼠的作用。
评分前将小鼠禁食、不禁水24 h。将自制的球囊蘸取液体石蜡后,沿小鼠肛门缓慢插至降结肠部分并固定,随后将小鼠放入透明小鼠固定盒中适应30 min,待小鼠安静后,用注射器将血压计压力值分别升至15、30、45、60 mmHg(1 mmHg≈0.133 kPa,下同),维持压力刺激20 s,不同压力刺激间隔30 s,每次循环后休息3min,共进行3个循环。取3次评分的平均值作为该球囊压力下的最终评分值。参照Alchaer等[16]的评分标准对小鼠球囊扩张刺激反应进行评分。0分:对球囊扩张无反应;1分:刺激开始时,小鼠偶有扭头,结直肠扩张(CRD)期间保持不动;2分:腹肌微微收缩,但无腹肌抬起;3分:腹肌强烈收缩伴抬起,但无盆腔及阴囊抬起;4分:身体弓起,盆腔及阴囊抬起。
1.5.5 行为学检测中的光遗传技术模型+eNpHR组和模型+ChR2组小鼠在病毒注射21 d后进行光遗传给光刺激。刺激前使用激光功率计对激光强度进行检测,需要达到20~30 mW后才可满足进行神经操控的强度,光纤跳线通过套管与小鼠颅骨的陶瓷头进行连接,使用光遗传控制软件进行激光刺激。光遗传589 nm黄色激光刺激方案参考Tovote等[14]方法,给予持续黄光刺激(20 Hz,5 ms,4 mW);光遗传473 nm蓝色激光刺激方案参考Bennett等[15]对vlPAG脑区神经元的刺激方法,给予相应的脉冲刺激,即蓝光刺激(20 Hz,5 ms,4 mW)5 s和休息15 s(无蓝光刺激),避免神经元的过度兴奋和兴奋性毒性。在给予程序刺激前和刺激过程中进行AWR行为学检测。
1.6 统计学分析实验采用SPSS26.0软件对数据进行统计学分析。对数据进行正态分布检验,符合正态分布数据采用均值±标准差(x±s)表示,多组比较采用单因素方差分析;非正态分布的数据用中位数(上四分位数,下四分位数)[M(Q25,Q75)]表示,两组间比较采用Mann-Whitney检验,多组比较采用Kruskal Wallis检验。P < 0.05为差异有统计学意义。
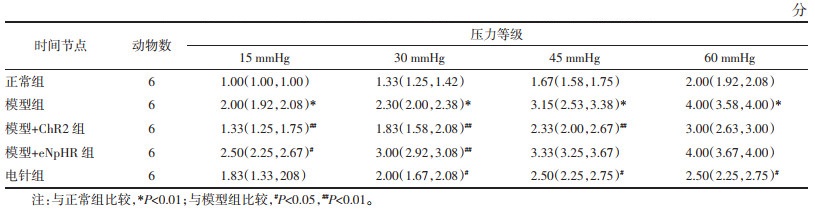
2 结果 2.1 各组小鼠干预前AWR评分比较各组小鼠干预前AWR评分结果显示,与正常组比较,在15、30、45、60 mmHg的CRD刺激下,模型组小鼠AWR评分明显增加(P<0.01),提示IBS内脏痛小鼠模型制备成功。见表 1。
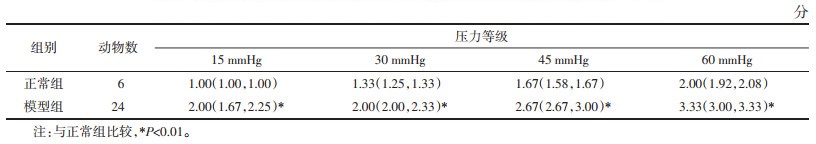
造模后第28天进行光遗传刺激时进行AWR评分,比较给光前、给光时小鼠AWR评分。统计结果显示,与给光前比较,在15、30 mmHg刺激强度下,模型+eNpHR组小鼠接受黄光刺激时,AWR评分上升(P<0.05);在45、60 mmHg刺激强度下,AWR评分与给光前比较上升,但差异无统计学意义(P>0.05)。见表 2。
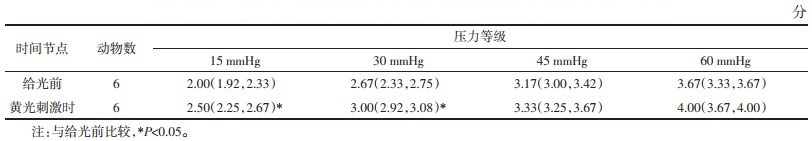
与给光前比较,在15、30、45 mmHg刺激强度下,模型+ChR2组小鼠在给予蓝光刺激时,AWR评分下降(P<0.01);在60 mmHg刺激强度下,AWR评分较给光前下降,差异无统计学意义(P>0.05)。见表 3。
比较光遗传干预后各组小鼠AWR评分,统计结果显示,与正常组比较,在15、30、45、60 mmHg刺激强度下,模型组小鼠AWR评分增加(P<0.01),从行为学角度说明IBS小鼠内脏痛模型制备成功。与模型组比较,模型+eNpHR组小鼠在15 mmHg刺激强度下,AWR评分上升(P < 0.05);在30 mmHg刺激强度下,AWR评分上升(P < 0.01);在45、60 mmHg刺激强度下,AWR评分上升,但差异无统计学意义(P>0.05)。与模型组比较,模型+ChR2组在15、30、45 mmHg刺激强度下,AWR评分下降(P < 0.01);在60 mmHg刺激强度下,AWR评分下降,差异无统计学意义(P>0.05)。与模型组比较,电针组小鼠在15 mmHg刺激强度下,AWR评分下降,差异无统计学意义(P>0.05);在30、45、60 mmHg刺激强度下,电针组小鼠AWR评分下降(P < 0.05),从行为学的角度说明电针能够缓解IBS小鼠内脏痛。见表 4。
IBS是目前临床常见的胃肠道功能性疾病,以内脏痛为主要临床表现。本研究使用TNBS溶液制备IBS内脏痛模型[12]。模型组小鼠在不同级别压力CRD诱导下的AWR评分随刺激强度增加而升高,内脏敏感性随之增加,表明本研究IBS内脏痛小鼠模型制备成功。
目前西医治疗IBS以对症治疗为主,无法系统性地改善患者整体情况,且部分药物不良反应明显,甚至导致缺血性心血管疾病和缺血性结肠炎等严重后果[17]。1项纳入17项临床研究的Cochrane系统评价显示:针刺治疗IBS的有效率高达84%,优于药物治疗的63%[18]。而电针将针刺和电流刺激相结合,通过电针仪增加了电刺激,对IBS的症状改善效果更为显著[19]。足三里穴为足阳明胃经合穴、胃之下合穴,刺激该穴可疏通局部经络气血,通调三焦气机,治疗肚腹疾病。研究表明,电针足三里穴可明显纠正偏于正常生理状态的胃肠功能抑制状态,对胃肠功能起促进作用[20]。课题组以往研究也发现电针能够抑制内侧丘脑和前扣带皮层中星形胶质细胞的活化,缓解IBS内脏痛。此外,另有研究发现,电针干预足三里穴可以恢复结肠慢波的频率和节律,达到减轻IBS小鼠内脏高敏感性的目的[21]。
作为介导痛觉信息处理的神经通路中的关键部分,vlPAG在电针镇痛过程中发挥重要作用[14, 22]。本研究利用脑立体定位技术精准定位vlPAG脑区,采用光遗传技术改变细胞膜两侧的离子通透性,实现了以毫秒级精度对特定区域中轴突末端的亚细胞定位进行光学调控,这种对神经元进行非侵入式的精确定位刺激操作,为神经科学领域提供了革命性的新研究手段[23]。基于光遗传技术的独特优势,本研究将光遗传技术与行为学相结合,通过光遗传技术精准控制vlPAG脑区中的GABA能神经元,观察小鼠AWR评分变化。采用光遗传蓝光刺激激活vlPAG中GABA能神经元,IBS内脏痛小鼠AWR评分显著下降(P<0.05);采用光遗传黄光刺激抑制vlPAG中GABA能神经元,IBS内脏痛小鼠AWR评分显著上升(P<0.05),从行为学角度说明vlPAG中GABA能神经元在IBS内脏痛中发挥重要作用,而电针足三里穴也能够降低IBS小鼠AWR评分,缓解IBS内脏高敏感状态,提示vlPAG中GABA能神经元可能参与电针缓解IBS小鼠内脏痛的效应机制。
以上实验结果说明采用光遗传的方法调控vlPAG中GABA能神经元具有可靠性,激活GABA能神经元能够模拟电针的镇痛作用,电针可能通过vlPAG中的GABA能神经元缓解IBS小鼠内脏痛。但本研究只采用行为学评分初步探索了vlPAG中GABA能神经元和IBS内脏痛的关系,后续仍需采用分子生物学技术进一步研究。
| [1] |
ROST B R, WIETEK J, YIZHAR O, et al. Optogenetics at the presynapse[J]. Nature Neuroscience, 2022, 25(8): 984-998. DOI:10.1038/s41593-022-01113-6 |
| [2] |
GENG Y M, LI Z X, ZHU J H, et al. Advances in optogenetics applications for central nervous system injuries[J]. Journal of Neurotrauma, 2023, 40(13/14): 1297-1316. |
| [3] |
MIRZAYI P, SHOBEIRI P, KALANTARI A, et al. Optogenetics: implications for Alzheimer's disease research and therapy[J]. Molecular Brain, 2022, 15(1): 20. DOI:10.1186/s13041-022-00905-y |
| [4] |
CHEN Q L, ROEDER Z, LI M H, et al. Optogenetic evidence for a direct circuit linking nociceptive transmission through the parabrachial complex with pain-modulating neurons of the rostral ventromedial medulla(RVM)[J]. eNeuro, 2017, 4(3): 202-217. |
| [5] |
王若曦. 脊髓神经元上行特异激活延髓On细胞易化慢性疼痛发生的新神经环路研究[D]. 上海: 上海交通大学, 2019. WANG R X. Spinal neurons ascending projection to On-cells in medulla: a study on a neural circuit of chronic pain generation[D]. Shanghai: Shanghai Jiao Tong University, 2019. |
| [6] |
SEBASTION DOMINGO J J. Irritable bowel syndrome[J]. Medicina Clinica, 2022, 158(2): 76-81. DOI:10.1016/j.medcli.2021.04.029 |
| [7] |
周云, 张方, 翁志军, 等. 电针对IBS内脏痛大鼠脊髓GFAP、P2X3受体的调节作用[J]. 世界科学技术-中医药现代化, 2021, 23(8): 2919-2927. ZHOU Y, ZHANG F, WENG Z J, et al. Regulation of GFAP and P2X3 receptors in the spinal cord of IBS rats with visceral Pain[J]. World Science and Technology-Modernization of Traditional Chinese Medicine, 2021, 23(8): 2919-2927. |
| [8] |
董明, 郭欣欣, 吴焕淦, 等. 内脏高敏感发生机制的研究进展[J]. 中国医药生物技术, 2012, 7(1): 54-58. DONG M, GUO X X, WU H G, et al. Research progress on the mechanism of visceral hypersensitivity[J]. Chinese Medicinal Biotechnology, 2012, 7(1): 54-58. |
| [9] |
YU W, PATI D, PINA M M, et al. Periaqueductal gray/dorsal raphe dopamine neurons contribute to sex differences in pain-related behaviors[J]. Neuron, 2021, 109(8): 1365-1380. DOI:10.1016/j.neuron.2021.03.001 |
| [10] |
肖智. 中脑导水管周围灰质P2X3受体在电针镇痛中的作用[D]. 重庆: 第三军医大学, 2010. XIAO Z. Role of midbrain periaqueductal gray P2X3 receptors in electroacupuncture-mediated endogenous pain modulatory systems[D]. Chongqing: Third Military Medical University, 2010. |
| [11] |
ZHU X X, XU Y L, SHEN Z, et al. Rostral anterior cingulate cortex-ventrolateral periaqueductal gray circuit underlies electroacupuncture to alleviate hyperalgesia but not anxiety-like behaviors in mice with spared nerve injury[J]. Frontiers in Neuroscience, 2022, 15(2): 757-768. |
| [12] |
HUGHES P A, BRIERLEY S M, MARTIN C M, et al. Post-inflammatory colonic afferent sensitisation: different subtypes, different pathways and different time courses[J]. Gut, 2009, 58(10): 1333-1341. DOI:10.1136/gut.2008.170811 |
| [13] |
LIU S B, WANG Z F, SU Y S, et al. A neuroanatomical basis for electroacupuncture to drive the vagal-adrenal axis[J]. Nature, 2021, 598(7882): 641-645. DOI:10.1038/s41586-021-04001-4 |
| [14] |
TOVOTE P, ESPOSITO M S, BOTTA P, et al. Midbrain circuits for defensive behaviour[J]. Nature, 2016, 534(7606): 206-212. DOI:10.1038/nature17996 |
| [15] |
BENNETT G J, XIE Y K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man[J]. Pain, 1988, 33(1): 87-107. DOI:10.1016/0304-3959(88)90209-6 |
| [16] |
ALCHAER E D, KAWASAKI M, PASRICHA P J. A new model of chronic visceral hypersensitivity in adult rats induced by colon irritation during postnatal development[J]. Gastroenterology, 2000, 119(5): 1276-1285. DOI:10.1053/gast.2000.19576 |
| [17] |
BONETTO S, FAGOONEE S, BATTAGLIA E, et al. Recent advances in the treatment of irritable bowel syndrome[J]. Polish Archives of Internal Medicine, 2021, 131(7/8): 709-715. |
| [18] |
YAKLAI K, PATTANAKUHAR S, CHATTIPAKORN N, et al. The role of acupuncture on the gut-brain-microbiota axis in irritable bowel syndrome[J]. The American Journal of Chinese Medicine, 2021, 49(2): 285-314. DOI:10.1142/S0192415X21500154 |
| [19] |
钟峰, 曹越, 罗容, 等. 电针大肠合募俞配穴治疗腹泻型肠易激综合征疗效观察[J]. 湖南中医药大学学报, 2018, 38(4): 435-438. ZHONG F, CAO Y, LUO R, et al. Clinical effect of electroacupuncture at he-mu acupoint combination in treatment of diarrhea-predominant irritable bowel syndrome[J]. Journal of Hunan University of Chinese Medicine, 2018, 38(4): 435-438. |
| [20] |
杨小梅, 许金森, 郑淑霞, 等. 电针足三里对胃肠功能偏态时胃肠电图影响的初步观察[J]. 中华中医药杂志, 2017, 32(4): 1867-1870. YANG X M, XU J S, ZHENG S X, et al. Preliminary observation on effects of electroacupuncture at zusanli(ST36) on EGEG when gastrointestinal function deviate from normal state[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2017, 32(4): 1867-1870. |
| [21] |
ZHANG L L, YU C, CHEN B W, et al. Modulation of colonic function in irritable bowel syndrome rats by electroacupuncture at ST25 and the neurobiological links between ST25 and the colon[J]. Frontiers in Neuroscience, 2022, 16(2): 930-939. |
| [22] |
VAUGHAN C W, INGRAM S L, CONNOR M A, et al. How opioids inhibit GABA-mediated neurotransmission[J]. Nature, 1997, 390(66): 611-614. |
| [23] |
LI S Y, FENG X L, BIAN H. Optogenetics: emerging strategies for neuropathic pain treatment[J]. Frontiers in Neurology, 2022, 13(3): 982-993. |
 2023, Vol. 42
2023, Vol. 42