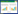文章信息
- 李盼盼, 高慧, 刘玉兰, 扈有芹, 吴斯怡, 张晴爽
- LI Panpan, GAO Hui, LIU Yulan, HU Youqin, WU Siyi, ZHANG Qingshuang
- 基于NF-κB信号通路探讨通管助孕方治疗输卵管阻塞性不孕症大鼠的作用机制
- Explore the mechanism of Tongguan Zhuyun Decoction in the treatment of tubal obstructive infertility rats based on NF-κB signal pathway
- 天津中医药大学学报, 2023, 42(5): 600-608
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(5): 600-608
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.05.10
-
文章历史
收稿日期: 2023-06-20
2. 承德医学院附属医院, 承德 067000;
3. 沧州中西医结合医院, 沧州 061000
2. Affiliated Hospital of Chengde Medical University, Chengde 067000, China;
3. Cangzhou Hospital of Integrated Traditional Chinese and Western Medicine, Cangzhou 061000, China
不孕症是指育龄夫妇有正常规律的性生活至少1年以上,男方生殖功能正常,在未采取任何避孕措施的情况下,不能受孕的一类妇科疾病[1]。输卵管阻塞是不孕症的首要病因,约占所有不孕因素的45%,且发病率逐年增加[2]。西医认为主要是由于金黄色葡萄球菌、溶血性链球菌、大肠杆菌、淋球菌、衣原体、支原体等病原体上行感染生殖道导致输卵管炎[3],进而引发炎性因子异常表达是引起输卵管阻塞性不孕症的关键因素[4]。通管助孕方是高慧教授临床长期用于治疗本病的经验方,本研究通过采用金黄色葡萄球菌接种法建立输卵管阻塞性不孕症大鼠模型,探究通管助孕方对模型大鼠血清和输卵管中炎性因子[核转录因子-κB(NF-κB)、核因子κB抑制蛋白(IκB)、环氧合酶2(COX-2)、前列腺素E2(PGE2)]表达的影响,揭示通管助孕方治疗本病的作用机制,为临床治疗提供理论依据。
1 材料 1.1 实验动物SPF级健康雌性SD大鼠140只,体质量(200±20)g,鼠龄10周;雄性SD大鼠14只,体质量(220±20)g,鼠龄10周。均购自斯贝福(北京)生物技术有限公司,许可证号:SCXK(京)2019-0010。饲养于SPF级实验室,5只/笼,室温18~26 ℃,相对湿度40%~70%,饲养室通风干燥,噪音50 dB以下。自然光照条件良好,光明光暗周期各12 h,SPF级维持鼠料饲养,自由饮水。
1.2 实验药品通管助孕方:皂角刺、穿心莲、当归、红花、蒲公英、柴胡、白芍、香附、丹参、青皮、路路通、通草。以上中药材购自河北省沧州中西医结合医院中药饮片药房。丹黄祛瘀胶囊(规格0.4 g/粒,24粒/盒,吉林龙鑫药业有限公司,批号:201109)。人胎盘组织液(2 mL/支,6支/盒,湖南一格制药有限公司生产,批号:2021050082)。金黄色葡萄球菌[浓度:3×1012/mL,菌号:CMCC(B)26003,广东环凯微生物科技有限公司,批号:G0081DX]。
1.3 药物制备中药通管助孕方:通管助孕方高、中、低剂量组的给药剂量分别以人与大鼠体表面积的等效剂量换算比例折算为成人等效剂量的1、2、4倍后[5],均煎成浓缩剂,分别为含生药3.654、1.827、0.913 5 g/mL。中药汤剂制备:将上述中药放入砂锅内,倒入适量清水以浸没药材4 cm为宜,浸泡0.5 h,先用文火煮沸后改用小火,再熬30 min;用纱布过滤,分离药液1和药渣1,向药渣1中添加适量清水,以浸没药面3 cm为宜,小火熬30 min,过滤分离药液2和药渣2;将两次所熬药液混合均匀,继续蒸煮,浓缩至50 mL左右,药液浓度为含生药3.654 g/mL。将药液放入容量瓶中,密封保存,置于4 ℃冰箱中冷藏,以供备用。高、中、低药液浓度比为2∶1∶0.5,同法制备中、低剂量组中药汤剂。
中成药组:灌胃丹黄祛瘀胶囊混悬液,按说明书上每人4.8 g/d计算,按人与大鼠的给药剂量比例进行换算后,打开胶囊,取胶囊内深褐色药物粉末;用温开水配成0.050 4 g/mL的混悬液灌胃给药。
西药组:肌肉注射人胎盘组织液,按1 mL/kg依据大鼠体质量给予相应的注射剂量。
1.4 主要试剂NF-κB、IκB、COX-2、PGE2酶联免疫吸附(ELISA)法试剂盒(河北贝博实验用品有限公司,批号202111),TIANScript RT KIT试剂盒、SuperReal PreMix Plus(SYBR Green)试剂盒、Trizol总RNA提取试剂盒(北京天根生物科技有限公司,批号分别为:KR109-02、FP208、DP436),NF-κB-p65一抗、IκBα一抗、PGE2一抗、COX-2一抗(美国Abcam公司,批号分别为:GR3192627-1、GR3193628-1、GR3191618-2、GR3190951-3),辣根过氧化物酶(HRP)羊抗鼠免疫球蛋白G(IgG,北京中杉金桥,批号:214800903),HRP羊抗兔IgG(武汉塞维尔生物公司,批号:GB23306),Mayer苏木素染色液(上海源叶生物有限公司,批号:Y25N12Y21279),伊红染色液(上海源叶生物有限公司,批号:Y25N12Y21305),氯仿(天津市永大化学试剂有限公司,批号:YD20200915)。
1.5 主要仪器光学显微镜(日本奥林巴斯公司),酶标分析仪(美国RAYTO公司),实时定量荧光聚合酶链反应(RT-PCR)仪(美国BIO-RAD公司),生物分光光度计(德国Eppendorf公司),离心机(德国Eppendorf公司),多功能脱色摇床(美国Thermo公司),电泳仪、垂直电泳槽及湿转槽(美国BIO-RAD公司)。
2 方法 2.1 动物造模与分组1)分组:将140只雌性SD大鼠适应性饲养1周后,随机分为正常组、模型组、中成药组、西药组及通管助孕方高、中、低剂量组(通管助孕方高、中、低剂量组以下简称高剂量组、中剂量组、低剂量组),每组20只,共7组。
2)建立模型:除正常组外,其余各组大鼠均构建模型,造模方法借鉴赵广兴等[6]的混合菌接种法与胡喜姣等[7]的金黄色葡萄球菌接种法建立输卵管阻塞性不孕症大鼠模型。术前禁食、水12 h,用10%水合氯醛按0.4 mL/100 g体质量腹腔注射麻醉大鼠,待麻醉药物起效后,将其仰卧位固定于手术台上,术区剃毛备皮,用酒精消毒;于下腹正中剪开1个约1 cm的纵行切口,逐层开腹,轻轻拨开腹腔组织,寻找并暴露Y行子宫,沿一侧子宫找到输卵管及卵巢;选取输卵管作为穿刺点进针,进针位置避开输卵管与子宫角、卵巢连接处即可,缓慢注入0.05 mL金黄色葡萄球菌菌悬液;注射完毕后,用动脉夹夹闭针孔以防菌液流出,污染腹腔;同法处理对侧输卵管。术后分层关腹,缝合切口,消毒术区,铺无菌垫料。
2.2 给药方法正常组自由饮水,常规饲养。模型组与各给药组均在造模后第7天(9:00—10:00)开始给药。通管助孕方高、中、低剂量组分别给予通管助孕汤剂36.54、18.27、9.135 g/(kg·d)生药量灌胃,中成药组灌胃丹黄祛瘀胶囊混悬液0.504 g/(kg·d),给药体积均为1 mL/100 g;模型组灌胃等量生理盐水;西药组肌肉注射人胎盘组织液1 mL/(kg·d),每日1次,连续给药21 d。
2.3 取材灌胃21 d后,取材。麻醉大鼠后腹主动脉取血,分装入离心管,离心后,将血清分装入EP管内,-20 ℃冰箱保存;切取适量双侧输卵管放入4%多聚甲醛中固定,4 ℃冰箱保存;剩余双侧输卵管组织放入EP管内,-80 ℃冰箱保存;分别备用于光镜、ELISA法、RT-PCR法、蛋白免疫印迹(Western Blot)法检测。
2.4 观察指标 2.4.1 肉眼观察观察输卵管形态、色泽、弹性的变化,管腔通畅与否,与周围组织粘连情况,有无增粗或变细,有无充血、肿胀、积液、化脓等病理变化。
2.4.2 光学显微镜观察迅速切取新鲜输卵管放入4%多聚甲醛中固定,24 h后取出,常规包埋、切片、脱蜡、苏木素-伊红(HE)染色,在光镜下观察输卵管组织的病理变化。
2.4.3 ELISA法检测血清中NF-κB、IκB、COX-2、PGE2的水平按照ELISA试剂盒说明书,进行测定大鼠血清中NF-κB、IκB、COX-2、PGE2的含量。1)加样:设空白孔、标准品孔、待测样品孔。在酶标包被板上标准品加样50 μL,待测样品孔先加样品稀释液40 μL,再加待测样品10 μL,样品最终稀释度为5倍。2)加酶:除空白孔外,每孔加入酶标试剂100 μL。3)温育:用封板膜封板后37 ℃温育60 min,然后配液、洗涤。4)显色:每孔加入显色剂A、B各50 μL,37 ℃避光显色15 min。5)终止:每孔加终止液50 μL,终止反应。6)测定:在酶标仪上,450 nm波长依序测量各孔的吸光度(A值)。
2.4.4 Western Blot法检测输卵管组织中NF-κB、IκB、COX-2、PGE2蛋白表达取少量输卵管组织加入至裂解液中充分裂解,4 ℃离心10 min(12 000 r/min,离心半径10 cm),取上清液,采用Bradford法测定蛋白浓度。将含20 μg蛋白质的样品与蛋白质凝胶电泳上样缓冲液混合,95 ℃变性10 min,电泳90 min,然后在10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶上分离并转移到聚偏氟乙烯(PVDF)膜上。在室温下封闭1 h,剪膜,再依次按时加入一抗,NF-κB-p65(1∶50 000)、IκBα(1∶1 000)、COX-2(1∶1 000)、PGE2(1∶1 000)、β-actin(1∶1 000),4 ℃孵育过夜;洗膜后,HRP标记二抗(1∶3 000),室温孵育1 h。采用增强型化学发光试剂(ECL)试剂盒显色检测,将印迹膜置于凝胶成像系统中曝光显影,利用Imag J软件对条带进行密度分析。
2.4.5 RT-PCR法检测输卵管组织中NF-κB、IκB、COX-2、PGE2基因的表达采用Trizol试剂提取输卵管组织中总RNA,再用TIANScript RT KIT将RNA逆转录为cDNA。以cDNA为模板,按照20 μL体系进行聚合酶链反应(PCR),RT-PCR法检测输卵管组织中NF-κB、IκB、COX-2、PGE2 mRNA的相对表达量,结果用2-ΔΔCt表示。反应体系:上游引物0.6 μL、下游引物0.6 μL,2×SuperReal PreMix Plus 10 μL、50×ROX Reference Dye 0.4 μL,每孔加入cDNA 100 ng,加双蒸水(ddH2O)至20 μL。反应条件:95 ℃预变性15 min,循环1次;95 ℃变性10 s,58 ℃退火30 s,72 ℃延伸32 s,共循环40次。引物序列见表 1。
经治疗取材后,每组大鼠均剩余10只,每笼5只雌性大鼠中放入1只雄性大鼠合笼,大鼠的动情周期为4~5 d,妊娠周期为19~23 d,以饲养60 d为限(即12个动情周期),观察受孕及产仔情况。
2.6 统计学方法数据采用SPSS 25.0软件进行统计学处理。计量资料以均数±标准差(x±s)表示,进行正态分布和方差齐性检验后,多组间比较使用单因素方差分析,组间两两比较采用LSD法,P<0.05表示差异有统计学意义。
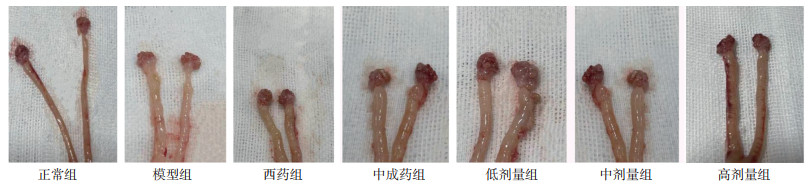
3 结果 3.1 肉眼观察输卵管结构变化情况正常组10只大鼠输卵管粗细均匀,管腔光滑,与周围组织均无粘连,无积水积脓,红润有光泽,质软,弹性好。模型组10只大鼠输卵管严重肿胀变粗,管腔粗糙,与周围组织均有严重粘连,严重积水或见积脓,苍白无光泽,质硬,弹性差;提示造模成功。中成药组10只大鼠输卵管肿胀变粗,管腔较粗糙,与周围组织均有较轻粘连,轻度积水,暗红少光泽,质地较硬,弹性略差。西药组10只大鼠输卵管肿胀变粗,管腔较粗糙,与周围组织均有较轻粘连,轻度积水,暗红少光泽,质地较硬,弹性略差。高剂量组10只大鼠输卵管粗细均匀,管腔光滑,与周围组织均有轻微粘连,无积水,红润有光泽,质软,弹性好。中剂量组10只大鼠输卵管略肿胀变粗,管腔稍粗糙,与周围组织均有轻微粘连,少许积水,淡红有光泽,质略硬,弹性可。低剂量组10只大鼠输卵管肿胀变粗,管腔粗糙,与周围组织均有少许粘连,轻度积水,暗红少光泽,质地较硬,弹性较差。见图 1。
|
| 图 1 各组大鼠输卵管肉眼形态观察 |
正常组管壁组织结构清晰,管腔通畅,纤毛丰富,未见炎性细胞及纤维组织。模型组管壁明显增厚,结构不清晰;管腔阻塞,粘连狭窄;纤毛凌乱,粘连变粗;大量炎性细胞浸润,大量纤维结缔组织增生;提示造模成功。中成药组管壁略增厚,结构基本清晰;管腔较通畅,管腔略细;纤毛分支少,轻度粘连;少量纤维结缔组织增生,少量炎性细胞浸润。西药组管壁略增厚,结构基本清晰;管腔较通畅,管腔略细;纤毛分支少,无粘连;少量纤维结缔组织增生,极少量炎性细胞浸润。高剂量组管壁组织结构清晰,管腔基本通畅;纤毛分支少,无粘连;较少纤维结缔组织增生,无炎性细胞浸润。中剂量组管壁略增厚,结构基本清晰;管腔较通畅,管腔略细;纤毛分支少,无粘连;少量炎性细胞浸润,少量纤维结缔组织增生。低剂量组管壁增厚,结构欠清晰;管腔欠通畅,部分管腔狭窄;纤毛分支较多,粘连较轻;多量炎性细胞浸润,少量纤维结缔组织增生。见图 2。
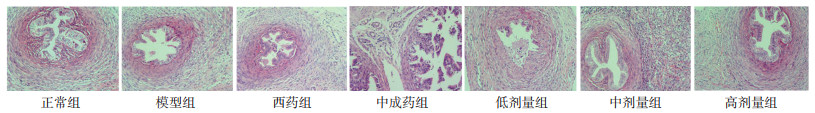
|
| 图 2 各组大鼠输卵管组织HE染色结果(×400) |
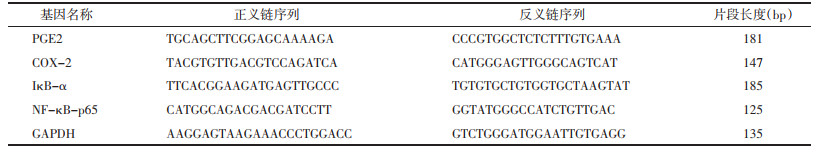
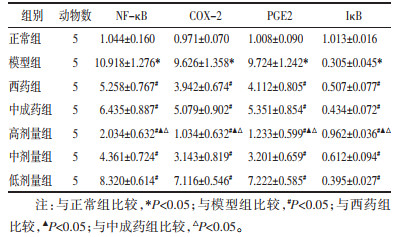
与正常组比较,模型组大鼠血清中NF-κB、COX-2、PGE2水平升高,IκB水平降低,差异有统计学意义(P<0.05)。与模型组比较,各给药组大鼠血清中NF-κB、COX-2、PGE2水平降低,IκB水平升高,差异有统计学意义(P<0.05)。与中成药组及西药组比较,通管助孕方高剂量组大鼠血清中NF-κB、COX-2、PGE2水平降低,血清中IκB水平升高,差异有统计学意义(P<0.05);通管助孕方中、低剂量组大鼠NF-κB、COX-2、PGE2及IκB水平差异不显著,无统计学意义(P>0.05)。见表 2。
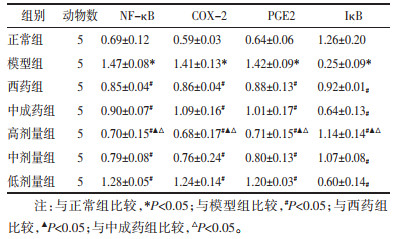
与正常组比较,模型组大鼠输卵管组织中NF-κB、COX-2、PGE2蛋白表达升高,IκB蛋白表达降低,差异有统计学意义(P<0.05)。与模型组比较,各给药组大鼠输卵管组织中NF-κB、COX-2、PGE2蛋白表达降低,IκB蛋白表达升高,差异有统计学意义(P<0.05)。与中成药组及西药组比较,通管助孕方高剂量组大鼠输卵管组织中NF-κB、COX-2、PGE2蛋白表达降低,IκB蛋白表达升高,差异有统计学意义(P<0.05);通管助孕方中、低剂量组大鼠NF-κB、COX-2、PGE2及IκB蛋白表达差异不显著,无统计学意义(P>0.05)。见表 3及图 3。

|
| 注:1.空白组;2.模型组;3.高剂量组;4.中剂量组;5.低剂量组;6.西药组;7.中成药组。 图 3 各组大鼠输卵管组织中NF-κB、IκB、COX-2、PGE2蛋白的表达 |
与正常组比较,模型组大鼠输卵管组织中NF-κB、COX-2、PGE2基因表达升高,IκB基因表达降低,差异有统计学意义(P<0.05)。与模型组比较,各给药组大鼠输卵管组织中NF-κB、COX-2、PGE2基因表达降低,IκB基因表达升高,差异有统计学意义(P<0.05)。与中成药组及西药组比较,通管助孕方高剂量组大鼠输卵管组织中NF-κB、COX-2、PGE2的mRNA表达水平降低,IκB的mRNA表达升高,差异有统计学意义(P<0.05);通管助孕方中、低剂量组大鼠NF-κB、COX-2、PGE2及IκB的mRNA水平差异不显著,无统计学意义(P>0.05)。见表 4。
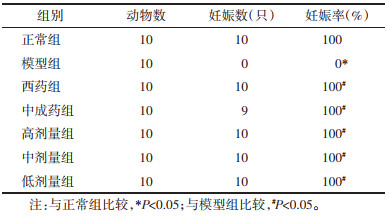
模型组大鼠妊娠率为0%,正常组大鼠妊娠率为100%,两组比较差异有统计学意义(P<0.05),表明造模成功。与模型组比较,通管助孕方高、中、低剂量组大鼠妊娠率升高,差异有统计学意义(P<0.05)。与中成药组及西药组比较,通管助孕方高、中、低剂量组大鼠妊娠率差异不显著,无统计学意义(P>0.05)。见表 5。
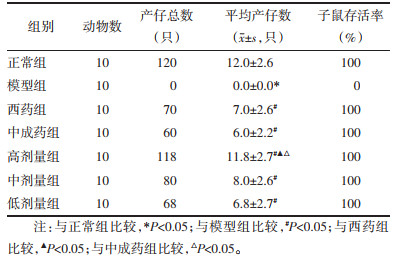
与模型组比较,经通管助孕方治疗后的各组大鼠总产仔数、平均产仔数增多,子鼠存活率升高,且子代无畸形。与正常组比较,模型组大鼠平均产仔数下降(P<0.05)。与模型组比较,各给药组大鼠平均产仔数升高(P<0.05)。与中成药组及西药组比较,通管助孕方高剂量组大鼠平均产仔数升高(P<0.05),中、低剂量组无明显差异(P>0.05)。见表 6。
中医并无输卵管阻塞性不孕症这一病名,相关论述多见于“全不产”“癥瘕”“断绪”“求嗣”“绝子”等。西医治疗本病常采用输卵管介入再通术、宫腹腔镜、输卵管注药术等方法,虽然能够机械性地松解粘连,疏通管腔,使输卵管在解剖结构上基本恢复正常,但不能彻底恢复输卵管的功能,且存在经济费用高、创伤性大、复通率低、术后复发率高等问题。中医认为本病性质多为虚实夹杂,但其根在“瘀”,故其治疗以活血通脉、消癥散结为主,以抗炎抗粘连、疏通管腔为辅,促进输卵管功能恢复,且治疗后不易再粘连,从而有效提高复通率。中药内服、中药外敷、针灸、保留灌肠等疗法可以多方位、多层次、多靶点、多角度整体调治本病,均能改善患者宫腔内环境,有利于下次受孕,提高受孕率;防止管腔再粘连,降低复发率;且创伤性小,经济安全高效,易于被患者接受。
高慧教授认为本病的病机主要在于瘀阻胞脉、胞络,湿热之毒蕴结于胞宫,病位在胞宫、胞络、胞脉,络属于肝经。故立法以活血化瘀、软坚散结为主,并佐以理气行滞、清热利湿解毒、通管助孕之品,创制通管助孕方治疗本病,效验颇佳。该方由皂角刺、穿心莲、香附、当归、柴胡、丹参、蒲公英、青皮、路路通、红花、通草、白芍组成,方中重用排毒祛脓的皂角刺为君,以其锋锐直达患处,促进管腔疏通,痈脓消散。臣以当归、红花、丹参活血祛瘀,软坚散结,通经活络止痛,以疏通胞脉、胞络,促进血液畅行;臣以穿心莲、蒲公英清热解毒燥湿,凉血消痈散结,抑制炎性渗出及瘢痕形成,以发挥抗炎抗粘连作用,共为臣药。佐以白芍养血敛阴,柔脉止痛,防止诸药破血妄行,使血行有度;佐以柴胡、香附、青皮疏肝行气,引诸药入肝经,肝脉过阴器,以达疏通输卵管之用。使以路路通、通草通经利水,消肿止痛,以发挥抗炎消肿止痛之功。
本实验阳性对照药物选用了人胎盘组织液和丹黄祛瘀胶囊。人胎盘组织液是人胎盘组织经酸水解后的混合物,具有活血通络止痛、软坚散结消癥之效,常用于治疗盆腔炎、术后宫腔粘连、瘢痕组织的消除等。研究表明,人胎盘组织液具有抗炎、抗粘连、抑制结缔组织增生、修复内皮功能、修复卵巢功能等作用,可以减轻输卵管炎症,消散积液,松解粘连,通管助孕,从而有利于输卵管功能的恢复[8],因此选择此药作为西药对照药物。丹黄祛瘀胶囊具有活血消肿止痛、软坚散结消痈之功,可缓解慢性盆腔疼痛,消散盆腔炎性包块,并且可以提高输卵管炎性不孕患者正常妊娠率[9],因此选择该药作为中成药对照药物。
NF-κB是一种能与免疫球蛋白κ轻链基因的增强子κB序列特异结合并促进κ轻链基因表达的蛋白因子[10],是调控免疫反应的一种多效性转录因子,存在于各种细胞,可通过调控其下游炎性因子而参与细胞免疫反应及炎症反应的调控[11]。NF-κB通路可被炎症因子、多脂糖、细菌等激活,活化的NF-κB转运到细胞核内,NF-κB会激活与炎症、免疫、细胞凋亡、细胞增殖和分化有关的靶基因转录[12]。活化的NF-κB在细胞核内调控TNF-α、COX-2、PGE2等炎症因子大量产生,引起大量炎性细胞浸润,炎症因子再次激活NF-κB通路,从而产生炎性因子瀑布样级联反应[13],进而加剧炎症反应,加重输卵管损伤而致瘢痕组织形成,引起管腔粘连阻塞而致不孕。
IκB是NF-κB主要的内源性抑制因子,存在于胞浆中,能够抑制NF-κB核移位。IκB蛋白家族成员主要包括IκBα、IκBβ、IκBε、IκBγ、IκBδ等构成NF-κB通路的典型抑制剂,其中IκBα作为NF-κB信号通路的负调节剂发挥主要作用[14]。IκBα既可以与细胞质内的NF-κB结合使其处于失活状态,又可以与细胞核内的NF-κB结合,此时NF-κB与IκBα的结合能力强于与κ轻链基因的结合能力,促进NF-κB解离失活,再次转移到细胞质内,从而形成负反馈调节,抑制NF-κB通路传导[15],从而下调促炎因子COX-2、PGE2的表达。
COX-2是花生四烯酸转化为前列腺素的关键酶之一,COX-2是诱导型酶,在发生炎症反应时,可以促进前列腺素的合成。NF-κB通路的激活会引起炎症反应,活化的NF-κB与COX-2基因启动子区域的NF-κB位点基因序列相结合,引起COX-2表达上调,COX-2可以促进PGE2的产生,进而引起NF-κB下游信号通路COX2/PGE2的激活,进一步加剧炎症反应[16]。
PGE2是一种源自花生四烯酸代谢产生的活性脂质化合物,是具有免疫抑制活性的促炎因子。PGE2不仅可以促进炎症反应,诱导成纤维细胞的增殖,引起炎区纤维化,同时还能增强缓激肽、组织胺的致痛作用[17]。在输卵管发生炎症反应时,PGE2能够刺激组胺释放,增强血管通透性,导致炎性渗出液增多,进而影响输卵管的蠕动功能,使卵子的运行受阻,精卵不能相遇,进而造成输卵管炎性不孕[18-19]。
研究结果显示,与正常组比较,模型组大鼠血清中及输卵管组织中的促炎因子NF-κB、COX-2、PGE2蛋白及基因的表达明显升高,抗炎因子IκB蛋白及基因的表达明显降低,提示造模成功。通管助孕方能够显著下调大鼠血清及输卵管组织中促炎因子NF-κB、COX-2、PGE2蛋白及基因的表达,上调抗炎因子IκB的表达,抑制炎症反应,减轻炎性渗出,抑制管腔组织纤维化、粘连形成,修复输卵管黏膜和纤毛,疏通管腔,并促进输卵管功能的恢复。通管助孕方治疗输卵管阻塞性不孕症的作用机制可能是通过抑制促炎因子NF-κB、COX-2、PGE2的表达,上调抗炎因子IκB的表达以限制NF-κB核移位,使大量NF-κB失活,减少COX-2、PGE2的释放,从而阻断了NF-κB信号通路的传导。
在输卵管组织形态学方面,肉眼观察下,与模型组比较,通管助孕方低剂量组大鼠管腔轻微肿胀,与周围组织粘连较轻,淡红有光泽,质较硬;中、高剂量组大鼠输卵管组织形态逐渐趋于正常。肉眼观察下,高剂量组大鼠输卵管走行对称,无迂曲变形,管腔通畅,管腔粗细均匀,光滑润泽,与周围组织轻微粘连,质地柔软,富有弹性。光镜观察下,高剂量组大鼠管壁结构清晰,管腔基本通畅;纤毛无粘连;较少纤维结缔组织增生,无炎性细胞浸润。表明通管助孕方具有显著的抗炎抗粘连作用,从而有效疏通管腔,促进输卵管结构的修复。
综上所述,通管助孕方可以有效抑制机体炎症反应,明显减轻输卵管组织的病理损伤程度,疏通输卵管并恢复其功能,其治疗本病的作用机制可能是通过抑制NF-κB信号通路的活化实现的,为通管助孕方的临床应用提供了理论依据。
| [1] |
陈子江, 刘嘉茵, 黄荷凤, 等. 不孕症诊断指南[J]. 中华妇产科杂志, 2019, 54(8): 505-511. CHEN Z J, LIU J Y, HUANG H F, et al. Guidelines for diagnosis of infertility[J]. Chinese Journal of Obstetrics and Gynecology, 2019, 54(8): 505-511. |
| [2] |
许春灵, 张兴平, 豆中敏. 宫腹腔镜下输卵管通液术联合通络方保留灌肠治疗输卵管阻塞性不孕临床研究[J]. 实用中医药杂志, 2022, 38(2): 274-275. XU C L, ZHANG X P, DOU Z M. Clinical study on treatment of tubal obstructive infertility by hysteroscopy combined with Tongluo Recipe retention enema[J]. Journal of Practical Traditional Chinese Medicine, 2022, 38(2): 274-275. |
| [3] |
何健英, 邹立波, 王荣, 等. 输卵管性不孕患者生殖道病原菌的分布[J]. 中华医院感染学杂志, 2017, 27(15): 3548-3551. HE J Y, ZOU L B, WANG R, et al. Distribution of pathogenic microbes of reproductive tract in patients with tubal infertility[J]. Chinese Journal of Nosocomiology, 2017, 27(15): 3548-3551. |
| [4] |
胡喜姣, 李硕熙, 郑跃, 等. 基于血流变及炎性因子探讨膈下逐瘀汤加减方对输卵管炎性不孕大鼠作用机制研究[J]. 世界中西医结合杂志, 2018, 13(4): 497-500. HU X J, LI S X, ZHENG Y, et al. Effects and mechanism of the modified Gexia Zhuyu Decoction on the oviduct inflammatory infertility in the rats based on hemorheology and inflammatory factors[J]. World Journal of Integrated Traditional and Western Medicine, 2018, 13(4): 497-500. |
| [5] |
徐叔云. 药理实验方法学[M]. 3版. 北京: 人民卫生出版社, 2002: 905-937. XU S Y. Pharmacological experimental methodology[M]. 3rd edition. Beijing: People's Medical Publishing House, 2002: 905-937. |
| [6] |
赵广兴, 王春田, 马宝璋, 等. 大鼠输卵管炎性不孕症模型的建立[J]. 中国比较医学杂志, 2004, 14(1): 23-26. ZHAO G X, WANG C T, MA B Z, et al. Establishment of a rat model of salpingitis-caused-sterility[J]. Chinese Journal of Laboratory Animal Science, 2004, 14(1): 23-26. |
| [7] |
胡喜姣, 林春盛, 李硕熙, 等. 金黄色葡萄球菌致急性与慢性输卵管炎性不孕症大鼠模型的建立[J]. 中国比较医学杂志, 2018, 28(8): 56-61. HU X J, LIN C S, LI S X, et al. Establishment of a rat model of acute and chronic fallopian tube inflammatory infertility caused by Staphylococcus aureus[J]. Chinese Journal of Comparative Medicine, 2018, 28(8): 56-61. |
| [8] |
朱天垣, 谢秀英, 蒲雯婕, 等. 宫腔粘连分离术后应用胎盘组织液预防再粘连效果[J]. 中国计划生育学杂志, 2022, 30(7): 1548-1550, 1554. ZHU T Y, XIE X Y, PU W J, et al. Effect of placental tissue fluid for preventing postoperative intrauterine readhesion of patients after intrauterine adhesion separation[J]. Chinese Journal of Family Planning, 2022, 30(7): 1548-1550, 1554. |
| [9] |
《中成药治疗优势病种临床应用指南》标准化项目组. 中成药治疗盆腔炎性疾病后遗症临床应用指南(2020年)[J]. 中国中西医结合杂志, 2021, 41(3): 286-299. Clinical Application Guide of Traditional Chinese Patent Medicines and Simple Preparations for Treatment of Dominant Diseases standardization project team. Clinical application guidelines of Chinese patent medicine in treatment of sequela of pelvic inflammatory disease(2020)[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2021, 41(3): 286-299. |
| [10] |
SEN R, BALTIMORE D. Multiple nuclear factors interact with the immunoglobulin enhancer sequences[J]. Cell, 1986, 46(5): 705-716. |
| [11] |
SUN S C, CHANG J H, JIN J. Regulation of nuclear factor-κB in autoimmunity[J]. Trends in Immunology, 2013, 34(6): 282-289. |
| [12] |
SILVA G E B, COSTA R S, RAVINAL R C, et al. NF-κB expression in IgA nephropathy outcome[J]. Disease Markers, 2011, 31(1): 9-15. |
| [13] |
MORGAN M J, LIU Z G. Crosstalk of reactive oxygen species and NF-κB signaling[J]. Cell Research, 2011, 21(1): 103-115. |
| [14] |
MULERO M C, BIGAS A, ESPINOSA L. IκBα beyond the NF-κB dogma[J]. Oncotarget, 2013, 4(10): 1550-1551. |
| [15] |
LAWRENCE T. The nuclear factor NF-kappaB pathway in inflammation[J]. Cold Spring Harbor Perspectives in Biology, 2009, 1(6): 15-21. |
| [16] |
ZHANG Z Y, HUANG S S, WU S F, et al. Clearance of apoptotic cells by mesenchymal stem cells contributes to immunosuppression via PGE2[J]. EBioMedicine, 2019, 45(2): 341-350. |
| [17] |
龚素蕊. 女性不孕症相关因素及病因分析[J]. 现代中西医结合杂志, 2012, 21(5): 499-500. GONG S R. Analysis of related factors and etiology of female infertility[J]. Modern Journal of Integrated Traditional Chinese and Western Medicine, 2012, 21(5): 499-500. |
| [18] |
罗志娟, 马钰婷, 吴媛媛, 等. 道地通管汤对输卵管炎性不孕家兔PGE2、PGF2a、CRP、IL-6的影响[J]. 广西医学, 2012, 34(11): 1509-1511. LUO Z J, MA Y T, WU Y Y, et al. Effects of Daodi Tongguan Decoction on PGE2, PGF2a, CRP and IL-6 in rabbits with tubal inflammatory infertility[J]. Guangxi Medical Journal, 2012, 34(11): 1509-1511. |
| [19] |
王秀明. 脂多糖刺激对奶牛输卵管上皮细胞PGE2和PGF2α合成分泌的影响研究[D]. 呼和浩特: 内蒙古农业大学, 2014. WANG X M. Studies on secretion of PGE2 and PGF2α induced by LPS in bovine oviduct epithelial cell[D]. Hohhot: Inner Mongolia Agricultural University, 2014. |
 2023, Vol. 42
2023, Vol. 42