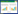文章信息
- 刘海帆, 冀祖恩, 彭一峰, 张丽, 孙琰琴, 罗恒磊, 张薇
- LIU Haifan, JI Zuen, PENG Yifeng, ZHANG Li, SUN Yanqin, LUO Henglei, ZHANG Wei
- 甘草地上部分活性部位的急性毒性和长期毒性实验研究
- Study on the acute and long-term toxicity of the aerial active parts of Glycyrrhiza uralensis
- 天津中医药大学学报, 2023, 42(5): 609-617
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(5): 609-617
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.05.11
-
文章历史
收稿日期: 2023-04-30
2. 新疆甘草及制品研究重点实验室, 库尔勒 841011;
3. 新疆全安药业股份有限公司, 库尔勒 841011
2. Xinjiang Key Laboratory for Research of Licorice and Products, Korla 841011, China;
3. Xinjiang Quan'an Pharmaceutical Co. Ltd., Korla 841011, China
甘草地上部分为甘草(Glycyrrhiza uralensis Fisch.)的干燥茎叶,其资源丰富且总黄酮含量可达5.64%[1]。课题组前期研究表明甘草地上部分醇提物具有抗慢性非细菌性前列腺炎(CNP)的作用[2],且黄酮类成分为其主要活性成分[3]。本研究对甘草地上部分醇提物进一步富集黄酮后得到的活性部位进行急性毒性和长期毒性实验,为甘草地上部分活性部位在临床上的安全应用提供合理的科学依据。
1 仪器与材料 1.1 仪器BC-2800vet迈瑞兽用全自动血液细胞分析仪(深圳雷杜生命科技);Chemray800全自动生化分析仪(深圳雷杜生命科技);ME203E/02电子天平(梅特勒-托利多仪器上海有限公司);KZ-Ⅱ高速组织研磨仪(武汉赛维尔生物科技有限公司);D3024R台式高速冷冻离心机(大龙兴创实验仪器北京股份公司);MX-F涡旋混合器(武汉赛维尔生物科技有限公司);EP-150-M 1.5 mL离心管(武汉赛维尔生物科技有限公司);KE0037273 1 000 μL移液器、YE3K030591 200 μL移液器、DS35110 50 μL移液器、KE0012951 10 μL移液器(移液器均购自大龙兴创实验仪器北京股份公司);1012710P载玻片(江苏世泰实验器材有限公司);Sw101-35烤箱(上海苏博仪器有限公司);10212450C盖玻片(江苏世泰实验器材有限公司);EG11组织包埋机(德国徕卡);SYD-PK切片烤片机(沈阳誉德电子仪器有限公司);RM2245切片机(德国徕卡)。
1.2 药物与试剂本实验样品甘草地上部分是采自甘肃省酒泉市瓜州县河东乡的9年生栽培甘草,经中国医学科学院王文全教授鉴定为甘草Glycyrrhiza uralensis Fisch.,经自然阴干后,粉碎过40目筛,备用。甘草地上部分以70%乙醇回流提取,提取温度75 ℃,液料比8∶1,提取时间90 min,提取2次,浓缩、干燥成粉末。将甘草地上部分醇提物用10倍量的去离子水溶解后静置12 h,3 500 r/min离心15 min(离心直径为80 cm)得到上清,将上清溶液部分挥干,收集得到的上清浸膏为甘草地上部分活性部位,即本研究的受试物(出膏率为79.3%,黄酮含量为14.58%),受试物的制备方法依据本课题组前期研究得到的最佳醇提工艺[4]进行微调;水(娃哈哈集团有限公司);无水乙醇(分析纯,北京化工厂);羧甲基纤维素钠(CMC-Na,coolaber公司);二甲苯(北京化工厂);中性树胶(上海实验器材厂);苏木素染液(珠海贝素生物技术公司);伊红染液(珠海贝素生物技术公司);S03030丙氨酸氨基转移酶(ALT)、S03040天门冬氨酸氨基转移酶(AST)、S03038碱性磷酸酶、S03043白蛋白、S03022总蛋白、S03036尿素、S03076肌酐、S03024肌酸激酶、S03027三酰甘油、S03042总胆固醇、S03039葡萄糖测定试剂盒(深圳市雷杜生命科学股份有限公司);C120总胆红素、C108钠、C013氯、C068钾测定试剂盒(长春汇力生物技术有限公司)。
1.3 动物SPF级昆明种雄性小鼠20只,体质量45~50 g(用于急性毒性实验);SPF级SD雄性大鼠40只,体质量180~200 g(用于长期毒性实验),均购自北京市维通利华实验动物技术有限公司。实验动物常规饲养,保持恒温24 ℃,12 h光/暗周期下,接受标准饮食和水,自由采食。本研究经中国医学科学院药用植物研究所动物福利伦理委员会批准,符合中国伦理委员会有关动物研究指导原则,急性毒性实验小鼠与长期毒性实验大鼠的伦理审查编号分别为SCXK(京)2016-0006、SLXD(京)-20200902021。
2 方法 2.1 急性毒性实验选取SPF级昆明种雄性小鼠20只,分为2组,分别为实验组和空白组,每组10只。实验组剂量为33.2 g/kg(最大给药剂量),灌胃给药,两组均每日给药2次(间隔5 h),空白组给予等体积0.5%CMC-Na溶液。给药后连续观察4~6 h,以后每日观察1次,持续观察14 d。观察小鼠的基本状况(是否腹泻、惊厥、嗜睡,是否出现被毛、皮肤、呼吸系统等异常),第14天处死所有小鼠,进行解剖观察是否有脏器病变,实验期间的第0、7、11、14天记录小鼠体质量。
2.2 长期毒性实验选取SD雄性大鼠40只,分为空白组、受试物8.3、16.6、33.2 g/kg组,每组10只,每日给药1次,每周连续给药6 d,停药1 d,共连续给药90 d,空白组给予等体积0.5%CMC-Na溶液。每日观察动物精神状态、行为活动、毛色、二便等一般体征,每周称取体质量1次,根据体质量变化及时调整灌胃量,2 d记录1次大鼠饮水量与摄食量,计算食物利用率(食物利用率=体质量增加量÷进食量×100%,表示大鼠摄入100 g饲料增加的体质量)。给药中期(45 d)及末期(90 d)禁食不禁水16 h,麻醉后眼眶取血,制备全血及血清标本,分别进行血液学及血清生化指标检测;实验结束后解剖取出脏器并称取质量,计算脏器指数,对脏器进行组织病理学检查。
2.3 数据统计与处理采用SPSS 20.0软件进行统计学分析,计量资料以均数±标准差(x±s)表示,对满足正态性分布及方差齐性的数据,组间比较采用单因素方差分析,两两比较采用LSD法,P<0.05为差异有统计学意义。
3 结果 3.1 急性毒性实验 3.1.1 小鼠死亡与生存状况分析在灌服甘草地上部分活性部位后,各组均未出现小鼠死亡情况,未发现腹泻、嗜睡、惊厥等行为,未发现被毛、皮肤等异常,实验组与空白组小鼠状态无明显差异。
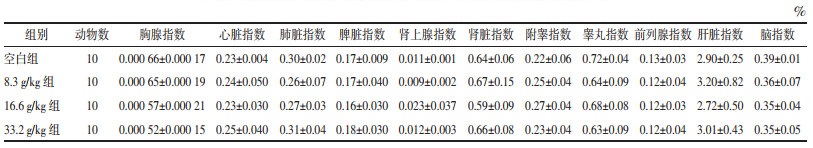
3.1.2 小鼠体质量与大体解剖情况分析各组小鼠平均体质量呈增长趋势,且实验组与空白组比较,差异无统计学意义(P>0.05)。第14天解剖小鼠后,两组均未发现明显脏器病变。见表 1。
实验过程中,各组大鼠身体状况良好,饮水与进食正常,体质量呈增长趋势,大小便正常,全程未见实验动物死亡情况。
3.2.1.1 甘草地上部分活性部位对大鼠体质量的影响各实验组与空白组大鼠体质量均呈增长趋势,第1周增长较快,各剂量组及空白组动物体质量均未发现异常变化。见表 2。
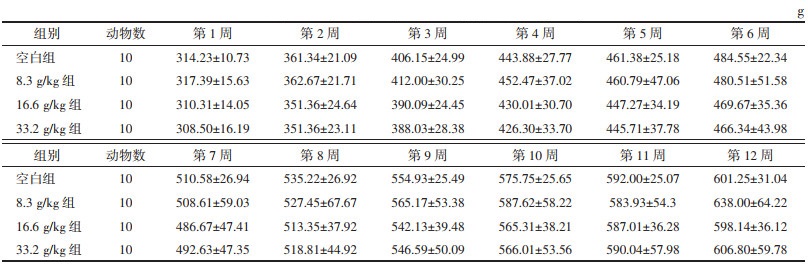
各组大鼠在90 d实验周期内的食物利用率趋势一致,均呈现降低的趋势,在同一时间节点,各实验组与对照组大鼠食物利用率比较,差异无统计学意义(P>0.05),认为甘草地上部分经口给药90 d对大鼠的正常进食无不良影响。各组大鼠的食物利用率随时间变化情况见表 3。
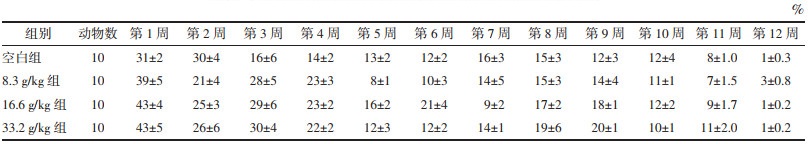
空白组与各实验组在90 d实验周期内的饮水量变化趋势基本一致,第10周时均出现下降趋势,在第11周恢复,可能是由于第10周时受环境因素影响,动物房温度升高或者环境出现异常所致。但各给药组与空白组趋势一致,所以认为甘草地上部分活性部位经口给药90 d对大鼠的正常饮水无不良影响。各组大鼠的饮水量随时间变化情况见表 4。
与空白组比较,各实验组大鼠大体解剖和脏器与体质量比例结果未见明显变化,差异无统计学意义(P>0.05)。主要指标见表 5。
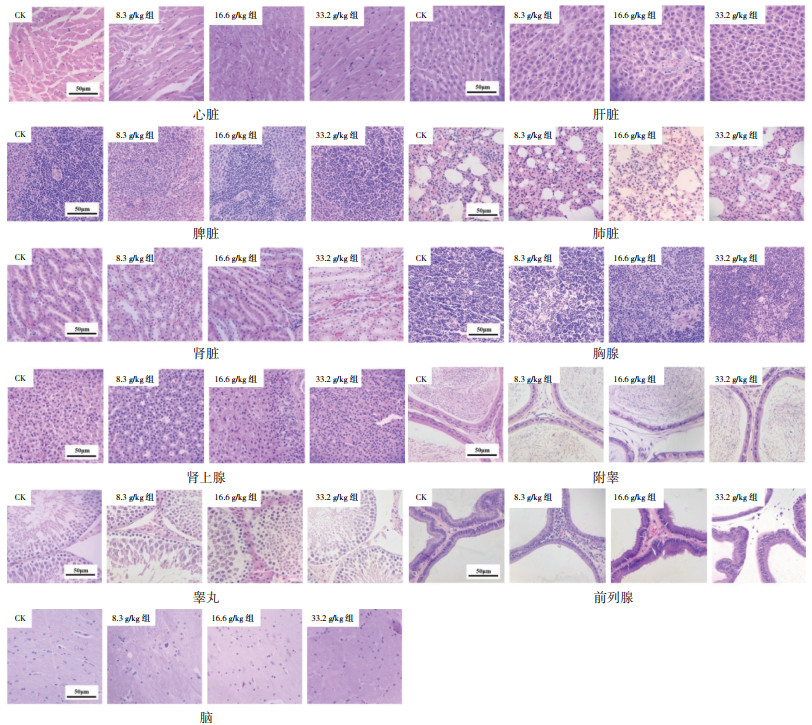
各实验组大鼠的心脏、肝脏、脾脏、肺脏、肾脏、胸腺、肾上腺、附睾、睾丸、前列腺、脑组织结构清晰,形态完整,未见明显病理改变。苏木精-伊红(HE)染色结果见图 1。
|
| 注:CK为空白组。 图 1 大鼠组织病理学HE染色结果(×400) |
心肌细胞排列正常,形态结构无紊乱;肝脏组织病理切片可见肝小叶结构完整,肝细胞及血窦清晰无异常,肝窦未见充血,肝汇管内无明显炎性细胞浸润;脾脏组织切片中红髓区和白髓区界限清晰,小梁结构无异常;肺泡组织形态、结构清晰,肺泡无塌陷及破裂,肺泡充盈适度,肺泡囊管壁结构完整;肾小体结构完整,肾小球位于小体中央且结构完整;胸腺皮髓界限清楚,小叶明显,皮质部成熟淋巴细胞较多,髓质部可见明显的胸腺小体;肾上腺皮质与髓质分界明显;皮质部网状带、球状带、束状带的细胞结构正常;附睾细胞排列紧密,界限清晰,附睾管内含有大量成熟精子;睾丸曲细小管内各级生精细胞发育良好;前列腺体未见萎缩,间质无水肿,无炎症细胞浸润,腺泡上皮排列整齐无增生现象;脑组织结构正常,皮质结构清晰,神经细胞结构完整,无炎性细胞浸润,白质部神经纤维染色均匀,为淡粉色,排列整齐,纹理清晰。
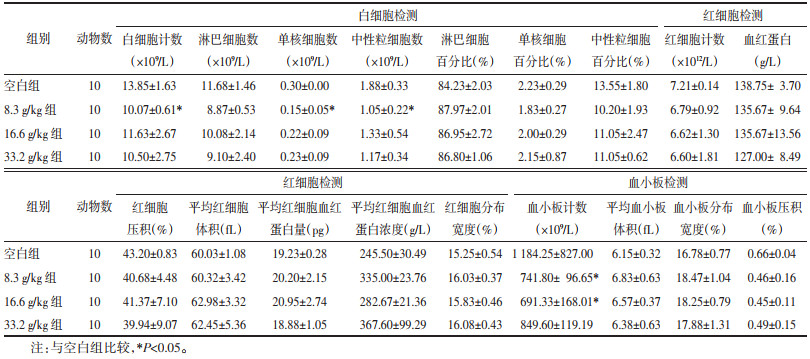
3.2.3 甘草地上部分活性部位对大鼠血液学指标的影响 3.2.3.1 实验45 d血液学检测结果实验45 d时,与空白组比较,部分实验组的检测指标出现变化,差异有统计学意义(P<0.05),其中8.3 g/kg组的白细胞计数、单核细胞数目、中性粒细胞数、血小板计数以及16.6 g/kg组的血小板计数降低。实验45 d时各组大鼠的血液学指标见表 6。
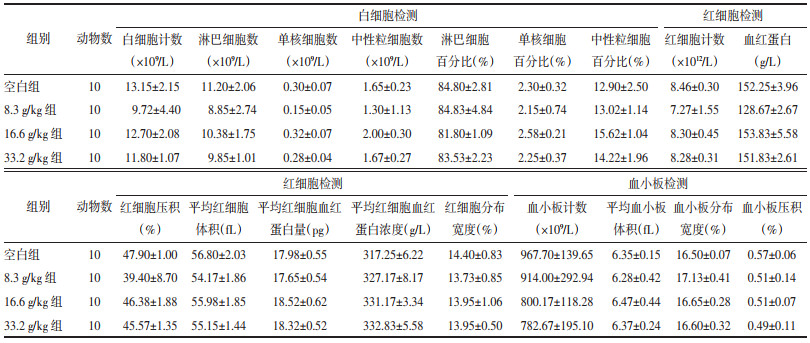
实验90 d时,与空白组比较,各实验组指标未见明显变化,差异无统计学意义(P>0.05)。实验90 d时各组大鼠血液学指标见表 7。
实验45 d时,8.3g/kg组的白细胞计数、单核细胞数、中性粒细胞数、血小板计数及16.6 g/kg组的血小板计数与空白组比较显著降低,而实验90 d时检测却未见显著性差异,考虑为采集时间、方法与个体差异所致。由于实验45 d时采用大鼠眼眶后静脉丛采血的方式采集血液,而实验90 d时采用腹主动脉采血方式,所以推测眼眶后静脉丛采血会造成动物产生兴奋与排尿、排便等现象,从而影响部分血液学、生化指标改变[5],且由于实验45 d与90 d采血时间相差45 d,有研究表明不同年龄大鼠的血液学指标会有所不同[6]。
上述结果中有较多的血液学检测指标异常,但根据毒理学实验的评价标准可知,血液学检测指标均存在正常范围,即使各实验组的实际检测值与空白组比较有统计学差异,但若这个数值在正常范围之内,则这个数值依然为正常值。或者部分指标只有异常升高时才具有临床意义,异常降低则不作为诊断标准,此时也不认为是发生毒性反应。按照此原则[7]对数据进行分析后,排除了无意义的异常值,最终提示甘草地上部分活性部位给药后实验45 d与实验90 d对大鼠血液学检测指标并无异常影响。
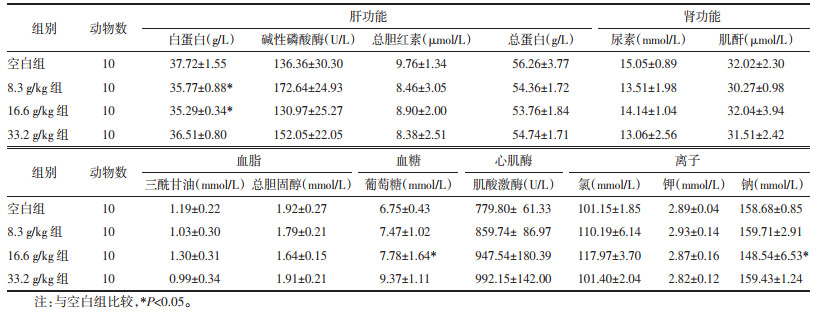
3.2.4 甘草地上部分活性部位对大鼠血清生化指标的影响 3.2.4.1 实验45 d大鼠血清生化检测结果实验45 d时,与空白组比较,8.3 g/kg组白蛋白异常降低,16.6 g/kg组白蛋白、钠离子异常降低,葡萄糖异常升高,差异有统计学意义(P<0.05)。实验45 d时各组大鼠血清生化指标见表 8。
实验90 d时,与空白组比较,各实验组大鼠的总胆红素均显著降低;8.3、16.6 g/kg组三酰甘油均显著降低,差异有统计学意义(P<0.05)。实验90 d时各组大鼠的血清生化指标见表 9。
实验45 d时,与空白组比较,8.3 g/kg组大鼠白蛋白异常降低,16.6 g/kg组大鼠白蛋白、钠离子异常降低,葡萄糖异常升高。实验90 d时,与空白组比较,各给药组的总胆红素均显著降低;8.3、16.6 g/kg组三酰甘油均显著降低。这些指标仅45 d或90 d时有统计学差异,但均在正常范围之内,所以认为其属于无意义的异常值。推测这些值的波动与取样时间有关,且在90 d取材前1 d将大鼠转移至另一房间,禁食1个晚上,可能由于环境的变化导致大鼠的某些生化指标产生波动。
血清生化指标同血液学指标一样,与空白组比较出现统计学差异不完全代表毒性作用,与血液学指标的分析结果相同。以此原则[8-9]对本次实验的结果进行分析,排除了无意义的异常值,最终提示甘草地上部分活性部位给药对大鼠血清生化指标无异常影响。
4 讨论与结论相关研究表明,在关注中药疗效的同时也应重视对其安全性的检测[10]。本课题组前期研究发现甘草地上部分水提物、醇提物具有潜在毒性[11],为保证临床用药的安全性,本研究按照《中药新药研究指南》[12]和《中药、天然药物长期毒性研究技术指导原则》[13]的要求对甘草地上部分活性部位的毒性进行评价,为新药研发提供安全性依据。
本实验中急性毒性与长期毒性研究均只使用雄性鼠,是由于本课题组研究发现甘草地上部分对前列腺炎治疗效果显著[2],将此药用于男性患者,故该研究未对雌性鼠展开实验。
甘草地上部分活性部位的小鼠急性毒性实验中,在14 d的观察期内,无小鼠死亡,各组小鼠被毛、皮肤、运动、身体健康状况无异常,无明显中毒症状。实验期间,小鼠体质量正常增长,甘草地上部分活性部位的最大耐受剂量>33.2 g/kg,属于无毒级,提示甘草地上部分活性部位无急性毒性。
长期毒性实验期间,各组实验动物正常进食进水,食物利用率及饮水量均未见异常;各组大鼠脏器指数均无明显差异,认为受试物对脏器指数没有影响。组织病理学方面,受试物对大鼠组织病理学切片无异常影响,且甘草地上部分对大鼠血液学及血清生化指标无异常影响。因此,甘草地上部分活性部位对大鼠一般生理状态及肝脏、肾脏功能与脏器组织学均无长期毒性反应。
综上所述,甘草地上部分活性部位无急性毒性和长期毒性反应,药物的最大耐受量≥33.2 g/kg,即有效剂量[14]的30倍;基本安全剂量≥33.2 g/kg,即临床剂量的30倍,在治疗剂量范围内用药安全性高。
血液生理生化指标不仅可以反映动物的生理状态和健康状态,还可以评价其生长性能和生产性能,对评价动物的代谢状况、生理状态和饲养管理具有重要意义。在实验中出现了个别指标的波动情况,但均在正常范围之内,推测其与大鼠的年龄、饲养条件及取样方法有关。杨林等[15]研究表明不同生理阶段的同性小鼠血液生理指标差异显著;詹纯列等[16]研究表明环境因素对小鼠血常规的指标有显著影响;李罡等[17]经研究发现,由于在研究中所收集的SD大鼠血液学指标和血清生化指标资料包括了3个不同实验室和4个季节的实验数据,实验所用动物的年龄、初始体质量、营养及喂养环境等条件有所差异,血样的采集、运送和检测条件等亦不完全一致,使血红蛋白等10项指标的测定值在不同批次间差异具有统计学意义(P < 0.05)。
针对受试物的化学成分,本课题组通过网络药理学和大鼠体内的入血及代谢成分,得到甘草地上部分醇提物的主要药效成分为葛根素、山奈酚、木犀草素和乔松素4种黄酮类成分,并且通过药代动力学实验探究了4种成分在血浆、尿液、粪便及前列腺中的浓度变化,得出这4种成分在血浆及前列腺中均有分布,之后可以考虑将这4种成分作为甘草地上部分活性部位的质控成分[3]。
受试物的主要成分为黄酮类成分,他们除了具有相应药效外,研究还表明其具有脏器保护作用,能够降低毒性。Yang等[18]发现甲基化黄酮的表观渗透系数是非甲基黄酮的4~7倍,吸收较好。硫酸酯化代谢会增加药物的水溶性,使其更容易随尿液排出,降低毒性[19]。侯筱婷[20]研究表明葛根素可以预防大鼠急性酒精性肝损伤,对肝脏具有保护作用。预先给予葛根素可以明显减轻急性肺损伤大鼠肺组织炎症反应及肺水肿程度[21],可有效拮抗庆大霉素所致的大鼠肾损害[22]。香叶木素在肝、肺、肾脏中均有分布,香叶木素可通过降低核苷酸结合寡聚化结构域样受体热蛋白结构域相关蛋白3(NLRP3)炎性小体活性缓解四氯化碳(CCl4)诱导的肝损伤大鼠肝纤维化[23],对胎粪诱导的新生大鼠急性肺损伤具有治疗作用[24],可以通过核因子E2相关因子2(Nrf2)抗氧化信号通路缓解顺铂诱导的急性肾损伤[25]。
除了保护作用,黄酮类化合物会影响人体内药物的代谢,甚至导致不良反应。如其在体内会和细胞色素P450作用,从而影响体内药物的浓度,导致药效减弱或者增强,甚至产生毒性[19];黄酮类化合物也可能影响亲和素蛋白的活性,导致亲和素-致癌物的活性增加[26]。研究发现,黄酮类化合物还可以激活CYP1A1和CYP1A2,从而诱导致癌物质的活化,如高良姜素、槲皮素、香叶木素可以增加CYP1A1基因的表达[27-28],在之后的研究中可以对其中特定的黄酮类毒性成分予以关注。
| [1] |
董怡. 光果甘草叶黄酮的分离纯化、活性研究及应用[D]. 广州: 华南理工大学, 2016. DONG Y. Purification of flavonoids from Glycyrrhiza glabra L. leaf and their biological activities and applications[D]. Guangzhou: South China University of Technology, 2016. |
| [2] |
LIU H F, CUI J, ZHANG L, et al. Screening of anti-chronic nonbacterial prostatitis activity of different extractions of the aerial part of Glycyrrhiza uralensis, and network pharmacology research[J]. Biomedical Reports, 2021, 15(6): 99. DOI:10.3892/br.2021.1475 |
| [3] |
LIU H F, CHANG G H, WANG W Q, et al. Pharmacokinetics, prostate distribution and metabolic characteristics of four representative flavones after oral administration of the aerial part of Glycyrrhiza uralensis in rats[J]. Molecules, 2022, 27(10): 3245. DOI:10.3390/molecules27103245 |
| [4] |
张鲁, 张媛, 王文全, 等. 甘草地上部分总黄酮提取工艺优化及抗氧化活性研究[J]. 辽宁中医药大学学报, 2018, 20(4): 55-59. ZHANG L, ZHANG Y, WANG W Q, et al. Optimization of extraction process and antioxidative activity of total flavonoids in the aerial parts of Glycyrrhiza uralensis[J]. Journal of Liaoning University of Traditional Chinese Medicine, 2018, 20(4): 55-59. |
| [5] |
程洁, 环飞, 靳苏香, 等. 试验相关因素对SD大鼠血液学指标的影响[J]. 中国比较医学杂志, 2017, 27(3): 43-46. CHENG J, HUAN F, JIN S X, et al. Effects of experiment-related factors on hematological parameters in SD rats[J]. Chinese Journal of Comparative Medicine, 2017, 27(3): 43-46. |
| [6] |
仉慧敏, 孙淑华, 胡晓燕, 等. 无菌大鼠血液学及血液生化指标正常参考值的测定[J]. 中国比较医学杂志, 2011, 21(5): 26-31. ZHANG H M, SUN S H, HU X Y, et al. Detection of blood parameters and blood biochemical parameters in germ-free rats[J]. Chinese Journal of Comparative Medicine, 2011, 21(5): 26-31. |
| [7] |
王蕊, 温贤涛, 王辉, 等. SD大鼠血常规参考值区间建立[J]. 医疗装备, 2015, 28(7): 11-15. WANG R, WEN X T, WANG H, et al. Establishment of reference value interval of blood routine in SD rats[J]. Medical Equipment, 2015, 28(7): 11-15. |
| [8] |
郎天琦, 邹世颖, 侯曼, 等. SD大鼠90 d喂养试验生理生化指标正常参考值的研究[J]. 中国兽医杂志, 2016, 52(12): 99-101. LANG T Q, ZOU S Y, HOU M, et al. Study on the normal reference interval of hematological and serum biochemical indexes in 90 d feeding study on SD rats[J]. Chinese Journal of Veterinary Medicine, 2016, 52(12): 99-101. |
| [9] |
邓雯, 陈莉莉, 刘晶, 等. SPF级SD大鼠血液学及血清生化指标正常值探讨[J]. 毒理学杂志, 2010, 24(2): 174-175. DENG W, CHEN L L, LIU J, et al. Discussion on normal values of hematology and serum biochemical indexes in SPF SD rats[J]. Journal of Toxicology, 2010, 24(2): 174-175. |
| [10] |
李硕, 李敏, 卫营芳, 等. 中药安全性评价的研究进展[J]. 中国现代中药, 2014, 16(2): 172-176. LI S, LI M, WEI Y F, et al. Review on research of safety evaluation for traditional Chinese medicine[J]. Modern Chinese Medicine, 2014, 16(2): 172-176. |
| [11] |
赵梓邯, 张琳, 杨柳, 等. 甘草地上部分的安全性评价[J]. 中国实验方剂学杂志, 2019, 25(3): 74-80. ZHAO Z H, ZHANG L, YANG L, et al. Safety evaluation of over-ground parts of Glycyrrhiza uralensis[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2019, 25(3): 74-80. |
| [12] |
中华人民共和国卫生部药政管理局. 中药新药研究指南[M]. 北京: 中华人民共和国卫生部药政管理局, 1994. Ministry of Health of the People's Republic of China Pharmaceutical Administration Bureau. Guide to research on new Chinese medicine[M]. Beijing: Ministry of Health of the People's Republic of China Pharmaceutical Administration Bureau, 1994. |
| [13] |
《中药、天然药物急性毒性试验技术指导原则》课题研究组. 中药、天然药物急性毒性研究技术指导原则[M]. 2004. Guidance Principles for Acute Toxicity Test of Traditional Chinese Medicine and Natural Medicine' Research Group. Technical guidelines for acute toxicity research of traditional Chinese medicine and natural medicine[M]. 2004. |
| [14] |
张琳, 赵梓邯, 于冰莉, 等. 甘草地上部分对慢性前列腺炎大鼠的影响[J]. 中成药, 2019, 41(6): 1407-1410. ZHANG L, ZHAO Z H, YU B L, et al. Effect of aerial parts of Glycyrrhiza uralensis Fisch. on rats with chronic prostatitis[J]. Chinese Traditional Patent Medicine, 2019, 41(6): 1407-1410. |
| [15] |
杨林, 朱叶萌, 刘科, 等. MRL/lpr狼疮小鼠和C57小鼠血常规、主要脏器系数的测定与比较[J]. 实验动物科学, 2015, 32(3): 44-47. YANG L, ZHU Y M, LIU K, et al. The determination and comparison between MRL/lpr mice and C57 mice blood, major organ coefficient[J]. Laboratory Animal Science, 2015, 32(3): 44-47. |
| [16] |
詹纯列, 肖育华, 许达, 等. SPF级BALB/c小鼠血常规指标的测定与比较[J]. 中国比较医学杂志, 2010, 20(10): 82. ZHAN C L, XIAO Y H, XU D, et al. Determination and comparison of blood routine indexes in SPF BALB/c mice[J]. Chinese Journal of Comparative Medicine, 2010, 20(10): 82. |
| [17] |
李罡, 刘建勋, 葛争艳. 清洁级SD大鼠血液学指标及生化指标正常值的大样本分析[J]. 中药药理与临床, 2009, 25(2): 128-131. LI G, LIU J X, GE Z Y. Analysis for the normal range of hematological and serum biochemical parameters in healthy CL SD rat based on large sample[J]. Pharmacology and Clinics of Chinese Materia Medica, 2009, 25(2): 128-131. |
| [18] |
YANG Z H, LIU R, LI X X, et al. Development and validation of a high-performance liquid chromatographic method for determination of pinocembrin in rat plasma: application to pharmacokinetic study[J]. Journal of Pharmaceutical and Biomedical Analysis, 2009, 49(5): 1277-1281. |
| [19] |
陆柏益, 张英, 吴晓琴. 黄酮类化合物的潜在毒性作用[J]. 中国中药杂志, 2006, 31(7): 533-537. LU B Y, ZHANG Y, WU X Q. Advances in studies on potential toxicity of flavonoids[J]. China Journal of Chinese Materia Medica, 2006, 31(7): 533-537. |
| [20] |
侯筱婷. 葛根素对心脑血管疾病影响的研究进展[J]. 中西医结合心脑血管病杂志, 2018, 16(14): 2002-2004. HOU X T. Research progress on the effect of puerarin on cardiovascular and cerebrovascular diseases[J]. Chinese Journal of Integrative Medicine on Cardio-Cerebrovascular Disease, 2018, 16(14): 2002-2004. |
| [21] |
何科. 葛根素对大鼠急性肺损伤的影响[J]. 中国实验方剂学杂志, 2016, 22(5): 178-181. HE K. Effect of puerarin on rats with acute lung injury[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2016, 22(5): 178-181. |
| [22] |
金婉冰. 葛根素对庆大霉素致大鼠肾毒性的保护作用[J]. 中国临床药理学与治疗学, 2013, 18(8): 864-867. JIN W B. Protective effects of puerarin on gentamicin-induced nephrotoxicity in rats[J]. Chinese Journal of Clinical Pharmacology and Therapeutics, 2013, 18(8): 864-867. |
| [23] |
崔东娟, 刘涛, 赵艳红. 香叶木素降低NLRP3炎性小体活性缓解CCl4诱导的肝损伤大鼠肝纤维化[J]. 中国免疫学杂志, 2019, 35(5): 555-559. CUI D J, LIU T, ZHAO Y H. Diosmetin relieves hepatic fibrosis in CCl4-induced liver injury rats via reducing activity of NLRP3 inflammasome[J]. Chinese Journal of Immunology, 2019, 35(5): 555-559. |
| [24] |
郝莉霞, 卢蓉, 马霞霞, 等. 香叶木素对胎粪诱导的新生大鼠急性肺损伤的作用及其机制探讨[J]. 实验动物与比较医学, 2020, 40(5): 384-390. HAO L X, LU R, MA X X, et al. Effect of diosmetin on acute lung injury induced by meconium and its mechanism in neonatal rats[J]. Laboratory Animal and Comparative Medicine, 2020, 40(5): 384-390. |
| [25] |
陈新亮. 香叶木素通过Nrf2抗氧化信号通路缓解顺铂诱导的急性肾损伤[D]. 大庆: 黑龙江八一农垦大学, 2020. CHEN X L. Diosmetin relieves cisplatin-induced acute kidney injury through the Nrf2 antioxidant signaling pathway[D]. Daqing: Heilongjiang Bayi Agricultural University, 2020. |
| [26] |
VAN DER WEIDE J, STEIJNS L S. Cytochrome P450 enzyme system: genetic polymorphisms and impact on clinical pharmacology[J]. Annals of Clinical Biochemistry, 1999, 36(6): 722-729. |
| [27] |
CIOLINO H P, WANG T T, YEH G C. Diosmin and diosmetin are agonists of the aryl hydrocarbon receptor that differentially affect cytochrome P450 1A1 activity[J]. Cancer Research, 1998, 58(13): 2754-2760. |
| [28] |
CIOLINO H P, YEH G C. The flavonoidgalangin is an inhibitor of CYP1A1 activity and an agonist/antagonist of the aryl hydrocarbon receptor[J]. British Journal of Cancer, 1999, 79(9/10): 1340-1346. |
 2023, Vol. 42
2023, Vol. 42