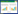文章信息
- 李胜, 李超, 丁辉, 宋新波
- LI Sheng, LI Chao, DING Hui, SONG Xinbo
- 经典名方开心散不同粉碎方式下成分含量差异研究
- Study on difference of component content of classic formula Kaixin Powder under different crushing methods
- 天津中医药大学学报, 2023, 42(5): 618-623
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(5): 618-623
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.05.12
-
文章历史
收稿日期: 2023-06-13
2. 省部共建组分中药国家重点实验室, 天津 301617;
3. 现代中药海河实验室, 天津 301617
2. Medicine State Key Laboratory of Provincial and Ministerial Co-construction of Component Traditional Chinese Medicine, Tianjin 301617, China;
3. Haihe Laboratory of Modern Chinese Medicine, Tianjin 301617, China
经典名方开心散(KXS)最初记载于唐代孙思邈所著的《备急千金药方·卷十四》,由远志、人参、茯苓、石菖蒲4味药物组成。经文献考证4味药物的比例为远志∶人参∶茯苓∶石菖蒲=1∶1∶2∶1[1]。其中远志安神益智,交通心肾,祛痰消肿;人参补气固脱,生津养血,宁心益智;茯苓利水渗湿,健脾宁心;石菖蒲开窍豁痰,醒神益智,化湿开胃[2]。各味药物活性物质之间相互协同,配伍主治好忘。临床常被用来治疗阿尔茨海默病[3-4]、血管性痴呆[5]、认知障碍[6]等以记忆功能障碍为主要表现的疾病,同时对抑郁[7-8]、失眠[9]、疲劳[10]、糖脂代谢紊乱[11]等疾病亦有积极的治疗效果。
散剂作为中药常用剂型之一,是指将药物粉碎后混匀成粉末状,具有制备简单、起效迅速、服用方便、有效成分利于溶出、药材利用度高、节约药物资源等优势,在历代方剂中使用频率颇高,历史悠久[12-13]。《中华人民共和国药典》2015年版记载的粉碎方法有“用时捣碎”“用时打碎”“切碎”“碾碎”“砸碎”“打成碎块”“研粉”“研末”“挫成粉末”“水飞”等方法[14]。目前,KXS的相关研究主要集中于化学成分[15-16]、药理机制[17-18]及体内代谢[19]方面,而关于KXS制备工艺方面的研究相对较少,其粉碎方式的研究未见文献报道。因此,本研究以KXS为研究对象,以传统捣碎、传统碾碎、现代机器粉碎对药材进行处理,采用高效液相-二极管阵列检测器(HPLC-PDA)法检测非挥发性成分,顶空固相微萃取-气质联用(HS-SPME-GC/MS)法检测挥发性成分,旨在探究不同粉碎方式对KXS成分含量的影响,为KXS药材粉碎工艺提供参考依据。
1 仪器与试药 1.1 仪器手持式红外测温仪,苏州特安斯电子有限公司;DLS粒径测定仪,美国布鲁克海文仪器公司;LC高效液相色谱仪,SHIMADZU日本岛津公司;HyPURITY C18色谱柱(250 mm×4.6 mm),塞默飞世尔科技有限公司;7890B-7000D三重四极杆气质联用仪,美国Agilent公司;手动固相微萃进样器,德国Gerstel公司;HP-5MS毛细管柱(30 m×0.25 mm×0.25 μm),美国Agilent公司;SPME萃取纤维(100 μm PDMS,85 μm Polyacrylate,65 μm PDMS/DVB,50/30 μm DVB/CRA/PDMS),美国Supelco公司;AL204型电子天平,梅特勒-托利多仪器(上海)有限公司;KQ2200DB型数控超声波清洗器,昆山超声仪器有限公司;CascadaTM超纯水机,美国PALL公司;中药捣药罐(纯铜),中药碾药槽(纯铜),天津市宏兴铸造厂;中草药粉碎机,天津市泰斯特仪器有限公司。
1.2 试药对照品远志酮Ⅲ(批号111850-201705,纯度≥96.5%)、3,6’-二芥子酰基蔗糖(批号111848-201604,纯度≥96.7%)、人参皂苷Re(批号110754-202028,纯度≥98%)均购于中国食品药品检定研究院,人参皂苷Rg1(批号22427-39-0,纯度≥98%)、人参皂苷Rb1(批号41753-43-9,纯度≥98%)均购于上海源叶生物科技有限公司;甲醇、乙腈均为色谱纯,购于美国Fisher公司;磷酸为分析纯,购于天津市风船化学试剂科技有限公司;水为超纯水;混合正构烷烃对照品(C8-C20)购于美国Sigma-Aldrich公司。
远志(批号190601)、人参(批号190704)、茯苓(批号190609)及石菖蒲(批号047-2017122902)均由天津中一制药有限公司提供,经天津中医药大学张丽娟教授鉴定,远志为远志科植物远志Polygala tenuifolia Willd.的干燥根,人参为五加科植物人参Panax ginseng C.A.Mey.的干燥根和根茎,茯苓为多孔菌科真菌茯苓Poria cocos(Schw.)Wolf的干燥菌核,石菖蒲为天南星科植物石菖蒲Acorus tatarinowii Schott的干燥根茎。
2 方法与结果 2.1 KXS散剂的制备按比例称取各单味药,混合,以不同粉碎方式(传统捣碎、传统碾碎、现代机器粉碎)处理,将细粉过6号筛,直至95%质量以上的药材均已过筛,即得KXS散剂,每种粉碎方法制备3份。
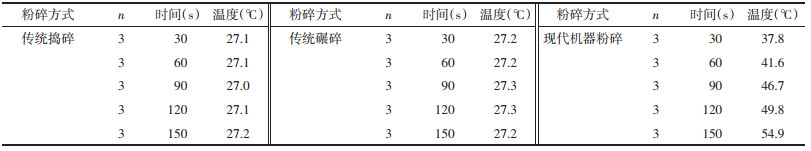
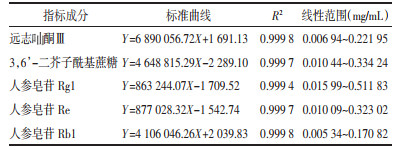
2.2 KXS粉碎过程中温度变化及成品粒径考察 2.2.1 温度测定粉碎前记录各单味药材的初始温度,粉碎过程中30 s进行1次测温(共测5次),结果见表 1及表 2。
精密称取3种粉碎方式制得的KXS 0.01 g,置于10 mL容量瓶中,加少量纯水摇匀,再加纯水定容至刻度线,超声混合30 min,拿出冷却至室温,粒径仪测定粒径,结果见表 3。
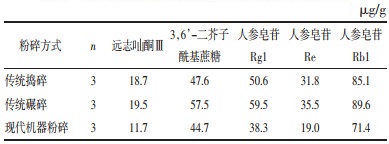
分别精密称取远志酮Ⅲ、3,6’-二芥子酰基蔗糖、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1对照品适量,置于5 mL容量瓶中,加入75%甲醇溶解定容至刻度线,配制成质量浓度分别为0.222 0、0.334 2、0.511 8、0.323 0、0.170 8 mg/mL的标准品母液。测定前用75%甲醇稀释0、2、4、8、16、32倍,得到系列质量浓度的标准品溶液。
2.3.2 供试品溶液的制备精密称取KXS 2.0 g,置于10 mL容量瓶中,加适量75%甲醇,超声45 min,冷却15 min,再次超声45 min,冷却至室温,加75%甲醇定容至刻度,抽滤,取滤液,用0.22 μm微孔滤膜过滤,即得。
2.3.3 色谱条件色谱柱:HyPURITY C18色谱柱(250 mm×4.6 mm);柱温:30 ℃;流动相:0.05%磷酸水溶液-乙腈,梯度洗脱:0~25 min,19%~21%乙腈;25~35 min,21%~21%乙腈;35~40 min,21%~32%乙腈;40~55 min,32%~40%乙腈;55~60 min,40%~95%乙腈;60~65 min,95%~95%乙腈;65~75 min,95%~19%乙腈;流速1 mL/min;进样体积50 μL;检测波长203 nm。混合对照品溶液、供试品溶液色谱图见图 1。
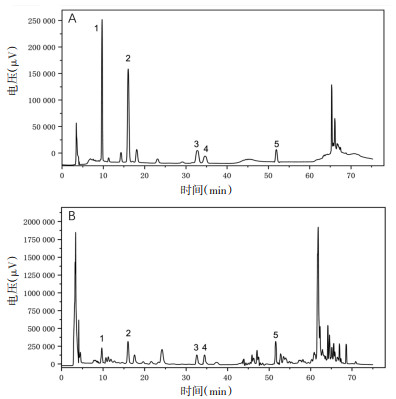
|
| 注:A.混合对照品;B.KXS样品;1.远志酮Ⅲ;2. 3,6’-二芥子酰基蔗糖;3.人参皂苷Rg1;4.人参皂苷Re;5.人参皂苷Rb1。 图 1 混合对照品和KXS样品液相色谱图 |
精密量取系列质量浓度的标准品溶液,75%甲醇配制成6个不同浓度的混标溶液,按照“2.3.3”项中的色谱条件进样,以峰面积为纵坐标,浓度为横坐标,计算回归方程及相关系数,结果见表 4,表明其线性关系良好。
精密量取“2.3.1”项中5种标准品溶液各1 mL,置于5 mL容量瓶中,加75%甲醇定容至刻度线,按照“2.3.3”项中的色谱条件连续进样6次,记录峰面积,计算远志酮Ⅲ、3,6’-二芥子酰基蔗糖、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1峰面的RSD值,结果分别为1.24%、1.48%、1.06%、1.11%、1.35%,RSD值均小于3.0%,表明仪器精密度良好。
2.4.3 重复性考察取“2.1”项中制备的KXS,按“2.3.2”项中的方法制备供试品溶液,按“2.3.3”项中的色谱条件进样,记录各组指标成分的峰面积,计算RSD值,该条件下各指标成分的峰面积RSD值分别为2.64%、0.54%、2.49%、2.78%、1.47%,RSD值均小于3.0%,表明该方法重复性良好。
2.4.4 稳定性考察取“2.1”项中制备的KXS,按“2.3.2”项中的方法制备供试品溶液,按“2.3.3”项中的色谱条件进样,分别在0、2、4、8、12、24 h分别进样1次,记录各组指标成分的峰面积,计算RSD值。远志酮Ⅲ、3,6’-二芥子酰基蔗糖、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1的峰面积RSD值分别为1.14%、0.52%、1.47%、1.49%、1.46%,RSD值均小于3.0%,表明该供试品溶液在24 h内稳定。
2.4.5 加样回收率考察精密称取已知指标成分含量的KXS 2.0 g,分别加入约与样品等量的各对照品,按“2.3.2”项中的方法制备供试品溶液,按“2.3.3”项中的色谱条件进样。计算远志酮Ⅲ、3,6’-二芥子酰基蔗糖、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1的平均加样回收率并计算RSD值,平均加样回收率分别为96.56%、97.88%、99.32%、98.37%、99.20%,RSD值分别为0.77%、0.83%、1.62%、1.37%、0.96%。
2.4.6 不同粉碎方式对KXS非挥发性成分的影响精密称取传统捣碎、传统碾碎、现代机器粉碎条件下制备的KXS样品每份2.0 g,按“2.3.2”项中的方法制备供试品溶液,每种粉碎方法制备3份供试品,按“2.3.3”项中的色谱条件进样检测,记录峰面积,代入标准曲线方程,计算出各指标成分的含量,结果见表 5。
结果显示,传统捣碎及碾碎制得的KXS中各指标成分含量均高于由现代机器粉碎制得的KXS,而捣碎与碾碎相比,由碾碎制备的KXS中各指标成分含量较高。
2.5 HS-SPME/GC-MS法测定不同粉碎方式下挥发性成分含量 2.5.1 顶空固相微萃取条件分别称取“2.1”项中的KXS粉末各0.1 g于20 mL的顶空瓶中,迅速压紧瓶盖,备用。
2.5.2 色谱质谱条件色谱柱:Agilent HP-5MS毛细管柱(30 m×0.25 mm×0.25 μm);进样口温度:250 ℃;载气为氦气(>99.999%);载气流速:1 mL/min;分流比为2∶1;程序升温条件:以初温45 ℃保持2 min,以12 ℃/min的速率升至117 ℃,以1 ℃/min的速率升至138 ℃,再以4 ℃/min的速率升至142 ℃,保持0.5 min,最后以20 ℃/min的速率升至230 ℃,保持3 min。孵化温度为55 ℃,孵化时间为55 min,吸附时间为40 min,解吸时间为300 s;质谱检测器离子源为EI离子源,电离电压为70 eV,离子源温度为230 ℃,四极杆温度为150 ℃,质量扫描范围为30~500 amu,全扫描模式采集,质谱标准库为NIST17。
2.5.3 不同粉碎方式对KXS挥发性成分的影响KXS总离子图如图 2所示,根据匹配度、保留指数及参考文献对各色谱峰进行定性分析,采用峰面积归一法确定各成分的相对百分含量[20],结果见开放科学(资源服务)标识码(OSID)。从不同粉碎方式处理的KXS中共鉴定出56种共有化合物,分别占总挥发性成分的93.19%(捣碎)、94.16%(碾碎)、94.04%(现代机器粉碎),可将其分为8类化合物,包括醚类、萜类、醇/酸/醛类、酯/酮类、碳氢化合物。其中醚类占比最高,达80.38%,种类有7种;萜类种类最多,有36种,占比为12%;醇/酸/醛类6种、酯/酮类4种、碳氢化合物3种,分别占比为0.99%、0.24%、0.19%。
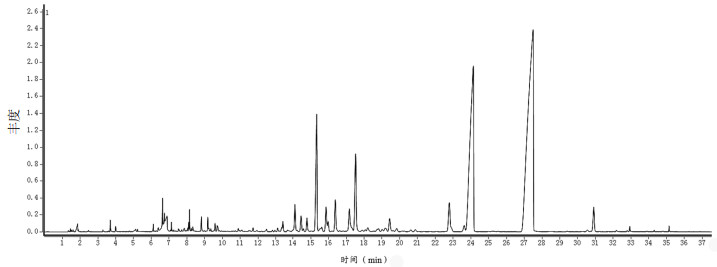
|
| 图 2 KXS 挥发性成分的总离子流图 |
选取8种相对百分含量较高的化合物进行分析,结果显示,(+)-长叶环烯、β-石竹烯、β-细辛醚在传统捣碎条件下占比最大,分别为1.09%、1.15%、43.98%。其中(+)-长叶环烯、β-石竹烯在传统捣碎、碾碎条件下占比差异不大,在现代机器粉碎条件下占比最小,分别为0.93%、1.02%。β-细辛醚在传统碾碎、现代机器粉碎条件下占比差异不大,在传统碾碎条件下占比最小,为43.22%;白菖烯、异丁香酚甲醚、γ-细辛醚在碾碎条件下占比最大,分别为1.45%、4.84%、24.32%。其中白菖烯在传统捣碎、碾碎条件下占比差异不大,在现代机器粉碎条件下占比最小,为1.27%。异丁香酚甲醚、γ-细辛醚在传统碾碎、现代机器粉碎条件下占比差异不大,在传统捣碎条件下占比最小,分别为4.21%、23.62%;甲基丁香酚和α-细辛醚在现代机器粉碎条件下占比最大,分别为6.58%、1.40%。甲基丁香酚在传统碾碎、现代机器粉碎条件下占比差异不大,在传统捣碎条件下占比最小,为5.54%。α-细辛醚在传统捣碎、碾碎条件下占比差异不大,在传统碾碎条件下占比最小,为1.16%。
3 讨论粉碎方式作为中药材前处理的一种,对其药效的影响不容忽视,在粉碎过程中温度与粉末粒径可能对KXS的成分含量有所影响,因此本实验对这两个因素进行了考察。结果表明,虽然散剂粉末均通过6号筛,但由于机器粉碎在粉碎过程中混合更加均匀,粉碎力度更大,同时由于机器刀头剧烈摩擦,因此粒径较其他两种粉碎方式要小且在粉碎过程中升温非常明显,温度最高达55 ℃,传统碾碎比传统捣碎制得的散剂粒径更小,在温度方面差异不大且各批次间基本没有差异。
对于5种非挥发性成分,现代机器粉碎制得的KXS均低于其他两种制法,推测由于高温使各种物质之间发生了相互作用,导致其部分成分发生了变化,且粉碎过程中的剧烈搅拌更加加剧了这种情况。而传统捣碎、碾碎均为人工操作,在粉碎过程中温度相差不大,但碾碎制得的KXS成分含量略高于捣碎,推测是由于碾碎更加能够将各单味药物混合均匀,也更加能够将其充分粉碎,所得粉末粒径更小所造成;HS-SPME/GC-MS法鉴定出的56种共有成分均占总挥发性成分的90%以上,其中由传统碾碎制备的KXS挥发性成分占比最高,为94.16%。除3种细辛醚外,(+)-长叶环烯、β-石竹烯、白菖烯、异丁香酚甲醚、甲基丁香酚的占比也高于其他成分,推测在KXS发挥药效时起到潜在作用。此8种成分中,有6种在由传统捣碎、碾碎制得KXS中的相对百分含量较高,虽然某些成分在传统捣碎、现代机器粉碎制得的KXS中占比较高,但均与传统碾碎相差不大。因此,综合两种检测KXS成分含量的方法,在其前处理过程中,以传统碾碎制备KXS能够较大程度保留其成分。对于本方,从目前的结果来看不同的粉碎方式已对其成分含量产生了一定影响,此种差异是否会在药效方面产生影响,还有待进一步研究证实。
| [1] |
张林, 曾凤. 《千金要方》开心散剂量的文献考证[J]. 北京中医药大学学报, 2020, 43(8): 641-644. ZHANG L, ZENG F. Textual research on the dosage of Kai-xin San in Qianjin Yaofang[J]. Journal of Beijing University of Traditional Chinese Medicine, 2020, 43(8): 641-644. DOI:10.3969/j.issn.1006-2157.2020.08.005 |
| [2] |
国家药典委员会. 中华人民共和国药典: 2015年版[M]. 北京: 中国医药科技出版社, 2015. National Pharmacopoeia Commission. People's republic of China(PRC) pharmacopoeia: 2015 edition[M]. Beijing: China Medical Science and Technology Press, 2015. |
| [3] |
王彬斌, 冯晓晓, 恩特扎尔·别尔克, 等. 开心散对APP/PS1小鼠神经炎症和Aβ沉积的作用研究[J]. 中草药, 2021, 52(24): 7511-7519. WANG B B, FENG X X, ENTZAL B, et al. Pharmacological effects of Kaixin San on neuroinflammation and Aβ deposition in APP/PS1 mice[J]. Chinese Traditional and Herbal Drugs, 2021, 52(24): 7511-7519. DOI:10.7501/j.issn.0253-2670.2021.24.013 |
| [4] |
FU H, XU Z, ZHANG X L, et al. Kaixinsan, a well-known Chinese herbal prescription, for Alzheimer's disease and depression: a preclinical systematic review[J]. Frontiers in Neuroscience, 2020, 13(11): 1421. |
| [5] |
王瑾, 周小江, 胡园, 等. 开心散药效物质基础和药理作用机制的研究进展[J]. 中草药, 2020, 51(18): 4780-4788. WANG J, ZHOU X J, HU Y, et al. Research progress on pharmacodynamic material basis and pharmacological action mechanism of Kaixin San[J]. Chinese Traditional and Herbal Drugs, 2020, 51(18): 4780-4788. |
| [6] |
XU Y M, WANG X C, XU T T, et al. Kaixin San ameliorates scopolamine-induced cognitive dysfunction[J]. Neural Regeneration Research, 2019, 14(5): 794-804. DOI:10.4103/1673-5374.249227 |
| [7] |
肖望重, 胡青, 唐林, 等. 开心散对抑郁模型大鼠海马CX3CL1-CX3CR1信号轴的影响[J]. 中医药导报, 2021, 27(9): 15-19. XIAO W Z, HU Q, TANG L, et al. The effect of Kaixin San on the signal axis of hippocampus CX3CL1-CX3CR1 in depression model rats[J]. Guiding Journal of Traditional Chinese Medicine and Pharmacy, 2021, 27(9): 15-19. |
| [8] |
ZHOU X J, WANG J, LU Y P, et al. Anti-depressive effects of Kaixin San on lipid metabolism in depressed patients and CUMS rats using metabolomic analysis[J]. Journal of Ethnopharmacology, 2020, 252(12): 112-125. |
| [9] |
HUANG X L, JIANG H J, PEI J, et al. Study on the potential mechanism, therapeutic drugs and prescriptions of insomnia based on bioinformatics and molecular docking[J]. Computers in Biology and Medicine, 2022, 149(3): 106-120. |
| [10] |
LUO C H, XU X R, WEI X C, et al. Natural medicines for the treatment of fatigue: bioactive components, pharmacology, and mechanisms[J]. Pharmacological Research, 2019, 148(7): 104-109. |
| [11] |
王登, 周珺, 张锦, 等. 开心散和当归芍药散对高脂饲料喂养的慢性应激大鼠糖脂代谢的影响及HPA轴相关机制[J]. 中药材, 2015, 38(9): 1919-1924. WANG D, ZHOU J, ZHANG J, et al. Effects and HPA axis related mechanism of Kaixin San and Danggui Shaoyao San on glucose and lipid metabolism in chronic stress rats with high-fat diet[J]. Journal of Chinese Medicinal Materials, 2015, 38(9): 1919-1924. |
| [12] |
焦其树, 郝丽霞, 吴治丽, 等. 经典名方中煮散和散剂粒度探讨[J]. 中国实验方剂学杂志, 2021, 27(1): 1-6. JIAO Q S, HAO L X, WU Z L, et al. Discussion on particle size of powders and decocted powders in famous classical formulas[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2021, 27(1): 1-6. |
| [13] |
项丽玲, 苗明三. 中药散剂的现代研究及思考[J]. 时珍国医国药, 2019, 30(11): 2720-2723. XIANG L L, MIAO M S. Modern Research and consideration on traditional Chinese medicine powder[J]. Lishizhen Medicine and Materia Medica Research, 2019, 30(11): 2720-2723. |
| [14] |
税丕先, 朱烨, 牛曼思, 等. 有关粉碎中药问题的再商榷[J]. 时珍国医国药, 2017, 28(10): 2489-2490. SHUI P X, ZHU Y, NIU M S, et al. Re-discussion on the problem of pulverizing traditional Chinese medicine[J]. Lishizhen Medicine and Materia Medica Research, 2017, 28(10): 2489-2490. |
| [15] |
LYU C X, HE B S, SUI Z Y, et al. Identification and determination of the major constituents in Kaixin-San by UPLC-Q/TOF MS and UFLC-MS/MS method[J]. Journal of Mass Spectrometry, 2016, 51(7): 479-490. |
| [16] |
YIN J X, LIN R M, WU M F, et al. Strategy for the multi-component characterization and quality evaluation of volatile organic components in Kaixin San by correlating the analysis by headspace gas chromatography/ion mobility spectrometry and headspace gas chromatography/mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 2021, 35(21): e9174. |
| [17] |
孙永康, 孙田烨, 李明远, 等. 开心散现代药理作用及作用机制研究[J]. 中国中医基础医学杂志, 2021, 27(4): 650-654. SUN Y K, SUN T Y, LI M Y, et al. Study on modern pharmacological action and mechanism of Kaixin San[J]. Journal of Basic Chinese Medicine, 2021, 27(4): 650-654. |
| [18] |
王海霞, 姜宁, 吕静薇, 等. 开心散抗抑郁、改善学习记忆作用及机制研究进展[J]. 中草药, 2020, 51(14): 3802-3813. WANG H X, JIANG N, LYU J W, et al. Review of anti-depression and improving learning and memory activities of Kaixin Powder and their mechanisms[J]. Chinese Traditional and Herbal Drugs, 2020, 51(14): 3802-3813. |
| [19] |
ZHANG X W, LI Q, LYU C X, et al. Characterization of multiple constituents in Kaixin San prescription and rat plasma after oral administration by liquid chromatography with quadrupole time-of-flight tandem mass spectrometry[J]. Journal of Separation Science, 2015, 38(12): 2068-2075. |
| [20] |
田宇, 江汉美, 邸江雪, 等. HS-SPME-GC-MS联用分析丁香、肉桂及其药对挥发性成分变化[J]. 中国医院药学杂志, 2021, 41(9): 912-916. TIAN Y, JIANG H M, DI J X, et al. HS-SPME-GC-MS combining for analyzing the changes in volatile components of cloves, cinnamon and their drug pairs[J]. Chinese Journal of Hospital Pharmacy, 2021, 41(9): 912-916. |
 2023, Vol. 42
2023, Vol. 42