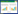文章信息
- 魏淑婕, 张蒙蒙, 贾晓华, 欧阳慧子, 李天祥, 何俊
- WEI Shujie, ZHANG Mengmeng, JIA Xiaohua, OUYANG Huizi, LI Tianxiang, HE Jun
- 不同产地半夏指纹图谱的建立及化学模式识别研究
- Establishment of Pinellia ternata fingerprints from different origins and research on chemical pattern recognition
- 天津中医药大学学报, 2023, 42(5): 624-629
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(5): 624-629
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.05.13
-
文章历史
收稿日期: 2023-05-15
2. 天津中医药大学第一附属医院, 天津 300381
2. First Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300381, China
半夏来源于天南星科多年生草本植物半夏Pinelliaternata (Thunb.)Breit.的干燥块茎,辛、温,有毒,归脾、胃、肺经[1],具有燥湿化痰、降逆止呕、消痞散结等功效[2]。半夏作为中药材始见于《五十二病方》,后在《伤寒杂病论》中被广泛使用。目前,因其具有抗肿瘤、降低血脂及抗新型冠状病毒感染等药理作用而备受关注,成为临床常用药材之一[3-4]。随着市场需求量不断增加,而半夏野生资源匮乏,存在市场缺口,人工栽培成为其替代途径,但人工栽培过程中存在栽培技术滞后、品种选育研究薄弱等问题[5],导致市售半夏质量参差不齐、来源复杂,给临床用药带来诸多不便。如何利用现代分析方法控制半夏质量,是半夏药材研究进展中亟待解决的问题。
中药所含化学成分多样复杂,单一或几个成分不能全面反映药材质量[6],指纹图谱能够在整体层面表征药材化学成分,是一种综合、可量化的鉴别与评价手段[7-9]。化学模式识别技术可对中药指纹图谱信息进行深度挖掘,反映中药的内在成分差异,对其质量控制具有重要意义[10-12]。因此,本研究采用超高效液相色谱(UPLC)法建立半夏药材指纹图谱,并运用SPSS和SIMCA软件进行化学模式识别分析,以期为半夏质量研究提供参考。
1 材料 1.1 仪器Agilent 1290 UPLC色谱仪(美国Agilent公司);Milli-Q IQ 7005超纯水制备仪(Millipore公司);5424 R型高速控温离心机(德国Eppendorf公司);AS 60/220. R2型十万分之一天平(波兰Radwag公司);G3KT18273型旋涡混合器(赛默飞世尔科技公司)。
1.2 试药对照品:胞苷(批号:DST190314-087)、次黄嘌呤(批号:DST190407-087)、尿苷(批号:DST190108-024)、肌苷(批号:DST180521-028)、鸟苷(批号:DST190311-045)、腺苷(批号:2-ALI-112-1)均购自成都曼斯特生物科技有限公司;磷酸(色谱级)购自美国ROE公司;乙腈(色谱级)购自美国Fisher公司;超纯水由Milli-Q超纯水制备仪制备。
1.3 药材半夏药材采自不同产区,样品去除泥沙与杂质,干燥,粉碎备用。具体样品信息见表 1,经天津中医药大学李天祥教授鉴定为天南星科植物半夏Pinelliaternata (Thunb.)Breit.的干燥块茎。
色谱柱:ACQUITY UPLC HSS T3柱(2.1 mm×100 mm,1.8 μm);流动相:A相0.1%磷酸水,B相乙腈;梯度洗脱,洗脱梯度为:0~5 min,1%~5%B;5~9 min,5%~14%B;9~10 min,14%~20%B;10~14 min,20%~45%B;流速:0.2 mL/min;进样体积:10 μL;柱温:32 ℃;检测波长:260 nm。
2.2 对照品溶液的制备精密称取胞苷、次黄嘌呤、尿苷、肌苷、鸟苷、腺苷对照品各5.0 mg,加水溶解,配制成1 mg/mL的对照品溶液,置于4 ℃冰箱储存备用。
2.3 供试品溶液的制备精密称取半夏粉末(过4号筛)1.0 g置于10 mL锥形瓶中,加水溶解定容至刻度线处,超声(功率250 W,频率50 kHz)提取30 min后取出,放至室温再次称取质量,补足失去的质量,用0.22 μm滤膜过滤取续滤液,即得供试品溶液。
2.4 方法学考察 2.4.1 精密度实验取半夏样品(S9)粉末,精密称定1.0 g,按照“2.3”项下的制备方法制备供试品溶液,在“2.1”项的色谱条件下连续进样6次,计算得到各共有峰保留时间RSD均小于0.1%,峰面积RSD小于1.7%,表明仪器精密度良好。
2.4.2 重复性实验取半夏样品(S9)粉末,精密称定1.0 g,按照“2.3”项下的制备方法,平行制备6份供试品溶液,在“2.1”项的色谱条件下进样,计算得到各共有峰保留时间RSD小于1.5%,峰面积RSD小于5.9%,表明该方法重复性良好。
2.4.3 稳定性实验取半夏样品(S9)粉末,精密称定1.0 g,按照“2.3”项下的制备方法制备供试品溶液,并在“2.1”项的色谱条件下分别于0、2、6、8、12、24 h进样分析,计算得到各共有峰保留时间RSD小于0.6%,峰面积RSD小于6.6%,表明样品在24 h内稳定性良好。
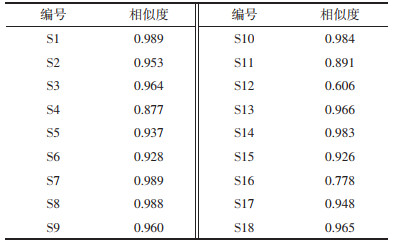
2.5 指纹图谱的建立分别称定18批半夏样品各1.0 g,按照“2.3”项下的制备方法制备供试品溶液,并在“2.1”项的色谱条件下进样分析,得到UPLC指纹图谱。将色谱图数据导入“中药色谱指纹图谱相似度评价系统(2012.130723版本)”,生成18批供试品色谱图,其中共标定15个共有峰,通过对照品比对指认出6个色谱峰,分别为胞苷(3号峰)、次黄嘌呤(4号峰)、尿苷(6号峰)、肌苷(7号峰)、鸟苷(10号峰)、腺苷(12号峰),供试品色谱图及混合对照品图谱见图 1。
|
| 注:A为18批半夏药材指纹图谱;B为混合对照品图谱。 图 1 供试品及混合对照品指纹图谱 |
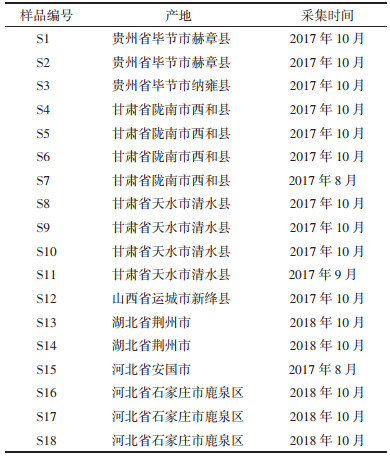
设置S1为参照图谱,采用平均数法,时间窗宽度为0.1,通过多点校正后进行整体相似度评价,相似度评价结果见表 2。16批不同产地半夏药材相似度均大于0.877,其余2批样品指纹图谱与对照图谱相比相似度较低,其中S12(山西省运城市新绛县)相似度为0.606,S16(河北省石家庄市鹿泉区)相似度为0.778。结果表明,大部分产地半夏样品指纹图谱的一致性较高,只有2批样品差异较大。
以18批不同产地半夏药材的15个共有峰面积为原始数据,经标准化处理后,导入SPSS 23.0软件,进行聚类分析。以平方欧式距离为测度,采用组间连接法,结果见图 2。当类间距离为10时,18批样品被分为两组,其中S1~S11、S13~S15、S18聚为一类,S12、S16聚为一类。

|
| 图 2 18批半夏样品的聚类分析树状图 |
将18批半夏药材的UPLC指纹图谱在260 nm波长下的15个共有峰峰面积进行标准化处理后,导入SIMCA 14.1软件,构建18×15的原始数据矩阵,Par作为标度化方式,进行主成分分析。从15个变量中提取出3个变量,累计方差贡献率为82.57%,表明该模型的预测能力良好[13],提取前3个主成分绘制PCA得分图,结果见图 3。由图 3可知,S1~S11、S13~S15、S18聚为一类,S12、S16聚为一类,与聚类分析结果一致。
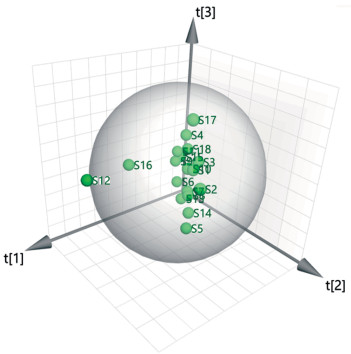
|
| 图 3 18批半夏样品主成分分析得分图 |
主成分分析载荷图中的点代表各共有峰,距离原点(0,0)越远,表明其权重越大,对样品质量差异影响越大[14],见图 4。由图 4可知,3号峰(胞苷)、4号峰(次黄嘌呤)、5号峰、8号峰、10号峰(鸟苷)、12号峰(腺苷)、13号峰和15号峰是不同批次产生差异的主要原因,表明造成S12、S16与其他批次产生差异是上述多种成分协同作用的结果。
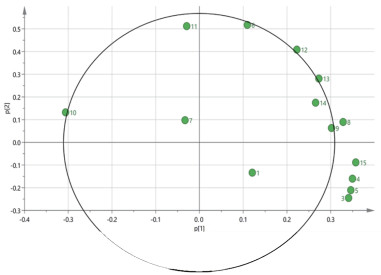
|
| 图 4 18批半夏样品主成分分析载荷图 |
为了进一步分析不同批次半夏样品的批间差异性,采用SIMCA 14.1软件在聚类分析和主成分分析的基础上对数据进行正交偏最小二乘-判别分析。正交偏最小二乘-判别分析得分见图 5,结果可见18批样品被较好地分为两类。在建立的分析模型中,结实率参数R2X为0.691,区分参数R2Y为0.927,预测参数Q2为0.789,均大于0.5,说明模型稳定性和预测准确性良好[15]。
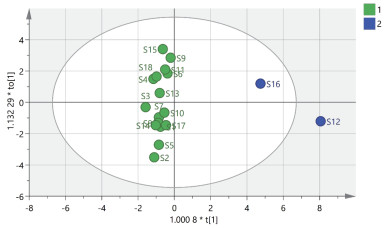
|
| 图 5 18批半夏样品正交偏最小二乘-判别分析得分图 |
随机改变分布变量Y的排列顺序200次进行置换检验,得到置换检验图 6,R2回归线在Y轴截距为0.217,Q2回归线在Y轴截距为-0.553,说明所建立的模型不存在过拟合现象,可用于判别分析18批样品的批间差异[16]。
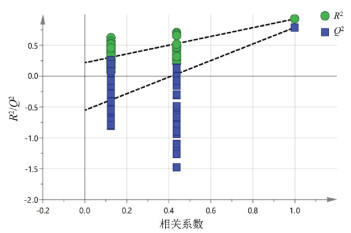
|
| 图 6 正交偏最小二乘-判别分析模型的置换检验结果(n=200) |
正交偏最小二乘-判别分析模型中变量重要性投影值(VIP值)可直观反映出各变量对样品分类的贡献值,筛选VIP值>1.0的变量为差异性标志成分[17],结果见图 7。通过对照品指认,具有统计学意义的6个差异性标志成分的贡献程度依次为3号峰(胞苷)>5号峰>4号峰(次黄嘌呤)>15号峰>10号峰(鸟苷)>8号峰,上述成分是S12、S16样品与其他批次样品之间产生差异的主要原因。在S12、S16样品中,3号峰、4号峰、5号峰和15号峰的峰面积均大于其他批次样品,而10号峰的峰面积均小于其他批次样品。该结果与主成分分析中载荷图的分析结果基本一致。
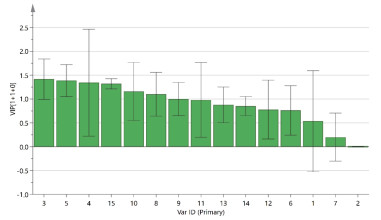
|
| 图 7 18批半夏样品正交偏最小二乘-判别分析各成分VIP图(x±s) |
本研究考察了不同提取溶剂(水、70%甲醇、30%甲醇)、色谱柱类型(CORTECS C18柱、ACQUITY UPLC HSS T3柱)、流动相种类(乙腈-0.1%磷酸水、甲醇-水、乙腈-水)及不同检测波长(210、254、260 nm)条件下样品分析时间、色谱峰峰形、峰数及峰响应的情况,确定采用ACQUITY UPLC HSS T3柱(2.1 mm×100 mm,1.8 μm),以乙腈-0.1%磷酸水为流动相,在260 nm检测波长下进行分析,所得色谱峰峰形良好,分析时间短。构建了半夏药材UPLC指纹图谱,并对18批不同产地样品进行分析。共标定15个共有峰,其中指认6个色谱峰,分别为胞苷、次黄嘌呤、尿苷、肌苷、鸟苷及腺苷。相似度结果显示16批样品相似度均大于0.877,其余2批分别为0.606、0.778。
聚类分析和主成分分析结果一致,大部分批次的样品具有较高一致性,只有2批样品与其他样品的差异较大。通过正交偏最小二乘-判别分析模型中的VIP值共筛选出6个差异性标志成分(经对照品比对指认出其中3种成分为胞苷、次黄嘌呤、鸟苷),是造成S12(山西省运城市新绛县)、S16(河北省石家庄市鹿泉区)与其他批次产生差异的主要原因。胞苷、次黄嘌呤、鸟苷所属的核苷类成分作为半夏中主要的一类成分,已被证实是半夏“降逆止呕”的主要物质基础[18]。现代研究表明核苷类成分参与DNA代谢过程,具有抗病毒、抗肿瘤等多种生物活性[19]。陈卫等[20]在不同炮制方法对半夏的差异性影响研究中发现,胸苷、次黄嘌呤和尿嘧啶的含量差异较为显著,可作为半夏不同炮制品有效区分的特征成分。王翠翠等[18]在对半夏及其混伪品的研究中发现,依据尿苷、腺嘌呤、鸟苷和腺苷4种核苷的含量可以很好地区分半夏、水半夏和虎掌南星。此外,徐文英[19]对比了不同品种半夏中鸟苷和腺苷的含量,发现在不同品种半夏样品中两种成分的含量存在明显差异,认为核苷类成分对于评价半夏质量具有重要意义。本研究结果与上述研究结果较为一致,胞苷、次黄嘌呤、鸟苷的含量可以反映出不同产地半夏样品的差异性,且其所属的核苷类成分为半夏的主要药效物质,因此在对半夏的质量研究中应重点关注胞苷、次黄嘌呤、鸟苷等成分的含量变化。
本研究建立了半夏药材的UPLC指纹图谱,结合聚类分析、主成分分析等化学模式识别方法进行综合分析,并采用正交偏最小二乘-判别分析筛选出不同产地半夏的差异性标志成分,可为半夏质量评价研究和资源开发利用提供参考。
| [1] |
国家药典委员会. 中华人民共和国药典: 2020年版[M]. 北京: 中国医药科技出版社, 2020: 123-124. The National Pharmacopoeia Commission. People's republic of China(PRC) pharmacopoeia: 2020 edition[M]. Beijing: China Medical Science and Technology Press, 2020: 123-124. |
| [2] |
黄凤英, 高健美, 龚其海. 半夏药理作用及其毒性研究进展[J]. 天然产物研究与开发, 2020, 32(10): 1773-1781. HUANG F Y, GAO J M, GONG Q H. Research progress on pharmacological effects and toxicity of Pinellia ternata[J]. Natural Product Research and Development, 2020, 32(10): 1773-1781. |
| [3] |
寸竹, 董益, 张广辉, 等. 云南省野生半夏资源调查及种质评价[J]. 南方农业学报, 2021, 52(8): 2069-2077. CUN Z, DONG Y, ZHANG G H, et al. Investigation and germplasm evaluation on wild Pinellia ternata(Thunb.) Berit. resources in Yunnan[J]. Journal of Southern Agriculture, 2021, 52(8): 2069-2077. DOI:10.3969/j.issn.2095-1191.2021.08.004 |
| [4] |
寇本沧. 经方中半夏的应用规律研究[D]. 济南: 山东中医药大学, 2020. KOU B C. Study on the application law of Pinellia ternata in classical prescription[D]. Jinan: Shandong University of Traditional Chinese Medicine, 2020. |
| [5] |
李婷, 李敏, 贾君君, 等. 全国半夏资源及生产现状调查[J]. 现代中药研究与实践, 2009, 23(2): 11-13. LI T, LI M, JIA J J, et al. Survey of national resources and production status of Pinellia ternata in China[J]. Research and Practice on Chinese Medicines, 2009, 23(2): 11-13. |
| [6] |
倪洋, 朱晶. 中药化学成分研究思路与方法[J]. 黑龙江科技信息, 2011, 15(29): 15. NI Y, ZHU J. Thoughts and methods of research on chemical constituents of traditional Chinese medicine[J]. Heilongjiang Science and Technology Information, 2011, 15(29): 15. |
| [7] |
姚令文, 刘燕, 郑笑为, 等. 指纹图谱、特征图谱技术在中药材和中成药中的应用[J]. 中国新药杂志, 2018, 27(8): 934-939. YAO L W, LIU Y, ZHENG X W, et al. Application of the fingerprint and characteristic fingerprint technology in traditional Chinese medicinal materials and Chinese patent medicine[J]. Chinese Journal of New Drugs, 2018, 27(8): 934-939. |
| [8] |
张宏梅, 崔佰吉. 色谱指纹图谱在中药质量控制中的应用[J]. 中西医结合心血管病电子杂志, 2017, 5(32): 169. ZHANG H M, CUI B J. Application of chromatographic fingerprint in quality control of traditional Chinese medicine[J]. Cardiovascular Disease Journal of Integrated Traditional Chinese and Western Medicine, 2017, 5(32): 169. |
| [9] |
LI G Z, YU F, WANG Y Y, et al. Comparison of the chromatographic fingerprint, multicomponent quantitation and antioxidant activity of Salvia miltiorrhiza Bge. between sweating and nonsweating[J]. Biomedical Chromatography, 2018, 32(6): e4203. |
| [10] |
孙立丽, 王萌, 任晓亮. 化学模式识别方法在中药质量控制研究中的应用进展[J]. 中草药, 2017, 48(20): 4339-4345. SUN L L, WANG M, REN X L. Application progress on chemical pattern recognition in quality control of Chinese materia medica[J]. Chinese Traditional and Herbal Drugs, 2017, 48(20): 4339-4345. |
| [11] |
赵宏苏, 赵茹, 乔金为, 等. 基于指纹图谱结合化学模式识别绿萼梅质量标志物的评价研究[J]. 中草药, 2022, 53(5): 1345-1353. ZHAO H S, ZHAO R, QIAO J W, et al. Evaluation of quality markers of Mume Flos based on fingerprint and chemical pattern recognition[J]. Chinese Traditional and Herbal Drugs, 2022, 53(5): 1345-1353. |
| [12] |
周冰倩, 高喜梅, 杨颖, 等. 不同来源竹茹药材HPLC指纹图谱和化学计量学分析[J]. 中草药, 2022, 53(3): 853-857. ZHOU B Q, GAO X M, YANG Y, et al. Quality analysis of Caulis Bambusae in Taeniam from different origins by HPLC coupled with chemometrics[J]. Chinese Traditional and Herbal Drugs, 2022, 53(3): 853-857. |
| [13] |
李虹, 黄晓欣, 刘勇, 等. 基于电子舌技术的生炒酸枣仁滋味比较[J]. 中国现代中药, 2022, 24(1): 122-127. LI H, HUANG X X, LIU Y, et al. Taste comparison between raw and fried ziziphi spinosae Semen based on electronic tongue technology[J]. Modern Chinese Medicine, 2022, 24(1): 122-127. |
| [14] |
张欣舒, 董金香, 杨净尧, 等. 经典名方保元汤物质基准指纹图谱及多指标量值传递研究[J]. 药物分析杂志, 2021, 41(2): 345-358. ZHANG X S, DONG J X, YANG J Y, et al. HPLC fingerprint of substance benchmarks of classical famous prescriptions Baoyuan Decoction and multi-component value transmitting[J]. Chinese Journal of Pharmaceutical Analysis, 2021, 41(2): 345-358. |
| [15] |
黄宽, 付鹏, 林艾和, 等. 不同产地夏枯草HPLC指纹图谱及化学模式识别研究[J]. 中华中医药学刊, 2021, 39(12): 124-128, 290. HUANG K, FU P, LIN A H, et al. Study on HPLC fingerprint and chemical pattern recognition of xiakucao(Prunella vulgaris) from different producing areas[J]. Chinese Archives of Traditional Chinese Medicine, 2021, 39(12): 124-128, 290. |
| [16] |
曹亚楠, 白雪, 赵钢, 等. UPLC指纹图谱结合化学计量学的多产地藜麦质量控制[J]. 食品科学, 2017, 38(20): 286-291. CAO Y N, BAI X, ZHAO G, et al. Application of UPLC fingerprint coupled with chemometry for quality control of quinoa from different geographical origins[J]. Food Science, 2017, 38(20): 286-291. |
| [17] |
谭小娟, 李世雄, 李璎峪, 等. 白术饮片的指纹图谱形状特征与质量标志物(Q-Marker)研究[J]. 中草药, 2021, 52(16): 4844-4851. TAN X J, LI S X, LI Y Y, et al. Study on fingerprint shape characteristics and quality markers of Atractylodis Macro-cephalae Rhizoma[J]. Chinese Traditional and Herbal Drugs, 2021, 52(16): 4844-4851. |
| [18] |
王翠翠, 毕启瑞, 张建青, 等. 一测多评法定量分析半夏及其混伪品中的4种核苷类成分[J]. 中草药, 2022, 53(19): 6180-6186. WANG C C, BI Q R, ZHANG J Q, et al. Quantitative analysis of four nucleosides in Pinellia Rhizoma and its adulterants by the quantitative analysis of multi-components by a single marker[J]. Chinese Traditional and Herbal Drugs, 2022, 53(19): 6180-6186. |
| [19] |
徐文英. 半夏核苷类成分含量测定及其指纹图谱初探[D]. 北京: 北京中医药大学, 2015. XU W Y. Determination of nucleosides in Pinellia ternata and preliminary study on its fingerprint[D]. Beijing: Beijing University of Chinese Medicine, 2015. |
| [20] |
陈卫, 张超, 孙磊, 等. 基于核苷类成分利用指纹图谱结合化学计量学方法鉴别4种半夏药材炮制品[J]. 药物分析杂志, 2021, 41(5): 919-928. CHEN W, ZHANG C, SUN L, et al. Combination of fingerprint and chemometrics for identification of four processed products of Pinelliae Rhizoma based on nucleosides and nucleobases[J]. Chinese Journal of Pharmaceutical Analysis, 2021, 41(5): 919-928. |
 2023, Vol. 42
2023, Vol. 42