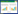文章信息
- 胡远康, 钟雨虹, 刘志东, 祁东利
- HU Yuankang, ZHONG Yuhong, LIU Zhidong, QI Dongli
- 不同促渗剂对芍药苷凝胶体外透皮吸收的影响
- Effect of different penetration enhancers on percutaneous absorption of paeoniflorin in vitro
- 天津中医药大学学报, 2023, 42(5): 630-635
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(5): 630-635
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.05.14
-
文章历史
收稿日期: 2023-06-08
2. 天津中医药大学现代中药发现与制剂技术教育部工程中心, 天津 301617
2. Engineering Research Center of Modern Chinese Medicine Discovery and Preparation Technique, Ministry of Education, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
芍药苷(PF)亦称芍药花素,来源于芍药科植物芍药根,是从中药赤芍、白芍中分离的一种蒎烷单萜苦味苷。在白芍总苷(TGP)中含量最高,约90%[1],为白色吸湿性无定形棕褐色粉末(90%为类白色粉末)。现代药理研究表明,PF具有抗抑郁、抗炎、镇痛、抗肿瘤、保肝、神经保护、免疫调节、防治糖尿病等作用[2-4]。PF常用于抗炎及镇痛,有助于临床治疗类风湿性关节炎[5-7]。
口服给药药动学研究表明,PF在胃肠道中吸收情况不佳,生物利用度低,因此改变PF给药途径对提高药物的体内吸收与增强药物疗效,具有非常重要的意义[8-10]。经皮吸收制剂可以避免肝脏的首过效应,且可以提高患者依从性。但是皮肤作为一道生理屏障,对药物的透过具有阻碍作用,因此,筛选合适的促渗剂显得尤为必要。目前,对PF的研究大多围绕其药理活性开展,而对透皮吸收少有报道[11-13],且将其制为凝胶剂尚无报道,本实验系统研究PF体外经皮渗透特性,意在为PF的制剂设计提供理论依据。
1 仪器、试药与实验动物 1.1 仪器智能磁力加热搅拌器(SCGL-4B,DTG-E1000,巩义市予华仪器有限责任公司);高效液相色谱(HPLC)仪(1260,VWD,DEACX18632,美国安捷伦公司);透皮扩散实验仪(TK-20B型,上海锴凯科技贸易有限公司);台式通用冷冻离心机(Thermo Fisher公司);去离子水机(Mill-Q,美国Millipore公司)。
1.2 试药PF对照品(批号:106H021,北京索莱宝科技有限公司,含量 > 98%);PF原料药(批号:FY00Y0816,南通飞宇生物科技有限公司,含量>98%);卡波姆940(批号:20200614,武汉拉那白医药化工有限公司);药用甘油(批号:K2019079,上海阿拉丁生化科技股份有限公司);羟苯乙酯(艾勒科技);三乙醇胺(批号:20210103,成都华邑药用辅料制造有限责任公司);生理盐水(批号:21020203B,安徽双鹤药业有限责任公司);薄荷油(批号:B22N9C75604,上海源叶生物科技有限公司);桉叶油(批号:B28S9C71133,上海源叶生物科技有限公司);油酸(药用级,批号:18513,上海阿拉丁生化科技股份有限公司);水溶性月桂氮卓酮(批号:200701,湖北科捷制药有限公司)。
1.3 实验动物SD雄性大鼠,SPF级,200~220 g,斯贝福(北京)生物技术有限公司,合格证号:110324210105296137。
2 方法与结果 2.1 分析方法的建立 2.1.1 色谱条件安捷伦色谱柱:ZORBAX EcLipse Plus,C18(4.6 mm×250 mm,5 μm);流动相:A(0.1%磷酸水溶液)-B(乙腈),梯度洗脱:0~9 min,20%~20%B;9~12 min,20%~60%B;流速1.0 mL/min;进样量10 μL;柱温30 ℃;检测波长230 nm;后运行时间3 min。
2.1.2 专属性考察取12 h空白PF凝胶透皮接受液、PF凝胶透皮接受液、PF对照品溶液。按照“2.1.1”项下的条件进样分析,记录HPLC图,结果表明该方法专属性良好。见图 1。

|
| 注:A.PF对照品;B.空白凝胶;C.PF凝胶;1.PF。 图 1 凝胶透皮接受液HPLC图 |
称取PF对照品(含量≥98%)适量置于10 mL容量瓶中,使用甲醇定容,母液浓度为2 720.48 μg/mL。将母液浓度依次配置为1 360.24、544.10、272.05、136.02、54.41、13.60 μg/mL,以PF浓度(C)为横坐标,峰面积(A)为纵坐标,计算标准曲线方程A=13.527C+82.105,R2=0.999 5。
2.1.4 精密度考察取“2.1.3”项下浓度分别为54.41、136.02、1 360.24 μg/mL的低、中、高浓度的供试品溶液,1 d内分别测定3次,连续测定3 d,根据供试品溶液的峰面积,计算3种浓度标准品溶液日内精密度RSD范围为0.15%~2.57%,日间精密度范围为1.92%~2.53%。
2.1.5 重复性考察取12 h内的同一PF凝胶透皮接受液,离心(10 000r/min,10 min,离心半径16.8 cm),过水系0.22 μm滤膜,平行处理6份,分别进样分析,计算RSD值为1.02%。
2.1.6 加样回收率取已知含量的PF凝胶透皮接受液,平行处理6份,分别加入PF对照品2.46 mg,进样分析,计算6份接受液加样回收率平均值为99.41%,RSD值为0.76%。
2.1.7 稳定性考察取12 h内的同一PF凝胶透皮接受液,离心(10 000r/min,10 min,离心半径16.8 cm),过水系0.22 μm滤膜,分别于0、2、4、6、8、10、12、24、36、48 h进样检测,以各样品中PF的含量计算RSD值为0.51%。
2.2 PF理化性质测定 2.2.1 PF表观溶解度的测定将过量的PF原料药加入至pH为7.4的2 mL磷酸缓冲盐溶液中(n=3),使用智能磁力加热搅拌器搅拌24 h,温度控制在(37±1)℃,制成过饱和溶液,静置,吸取上清药液使用0.22 μm有机滤膜过滤,离心(10 000 r/min,10 min,离心半径16.8 cm),取0.1 mL加至50 mL容量瓶中,使用pH为7.4的磷酸缓冲盐溶液进行稀释、定容,按照“2.1.1”项下的色谱条件进样分析,计算PF在pH为7.4的磷酸缓冲盐溶液中的溶解度为(118.00±0.48)mg/mL。
2.2.2 PF油水分配系数测定精密量取上述离心后的PF饱和溶液1 mL置于4 mL离心管中,加等量的水饱和正辛醇恒温振荡2 h,静置24 h分层,精密量取下层水溶液0.1 mL,加入pH为7.4的磷酸缓冲盐溶液稀释至50 mL,按照“2.1.1”项下条件进样,用HPLC法测定水相中PF含量,根据下列公式进行计算,PF在pH为7.4的磷酸盐缓冲溶液中的油水分配系数LogP=-0.59。
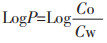
|
Co为PF在油相(即正辛醇)中的浓度,Cw为PF在水相中的浓度。
2.3 PF体外经皮渗透实验 2.3.1 离体大鼠皮肤处理取健康SD雄性大鼠,剔除腹部皮肤绒毛,以10%水合氯醛(0.8 mL/只)麻醉大鼠,使用剪刀小心剥离腹部皮肤,并用刀片剔除皮肤组织及脂肪,过程中不得破损皮肤。用生理盐水反复冲洗后,平铺于铝箔纸上,包好,置于-20 ℃冰箱保存备用。存放不得超过7 d,实验时室温下自然解冻。
2.3.2 含不同促渗剂PF凝胶剂的制备称取0.4 g卡波姆940于100 mL烧杯中,加入适量去离子水,使用磁力搅拌器搅拌均匀,溶胀过夜后加入处方量的PF原料药,加入甘油10 g,分别加入不含和含有促渗剂薄荷油(3%、5%、7%、9%)、油酸(2%、3%、4%)、氮酮(3%、4%、5%)、桉叶油(3%、4%、5%),搅拌均匀,加入去离子水至100 g,加入处方量的羟苯乙酯,搅拌,加入处方量的三乙醇胺,充分搅拌均匀,离心(4 000 r/min,10 min,离心半径16.8 cm),去除气泡即得。
2.3.3 经皮渗透动力学方程及其动力学参数考察使用改良后的Franz垂直扩散池,扩散池分为供给池和接收池两个部分,接收池体积为8 mL,扩散池有效透皮面积为3.14 cm2。分别取1.0 g凝胶于透皮扩散池供给池上,使之与大鼠皮肤充分接触。接受池中注入pH为7.4的磷酸缓冲盐溶液8 mL,排空气泡,将透皮扩散仪水浴温度控制在(37±1)℃,磁力搅拌(500 r/min)。分别于给予凝胶后1、2、4、6、8、10、12 h从接收池中取2.0 mL接收液,同时补充等体积相同温度的空白接收介质,将取出的接收液离心(13 000 r/min,10 min,离心半径16.8 cm),过水系0.22 μm微孔滤膜,取续滤液按“2.1.1”项色谱条件进样,测定并计算各时间点接收液中药物的浓度(Cn)、单位面积药物累积透皮量(Qn)和药物累积透皮率(Fn)。按照如下公式进行计算:
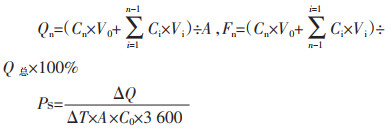
|
其中Cn、Ci为第n个和第i个取样点测得的药物浓度,V0为接收池中接收液的体积,Vi为每次取样的体积,A为有效透皮面积,Q总为供给池凝胶中的PF总含量,Ps为表观渗透系数。以单位时间(t)对Qn作图,可得到药物累积释放曲线,进行线性回归得到拟合方程,其斜率即为稳态透皮速率(Js)。
2.4 不同促渗剂对PF透皮吸收的影响本研究使用不同比例的薄荷油、油酸、氮酮和桉叶油作为促渗剂,以12 h时的Q值、Js、Ps及增渗比为考察指标,结果见表 1。
由表 1可知,PF的经皮渗透动力学符合零级动力学方程,不同时刻累积渗透量与时间具有良好的线性关系。统计学处理方面,以Js为考察指标,进行t检验。图 2为采用4种不同促渗剂时PF凝胶的药物累积渗透曲线。图 2A可以看出,薄荷油由低浓度3%到7%时,PF累积透过量呈增加趋势,当在7%浓度时,12 h的PF经皮累积透过量达到最高值,当薄荷油浓度继续增加到9%时,PF 12 h累积透过量降低,说明薄荷油作为促渗剂具有一个最佳浓度,比此浓度高或低的促渗剂促渗作用不理想,甚至会对PF的经皮渗透产生抑制作用。与空白促渗剂比较,差异具有统计学意义的是5%薄荷油与7%薄荷油(P<0.01),分别使PF经皮速率提高至1.63、1.95倍。在7%薄荷油作用下,PF 6 h累积透过率为60.50%,12 h累积透过率为81.20%;而未添加促渗剂时,PF 6 h累积透过率为13.70%,12 h累积透过率为33.80%,即7%薄荷油可以提高PF累积透过率。通过图 2B及图 2D可以看出,当分别提高油酸和桉叶油浓度时,PF累积透过量均是先升高后降低,但只有3%油酸及4%桉叶油对PF具有促渗作用,与空白促渗剂比较,这两种促渗剂透皮速率的差异具有统计学意义(P<0.05),分别使PF经皮速率提高至1.19、1.20倍。图 2C考察氮酮最常用的促渗浓度,未发现其对PF具有促渗作用。通过表 1可知,这几种促渗剂对PF促渗作用依次为7%薄荷油 > 5%薄荷油 > 4%桉叶油 > 3%油酸。
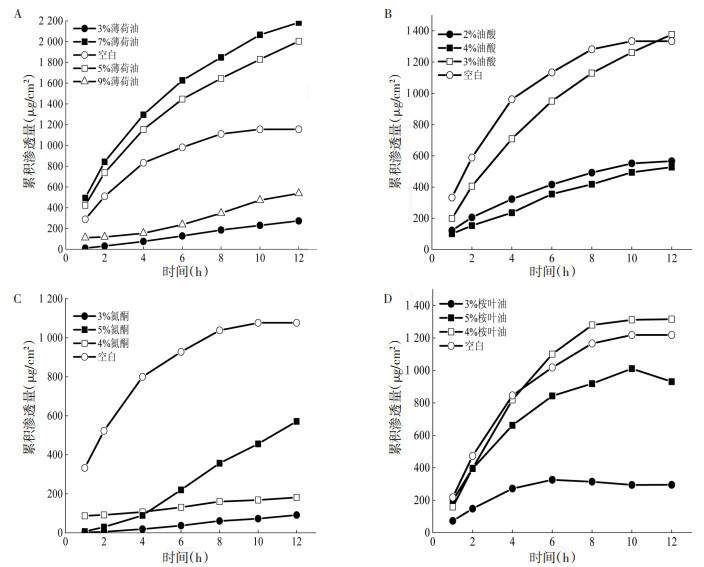
|
| 注:A.不同浓度薄荷油的PF累积透过曲线;B.不同浓度油酸的PF累积透过曲线;C.不同浓度氮酮的PF累积透过曲线;D.不同浓度桉叶油的PF累积透过曲线。 图 2 不同促渗剂中PF累积透过曲线图 |
一般来讲,药物的溶解度、油水分配系数、相对分子质量等对其经皮吸收能力起决定性作用,由“2.2.1”及“2.2.2”项下的考察结果可知,PF在pH为7.4的磷酸缓冲盐溶液中的溶解度为(118.00±0.48)mg/mL,表明PF是一种强水溶性药物,过高的水溶性药物或脂溶性药物均不利于制成外用制剂。通常logP值范围在2~3的药物具有较好的经皮渗透效果[14],PF的logP值为-0.59,数值较小,PF相对分子质量为480.462,分子质量小于500,有利于通过皮肤障碍,但由于logP值较小,与皮肤的相容性较差,导致其不易透过角质层。因此筛选合适的促渗剂,提高PF累积透过量,增加药物吸收率显得尤为重要。
本实验通过查阅相关文献[15-17],选择对薄荷油、桉叶油、油酸及氮酮4种常用促渗剂进行考察。参照文献,桉叶油、油酸和氮酮促渗剂常用质量分数为1%~5%,本实验主要选取这一范围进行考察。
透皮结果发现,与空白促渗剂比较,在4%桉叶油及3%油酸作用下,这两种促渗剂均有促渗效果,透皮速率提高(P<0.05),在其他质量分数下呈现抑制作用。桉叶油对水溶性药物及脂溶性药物均具有促进渗透作用,机制可能为桉叶油作用于皮肤类脂间质,使其结构遭到破坏,通透性增加,从而促进药物的透皮吸收[18]。油酸在低浓度时对水溶性药物具有促进渗透作用[19],机制可能是其对皮肤的整个角质层中的脂质作用,使脂质流动性增强,减少药物透过时的阻力[20]。氮酮作为最常用的促渗剂,一般促渗效果较好,本实验中未发现氮酮对PF的经皮产生促渗作用,3种质量分数的氮酮均对PF表现出抑制作用(增渗比<1),可能是因为提高氮酮质量分数会增加凝胶的黏稠性,因此呈现出抑制作用。既往研究结果表明,薄荷油对水溶性药物具有较好的促渗透作用[21-23],且薄荷油浓度较高时,促渗效果较强,这与本实验结果一致。当薄荷油浓度为5%时,透皮速率提高(P<0.01);当薄荷油浓度为7%时,促渗效果最强。但当浓度继续增加时,反而不利于PF渗透。薄荷油的促渗机制可能是通过破坏角质层间质,从而引起细胞间隙增加,降低了PF通过角质层的阻力[24]。
本研究最终选择7%薄荷油作为PF凝胶促渗剂,可为治疗类风湿性关节炎开发新药提供依据。
| [1] |
杨丽梅, 岳广欣. 白芍总苷及其神经精神药理作用研究概况[J]. 河北中医, 2017, 39(4): 614-618. YANG L M, YUE G X. General situation of total glucosides of Paeonia lactiflora and its neuropsychopharmacological effects[J]. Hebei Journal of Traditional Chinese Medicine, 2017, 39(4): 614-618. |
| [2] |
张育贵, 张淑娟, 边甜甜, 等. 芍药苷药理作用研究新进展[J]. 中草药, 2019, 50(15): 3735-3740. ZHANG Y G, ZHANG S J, BIAN T T, et al. New progress in pharmacological action of paeoniflorin[J]. Chinese Traditional and Herbal Drugs, 2019, 50(15): 3735-3740. |
| [3] |
车娅莉, 张文武, 尚立宏, 等. 芍药苷研究进展[J]. 中兽医医药杂志, 2021, 40(4): 47-51. CHE Y L, ZHANG W W, SHANG L H, et al. Research progress of paeoniflorin[J]. Journal of Traditional Chinese Veterinary Medicine, 2021, 40(4): 47-51. |
| [4] |
ZHANG L L, WEI W. Anti-inflammatory and immunoregulatory effects of paeoniflorin and total glucosides of paeony[J]. Pharmacology & Therapeutics, 2020, 207(12): 107-115. |
| [5] |
刘俊彤, 李轶聪, 董丽强, 等. 芍药苷对抗炎反应因子TNF-α和IL-6的作用研究[J]. 中西医结合心血管病电子杂志, 2020, 8(30): 1, 6. LIU J T, LI Y C, DONG L Q, et al. Study on the effect of paeoniflorin on TNF-α and IL-6[J]. Cardiovascular Disease Electronic Journal of Integrated Traditional Chinese and Western Medicine, 2020, 8(30): 1, 6. |
| [6] |
吴玲芳, 王晓晴, 陈香茗, 等. 白芍化学成分及药理作用研究进展[J]. 国际药学研究杂志, 2020, 47(3): 175-187. WU L F, WANG X Q, CHEN X M, et al. Chemical constituents and pharmacological activities of radixpaeoniaealba: research advances[J]. Journal of International Pharmaceutical Research, 2020, 47(3): 175-187. |
| [7] |
ZHANG L, YU J, WANG C, et al. The effects of total glucosides of paeony (TGP) and paeoniflorin (Pae) on inflammatory-immune responses in rheumatoid arthritis (RA)[J]. Functional Plant Biology, 2019, 46(2): 107-117. |
| [8] |
FEI F, AN L X, QI Q, et al. Paeoniflorin inhibits Th1 and Th17 cells in gut-associated lymphoid tissues to produce anti-arthritis activities[J]. Inflammopharmacology, 2019, 27(6): 1193-1203. |
| [9] |
YU J B, ZHAO Z X, PENG R, et al. Gut microbiota-based pharmacokinetics and the antidepressant mechanism of paeoniflorin[J]. Frontiers in Pharmacology, 2019, 10(1): 268. |
| [10] |
YANG X Z, WEI W. CP-25, a compound derived from paeoniflorin: research advance on its pharmacological actions and mechanisms in the treatment of inflammation and immune diseases[J]. Acta Pharmacologica Sinica, 2020, 41(11): 1387-1394. |
| [11] |
吴红旗. 不同种类的促渗剂对芍药苷透皮吸收的影响[J]. 首都医药, 2014, 21(22): 95-96. WU H Q. Effects of different penetration enhancers on transdermal absorption of paeoniflorin[J]. Capital Medicine, 2014, 21(22): 95-96. |
| [12] |
周蕾, 陈彦, 张振海, 等. 不同促渗剂对芍药苷透皮吸收的影响[J]. 中华中医药杂志, 2011, 26(9): 2100-2103. ZHOU L, CHEN Y, ZHANG Z H, et al. Effect of different penetration enhancers on percutaneous absorption of paeoniflorin[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2011, 26(9): 2100-2103. |
| [13] |
李得堂, 唐洪梅, 丘振文, 等. 促渗剂对疗筋涂膜剂中芍药苷经皮渗透的影响[J]. 中国实验方剂学杂志, 2009, 15(3): 62-66. LI D T, TANG H M, QIU Z W, et al. Effect of penetration enhancers on the transdermal penetration of peoniflorin in the Liaojin membrares[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2009, 15(3): 62-66. |
| [14] |
赵小静, 洪延涵, 刘卫. 纳米载体技术: 从经皮给药到功效性化妆品[J]. 日用化学品科学, 2021, 44(7): 12-16. ZHAO X J, HONG Y H, LIU W. Nanocarrier technology: from transdermal drug delivery to functional cosmetics[J]. Detergent & Cosmetics, 2021, 44(7): 12-16. |
| [15] |
赵雪玮, 张楠, 刘成禹, 等. 经皮给药系统中透皮促渗透的研究概况[J]. 中国社区医师, 2020, 36(10): 9. ZHAO X W, ZHANG N, LIU C Y, et al. General situation of research on transdermal penetration in transdermal drug delivery system[J]. Chinese Community Doctors, 2020, 36(10): 9. |
| [16] |
庞晓晨, 成睿珍, 赵静, 等. 中药透皮给药系统研究进展及其新剂型的应用[J]. 中国新药杂志, 2019, 28(3): 286-291. PANG X C, CHENG R Z, ZHAO J, et al. Research progress of transdermal drug delivery system of traditional Chinese medicine and the application of new formulations[J]. Chinese Journal of New Drugs, 2019, 28(3): 286-291. |
| [17] |
顾健沛, 闫治攀. 基于统计分析法探讨透皮促渗剂的应用研究现状[J]. 西部中医药, 2020, 33(7): 152-160. GU J P, YAN Z P. Application of penetration enhancers based on statistical analysis[J]. Western Journal of Traditional Chinese Medicine, 2020, 33(7): 152-160. |
| [18] |
JIANG Q D, WU Y M, ZHANG H, et al. Development of essential oils as skin permeation enhancers: penetration enhancement effect and mechanism of action[J]. Pharmaceutical Biology, 2017, 55(1): 1592-1600. |
| [19] |
王森, 欧水平, 涂高, 等. 吴茱萸次碱透皮贴剂的处方优化[J]. 中国药学杂志, 2018, 53(6): 439-444. WANG S, OU S P, TU G, et al. Formulation optimization of rutaecarpine transdermal patch[J]. Chinese Pharmaceutical Journal, 2018, 53(6): 439-444. |
| [20] |
朱学敏, 马敏, 任略, 等. 透皮吸收促进剂评价的新技术[J]. 中国药学杂志, 2017, 52(15): 1301-1307. ZHU X M, MA M, REN L, et al. New techniques for the evaluation of penetration enhancers[J]. Chinese Pharmaceutical Journal, 2017, 52(15): 1301-1307. |
| [21] |
谢伟杰, 张永萍, 徐剑. 薄荷油与氮酮对吲哚美辛亲水凝胶贴剂促渗作用的比较研究[J]. 时珍国医国药, 2018, 29(1): 84-87. XIE W J, ZHANG Y P, XU J. Screening and comparative Study on chemical penetration enhancers of indomethacin hydrophilic gel patches[J]. Lishizhen Medicine and Materia Medica Research, 2018, 29(1): 84-87. |
| [22] |
曾明辉, 李旭, 熊静悦, 等. 塞来昔布凝胶透皮促渗剂的配方研究[J]. 西北药学杂志, 2018, 33(6): 781-784. ZENG M H, LI X, XIONG J Y, et al. Study on the formulation of penetration enhancers in Celecoxib Gels[J]. Northwest Pharmaceutical Journal, 2018, 33(6): 781-784. |
| [23] |
王敏, 董雪荣, 李静, 等. 不同促渗剂对蒿甲醚软膏体外透皮吸收的影响[J]. 世界中医药, 2017, 12(11): 2795-2798. WANG M, DONG X R, LI J, et al. Effects of different enhancers on in vitro transdermal absorption of artemether ointment[J]. World Chinese Medicine, 2017, 12(11): 2795-2798. |
| [24] |
黄兴雨, 杨黎燕, 尤静. 薄荷挥发油研究进展[J]. 化工科技, 2019, 27(3): 70-74. HUANG X Y, YANG L Y, YOU J. Research progress in volatile oil in mentha[J]. Science & Technology in Chemical Industry, 2019, 27(3): 70-74. |
 2023, Vol. 42
2023, Vol. 42