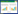文章信息
- 方萍, 邓雪丽, 杜芳芳, 彭琦, 张莉
- FANG Ping, DENG Xueli, DU Fangfang, PENG Qi, ZHANG Li
- 冬凌草甲素对雨蛙素诱导的重症急性胰腺炎大鼠免疫紊乱和组织损伤的影响
- Effect of oridonin on severe acute pancreatitis and tissue damage induced by ranin in rats
- 天津中医药大学学报, 2023, 42(5): 636-642
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(5): 636-642
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.05.15
-
文章历史
收稿日期: 2023-04-28
2. 荆州市中医医院手术室, 荆州 434002;
3. 荆州市中医医院骨科, 荆州 434002;
4. 湖北民族大学附属民大医院普外科, 恩施 445000
2. Operating Room, Jingzhou Hospital of Traditional Chinese Medicine, Jingzhou 434002, China;
3. Department of Orthopedics, Jingzhou Hospital of Traditional Chinese Medicine, Jingzhou 434002, China;
4. Department of General Surgery, Minda Hospital Affiliated to Hubei University for Nationalities, Enshi 445000, China
重症急性胰腺炎属于急性胰腺炎的特殊类型,占全部急性胰腺炎的10%~20%,是一种炎症性疾病且病情复杂多变、并发症多、病死率高,其发病机制与胰酶活性、细胞凋亡因子失访和炎性细胞因子等密切相关[1-2]。重症急性胰腺炎发生时,胰腺内的消化酶被异常活化导致大量的炎性细胞因子分泌,引起胰腺组织发生炎性反应、水肿、细胞死亡、免疫紊乱和组织损伤等[3-4]。重症急性胰腺炎胰腺组织分泌的炎性因子会进一步引起肝损伤、肺损伤等并发症[5]。冬凌草甲素(Ori)是冬凌草的主要活性成分,属于二萜类化合物,在抗炎症、抗细胞凋亡、抗氧化、血管生成、免疫调节、细胞自噬等多种生物学活性中起作用[6-8]。Xu等[9]研究发现,Ori可以抑制胰腺癌BxPC-3细胞增殖,下调炎性因子白细胞介素-1β(IL-1β)表达,但Ori在重症急性胰腺炎中的作用研究鲜见报道。因此,本研究通过建立重症急性胰腺炎大鼠模型,围绕Ori对重症急性胰腺炎模型大鼠胰腺组织免疫功能紊乱和组织损伤的影响进行研究,探讨Ori对重症急性胰腺炎大鼠组织损伤和免疫功能的影响。
1 材料与方法 1.1 实验材料 1.1.1 实验动物清洁级SD雄性大鼠(5周龄,体质量120~150 g)购自北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2019-009,使用许可证号:SYXK(京)2017-0022。实验动物严格遵守“3R”原则,并通过荆州市中医医院伦理委员会批准,每只大鼠给予24 h昼夜灯光照射控制及严格、规范的卡片登记管理,24 ℃条件下封闭群养。
1.1.2 实验试剂Ori(纯度≥98%)购自四川维克奇生物技术有限公司(CAS:28957-04-2);酶联免疫吸附(ELISA)试剂盒、苏木精-伊红(HE)染色试剂盒、免疫组化染色试剂盒、3,3’-二氨基联苯胺四盐酸盐(DAB)显色试剂盒购自美国Sigma公司;羊抗兔辣根过氧化物酶(HRP)-免疫球蛋白G(IgG)(ab6728)、兔抗单克隆抗体B淋巴细胞瘤-2(Bcl-2)相关X蛋白(Bax)(ab104156)、兔抗单克隆抗体Bcl-2(ab194583)、兔抗单克隆抗体GAPDH(ab22555)购自英国Abcam公司。
1.1.3 主要实验器材普通光学显微镜(Eclipse E100,日本奥林巴斯公司),电子天平(YP201N,上海天平仪器厂),酶标仪(RT-6100,Rayto),-80 ℃冰箱(902-ULTS,美国Thermo公司),台式高速离心机(D3024R,DRAGONLAB),聚合酶链反应(PCR)仪(冬胜龙ETC811,北京东胜创新生物科技有限公司),电泳仪(Powerpace Basic,美国Bio-rad公司),转膜仪(The Trans-Blot Turbo,美国Bio-rad公司)。
1.2 实验方法 1.2.1 动物分组、造模及给药将SD雄性大鼠随机分为5组,分别为对照组(Control)、大鼠重症急性胰腺炎组(SAP)、SAP+Ori 5 mg/kg组(SAP+Ori 5 mg/kg)、SAP+Ori 10 mg/kg组(SAP+Ori 10 mg/kg)、SAP+Ori 20 mg/kg组(SAP+Ori 20 mg/kg)。采用4%水合氯醛0.1 mL/10 g麻醉大鼠,SAP和各给药组SD大鼠皮下注射雨蛙素(25 μg/kg)诱导大鼠急性胰腺炎,采用化学诱导法建立重症急性胰腺炎大鼠模型[10],大鼠出现胰腺水肿,胰腺与体质量比值、血清脂肪酶和淀粉酶升高表示造模成功。本实验造模成功率为80%,造模成功后2 h内,各给药组分别口服5、10、20 mg/kg的Ori[9],Control和SAP喂食生理盐水,1 h内测定各组大鼠胰腺功能指标,测定完成后颈椎脱臼法处死大鼠进行后续实验。
1.2.2 样本采集建模成功后2 h,各组取10只大鼠,称取大鼠体质量,颈椎脱臼法处死大鼠并取出胰腺组织,称取胰腺组织质量,计算胰腺质量指数(胰腺质量指数=胰腺质量÷体质量×100%),眼眶取血用于测定脂肪酶和淀粉酶水平。胰腺组织用于实时定量荧光PCR(RT-PCR)和蛋白免疫印记(Western Blot)法检测,其余组织用福尔马林固定,石蜡包埋,用于HE染色和免疫组化检测。
1.2.3 ELISA法检测肿瘤坏死因子-α(TNF-α)、诱导型一氧化氮合酶(iNOS)、白细胞介素-10(IL-10)含量水平将各组大鼠眼眶静脉血3 000 r/min离心15 min(离心半径10 cm)后取上清液,重复3次,按照ELISA试剂盒操作说明测定血清脂肪酶和淀粉酶以及TNF-α、iNOS、IL-10的表达水平。
1.2.4 HE染色观察胰腺组织病理损伤情况将各组大鼠胰腺石蜡组织切片后,行HE染色,光镜下拍照并观察记录组织形态学变化,按照Kusske评分标准[11]和Schmidt评分标准进行评分。Kusske评分内容为:1)水肿。0分为无水肿;1分为小叶间区域水肿;2分为弥漫小叶间水肿;3分为腺泡肿胀,小叶间隙增宽;4分为明显小叶分割。2)炎症。0分为无炎症;1分为腺管边缘感染;2分为实质感染 < 50%;3分为实质感染50%~75%;4分为块状聚集,脓肿。3)出血。0分为无出血;1分为实质出血 < 25%;2分为实质出血25%~50%;3分为实质出血51%~75%;4分为实质出血 > 75%。4)坏死。0分为无坏死;1分为腺管周围实质坏死;2分为点状实质坏死 < 20%;3分为小叶缺失20%~50%;4分为小叶缺失 > 50%。Schmidt评分按水肿、腺泡细胞坏死、出血、炎症细胞浸润病理变化的不同程度分为0、0.5、1.0、1.5分4个档次,其总分作为胰腺损伤评分。
1.2.5 免疫组化检测凋亡细胞胰腺组织切片脱蜡,放入柠檬酸抗原修复缓冲液(pH=6.0)中进行修复15 min,加入山羊血清封闭液封闭30 min,加入提前配好的一抗[半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)多克隆抗体1:500]孵育过夜,加入二抗,室温孵育50 min[阴性对照组用磷酸缓冲盐溶液(PBS)代替],DAB显色,苏木素复染3 min,二甲苯透明处理,中性树胶封片,显微镜下检测,采集图片,分析阳性细胞率(显微镜下阳性细胞为棕黄色)。
1.2.6 Western Blot法检测凋亡蛋白Bax/Bcl-2水平将胰腺组织用1×PBS液冲洗去除血液和其他组织(冲洗3次),用手术剪于冰上将组织剪成小块并加入提前配制好的2 mL蛋白裂解液{含7 mol/L尿素、2 mol/L硫脲、5 mL/L IPG Buffer、65 mmol/L二硫苏糖醇(DTT)、40 g/L尿素-3-[(3-胆酰胺丙基)-乙二胺]-1-丙磺酸(CHAPS)、5 mg/L蛋白酶抑制剂、10 mL/L胰酶抑制剂}充分混匀后,在冰上用超声粉碎,4 ℃、12 000 r/min离心30 min(离心半径10 cm),取上清。用二喹啉甲酸(BCA)蛋白浓度测定试剂盒测定胰腺组织蛋白浓度,每孔上样20 μg,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳、转模、脱脂奶粉封闭,加入一抗,4 ℃孵育摇床过夜。回收一抗,加入按比例稀释HRP标记的对应二抗,室温孵育120 min。采用电化学发光(ECL)法进行化学发光,于暗室下曝光显影(GADPH作为内参)。将胶片进行扫描存档,Photoshop整理去色,Alpha软件分享光密度值。
1.2.7 RT-PCR法检测IL-1β、白细胞介素-4(IL-4)mRNA水平取新鲜冻存的大鼠胰腺组织50 mg,用PBS冲洗3次,眼科手术剪剪成小块,加入1 mL Trizol试剂混匀,用电动匀浆机匀浆后,转移至1.5 mL无RNA酶的离心管中,使细胞充分裂解。加入200 μL三氯甲烷充分混匀后,4 ℃、12 000 r/min离心15 min(离心半径10 cm),弃上清。沿离心管管壁缓慢加入75%乙醇1 mL。4 ℃、7 500 r/min离心5 min(离心半径10 cm)后弃上清。待室温干燥完成后,加入预冷的焦碳酸二乙酯(DEPC)水50 μL溶解沉淀并立即置于冰上。用1 μL DEPC水稀释200倍后,测定RNA浓度值。按逆转录试剂盒说明书进行逆转录合成cDNA,按RT-PCR试剂盒操作说明配制反应体系。按试剂盒操作说明加入反应液,待反应完成后放入PCR仪中进行RT-PCR反应(PCR反应条件:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,共40个循环),以目的基因和GADPH比值表示mRNA表达水平,采用2-ΔΔCt法分析结果。引物由上海生工生物工程有限公司设计合成,IL-1β上游序列为5’-GGCTTCCTTGTGCAAGTGTC-3’,下游序列为5’-TGTCGAGATGCTGCT-GTGAG-3’;IL-4上游序列为5’-TACAGCCACCATGAGAAGGAC-3’,下游序列为5’-TGATCGTCTTTAGCCTTTCCA-3’;GAPDH上游序列为5’-GACCTGACCTGCCGT-CTA-3’,下游序列为5’-AGGAGTGGGTGCGCTGT-3’。
1.3 统计学分析使用SPSS 17.0软件进行统计学分析,所有实验均有3份且在不同时间进行3次重复实验,取其平均值。正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析,若满足方差齐性,两两比较采用LSD法;若方差不齐,两两比较采用Dunnett t法,P<0.05为差异有统计学意义。
2 结果 2.1 Ori对重症急性胰腺炎大鼠胰腺功能和血清炎性因子水平的影响与Control比较,SAP大鼠胰腺与体质量比值、血清脂肪酶和淀粉酶均明显增加(P<0.05),证明造模成功。与SAP比较,经5 mg/kg Ori给药治疗后,大鼠胰腺与体质量比值、血清脂肪酶和淀粉酶无明显变化,10、25 mg/kg Ori治疗后显著降低(P<0.05)。ELISA法检测血清中TNF-α、iNOS、IL-10蛋白含量,与Control比较,SAP大鼠TNF-α、iNOS、IL-10高表达(P<0.05);与SAP比较,5 mg/kg Ori治疗后大鼠血清中TNF-α、iNOS、IL-10蛋白含量无明显差异,经10、20 mg/kg Ori治疗后,大鼠血清中TNF-α、iNOS蛋白含量显著下调,IL-10蛋白含量上调(P<0.05)。见图 1。
|
| 注:与Control比较,*P < 0.05;与SAP比较,#P < 0.05。 图 1 Ori对重症急性胰腺炎模型大鼠胰腺功能的影响(x±s,n=10) |
大鼠胰腺组织切片行HE染色,显微镜下观察胰腺组织形态并行胰腺组织学Kusske评分和胰腺病变Schmidt评分。结果发现,Control大鼠的胰腺组织形态基本正常。与Control比较,SAP大鼠具有胰腺组织水肿、炎症细胞浸润、细胞坏死等损伤,Kusske和Schmidt评分明显高于Control(P<0.05);与SAP比较,5 mg/kg Ori给药治疗后,大鼠胰腺损伤和Kusske、Schmidt评分无明显差异,10、20 mg/kg Ori大鼠的胰腺组织水肿、炎症细胞浸润、细胞坏死等损伤均有缓解,且Kusske评分显著低于SAP(P<0.05)。结果提示,Ori能够改善重症急性胰腺炎大鼠胰腺组织病理损伤。见图 2。

|
| 大鼠胰腺组织HE染色(×400)及Kusske、Schmidt评分结果(x±s,n=10) 图 2 大鼠胰腺组织HE染色(×400)及Kusske、Schmidt评分结果(x±s,n=10) |
免疫组化结果显示,与Control比较,SAP大鼠胰腺组织中凋亡细胞数量明显增多(棕黄色或褐色);与SAP比较,经5 mg/kg Ori给药治疗后,凋亡细胞数量无明显差异,10、20 mg/kg Ori治疗后大鼠凋亡细胞数量显著降低。见图 3。

|
| 图 3 大鼠胰腺组织免疫组化染色结果(×400) |
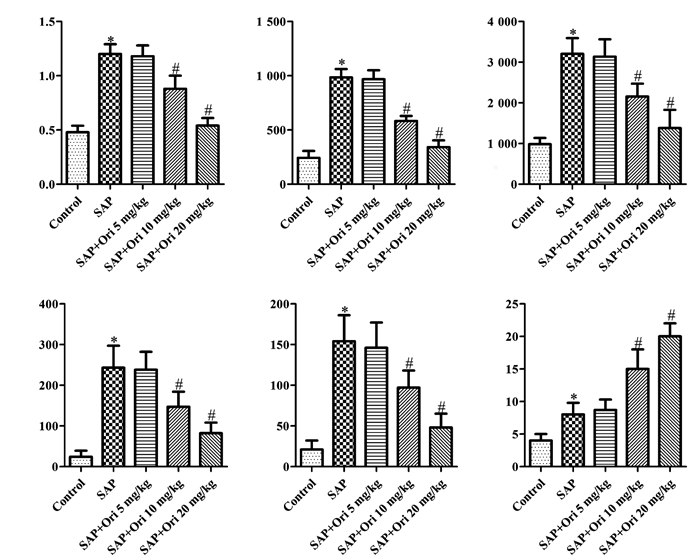
与Control比较,SAP大鼠Bax蛋白高表达且Bcl-2蛋白低表达;与SAP比较,经5 mg/kg Ori治疗后,Bax、Bcl-2蛋白表达水平无明显变化,10、20 mg/kg Ori显著下调Bax蛋白表达并上调Bcl-2蛋白表达,见图 4A。与Control比较,SAP大鼠胰腺组织细胞凋亡数量明显升高(P<0.05);与SAP比较,5 mg/kg Ori无明显调节作用,10、20 mg/kg Ori能显著抑制胰腺组织细胞凋亡(P<0.05),见图 4B。结果表明,Ori能够抑制重症急性胰腺炎大鼠胰腺组织细胞凋亡,缓解因凋亡引起的组织损伤。
|
| 注:A.Bax与Bcl-2蛋白表达条带;B.胰腺组织凋亡水平(Bax/Bcl-2);与Control比较,*P < 0.05;与SAP比较,#P < 0.05。 图 4 Ori抑制重症急性胰腺炎模型大鼠细胞凋亡蛋白表达情况(x±s,n=10) |
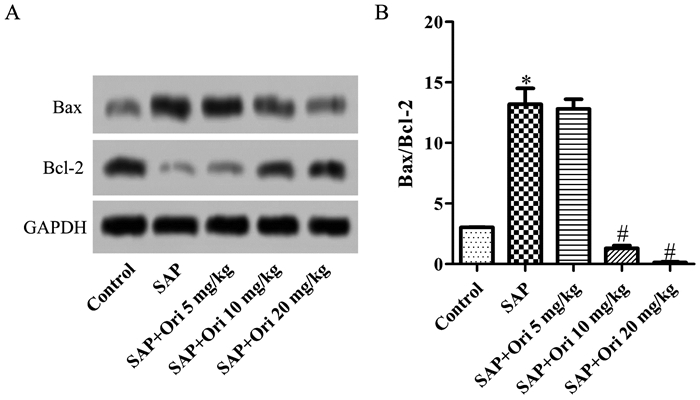
与Control比较,SAP大鼠IL-1β、IL-4 mRNA水平高表达(P<0.05);与SAP比较,5 mg/kg Ori治疗后无明显变化,10、20 mg/kg Ori治疗后显著抑制IL-1β mRNA表达(P<0.05),促进IL-4 mRNA表达(P<0.05),且呈剂量依赖性,见图 5。结果进一步提示,Ori促进免疫调节因子和抗炎因子表达,缓解重症急性胰腺炎引起的免疫失调和组织损伤。
|
| 注:与Control比较,*P<0.05;与SAP比较,#P<0.05。 图 5 胰腺组织IL-1β、IL-4 mRNA表达水平(x±s,n=3) |
重症急性胰腺炎是比较常见的一种炎症性疾病,主要表现为胰腺出血和坏死,炎症反应加剧伴随全身性多器官功能失调,故致死率居高不下[12]。重症急性胰腺炎因并发症多、病因复杂,导致药物研发困难,目前国内外尚无特效治疗药物,因此,探寻有效的治疗药物迫在眉睫[13]。Ori是冬凌草的主要活性成分,具有多种生物学活性。研究表明,Ori在糖尿病肾病、心肌损伤、急性肾损伤和骨关节炎等疾病中起到调节作用[14-15]。胰腺与体质量比值、血清脂肪酶和淀粉酶水平可以作为急性胰腺炎的诊断指标[16],也能从侧面反映胰腺组织的功能。本研究发现经Ori治疗后,大鼠胰腺组织中血清脂肪酶和淀粉酶的表达均下调,表明Ori对胰腺功能具有调节作用,HE染色结果进一步表明Ori具有改善胰腺组织功能的作用。
细胞凋亡和细胞坏死在重症急性胰腺炎发病过程中起到重要作用,Caspase-3、Bax和Bcl-2是细胞凋亡的标志性因子。Caspase-3和Bax在细胞凋亡过程中发挥诱导作用,促进凋亡发生过程进展,引导细胞走向凋亡,加剧组织损伤和组织功能障碍。Bcl-2则与之相反,在细胞凋亡过程中具有抑制作用[17]。本研究发现,10、20 mg/kg Ori能够显著上调Bcl-2蛋白表达,下调Caspase-3和Bax蛋白表达,结果提示,Ori能够抑制胰腺组织细胞凋亡水平,保护重症急性胰腺炎模型大鼠因细胞凋亡引起的组织损伤和免疫紊乱。
氧化应激引起的炎症反应诱导胰腺组织发生重症急性胰腺炎,TNF-α和iNOS是重要的炎症介导因子,iNOS诱导机体产生大量的活性氧(ROS),促使机体遭受因氧化应激反应引起的组织损伤,IL-10作为抗炎因子,能够抑制组织炎性活动并下调TNF-α和iNOS诱导的炎症反应[18-19]。本研究中Western Blot法检测结果发现,经Ori治疗后,重症急性胰腺炎模型大鼠胰腺组织血清中TNF-α和iNOS蛋白表达明显降低,IL-10蛋白表达显著增加,说明Ori在重症急性胰腺炎模型大鼠炎症反应中起到抑制作用,缓解因炎症反应引起的组织损伤。炎症反应通过干扰机体稳定的免疫系统,致使组织损伤、免疫系统紊乱,相反免疫系统紊乱又会进一步导致炎症反应加剧,促使机体产生恶性循环。IL-1β和IL-4是重要的免疫系统调控因子,在正常机体免疫系统中,两者相互调节,保护机体免受外来感染源的入侵,这种平衡一旦被打破,机体的免疫系统就会出现失调,促使炎症反应等多种病理性因素扰乱机体正常功能,从而出现组织损伤、细胞坏死等[20-21]。本研究检测了IL-1β和IL-4在胰腺组织中的mRNA表达水平,结果发现,IL-1β在SAP大鼠中高表达,但经Ori治疗后,IL-1β的表达水平被明显下调,同时IL-4的表达被上调,说明Ori能够通过调节免疫相关因子表达,起到保护大鼠免受因重症急性胰腺炎引起的免疫系统紊乱和组织损伤作用。
综上所述,Ori能够通过调控凋亡蛋白、炎症因子和免疫调节因子表达水平,减轻重症急性胰腺炎大鼠胰腺组织细胞凋亡、炎症反应和免疫紊乱,缓解胰腺组织损伤。
| [1] |
史增辉, 代金玉, 苏卫仙. 重组人生长激素联合生长抑素治疗重症急性胰腺炎的效果及对炎性、免疫因子的影响[J]. 临床误诊误治, 2019, 32(7): 20-25. SHI Z H, DAI J Y, SU W X. Effects of recombinant human growth hormone combined with somatostatin on severe acute pancreatitis and its effects on inflammatory and immune factors[J]. Clinical Misdiagnosis & Mistherapy, 2019, 32(7): 20-25. |
| [2] |
赵彦, 刘俐, 吕辰艳, 等. 重症胰腺炎患者预后生存情况及与其临床特征的相关性研究[J]. 解放军医药杂志, 2020, 32(5): 78-81, 98. ZHAO Y, LIU L, LYU C Y, et al. Prognosis of patients with severe acute pancreatitis and its correlation with clinical features[J]. Medical & Pharmaceutical Journal of Chinese PLA, 2020, 32(5): 78-81, 98. |
| [3] |
CHEN Z, DONG W H, WU Q, et al. Two-layer regulation of TRAF6 mediated by both TLR4/NF-κB signaling and miR-589-5p increases proinflammatory cytokines in the pathology of severe acute pancreatitis[J]. American Journal of Translational Research, 2020, 12(6): 2379-2395. |
| [4] |
ROBERTS K M, NAHIKIAN-NELMS M, UKLEJA A, et al. Nutritional aspects of acute pancreatitis[J]. Gastroenterology Clinics of North America, 2018, 47(1): 77-94. DOI:10.1016/j.gtc.2017.10.002 |
| [5] |
JIN H Z, YANG X J, ZHAO K L, et al. Apocynin alleviates lung injury by suppressing NLRP3 inflammasome activation and NF-κB signaling in acute pancreatitis[J]. International Immunopharmacology, 2019, 75(6): 105-121. |
| [6] |
LU C H, CHEN C B, CHEN A, et al. Oridonin attenuates myocardial ischemia/reperfusion injury via downregulating oxidative stress and NLRP3 inflammasome pathway in mice[J]. Evidence-Based Complementary and Alternative Medicine, 2020, 20(13): 739-751. |
| [7] |
YAN Y, TAN R Z, LIU P, et al. Oridonin alleviates IRI-induced kidney injury by inhibiting inflammatory response of macrophages via AKT-related pathways[J]. International Medical Journal of Experimental and Clinical Research, 2020, 26(6): e921114. |
| [8] |
HUANG J H, LAN C C, HSU Y T, et al. Oridonin attenuates lipopolysaccharide-induced ROS accumulation and inflammation in HK-2 cells[J]. Evidence-Based Complementary and Alternative Medicine, 2020, 20(16): 972-982. |
| [9] |
XU W, SUN J, ZHANG T T, et al. Pharmacokinetic behaviors and oral bioavailability of oridonin in rat plasma[J]. Acta Pharmacologica Sinica, 2006, 27(12): 1642-1646. DOI:10.1111/j.1745-7254.2006.00440.x |
| [10] |
JAWOREK J, SZKLARCZYK J, KOT M, et al. Chemerin alleviates acute pancreatitis in the rat thorough modulation of NF-κB signal[J]. Official Journal of the International Association of Pancreatology, 2019, 19(3): 401-408. |
| [11] |
KUSSKE A M, RONGIONE A J, ASHLEY S W, et al. Interleukin-10 prevents death in lethal necrotizing pancreatitis in mice[J]. Surgery, 1996, 120(2): 284-289. DOI:10.1016/S0039-6060(96)80299-6 |
| [12] |
王丽晖, 吴广礼, 黄旭东, 等. CVVH联合HP治疗重症急性胰腺炎并发多器官功能障碍综合征的临床效果[J]. 解放军医药杂志, 2020, 32(9): 53-57. WANG L H, WU G L, HUANG X D, et al. Clinical effect of CVVH combined with HP in the treatment of severe acute pancreatitis complicated with multiple organ dysfunction syndrome[J]. Medical & Pharmaceutical Journal of Chinese PLA, 2020, 32(9): 53-57. |
| [13] |
苗建军, 周伟, 尚培中. 重症急性胰腺炎临床救治研究进展[J]. 临床误诊误治, 2013, 26(12): 97-100. MIAO J J, ZHOU W, SHANG P Z. Research progress on clinical treatment of severe acute pancreatitis[J]. Clinical Misdiagnosis & Mistherapy, 2013, 26(12): 97-100. |
| [14] |
何荃, 王萌, 魏萌, 等. 冬凌草甲素抑制NF-KBp65活化对糖尿病肾病幼龄大鼠肾损伤和免疫紊乱的影响[J]. 西部医学, 2019, 31(11): 1646-1650, 1656. HE Q, WANG M, WEI M, et al. Effect of oridonin on renal injury and immune disorder in diabetic nephropathy young rats by inhibiting activation of NF-KB p65[J]. Medical Journal of West China, 2019, 31(11): 1646-1650, 1656. |
| [15] |
JIA T, CAI M M, MA X, et al. Oridonin inhibits IL-1β-induced inflammation in human osteoarthritis chondrocytes by activating PPAR-γ[J]. International Immunopharmacology, 2019, 69(7): 382-388. |
| [16] |
姚俊英. 血清脂肪酶和淀粉酶联合检测在急性胰腺炎诊断中的作用[J]. 中国医药指南, 2017, 15(18): 103-104. YAO J Y. The role of combined detection of serum lipase and amylase in the diagnosis of acute pancreatitis[J]. Guide of China Medicine, 2017, 15(18): 103-104. |
| [17] |
XIONG Y L, WANG Y M, XIONG Y L, et al. Salidroside alleviated hypoxia-induced liver injury by inhibiting endoplasmic reticulum stress-mediated apoptosis via IRE1α/JNK pathway[J]. Biochemical and Biophysical Research Communications, 2020, 529(2): 335-340. |
| [18] |
KANG L L, LI X Y, LIU J H, et al. Recombinant human insulin-like growth factor binding protein 3 attenuates lipopolysaccharide-induced acute lung injury in mice[J]. International Journal of Clinical and Experimental Pathology, 2020, 13(7): 1924-1931. |
| [19] |
YAO C, ZHANG Q Q, LI J, et al. Implantable zoledronate-PLGA microcapsules ameliorate alveolar bone loss, gingival inflammation and oxidative stress in an experimental periodontitis rat model[J]. Journal of Biomaterials Applications, 2021, 35(6): 569-578. |
| [20] |
PALUDAN S R, PRADEU T, MASTERS S L, et al. Constitutive immune mechanisms: mediators of host defence and immune regulation[J]. Nature Reviews Immunology, 2021, 21(3): 137-150. |
| [21] |
CHOE S H, CHOI E Y, HYEON J Y, et al. Effect of nifedipine, a calcium channel blocker, on the generation of nitric oxide and interleukin-1β by murine macrophages activated by lipopolysaccharide from Prevotella intermedia[J]. Naunyn-Schmiedeberg's Archives of Pharmacology, 2021, 394(1): 59-71. |
 2023, Vol. 42
2023, Vol. 42