文章信息
- 申莉铎, 张慧, 邵笑笑, 蒋若琛, 简芋鑫
- SHEN Liduo, ZHANG Hui, SHAO Xiaoxiao, JIANG Ruochen, JIAN Yuxin
- 解郁止痛方对偏头痛—抑郁共病模型大鼠行为学及脑组织中Iba1/RhoA蛋白表达的影响
- Effects of antidepressant and analgesic formula on behavior and expression of Iba1/RhoA protein in brain tissue of rats with migraine-depression co-morbidity model
- 天津中医药大学学报, 2023, 42(6): 742-749
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(6): 742-749
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.06.11
-
文章历史
收稿日期: 2023-08-02
2. 陕西中医药大学附属医院, 咸阳 712000
2. Affiliated Hospital of Shaanxi University of Chinese Medicine, Xianyang 712000, China
偏头痛是一种常见的以单侧或双侧搏动性中度或重度为主的原发性头痛,在现代社会中广泛存在[1-2],严重影响了人类的生活质量,对人类的健康造成了极大影响。有数据表明,在当今社会,越来越多的人饱受偏头痛的折磨,偏头痛的患病率也逐步上升,其在全世界年患病率高达18%,在中国患病比例为9.3%[3-4]。此外,偏头痛不仅对人体伤害巨大,还可与多种疾病共病,进一步给人体生理、心理带来极大创伤。抑郁是偏头痛病程中一种常见的并发疾病[5],与其他正常人群相比,偏头痛患病人群抑郁的发病率风险增加(OR=5.8),同时,抑郁患病人群并发偏头痛的风险也呈增加趋势(OR=3.4),由此可见,偏头痛与抑郁共病具有双向性,两者常相伴存在,互相影响[6],对人类的生活质量产生严重的影响,进一步对社会生产力造成影响。因此,偏头痛-抑郁共病的预防与治疗尤为重要,现代临床对于偏头痛-抑郁共病暂无明确、有效、规范的认识,关于其发病机制的研究也较贫乏,临床多以西医治疗为主,西药多副作用大,且症状改善不明显。中医治疗疾病具有个体差异,且多药联合可多靶点发挥作用,并可减轻西药带来的不良作用,有效防治偏头痛-抑郁共病对个人及社会的危害,提高社会生产力。有研究表明,偏头痛与抑郁两者之间常相伴存在可能与其受相同的脑组织调控有关,偏头痛-抑郁患者脑组织海马及杏仁核等均发生了明显改变[7-8]。疼痛与抑郁有共同的传导通路,中枢神经系统痛觉信息传导通路中神经元敏化可产生皮肤异常性疼痛伴随强烈的负性情绪。小胶质细胞是中枢神经系统中固有的免疫效应细胞,在维持脑内稳态和神经炎症反应中发挥重要作用。电离钙结合适应分子1(Iba1)是小胶质细胞分子标记物,激活后表达增加[9],神经再生抑制因子Ras同源物基因A(RhoA)与下游Rho蛋白激酶(ROCK)的相互作用可阻止中枢神经再生,加重神经元受损[10]。解郁止痛方在治疗偏头痛—抑郁共病疾患方面有着显著疗效,但其作用机制尚不明确。相关研究表明,偏头痛—抑郁共病大鼠模型中大鼠脑组织杏仁核内Iba1及RhoA蛋白含量均显著升高[11],本实验主要研究偏头痛—抑郁共病大鼠模型行为学改变及脑组织杏仁核内Iba1/RhoA蛋白的含量,探究偏头痛—抑郁共病大鼠的发病机制及解郁止痛方治疗偏头痛—抑郁共病疾患的分子机制,以期为临床偏头痛—抑郁共病疾患的防治提供可靠依据。
1 材料与方法 1.1 实验动物健康雄性SD大鼠54只,体质量(200±20)g,由成都达硕实验动物有限公司提供。合格证书号:SCXK(川)2022-002。实验前于陕西中医药大学动物实验中心适应性喂养1周,实验中心动物房于8:00-20:00光照、20:00-8:00黑暗,实验室温度(23±1)℃,湿度(50±5)%,喂养期间自由饮食,饮自来水,食标准颗粒饲料。
1.2 药物和试剂解郁止痛方(由川芎12 g,柴胡10 g,合欢皮10 g,全蝎6 g,黄芪10 g组方),由陕西中医药大学校医院制剂中心提供;硝酸甘油注射液,规格1 mL∶5 mg,山东华信制药有限公司;国药准字:H37021469;尼莫地平片,规格:20 mg/片,广东华南药业集团有限公司,国药准字:H44025019。
Iba1抗体,兔克隆抗体,货号:GTX100042,genetex;RhoA抗体,鼠克隆抗体,货号:66733-1-lg,proteintech;β-actin抗体,兔克隆抗体,货号:AC026,abclonal;生物素化山羊抗鼠IgG(H+L),货号:ab6789,英国abcam艾博抗(上海)贸易有限公司;生物素化山羊抗兔IgG(H+L),货号:s0001,affinity;1.0 mol/L Tris-HCl(pH=8.8)电泳缓冲液、PBS磷酸盐缓冲液、RIPA裂解液(强),货号:G2002-100 mL,servicebio;BCA蛋白浓度测定试剂盒,货号:P0009,beyotime;PAGE凝胶快速制备试剂盒,货号:PG112,上海雅酶生物科技有限公司;甘氨酸,货号:G5010-500 g,servicebio;Tris-base,货号:1115GR500,Biofroxx;SDS,货号:1275GR500,Biofroxx;氯化钠,天津市致远化学试剂有限公司。
1.3 主要仪器电子天平(上海民桥公司);2390系列电子VonFrey测痛仪(美国ITLife Science公司);JY-SCZ4+型垂直电泳槽、JY200C型电泳仪(北京君意东方电泳设备有限公司);TY-80A型水平脱色摇床(江苏科析仪器有限公司);5200型化学发光凝胶成像仪(上海天能科技有限公司);MK3型全功能酶标仪(美国ThermoFisher仪器有限公司);DW-86L386型超低温冰箱(海尔集团);H2050R高速低温离心机(湘仪集团);优普超纯水制造系统(成都超纯科技有限公司);KZ-Ⅲ-F型高速低温组织研磨仪(武汉赛维尔生物科技有限公司);HI1210型水浴锅(德国Leica公司)。
1.4 实验方法健康SD实验大鼠适应性喂养1周,1周后将54只大鼠随机分为6组(空白组、模型组、西药组、中药解郁止痛方低、中、高剂量组),每组9只。实验开始第1天,除空白组外,其余5组复制偏头痛模型,按照偏头痛间断性发作特点,于实验开始第1、7、14、21天分别在大鼠颈背部皮下注射硝酸甘油注射液(硝酸甘油注射液用生理盐水稀释为10 mg/kg),偏头痛造模成功的标志为:大鼠颈背部注射硝酸甘油注射液20 min后,大鼠耳朵发红,前肢搔头动作和攀笼次数增多[12]。偏头痛模型复制成功7天内,每天对除空白组外其余5组大鼠进行一种随机不重复慢性不可预知性刺激诱导偏头痛-抑郁共病大鼠模型[13]。1)晃笼:200 Hz 10 min。2)夹尾:将大鼠分笼放置,使用夹取力度相同且适中的鼠尾夹,在距大鼠尾巴根部1 cm处夹紧,时间4 min。3)湿笼:在笼子里撒100 mL水,至垫料全部湿透,持续24 h。4)冰水游泳:将4 ℃冷水加入水深15 cm的水桶,放入大鼠8 min后取出,其间保证大鼠的足尖可以碰到水桶的底部但不能越出水桶。5)电击足底:电压38 V每次1 s间隔2 s刺激1次持续2 min。6)斜笼:将动物笼倾斜45°放置,持续24 h。7)禁食、禁水:禁食、禁水24 h。通过观察大鼠搔头及攀笼次数、矿场实验、糖水消耗实验、强迫游泳实验、新奇抑食实验等行为学检测评分判断偏头痛-抑郁共病大鼠造模是否成功[13]。实验开始造模同时予以药物灌胃干预,空白组以纯水灌胃,模型组以0.9% NaCl溶液灌胃,西药组以尼莫地平尼混悬液6 mg/kg灌胃,中药低、中、高剂量组分别予以解郁止痛方(0.25 g/100 g、0.5 g/100 g、1.0 g/100 g)灌胃,每日1次,共21 d。
1.5 检测指标与方法 1.5.1 行为学评分于实验造模前第0天、造模治疗中第10天、造模治疗后第21天分别测量实验各组大鼠以下行为学。
1.5.1.1 体质量分别测量各组大鼠体质量并记录。
1.5.1.2 旷场试验准备长、宽各100 cm,高50 cm的敞口纸箱,并将其内壁四面均匀涂黑,内底等分为25个正方形。将大鼠沿一侧内壁放置于纸箱中,适应2 min后观察4 min内其爬过的方块数量(四肢同时经过)及直立次数(双侧前肢离开地面或爬于侧壁)评分[14]。各组大鼠依次检测,检测过程中尽量保持安静以确保实验准确性,并用视频记录检测结果,每次检测前保证纸箱干净无排泄物。分析各组大鼠旷场水平及垂直运动评分之间的差异。
1.5.1.3 糖水消耗实验实验前准备两只500 mL水瓶,一只瓶身标注糖水,另一只标注纯水。每次评估前24 h对大鼠实行糖水摄入适应性训练,即每笼同时放2个瓶内均装有1%蔗糖水500 mL的水瓶。24 h后,一只瓶内仍装1%蔗糖水500 mL、另一只瓶内装纯水500 mL。24 h后,取走水瓶,分别记录每只大鼠的总液体摄入量、糖水摄入量、纯水摄入量。计算其糖水偏好百分率(糖水偏好百分率=糖水摄入量/总液体摄入量×100%)[14]。比较各组大鼠糖水偏好差异。
1.5.1.4 强迫游泳实验检测前准备一长方形塑料桶(桶长100 cm宽50 cm高50 cm),桶内放置高40 cm 23~25 ℃的水。将同组大鼠依次放入水中,强迫其游泳8 min,大鼠被动漂浮在水中,将其在水中停止挣扎3 s以上规定为不动状态,记录大鼠不动时间[14],分析各组之间的差异。
1.5.1.5 新奇抑食实验实验前大鼠禁食1 d,不禁水,准备1个50 cm×40 cm的箱子,在箱子中央放置数枚大小相似的食标准颗粒饲料,每次从箱子的同一个角放入大鼠,记录大鼠第一次咬食的时间[15]。分析各组大鼠新奇抑食-潜伏时间之间的差异。
1.5.2 机械痛阈的测定实验开始第1、7、14、21天复制偏头痛模型前测量各组实验大鼠的机械痛阈值。机械痛阈的测定:将各组大鼠依次放置于底部具有网状金属孔格的透明测试笼中,适应5 min,待大鼠趋于安静后用Vonfrey纤维丝缓慢轻柔地刺激大鼠左后肢足底中部,持续几秒,观察大鼠缩足反应,记录引起爪子回缩的最小阈值,机械痛阈值均每只测量3次,每次测量应间隔5 min,取其均值[15]。
1.5.3 Western blot检测各组大鼠模型脑组织杏仁核中Iba1及RhoA蛋白的含量实验第21天造模治疗结束后,腹腔注射麻药麻醉大鼠,腹主动脉采血约4 mL,室温凝固20 min,离心机3 000 g离心20 min,ep管收集离心后血清进行分装,置于-80 ℃冰箱保存。取血后大鼠用0.9%Nacl心脏灌注以置换出全身血液,随后进行断头取脑,取出的脑组织在-20 ℃冰箱加以凝固后依照大鼠脑解剖图谱将杏仁核取出并称质量,放于2 mL离心管中液氮速冻后转-80 ℃冰箱保存。于WB检测时将样本取出放入2 mL研磨管中,向每管加入3 mm钢珠及RIPA裂解液(按照质量比样本:裂解液=1∶10),置于高速低温组织研磨仪内(温度-20 ℃,研磨4次,每次60 s);取出放4 ℃冰箱30 min进行裂解,30 min后取出放入离心机(4 ℃、12 000 g离心、10 min);离心完后取上清液,通过BCA蛋白定量试剂盒进行分析、蛋白变性、上样、电泳、转膜、封闭、孵育抗体、显影定影等步骤以检测大鼠脑组织杏仁核中Iba1及RhoA蛋白的水平。
1.6 统计学处理实验数据均采用SPSS 22.0软件进行统计学分析。计量数据均符合正态分布,将其按均数±标准差(x±s)表示,组间比较采用One-Way ANOVA单因素方差分析,P<0.05则有统计学意义,差异显著。
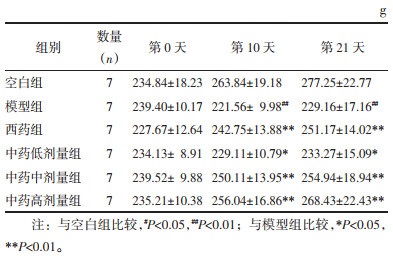
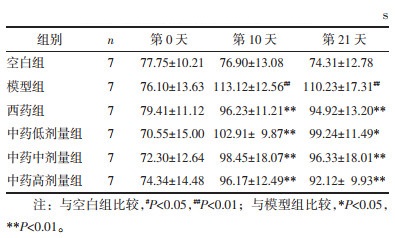
2 结果 2.1 大鼠体质量比较在造模治疗前(第0天)各组大鼠体质量均差异无统计学意义(P > 0.05)。在造模治疗第10天、21天,与空白组相比,模型组大鼠体质量明显下降(P < 0.01);与模型组相比,中药低剂量组大鼠体质量增加(P < 0.05),西药组、中药中剂量及高剂量组大鼠体质量显著升高(P<0.01)。见表 1。
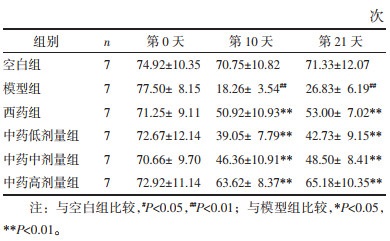
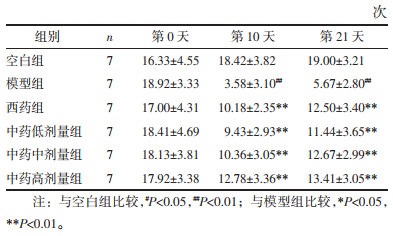
造模治疗前(第0天),各组大鼠旷场实验的水平及垂直运动评分均无统计学的差异(P > 0.05)。造模治疗第10天、21天,与空白组相比,模型组大鼠水平及垂直运动评分均下降(P < 0.01);与模型组相比,西药组及中药各剂量组大鼠水平及垂直运动评分均显著升高(P < 0.01)。见表 2,表 3。
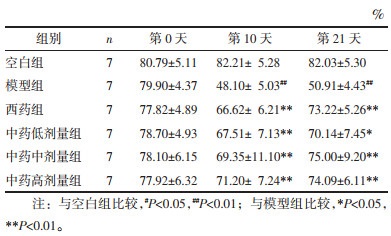
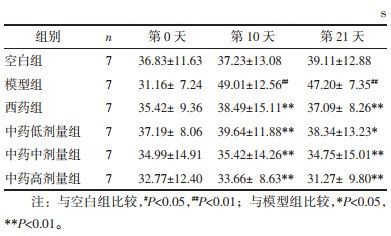
造模治疗前(第0天)各组大鼠的糖水偏好百分率均无统计学差异(P > 0.05)。造模治疗第10天,与空白组相比,模型组大鼠糖水偏好百分率降低(P < 0.01);与模型组相比,西药组及中药各剂量组大鼠糖水偏好百分率均显著升高(P < 0.01)。造模治疗第21天,与空白组相比,模型组大鼠糖水偏好百分率降低(P < 0.01);与模型组相比,中药低剂量组大鼠糖水偏好百分率升高(P < 0.05),西药组、中药中剂量及高剂量组大鼠糖水偏好百分率均显著升高(P<0.01)。见表 4。
造模治疗前(第0天)各组大鼠的强迫游泳实验均差异无统计学意义(P > 0.05)。造模治疗第10天,与空白组相比,模型组大鼠游泳不动时间延长(P < 0.01);与模型组相比,西药组及中药各剂量组大鼠游泳不动时间均显著缩短(P<0.01)。造模治疗第21天,与空白组相比,模型组大鼠游泳不动时间延长(P < 0.01);与模型组相比,中药低剂量组大鼠游泳不动时间缩短(P < 0.05),西药组、中药中剂量及高剂量组大鼠游泳不动时间均显著缩短(P < 0.01)。见表 5。
造模治疗前(第0天)各组大鼠的潜伏时间均差异无统计学意义(P > 0.05)。造模治疗第10天,与空白组相比,模型组大鼠新奇抑食-潜伏时间延长(P < 0.01);与模型组相比,西药组及中药各剂量组大鼠新奇抑食-潜伏时间均显著缩短(P < 0.01)。造模治疗第21天,与空白组相比,模型组大鼠新奇抑食-潜伏时间延长(P < 0.01);与模型组相比,中药低剂量组大鼠新奇抑食-潜伏时间缩短(P < 0.05),西药组、中药中剂量及高剂量组大鼠新奇抑食-潜伏时间均明显缩短(P < 0.01)。见表 6。
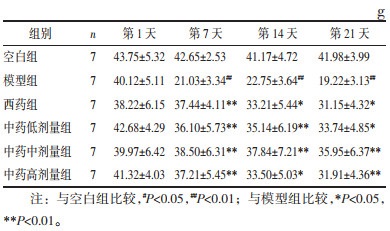
造模治疗第1天,各组大鼠的机械痛阈值比较均差异无统计学意义(P > 0.05)。造模治疗第7天,与空白组相比,模型组大鼠机械痛阈值明显降低(P<0.01);与模型组比较,西药组及中药各剂量组大鼠机械痛阈值明显升高(P < 0.01)。造模治疗第14天,与空白组相比,模型组大鼠机械痛阈值显著降低(P<0.01);与模型组比较,西药及中药高剂量组大鼠机械痛阈值升高(P<0.05),中药低、中剂量组大鼠机械痛阈值明显升高(P<0.01)。造模治疗第21天,与空白组相比,模型组大鼠机械痛阈值明显下降(P < 0.01);与模型组比较,西药及中药低剂量组大鼠机械痛阈值升高(P < 0.05),中药中、高剂量组大鼠机械痛阈值显著升高(P < 0.01)。见表 7。
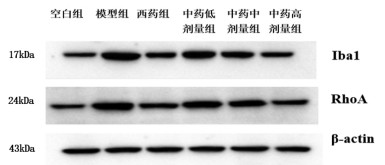
造模治疗结束后,检测大鼠杏仁核组织Iba1蛋白的表达水平,与空白组相比,模型组大鼠杏仁核组织中的Iba1升高,但差异无统计学意义(P > 0.05);与模型组相比,西药组及中药各剂量组大鼠杏仁核组织中的Iba1蛋白表达呈下降趋势,但差异无统计学意义(P > 0.05)。检测大鼠杏仁核组织RhoA蛋白表达水平,与空白组相比,模型组大鼠杏仁核中的RhoA蛋白表达显著升高(P < 0.01);与模型组相比,中药低剂量组大鼠杏仁核组织中的RhoA蛋白表达无明显差异(P > 0.05),中药中剂量组大鼠杏仁核组织中的RhoA蛋白表达降低(P < 0.05),西药组及中药高剂量组大鼠杏仁核组织中的RhoA蛋白表达显著降低(P < 0.01)。见表 8,图 1。
|
| 图 1 大鼠杏仁核组织中Iba1及RhoA蛋白的表达水平 |
偏头痛是临床上常见的致残性疾病之一。随着现代社会压力的增加,偏头痛的患病人数逐年增加并趋于年轻化,偏头痛反复频繁发作且严重时使人丧失生活能力[16]。久而久之,患者产生负面情绪,影响患者的身心健康,致使很大一部分患者产生抑郁,进而导致偏头痛与抑郁共病疾患,使其丧失劳动生产力,减少了社会生产率,对社会经济造成极大影响。因此,应尽早对偏头痛-抑郁共病进行普及与预防,重视中医药治疗。
中医认为肝主疏泄、主藏血。肝脏疏泄功能失调,影响人体气机,使情志产生变化。肝疏泄失调,气行不顺,致使体内肝气瘀滞,使人出现情绪低落、喜叹气、胸胁两肋胀痛等症状;情志不舒,气郁于内,进而化火,肝火上炎出现面红耳赤、耳鸣、头胀头痛等。肝藏血功能受损,肝血不足,可出现头晕目眩、心烦意乱等;肝气血不足,周身气血运行不畅,日久损伤正气,出现湿气、痰浊、内热、淤血等病理产物[17],发为头痛抑郁共病。解郁止痛方是治疗偏头痛—抑郁共病效果显著的验方。该方以川芎、柴胡共同组成君药,川芎辛温升散功用活血行气、祛风止痛,《医学启源》有“头痛需用川芎”之说,酒制川芎,可增强其止痛之功。现代医学研究表明;川芎中含有的阿魏酸钠及川芎嗪可明显抑制偏头痛活性[18]。此外,川芎嗪还有抗炎、防止细胞老化及营养神经等功能[19-21]。柴胡可疏肝解郁,疏散退热,其性升散,古有“柴胡劫肝阴”之说;现代药理学研究表明:柴胡含有的皂苷、多糖、黄酮等具有抗炎、抗抑郁及保护心、肝、肾脏器的作用[22-24]。两者共用疏肝调肝止痛功用更甚。合欢皮为臣,归心、肝、肺经,功用解郁安神活血,提取物合欢皮总皂苷可镇静宁心安神,对于郁症引起的心神不宁、失眠多梦效果甚佳。黄芪可益气生津养血,含有的黄芪多糖等对机体免疫、造血功能及心脑血管系统等均具有良好的保护作用,偏头痛—抑郁病症缠绵难愈,久病易耗伤元气,而《本草纲目》言黄芪“耄,长也,黄耄色黄,为补药之长”,故黄芪可扶正气以驱邪。全蝎归肝经,功用息风镇痉、通络止痛,可应用于风湿顽痹及偏正头痛,其含有的三甲胺、甜菜碱及牛磺酸等可镇静安神、抗惊厥、抗血栓及镇痛等。全方中诸药和用共奏疏肝活血、理气补气之功。
偏头痛所表现出来的疼痛是发作性的钝痛,其严重程度可能与患者负面情绪密切相关[25]。研究表明,疼痛和抑郁疾患均与杏仁核之间有不可分割的关系,杏仁核不仅可参与疼痛及抑郁的生理过程,还能调控情绪并记录与储存所发生的情感事件[26]。因此,它参与对疼痛刺激的编码和调节,从而在痛与镇痛中均起重要作用。
现代医学对于偏头痛-抑郁共病疾患的病理机制尚不完全清楚。有研究发现,偏头痛的发病机制与小胶质细胞活化有很大关系。小胶质细胞占据神经胶质细胞的5%-20%,小胶质细胞被激活后,会产生大量的神经递质(脑源性神经营养因子、肿瘤坏死因子、白细胞介素等)提高神经兴奋作用,神经兴奋性增强导致痛觉过敏进而产生偏头痛[27]。Iba1被认为是小胶质细胞激活的标志,它是结合特殊信号传递的信号分子,是一种特异性的钙结合蛋白,可捆绑肌动蛋白活性、参与小胶质细胞的重塑并在激活的小胶质细胞中调控细胞的迁移、膜褶皱及吞噬。RhoA是一种小分子G蛋白,在活性(GTP结合)和非活性(GDP结合)形式之间循环。GTP-RhoA通过与下游Rho蛋白激酶ROCK的相互作用参与调控细胞功能。Rho蛋白激酶ROCK抑制剂可改变小胶质细胞极化、增强小胶质细胞吞噬能力,降低神经病理学疼痛的发生,表明ROCK介导偏头痛的病理作用,但对于RhoA参与偏头痛的发生无明确研究。因此本实验通过硝酸甘油注射液及不同刺激诱导偏头痛—抑郁共病大鼠模型,予以中医药的治疗来研究偏头痛—抑郁共病大鼠行为学及脑组织杏仁核内Iba1及RhoA蛋白含量的变化。
本实验研究结果显示:解郁止痛方能明显改善偏头痛—抑郁共病模型大鼠体质量、旷场实验水平和垂直运动评分、糖水偏好程度,降低强迫游泳不动时间及新奇抑食—潜伏时间,减少偏头痛发作时的挠头、攀笼次数,降低机械痛阈值。偏头痛—抑郁共病模型组大鼠脑组织杏仁核内Iba1及RhoA蛋白表达水平明显升高,表明两者共病可能由发生中枢敏化激活小胶质细胞介导Iba1/RhoA/ROCK信号通路引发,而解郁止痛方能够有效降低本实验模型大鼠脑组织杏仁核内Iba1及RhoA的蛋白表达水平,推测解郁止痛方可能通过抑制Iba1/RhoA/ROCK信号通路激活,减少中枢敏化,从而抑制小胶质细胞活化,减少炎症反应,从而减少偏头痛-抑郁共病的发生。
| [1] |
HUANG Y L, NI N, HONG Y L, et al. Progress in traditional Chinese medicine for the treatment of migraine[J]. The American Journal of Chinese Medicine, 2020, 48(8): 1731-1748. DOI:10.1142/S0192415X2050086X |
| [2] |
GRIBBIN C L, DANI K A, TYAGI A. Chronic migraine: an update on diagnosis and management[J]. Neurology India, 2021, 69(Supplement): S67-S75. |
| [3] |
CHEN Y Q, LIU B Y, GONG W N, et al. Auricular acupuncture for migraine: a protocol for systematic review and meta-analysis[J]. Medicine, 2020, 99(44): e23036. DOI:10.1097/MD.0000000000023036 |
| [4] |
RADAT F. What is the link between migraine and psychiatric disorders? From epidemiology to therapeutics[J]. Revue Neurologique, 2021, 177(7): 821-826. DOI:10.1016/j.neurol.2021.07.007 |
| [5] |
徐燕, 刘冬光, 宁停波, 等. 基于BDNF/TrkB/CREB通路探讨参苓开心颗粒的抗抑郁作用机制[J]. 中国中药杂志, 2023, 48(8): 2184-2192. XU Y, LIU D G, NING T B, et al. Antidepressant mechanism of Shenling Kaixin Granules based on BDNF/TrkB/CREB pathway[J]. China Journal of Chinese Materia Medica, 2023, 48(8): 2184-2192. DOI:10.19540/j.cnki.cjcmm.20221114.402 |
| [6] |
CHEN Y H, WANG H. The association between migraine and depression based on miRNA biomarkers and cohort studies[J]. Current Medicinal Chemistry, 2021, 28(27): 5648-5656. DOI:10.2174/0929867327666201117100026 |
| [7] |
NEUGEBAUER V, MAZZITELLI M, CRAGG B, et al. Amygdala, neuropeptides, and chronic pain-related affective behaviors[J]. Neuropharmacology, 2020, 170(12): 108052. |
| [8] |
LIU H Y, CHOU K H, CHEN W T. Migraine and the hippocampus[J]. Current Pain and Headache Reports, 2018, 22(2): 13. DOI:10.1007/s11916-018-0668-6 |
| [9] |
LITUMA P J, WOO E, O'HARA B F, et al. Altered synaptic connectivity and brain function in mice lacking microglial adapter protein Iba1[J]. Proceedings of the National Academy of Sciences of the United States of America, 2021, 118(46): e2115539118. |
| [10] |
HUTSON T H, DI GIOVANNI S. The translational landscape in spinal cord injury: Focus on neuroplasticity and regeneration[J]. Nature Reviews Neurology, 2019, 15(12): 732-745. DOI:10.1038/s41582-019-0280-3 |
| [11] |
JING F, ZHANG Y X, LONG T, et al. P2Y12 receptor mediates microglial activation via RhoA/ROCK pathway in the trigeminal nucleus caudalis in a mouse model of chronic migraine[J]. Journal of Neuroinflammation, 2019, 16(1): 217. DOI:10.1186/s12974-019-1603-4 |
| [12] |
JIANG L, ZHANG Y X, JING F, et al. P2X7R-mediated autophagic impairment contributes to central sensitization in a chronic migraine model with recurrent nitroglycerin stimulation in mice[J]. Journal of Neuroinflammation, 2021, 18(1): 5. DOI:10.1186/s12974-020-02056-0 |
| [13] |
刘溪, 张慧, 冯思娜, 等. 解郁止痛方对偏头痛-抑郁病模大鼠行为学及c-fos、c-jun基因表达影响[J]. 辽宁中医药大学学报, 2022, 24(10): 25-30, 221. LIU X, ZHANG H, FENG S N, et al. Effect of Jieyu Zhitong Recipe on behavior and expression of c-fos and c-Jun gene in migraine-depression model rats[J]. Journal of Liaoning University of Traditional Chinese Medicine, 2022, 24(10): 25-30, 221. DOI:10.13194/j.issn.1673-842x.2022.10.006 |
| [14] |
HUANG Y J, JIN Y S, YAO S, et al. LncRNA NEAT1 inhibits neuronal apoptosis and induces neuronal viability of depressed rats via microRNA-320-3p/CRHR1 axis[J]. Neurochemical Research, 2022, 25(1): 1-12. |
| [15] |
邵笑笑, 张慧, 申莉铎, 等. 解郁止痛方对偏头痛-抑郁共病模型大鼠行为学及NLRP3和Caspase-1基因表达的影响[J]. 湖南中医药大学学报, 2023, 43(1): 1-8. SHAO X X, ZHANG H, SHEN L D, et al. Effects of Jieyu Zhitong Formula on behaviors and expressions of NLRP3 and Caspase-1 genes in migraine-depression model rats[J]. Journal of Hunan University of Chinese Medicine, 2023, 43(1): 1-8. |
| [16] |
杨晓苏. 偏头痛成第二大致残原因[J]. 江苏卫生保健, 2022, 24(8): 10-11. YANG X S. Migraine is the second leading cause of disability[J]. Jiangsu Journal of Health Care, 2022, 24(8): 10-11. |
| [17] |
田径, 刘朴霖, 刘建民, 等. 张志远分型辨治郁证经验[J]. 中医杂志, 2022, 63(19): 1820-1823. TIAN J, LIU P L, LIU J M, et al. ZHANG Zhiyuan's experience in syndrome differentiation and treatment of constraint syndrome[J]. Journal of Traditional Chinese Medicine, 2022, 63(19): 1820-1823. |
| [18] |
WU S P, WANG N, LI J, et al. Ligustilide ameliorates the permeability of the blood-brain barrier model in vitro during oxygen-glucose deprivation injury through HIF/VEGF pathway[J]. Journal of Cardiovascular Pharmacology, 2019, 73(5): 316-325. DOI:10.1097/FJC.0000000000000664 |
| [19] |
SHI Y N, CHEN M Q, ZHAO Z H, et al. Network pharmacology and molecular docking analyses of mechanisms underlying effects of the Cyperi rhizoma-Chuanxiong rhizoma herb pair on depression[J]. Evidence-Based Complementary and Alternative Medicine: ECAM, 2021, 2021(2): 5704578. |
| [20] |
GAO J, WANG T S, WANG C, et al. Effects of Tianshu capsule on spontaneously hypertensive rats as revealed by 1H-NMR-based metabolic profiling[J]. Frontiers in Pharmacology, 2019, 21(10): 989. |
| [21] |
WEN X H, GU Y C, CHEN B L, et al. Exploring the potential mechanism of Chuanxiong rhizoma treatment for migraine based on systems pharmacology[J]. Evidence-Based Complementary and Alternative Medicine: ECAM, 2021, 2021(4): 2809004. |
| [22] |
WEN L R, JIANG Y M, YANG J L, et al. Structure, bioactivity, and synthesis of methylated flavonoids[J]. Annals of the New York Academy of Sciences, 2017, 1398(1): 120-129. |
| [23] |
LI X Q, SONG Y N, WANG S J, et al. Saikosaponins: A review of pharmacological effects[J]. Journal of Asian Natural Products Research, 2018, 20(5): 399-411. |
| [24] |
XIE J H, JIN M L, MORRIS G A, et al. Advances on bioactive polysaccharides from medicinal plants[J]. Critical Reviews in Food Science and Nutrition, 2016, 56(Suppl 1): S60-S84. |
| [25] |
Gandhi W, Rosenek NR, Harrison R, 等. 杏仁核的功能连接与情绪性疼痛易化的个体差异相关[J]. 中国疼痛医学杂志, 2020, 26(12): 891-893. GANDHI W, NR R, HARRISON R, et al. Functional connectivity of the amygdala is linked to individual differences in emotional pain facilitation[J]. Chinese Journal of Pain Medicine, 2020, 26(12): 891-893. |
| [26] |
NEUGEBAUER V. Amygdala physiology in pain[J]. Handbook of Behavioral Neuroscience, 2020, 26(3): 101-113. |
| [27] |
CHEN G, ZHANG Y Q, QADRI Y J, et al. Microglia in pain: Detrimental and protective roles in pathogenesis and resolution of pain[J]. Neuron, 2018, 100(6): 1292-1311. |
 2023, Vol. 42
2023, Vol. 42