文章信息
- 张娜贤, 刘柳, 李刚, 刘琳瑞, 李元颖
- ZHANG Naxian, LIU Liu, LI Gang, LIU Linrui, LI Yuanying
- 芹菜素7-O-葡萄糖苷对抗TRAIL乳腺癌细胞凋亡的作用机制研究
- Action mechanism of apigenin 7-O-glucoside on the apoptosis of anti-TRAIL breast cancer cells
- 天津中医药大学学报, 2023, 42(6): 761-768
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(6): 761-768
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.06.13
-
文章历史
收稿日期: 2023-08-10
乳腺癌是上皮细胞增殖失控所致恶性病变,位居女性恶性肿瘤首位,早期症状表现为乳房肿块和腋窝淋巴结肿大,晚期可出现远处转移[1]。中国乳腺癌每年新增约30万人,目前乳腺癌主要以精准化综合性治疗为主,根据患者状态给予局部和全身性治疗[2-3]。肿瘤坏死因子相关凋亡诱导配体(TRAIL)是具有诱导多种肿瘤细胞凋亡的内源性蛋白,但对正常细胞的毒性很小,被认为是一种潜在、较安全的抗癌剂,在恶性肿瘤治疗和预防中有较好的运用前景[4-5],但仍有部分恶性肿瘤细胞对TRAIL所致细胞凋亡存在抗性。芹菜素7-O-葡萄糖苷(AGL)是具有抗炎、抗癌作用的黄酮类化合物[6],可抑制宫颈癌细胞迁移[7],但AGL在乳腺癌作用机制尚不清楚。本研究旨在探讨AGL对抗TRAIL诱导凋亡乳腺癌细胞的影响,希望为恢复抗TRAIL乳腺癌细胞的TRAIL敏感性提供实验依据。
1 材料与方法 1.1 材料 1.1.1 细胞人正常乳腺细胞MCF-10A(HZNC044,上海沪震实业有限公司),人乳腺癌细胞MB231、MCF-7(HT-X1647、HT-X1646,深圳市豪地华拓生物科技有限公司)。
1.1.2 实验动物SPF级BALB/c裸鼠,雌性,72只,3~4周龄,体质量(13±1)g,购自南方医科大学[许可证号,SCXK(粤)2016-0041],饲养房环境为温度20~25 ℃,空气湿度50%~55%,人工光照12 h/d,饮水自由,进食自由。
1.1.3 试剂AGL(ZT-23726,上海甄准生物科技有限公司,纯度 > 98%),N-乙酰基半胱氨酸(NAC)(A7250,美国SIGMA公司,纯度≥99%),Cas-3抑制剂z-DEVD-fmk、Cas-9抑制剂Z-LEHD-FMK(abs812077、abs813893,爱必信上海生物科技有限公司,纯度:98%),Annexin V-FITC/PI细胞凋亡试剂盒(40302ES20,上海翊圣生物科技有限公司),CCK8试剂盒(40203ES76,上海翊圣生物科技有限公司),兔多抗Cleaved-Cas-9、Cleaved-Cas-3、p53上调凋亡调制物(PUMA)抗体和兔抗人p53、Cleaved PARP-1、PARP-1抗体(ATA27024、ATA25877、ATA36082、ATA34929、ATA27078、ATA35118,武汉益普生物科技有限公司),ECL Kit(ECL-0013,美北京鼎国昌盛生物技术有限责任公司),超氧化物歧化酶(SOD)Elisa试剂盒(R-1298,上海广锐生物科技有限公司),丙二醛(MDA)Elisa试剂盒(CK-E10376,武汉益普生物科技有限公司)。
1.1.4 仪器高速冷冻离心机(Avanti JXN-26,Beckman Coulter),荧光显微镜(DMi8-电动,奥地利徕卡),共聚焦显微镜(STELLARIS,德国徕卡公司)。
1.2 细胞培养MCF-10A置于DMEM/F12培养基(5%马血清、10 μg/mL胰岛素、20 ng/mL表皮生长因子、100 ng/mL霍乱毒素、0.5 μg/mL氢化可的松)37℃、5% CO2培养,MCF-7细胞置于DMEM(10 %胎牛血清、1%丙酮酸钠)37℃、5% CO2培养,MB231细胞置于含10% L15培养基(10 %胎牛血清)37 ℃、无CO2培养[8]。当各组细胞生长至80%~90%时,进行传代培养,选取第3代细胞用于后续实验。
1.3 体外实验 1.3.1 CCK-8检测细胞活力取对数生长期的MCF-10A、MCF-7、MB231细胞种于96孔培养板(1×105个/孔),同1.2培养条件培养至过夜,待贴壁后更换培养基,加入不同作用试剂,使其最终浓度为TRAIL(0、5、10、20、50、100、200 ng/mL)、AGL(0、10、20、40、80 μmol/L)、NAC(4 mmol/L)、z-DEVD-fmk(25 μmol/L)[9]、Z-LEHD-FMK(20 μmol/L)[10],继续培养24 h后,加入CCK-8(20 μL/孔),避光37 ℃孵育3 h,450 nm波长检测吸光度值,细胞存活=(实验组吸光度值/对照组吸光度值)×100%。设置不做任何处理的细胞为Control组,每种浓度分别设置5个复孔,取均值作为该组结果。实验重复3次。
1.3.2 针对细胞凋亡的检测取对数生长期MCF-10A、MCF-7、MB231细胞接种于6孔培养板(1.5×105个/孔),药物作用前培养方式同1.3.1,将细胞按如下分组:MCF-10A(20 μmol/L AGL+50 ng/mL TRAIL)和MCF-7(20 μmol/L AGL+50 ng/mL TRAIL)、MCF-7[TRAIL(0、100 ng/mL)]和MB231[TRAIL(0、100 ng/mL)],给予药物干预,培养24 h,收集细胞于3 000 r/min离心5 min,PBS洗涤2遍,弃上清液,300 μL 1×Binding Buffer缓冲液重悬细胞,加入5 μL Annex-inV/FITC和10 μL PI混合,室温避光孵育20 min,流式细胞仪上样,自带软件分析计算细胞凋亡率。复孔设置和实验次数同1.3.1。
1.3.3 蛋白免疫印迹(Western-blot)检测蛋白水平收集1.3.1中的细胞并提取总蛋白,Bradford调整各组提取蛋白浓度一致,经SDS-PAGE凝胶电泳、电转膜至PVDF膜,密封2 h,加入兔抗人Cleaved-Cas-9、Cleaved-Cas-3、p53、PUMA、Cleaved PARP-1、PARP-1、β-actin抗体(1∶500)4 ℃孵育过夜,TBST漂洗40 min,加入HRP标记二抗(1∶500)孵育1 h,TBST漂洗40 min,ECL显影,Image Lab软件分析目标蛋白相对灰度值。实验重复3次。
1.3.4 ROS荧光检测取对数生长期MCF-10A细胞接种于Petri培养皿(1.0×1010个),分别设置H2O2组(50 μmol/L)、TRAIL组(0、50 ng/mL)、AGL组(0、10、20 μmol/L)、NAC组(4 mmol/L)、50 ng/mL TRAIL+20 μmol/L AGL组、50 ng/mL TRAIL+20 μmol/L AGL+4 mmol/L NAC组,培养方式同1.3.1,培养24 h,去培养基,PBS漂洗2次,加入10 μmol/L DCFDA无血清培养液2 mL,孵育20 min,弃培养基,PBS漂洗2次,加入1 mL PBS,用于共聚焦显微镜扫描检测,λex=495 nm,λem=525 nm,ROS荧光信号为绿色。实验重复3次。
1.3.5 MDA水平和SOD活性检测收集1.3.4中H2O2组(50 μmol/L)、AGL组(0、10、20 μmol/L)MCF-10A细胞,3 500 r/min离心10 min,取上清液备用,采用Elisa检测MDA水平和SOD活性。实验重复3次。
1.4 体内实验 1.4.1 移植瘤动物模型建立将72只雌性BALB/c裸鼠随机均分为Control组和AGL+TRAIL组,将MCF-10A细胞皮下注射(5.0×107个)裸鼠右前肢腋,次日,AGL+TRAIL组腹腔注射AGL[25 mg/(kg·d)][11]和200 μL TRAIL(1 μg/mL)[12],Control组给予等体积生理盐水,每隔5 d,各组随机选取5只小鼠分离移植瘤并测量肿瘤体积变化。30 d后,麻醉处死所有小鼠并分离移植瘤,测定移植瘤重量,4%中性甲醛溶液固定移植瘤,用于TUNEL检测和p53、PUMA免疫组化。
1.4.2 TUNEL检测移植瘤常规石蜡包埋、切片(4 μm)、脱蜡,蛋白酶K修复20 min,3% H2O2室温5 min,PBS洗2次,TdT酶于37 ℃作用60 min,PBS洗3次,氧化物酶标记的链酶卵白素工作溶液作用30 min,PBS洗4次,0.05% DAB显色4 min,蒸馏水洗4次,苏木精复染10 min,蒸馏水洗3次,脱水,透明,封片。细胞核棕黄色或棕褐色颗粒为凋亡阳性细胞,每张片子选取5个视野,记录阳性细胞数,计算细胞凋亡率=(阳性细胞数目)/(总细胞数目)×100%。
1.4.3 免疫组化移植瘤固定至切片步骤同1.4.2,PBS溶液漂洗、3%H2O2与甲醇混合液浸泡10 min,超纯水漂洗、抗原修复、PBS漂洗5 min、加入p53、PUMA一抗37 ℃反应2h、PBS漂洗5 min、加入二抗37 ℃反应40 min、PBS漂洗5 min、DAB室温显色30 min,镜检观察有棕黄色颗粒出现时自来水终止,苏木素复染30 s,后续步骤同1.4.2。
1.5 统计学分析使用SPSS 22.0软件进行数据统计分析,GraphPad Prism 6.0软件绘制柱状图,符合正态分布且方差剂性数据均以均值±标准差(x±s)表示,两组间比较采用t检验,P < 0.05表示存在统计差异。
2 结果 2.1 TRAIL对乳腺癌细胞存活及凋亡的影响为筛选出抗TRAIL乳腺癌细胞株,对MB231细胞株、MCF7细胞株进行TRAIL浓度梯度实验,采用CCK-8法、流式法检测细胞存活率和细胞凋亡率,结果显示TRAIL作用浓度为50、100、200 ng/mL时,MB231细胞存活率显著降低且Cleaved PARP-1水平显著升高(P < 0.05),MCF7细胞存活率变化无统计差异且无Cleaved PARP-1表达(P > 0.05)(图 1A、B);TRAIL(100 ng/mL)作用下,TMCF7细胞细胞凋亡率无明显变化(P > 0.05),MB231细胞凋亡率升高(P < 0.05)(图 1C、D),说明MCF7细胞对TRAIL作用不敏感,对TRAIL存在抗性。
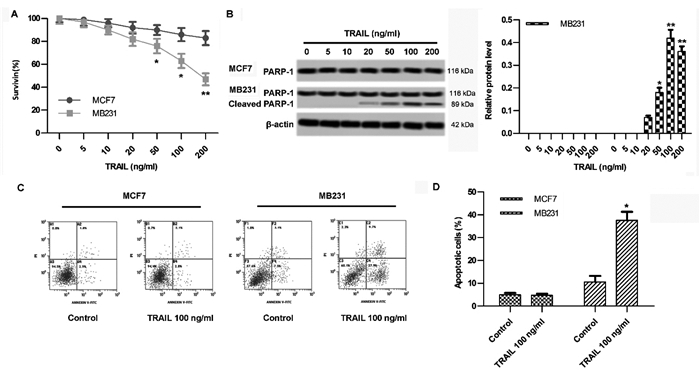
|
| 注:A,乳腺癌细胞的生存曲线;B,Cleaved PARP-1表达水平;C,MCF7、MB231细胞凋亡(流式细胞仪检测);D,MCF7、MB231细胞凋亡率。与Contro(l 0 ng/mL TRAIL)比较,*P < 0.05,**P < 0.01。 图 1 TRAIL对乳腺癌细胞存活及凋亡的影响 |
为探究AGL联合TRAIL作用对抗TRAIL性MCF7细胞凋亡的影响,进行AGL浓度梯度处理,筛选出无细胞毒性AGL浓度与TRAIL联合作用MCF7细胞,观察细胞凋亡和Cleaved PARP-1蛋白表达情况,结果显示AGL作用浓度为40、80 μmol/L时,MCF7细胞存活率显著低于Control(P < 0.05);TRAIL(50 ng/mL)增加AGL(20、40 μmol/L)处理时,MCF7细胞存活率显著低于TRAIL(50 ng/mL)处理(P<0.05),Cleaved PARP-1水平显著高于TRAIL(50 ng/mL)处理(P < 0.05)(图 2A-C)。AGL(20 μmol/L)+TRAIL(50 ng/mL)处理时,MCF7细胞凋亡率显著高于AGL(20 μmol/L)处理(P < 0.05),而MCF-10A细胞与AGL(20 μmol/L)处理差异无统计学意义(P > 0.05)(图 2D、E),说明AGL联合TRAIL可能通过提高Cleaved PARP-1蛋白表达促进MCF7细胞凋亡。
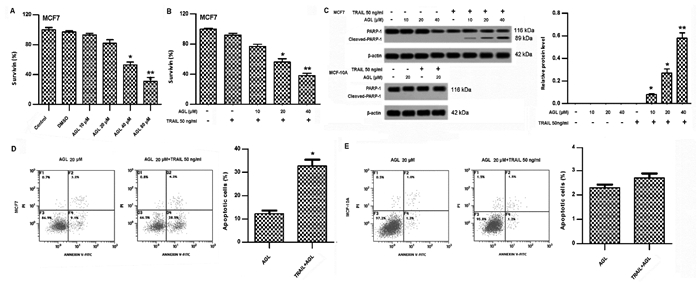
|
| 注:A,MCF7细胞存活率;与Contro(l 0 μM AG)比较,*P < 0.05,**P < 0.01。B,MCF7细胞存活率;C,Cleaved PARP-1表达水平;与50 ng/mL TRAIL比较,*P < 0.05,**P < 0.01。D,MCF7细胞凋亡;E,MCF-10A细胞凋亡,与AGL(0 μmol/L)比较,*P < 0.05。 图 2 AGL和TRAIL协同促进MCF7细胞凋亡 |
在AGL联合TRAIL处理基础上增加Caspases信号级联相关蛋白酶抑制剂,为探究AGL联合TRAIL作用促进MCF7细胞凋亡的作用机制,结果显示TRAIL(50 ng/mL)、AGL(20 μmol/L)作用24 h时,MCF7细胞均未检测出Cleaved PARP-1、Cleaved-Cas-3、Cleaved-Cas-9表达;TRAIL(50 ng/mL)+AGL(20 μmol/L)作用8 h、16 h和24 h时,MCF7细胞Cleaved PARP-1、Cleaved-Cas-3、Cleaved-Cas-9水平显著高于Control(P < 0.05);TRAIL(50 ng/mL)+AGL(20 μmol/L)作用4 h时,MCF7细胞Cleaved PARP-1水平显著高于Control(P < 0.05)(图 3A)。TRAIL(50 ng/mL)分别联合AGL(10、20、40 μmol/L)作用24 h时,MCF7细胞Cleaved-Cas-3、Cleaved-Cas-9水平显著高于TRAIL(50 ng/mL)处理(P < 0.05)(图 3B)。TRAIL(50 ng/mL)+AGL(20 μmol/L)作用24 h时,MCF7细胞存活率显著低于Control(P < 0.01),而Cleaved PARP-1相对蛋白水平显著高于Control(P<0.01);TRAIL(50 ng/mL)+AGL(20 μmol/L)+Cas-3 inhibitor、TRAIL(50 ng/mL)+AGL(20 μmol/L)+Cas-9 inhibitor作用24 h时,MCF7细胞存活率与Control比较无统计差异(P > 0.05),且均未检测出Cleaved PARP-1表达(图 3C、D),说明AGL联合TRAIL处理可能通过促进Cleaved PARP-1、Cleaved-Cas-3、Cleaved-Cas-9蛋白表达激活Caspases信号级联反应,从而降低MCF7细胞存活率。
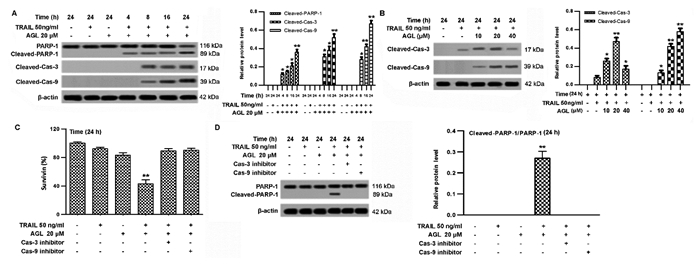
|
| 注:A. MCF7细胞Cleaved PARP-1、Cleaved-Cas-3、Cleaved-Cas-9蛋白表达;与AGL(0 μmol/L)+TRAIL(0 ng/mL)比较,*P < 0.05,**P < 0.01;B. MCF7细胞Cleaved-Cas-3、Cleaved-Cas-9蛋白表达;与TRAIL(50 ng/mL)比较,*P < 0.05,**P < 0.01;C. MCF7细胞存活率;D,MCF7细胞Cleaved PARP-1蛋白表达;与AGL(0 μmol/L)+TRAIL(0 ng/mL)比较,**P < 0.01。 图 3 AGL联合TRAIL处理对Caspases信号级联的影响 |
进行AGL、TRAIL、AGL+TRAIL、H2O2、NAC、AGL+TRAIL+NAC处理MCF7细胞为探究AGL联合TRAIL处理促进MCF7凋亡是否与细胞活性氧产生有关,结果显示AGL(10、20 μmol/L)、H2O2(50 μmol/L)处理下的MCF7细胞ROS(+)细胞数、MDA水平显著高于Control(P < 0.05),而SOD活性显著低于Control(P < 0.05)(图 4A-C)。TRAIL(50 ng/mL)、AGL(20 μmol/L)处理下的MCF7细胞ROS(+)细胞数显著高于Control(P < 0.05),而NAC(4 mmol/L)处理下的MCF7细胞ROS(+)细胞数显著低于Control(P < 0.05);TRAIL(50 ng/mL)+AGL(20 μmol/L)处理下MCF7细胞ROS(+)细胞数、p53、PUMA、Cleaved PARP-1相对蛋白水平显著高于TRAIL(50 ng/mL)处理(P < 0.05),而细胞存活率显著低于TRAIL(50 ng/mL)处理(P < 0.05);TRAIL(50 ng/mL)+AGL(20 μmol/L)+NAC(4 mmol/L)处理下MCF7细胞ROS(+)细胞数、p53、PUMA、Cleaved PARP-1相对蛋白水平显著低于TRAIL(50 ng/mL)+AGL(20 μmol/L)处理(P<0.05)(图 4D-F),说明AGL联合TRAIL可能是通过增加MCF7细胞活性氧产生和p53、PUMA、Cleaved PARP-1表达上调,加重细胞氧化应激损伤,从而促进MCF7细胞死亡。
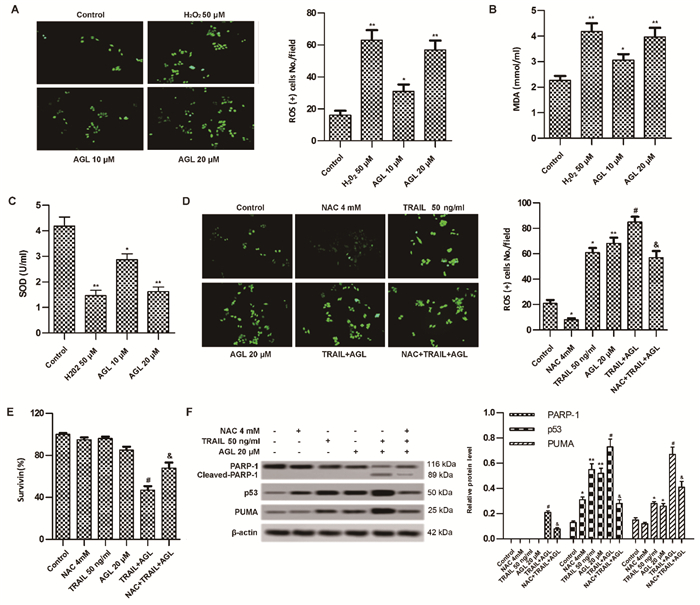
|
| 注:A. MCF7细胞ROS水平(激光扫描共焦显微镜检测,×400);B. MCF7细胞MDA水平;C. MCF7细胞SOD活性;D. MCF7细胞ROS水平(激光扫描共焦显微镜检测,×400);E. MCF7细胞存活率;F. MCF7细胞中p53、PUMA、Cleaved PARP-1蛋白表达。与Control比较,*P < 0.05,**P< 0.01;与TRAIL(50 ng/mL)比较,#P < 0.05;与TRAIL(50 ng/mL)+AGL(20 μmol/L)比较,&P < 0.05。 图 4 AGL对MCF7细胞活性氧产生的影响 |
为探究AGL联合TRAI对体内肿瘤生长的影响,建立裸鼠移植瘤模型,结果显示AGL+TRAIL组小鼠乳腺癌原位移植瘤重量、体积、p53阳性率、PUMA3阳性率均显著低于Control(P < 0.05),肿瘤组织细胞凋亡率显著高于Control(P < 0.05)(图 5),说明AGL联合TRAIL处理可抑制小鼠乳腺癌原位移植瘤生长。
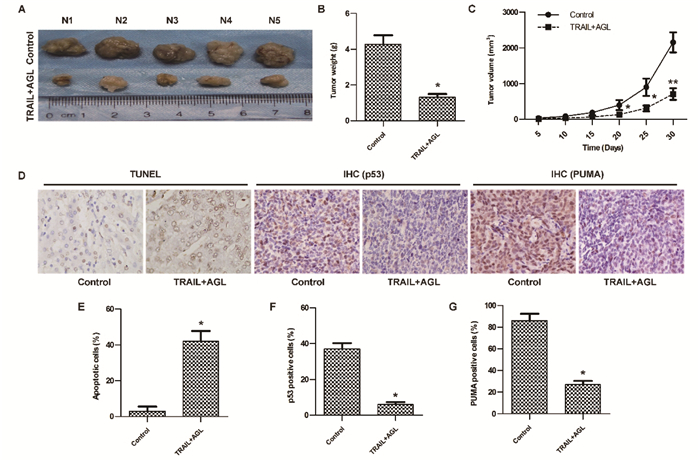
|
| 注:A.移植瘤图像采集;B.移植瘤质量;C.移植瘤体积;D.移植瘤凋亡(TUNEL检测,×400),p53和PUMA3表达(免疫组化,×400);E.移植瘤凋亡率;F. p53阳性率;G. PUMA3阳性率。与Control比较,*P < 0.05,**P < 0.01。 图 5 AGL联合TRAIL对小鼠乳腺癌原位移植瘤生长的影响 |
TRAIL是由281AA编码形成的Ⅱ型跨膜蛋白,可通过与死亡受体结合选择性诱导肿瘤细胞凋亡[13],已有研究表明:多种肿瘤细胞对TRAIL呈现出抗性,其作用机制尚未完全阐明,但普遍认为与死亡受体、线粒体、PI3/AKt信号通路和MAP激酶通路等有关。本研究结果发现人MCF7细胞和MB231细胞对TRAIL敏感性存在明显差异,MB231细胞在TRAI适宜浓度处理下细胞存活率显著降低,而细胞凋亡率和Cleaved PARP-1水平明显升高,但MCF7细胞无上述相似趋势,说明MCF7细胞对TRAIL作用存在抗性。
克服TRAIL耐药性肿瘤细胞重点是如何恢复肿瘤细胞对TRAIL的敏感性,单一使用TRAIL或其他致敏剂对肿瘤细胞的灭杀效果较低,而TRAIL联合致敏剂使用可增加其对肿瘤细胞的灭杀效果,例如多酚致敏剂。AGL是一种稳定的天然黄酮物质,相比于其他芹菜素物质具有更好的溶解性,还能够抑制癌细胞、真菌生长,在细胞内、外均可促进活性氧生成,诱导细胞质膜损伤。本研究发现AGL一定浓度时可以显著抑制MCF7细胞生长,并且以非细胞毒性剂量AGL(20 μmol/L)联合TRAIL(50 ng/mL)处理可以显著提高MCF7细胞凋亡率和Cleaved PARP-1水平,但是对正常乳腺上皮细胞MCF-10A无毒性影响。有研究认为AGL比芹菜素具有更强的生物活性,在低浓度时就能促进结肠癌HCT116细胞内出现染色质浓缩、凋亡小体形成和凋亡相关基因表达,具有细胞毒性作用。本研究结果趋势也和上述前人研究趋势相似,说明AGL(20 μmol/L)联合TRAIL(50 ng/mL)能协同促进MCF7细胞凋亡。
本研究发现AGL联合TRAIL处理可促进MCF7细胞Cleaved PARP-1、Cleaved-Cas-3、Cleaved-Cas-9升高,而在两者联合作用的基础上增加Cas-3抑制剂、Cas-9抑制剂能够逆转Cleaved PARP-1水平上升。Caspases参与细胞生长、分化、凋亡等过程,一般情况下Caspases是以非活性酶原分布在细胞质中,接收凋亡信号刺激后,形成催化活性的Caspases,Cas-3、Cas-9在Caspases级联细胞凋亡反应中占据重要作用。PARP-1是细胞核酶,能够催化聚二磷酸腺苷核糖化,参与DNA损伤及修复、转录调控和细胞死亡等过程。细胞凋亡主要有Caspases依赖途径和Caspases非依赖途径,Caspases可裂解PARP-1,PARP-1裂解功能丧失是细胞凋亡顺利进展的保证,本研究结果说明AGL联合TRAIL处理促进MCF7细胞凋亡与增强Caspases信号级联反应有关。
本研究发现AGL联合TRAIL处理能促进MCF7细胞内ROS水平和p53、PUMA蛋白表达上调,而在此基础上增加NAC可降低ROS水平和p53、PUMA蛋白表达。ROS是细胞的代谢产物,可在线粒体电子传递链中产生,线粒体ROS水平异常升高可诱导线粒体膜出现去极化,改变线粒体膜结构稳定性,促凋亡因子进入胞基质诱导凋亡,线粒体介导的细胞凋亡途径也属于Caspases依赖途径之一。p53是细胞凋亡的重要调节因子,当细胞受致癌因子刺激时,p53能抑制细胞周期运行并参与细胞凋亡进程。PUMA能够被p53快速诱导表达,其翻译蛋白是Bcl-2同源家族成员,可解除Bcl-2的抗凋亡作用,促进细胞凋亡。本研究结果说明AGL联合TRAIL促进MCF7细胞Caspases信号级联反应可能与增强细胞内ROS含量和p53、PUMA蛋白表达有关。本研究还发现AGL联合TRAIL处理可抑制小鼠体内移植瘤生长、促进移植瘤组织细胞凋亡,但没有提高肿瘤组织p53、PUMA表达,可能是因为体内自身存在一套完善的免疫体系,参与移植瘤的生长调节过程,其中的具体作用机理还需要进一步探究。
综上所述,MCF7细胞对TRAIL诱导的细胞凋亡存在抗性,在TRAIL处理基础上增加非细胞致毒剂量AGL可提高细胞内ROS水平和MDA含量,加重氧化应激损伤,还能激活Caspase级联反应,加快PARP-1裂解,上调p53、PUMA表达,降低MCF7细胞对TRAIL的抗性,从而促进MCF7细胞凋亡。虽然体内研究也证实AGL联合TRAIL处理可降低移植瘤细胞生长,但其作用机制还需深入研究。
| [1] |
HANKER A B, SUDHAN D R, ARTEAGA C L. Overcoming endocrine resistance in breast cancer[J]. Cancer Cell, 2020, 37(4): 496-513. DOI:10.1016/j.ccell.2020.03.009 |
| [2] |
LI T, MELLO-THOMS C, BRENNAN P C. Descriptive epidemiology of breast cancer in China: Incidence, mortality, survival and prevalence[J]. Breast Cancer Research and Treatment, 2016, 159(3): 395-406. DOI:10.1007/s10549-016-3947-0 |
| [3] |
BRITT K L, CUZICK J, PHILLIPS K A. Key steps for effective breast cancer prevention[J]. Nature Reviews Cancer, 2020, 20(8): 417-436. DOI:10.1038/s41568-020-0266-x |
| [4] |
GOTO M, HIRATA A, MURAKAMI M, et al. Trimer form of tumor necrosis factor-related apoptosis inducing ligand induces apoptosis in canine cell lines derived from mammary tumors[J]. The Journal of Veterinary Medical Science, 2019, 81(12): 1791-1803. DOI:10.1292/jvms.19-0469 |
| [5] |
GUIHO R, BITEAU K, GRISENDI G, et al. In vitro and in vivo discrepancy in inducing apoptosis by mesenchymal stromal cells delivering membrane-bound tumor necrosis factor-related apoptosis inducing ligand in osteosarcoma pre-clinical models[J]. Cytotherapy, 2018, 20(8): 1037-1045. DOI:10.1016/j.jcyt.2018.06.013 |
| [6] |
WANG W, YUE R F, JIN Z, et al. Efficiency comparison of apigenin-7-O-glucoside and trolox in antioxidative stress and anti-inflammatory properties[J]. The Journal of Pharmacy and Pharmacology, 2020, 72(11): 1645-1656. DOI:10.1111/jphp.13347 |
| [7] |
LIU M M, MA R H, NI Z J, et al. Apigenin 7-O-glucoside promotes cell apoptosis through the PTEN/PI3K/AKT pathway and inhibits cell migration in cervical cancer HeLa cells[J]. Food and Chemical Toxicology, 2020, 146(2): 111843. |
| [8] |
曹让娟, 李凯, 邢琬莹, 等. Disabled-1在人乳腺癌细胞中的表达及其对细胞周期的影响[J]. 吉林大学学报(医学版), 2016, 42(5): 932-936. CAO R J, LI K, XING W Y, et al. Expression of Disabled-1 in human breast cancer cells and its role in cell cycle[J]. Journal of Jilin University(Medicine Edition), 2016, 42(5): 932-936. |
| [9] |
王超, 蔡平, 周陈西, 等. Caspase-3抑制剂联合葛根素对颈椎间盘纤维环细胞增殖活力及磷酸化信号转导与转录因子表达的影响[J]. 中国老年学杂志, 2018, 38(2): 307-310. WANG C, CAI P, ZHOU C X, et al. Effects of Caspase-3 inhibitor combined with puerarin on proliferation activity, phosphorylation signal transduction and transcription factor expression of cervical disc annulus fibrosus cells[J]. Chinese Journal of Gerontology, 2018, 38(2): 307-310. DOI:10.3969/j.issn.1005-9202.2018.02.021 |
| [10] |
OZOREN N, KIM K, BURNS T F, et al. The caspase 9 inhibitor Z-LEHD-FMK protects human liver cells while permitting death of cancer cells exposed to tumor necrosis factor-related apoptosis-inducing ligand[J]. Cancer Research, 2000, 60(22): 6259-6265. |
| [11] |
李卫林, 南存金, 王怡君, 等. 芹菜素对人前列腺癌裸鼠移植瘤的抑制作用[J]. 中华实验外科杂志, 2011, 28(12): 2049-2051. LI W L, NAN C J, WANG Y J, et al. Inhibitory effect of apigenin on the growth of human prostate cancer PC-3 cells transplanted tumor in nude mice[J]. Chinese Journal of Experimental Surgery, 2011, 28(12): 2049-2051. |
| [12] |
刘培淑, 白琴, 侯萍, 等. TRAIL对3AO裸鼠移植瘤治疗作用的实验研究[J]. 现代妇产科进展, 2004, 13(2): 114-116, 119. LIU P S, BAI Q, HOU P, et al. Experimental study on the treatment action of TNF-related apoptosis-inducing ligant on nude mice transplation tumor in vivo[J]. Current Advances in Obstetrics and Gynecology, 2004, 13(2): 114-116, 119. |
| [13] |
CHEN Y M, XU Y J, ZHU K S, et al. Tumor necrosis factor-related apoptosis-inducing ligand modulates angiogenesis and apoptosis to inhibit non-small cell lung carcinoma tumor growth in mice[J]. The Journal of International Medical Research, 2019, 47(7): 3243-3252. |
 2023, Vol. 42
2023, Vol. 42


