文章信息
- 牛潇菲, 张畅, 李小江
- NIU Xiaofei, ZHANG Chang, LI Xiaojiang
- 基于网络药理学的消岩汤治疗胃癌机制探讨
- Mechanism of Xiaoyan Decoction in treating gastric cancer based on network pharmacology
- 天津中医药大学学报, 2023, 42(6): 769-779
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(6): 769-779
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.06.14
-
文章历史
收稿日期: 2023-08-02
2. 平煤神马集团总医院, 平顶山 467000;
3. 天津中医药大学第一附属医院, 天津 300381;
4. 国家中医针灸临床医学研究中心, 天津 300381
2. General Hospital of Pingmei Shenma Group, Pingdingshan 467000, China;
3. First Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300381, China;
4. National Clinical Research Center for Chinese Medicine Acupuncture and Moxibustion, Tianjin 300381, China
胃癌是一种常见的消化系统肿瘤,据世界卫生组织国际癌症研究机构发布的全球最新癌症负担数据预估,2020年全球胃癌新增人数达109万,位居第5位,死亡人数达77万,位居第4位[1]。2020年中国胃癌新发病例47.8万例,占全球胃癌发病的43.9%;胃癌死亡病例37.4万例,占全球胃癌死亡的48.6%[1]。无论是在全球范围,还是在中国,胃癌患者的发病率和死亡率均居于所有癌种的前列。由于胃癌早期症状不明显,中国90%的胃癌患者被发现时已是进展期,错过了最佳诊疗时机,一定程度上加大了胃癌的治疗难度。近几年来,随着医疗水平的提高和相关药物的研发,胃癌的西医治疗已从手术、放疗、化疗时代逐步走向免疫、靶向精准医疗时代,一定程度上延长了患者的生存时间,但胃癌患者的整体预后仍未得到明显改善,总体生存率仍未有明显提高,如何突破现有的治疗瓶颈,改善胃癌患者的生存预后是临床迫切要解决的难题。
中医药在改善胃癌患者症状、延长患者生存期等方面具有独特的优势。消岩汤作为天津中医药大学第一附属医院的院内制剂,已应用于临床治疗10余年,此方以黄芪、太子参为君药培补正气,姜黄、郁金为臣药行气散结、活血祛瘀,白花蛇舌草、夏枯草、生牡蛎为佐药清热解毒、软坚散结,共奏扶正抗癌之效[2]。临床研究数据[2-8]表明:消岩汤具有提高患者免疫力、延缓肿瘤进展、提高患者生存质量等疗效。诸多临床案例[9]显示此方可有效改善胃癌患者的预后,使得更多的胃癌患者从中获益。现代药理学研究[10-16]表明,消岩汤水煎液可抑制多种肿瘤细胞的增殖,促进肿瘤细胞凋亡,并可有效逆转肺癌细胞的顺铂耐药。但中药复方成分复杂、靶点众多,其具体的有效成分及作用机制尚不明确,本研究利用网络药理学方法全面阐述了消岩汤治疗胃癌的作用机制,为消岩汤治疗胃癌提供理论支撑,并为其进一步的深入研究提供参考。
1 资料与方法 1.1 消岩汤化合物筛选运用中药系统药理学数据库与分析平台(TCMSP)分别检索消岩汤的组成药物:黄芪、郁金、姜黄、白花蛇舌草、太子参、夏枯草,获取其对应的化合物,并以OB≥30%和DL≥0.18作为筛选条件进行筛选,其中OB代表药物口服利用率,DL代表类药性。运用中医药综合数据库(TCMID)和BATMAN-TCM(a Bioinformatics Analysis Tool for Molecular mechANism of Traditional Chinese Medicine)数据库检索TCMSP未收录的牡蛎的化学成分。
1.2 消岩汤药物靶点筛选运用中药系统药理学数据库与分析平台(TCMSP)查找与所得化合物相对应的蛋白靶点,利用Uniprot查询蛋白靶点所对应的基因名称;运用BATMAN-TCM数据库对TCMSP未收录的化合物进行靶点查询,并汇总整理。
1.3 胃癌靶点筛选分别利用DrugBank、GeneCards(设置Relevance score≥9.81)、OMIM数据库检索胃癌对应的疾病基因,并对3个数据库的检索结果进行合并,去除重复和假阳性的靶点基因。
1.4 药物-化合物-交集靶点网络构建获取药物靶点基因和胃癌靶点基因的交集,并利用交集基因对化合物进行反向筛选,运用Cytoscape3.7.2软件绘制药物-活性成分-交集靶点网络图。
1.5 蛋白相互作用网络构建将获得的交集靶点基因输入String数据分析平台(https://string-db.org)进行数据分析,置信度设置为≥0.900,隐藏游离节点,构建蛋白相互作用(PPI)网络,运用Cytoscape3.7.2软件绘制相关图谱,并运用MCODE插件对PPI网络进行Cluster模块分析。
1.6 GO富集分析和KEGG富集分析运用Metascape数据库对交集靶点基因进行KEGG富集分析及GO富集分析,设定物种为人(Homo sapiens),分别选择生物过程(Biological Processes)、分子功能(Molecular Functions)、细胞组成(Cellular Components)、KEGG通路(KEGG Pathway)进行富集分析,并绘制水平柱状图及气泡图。
1.7 生存分析利用Kaplan-Meier Plotter数据库(http://kmplot.com/analysis/index.php?p=service)探索关键基因靶点对胃癌患者OS的影响,绘制相关基因高低表达的生存曲线,以评估每个基因靶点的预后意义。
2 结果 2.1 活性成分筛选结果利用TCMSP数据库分别收集消岩汤中活性成分的基本信息,以OB≥30%和DL≥0.18为筛选条件,共得到消岩汤活性成分64个,其中:黄芪20个、白花蛇舌草7个、太子参8个、夏枯草11个、郁金15个、姜黄3个;利用TCMID数据库和BATMAN-TCM数据库收集牡蛎的活性成分,获得活性成分10个。剔除重复的活性成分及未找到对应靶点的活性成分,最终获得消岩汤活性成分41个,表 1列出了符合条件的消岩汤活性成分的基本信息。
通过TCMSP数据平台及BATMAN-TCM数据库对消岩汤药物组成中的活性成分所对应的蛋白靶点进行搜集整理,并利用UniProt数据库将其转换为对应的人类基因名称,共得到266个靶点基因。通过检索DrugBank、GeneCards(设置Relevance score≥9.81)、OMIM数据库,合并去重后共获得胃癌靶基因1163个。将消岩汤药物靶基因与胃癌靶基因进行映射,得到交集靶基因共116个(见图 1)。
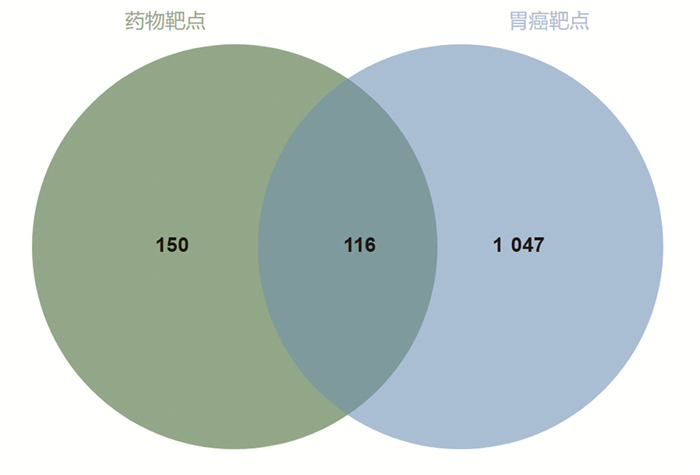
|
| 图 1 消岩汤组方药物与疾病交集靶点 |
利用Cytoscape3.7.2软件绘制消岩汤治疗胃癌的药物—活性成分—交集靶点网络(见图 2),其中黄色菱形代表消岩汤药物组成,蓝色矩形代表交集靶点所对应的活性成分,紫色椭圆形代表消岩汤治疗胃癌的交集靶点。

|
| 图 2 消岩汤药物—活性成分—交集靶点网络 |
将消岩汤治疗胃癌的交集靶点导入String数据库,进行数据分析及PPI网络构建,并运用Cytoscape 3.7.2软件绘制蛋白相互作用网络图谱,设置节点大小与颜色以反映Degree值,设置连线粗细与颜色以反映Combine score值,最终得到图 3。图中共有109个节点,512条连线,其中Degree值排名前十的蛋白依次为TP53、JUN、AKT1、MAPK3、RELA、MAPK1、ESR1、MAPK14、IL6、FOS,表明这些蛋白为消岩汤治疗胃癌的关键靶点蛋白。为进一步了解PPI网络的生物作用,利用MCODE插件对PPI网络进行Cluster模块分析,共获得5个Cluster模块,图 4列出了排名前三的Cluster模块(具体信息见表 2)。分别对三个Cluster模块进行GO分析,发现Cluster1主要对脂多糖的反应、对生长因子的反应、对细胞白介素-1的反应、上皮细胞增殖等生物过程相关;Cluster2主要与外源性凋亡信号通路、上皮细胞迁移调节、防御反应的调节、脂多糖应答、巨噬细胞分化等生物过程相关;Cluster3主要与线粒体膜通透性的调控、凋亡信号通路、P53类介导的固有凋亡信号通路、线粒体膜通透性的正调节、成纤维细胞增殖的调控等生物过程相关。

|
| 图 3 消岩汤治疗胃癌的有效靶点PPI网络 |
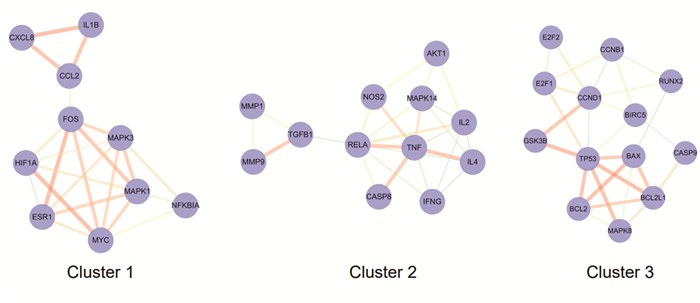
|
| 图 4 消岩汤治疗胃癌MCOED基因簇聚类分析 |
运用Metascape数据库对消岩汤治疗胃癌的交集靶点基因分别进行GO生物过程(Biological Processes)、分子功能(Molecular Functions)以及细胞组成(Cellular Components)的富集分析,并绘制水平柱状图(图 5),条形的长度代表对应条目所富集的基因数目,条形的颜色代表不同的GO富集类别,富集结果主要包括:凋亡的信号通路、对无机物质的反应、对氧化应激的反应、对化学应激的反应、活性氧反应、细胞死亡的正调控等生物过程;转录因子结合、蛋白激酶结合、蛋白结构域特异性结合、细胞因子受体结合、细胞因子活性、蛋白激酶活性等分子功能;膜筏、膜微区、囊腔、细胞质囊泡腔等细胞组成。
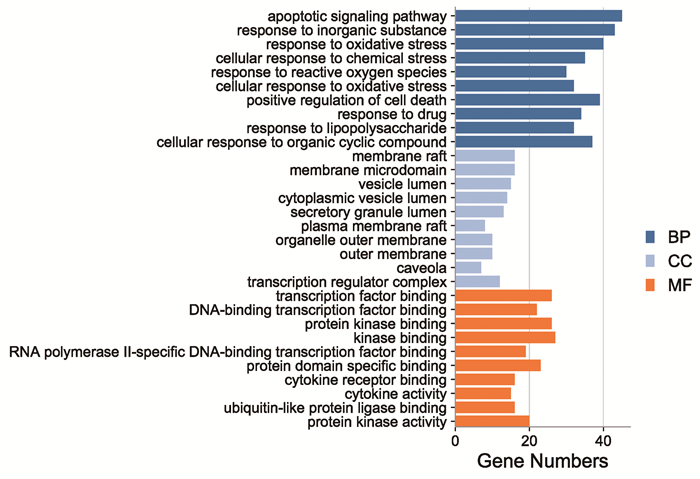
|
| 图 5 GO生物学功能富集分析 |
运用Metascape数据库对消岩汤治疗胃癌的交集靶点基因进行KEGG通路的富集分析,表 3列出了排名前十位的KEGG通路(P值越小表明富集越显著):肿瘤相关信号通路、乙型肝炎、丙型肝炎、膀胱癌、癌症中的蛋白多糖、糖尿病并发症中的AGE-RAGE信号通路、内分泌抵抗、前列腺癌、查加斯病(美国锥虫病)、PI3K-Akt信号通路。并以节点大小反映基因数,以节点颜色反映P值高低,绘制KEGG通路富集气泡图(图 6)。
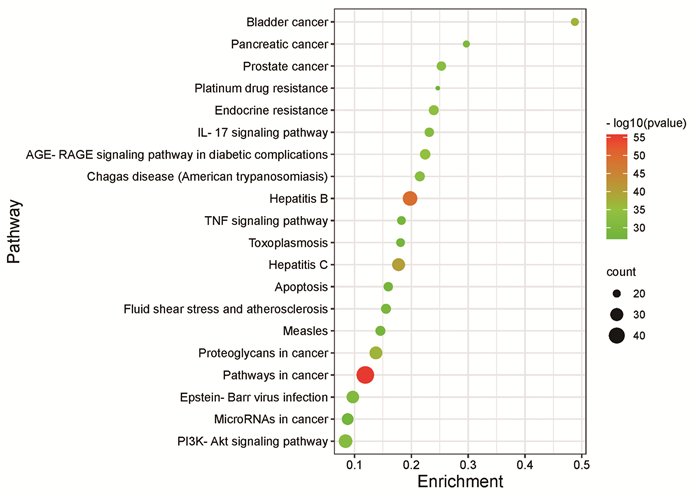
|
| 图 6 KEGG通路富集分析 |
利用Kaplan-Meier Plotter数据库,分别对TP53、JUN、AKT1、MAPK3、RELA、MAPK1、ESR1、MAPK14、IL6九个Degree值排名靠前的关键基因的表达与胃癌患者相关数据进行了多因素Cox回归分析。分析结果显示,TP53、AKT1、MAPK3、RELA、ESR1高表达的患者总生存显著低于低表达组,JUN、MAPK1、MAPK14高表达患者的总生存则显著高于低表达组,IL-6的高低表达与患者的总生存无明显相关性(P>0.05)。
3 讨论胃癌,据其临床表现,可归属于中医“积聚”“反胃”“症瘕”“伏梁”“胃脘痛”“心腹痞”等病范畴。胃癌的发生发展过程中,正气亏虚为根本,痰、瘀、毒邪相互搏结是基本病机,其中脾虚是所有病机共用的主线,“阴阳气不相顺接”,脾胃之气的“耗散”是其病机转化的关键[17]。消岩汤以“扶正抗癌,黜浊培本”的治疗大法,重用黄芪培补元气;加以太子参益气健脾,以防脾气耗散;臣以姜黄、郁金活血祛瘀;佐以白花蛇舌草、夏枯草、生牡蛎清热解毒、软坚散结,以达扶正气、散积聚、化瘀毒之功。
本研究借助网络药理学分析方法,构建“药物—活性成分—靶点”网络图,对中药复方消岩汤治疗胃癌的作用机制进行了系统全面的分析。利用数据平台分别对药物和疾病的靶基因进行筛选,将药物活性成分对应的靶基因以及疾病对应的靶基因进行对比,获得交集基因116个,筛选到潜在化合物35种,其中部分化合物的有效性及作用机制已得到证实。黄芪、白花蛇舌草、夏枯草均富含槲皮素。现代药理学研究表明,槲皮素可以直接抑制肿瘤,诱导多种肿瘤细胞株的凋亡,有效发挥抗癌作用。研究数据[18]显示,槲皮素通过增加ROS(活性氧)的产生、降低线粒体膜电位水平而诱导AGS细胞凋亡。此外,研究[19]发现槲皮素能够通过调节NF-κb、PKC-δ、ERK1/2和AMPKα,阻断uPA/uPAR功能,从而发挥抗胃癌细胞转移的作用。黄芪和夏枯草中均含有一种常见的黄酮类化合物—山柰酚,一项关于山柰酚抑制胃癌肿瘤生长的体内外研究[20]显示,山柰酚对胃癌MKN28和SGC7901细胞的增殖有明显的抑制作用,而实验剂量下对GSE-1正常胃上皮细胞株无明显抑制作用,此外,山柰酚处理后胃癌细胞出现明显的凋亡和G2/M期细胞周期阻滞,体外的研究显示山柰酚还对胃癌移植瘤的生长有明显抑制作用。另有研究表明[21]:山柰酚可以通过IRE1-JNK-CHOP途径诱导胃癌细胞自噬死亡,从而起到抗癌的作用。太子参的主要活性成分木犀草素同样具有抗肿瘤的药理活性,其通过调控Notch1[22-23]、PI3K-Akt[24]、MAPK[24]、mTOR[25]、STAT3[25]等信号通路,抑制胃癌细胞增殖、侵袭、迁移以及血管生成,促进胃癌细胞凋亡,起到抗癌的功效。上述化合物多数具有较高的度值,提示这些化合物对应的靶点基因可能在消岩汤治疗胃癌过程中起主要作用。

|
| 图 7 消岩汤活性成分核心靶标的预后分析 |
由靶点蛋白相互作用网络图可知,TP53、AKT1、JUN、MAPK1、MAPK3等靶点节点较大,与其相连的成分较多,可能为消岩汤治疗胃癌的关键靶点。TP53是与人类肿瘤相关性最高的基因之一,也是胃癌中最常见的突变基因,本研究利用Kaplan-Meier Plotter数据库的相关数据进行生存分析,结果显示TP53的高表达提示较差的胃癌预后。免疫组学分析[26]显示TP53突变能够抑制胃癌的肿瘤免疫,通过检测TP53突变状态有助于对胃癌患者某种免疫治疗的反应进行分层。AKT1属于AKT基因家族,能够推动胃癌的进展并促进胃癌细胞的增殖[27]。沉默AKT1可抑制胃癌细胞增殖,增加细胞凋亡,同时还会导致胃癌细胞对顺铂的化疗敏感性明显增强,这可能与PI3K/Akt1信号通路失活相关[28]。MAPK1、MAPK3均属于MAPK家族,通常形成多层通路,在基因表达调控和细胞质功能活动中发挥关键作用。研究表明,多种LncRNA[29-31]通过直接或间接靶向MAPK1调控胃癌细胞的增殖和迁移。生存分析的数据显示,MAPK3的高表达与胃癌患者的不良预后相关,MAPK1高表达则多提示较长的总生存。
分别对交集基因进行GO功能富集分析和KEGG通路富集分析以探讨其具体的功能作用和相关通路。GO功能富集结果显示,消岩汤主要通过调控细胞因子介导的信号通路、凋亡的信号通路、对无机物质的反应、对毒性物质的反应、细胞死亡的正调控等达到抗胃癌的功效。KEGG通路富集分析结果显示,消岩汤治疗胃癌主要涉及PI3K-AKT、IL-17、TNF等信号通路以及癌症中的蛋白多糖、microRNA、铂类耐药等分子机制。其中PI3K-AKT信号通路作为消岩汤治疗胃癌的关键通路,在调控包括细胞增殖[32-33]、凋亡[33]、血管生成[34]、侵袭和转移[32]在内的多种细胞功能中起着至关重要的作用。另有研究[35]发现,可以通过抑制PI3K-AKT-mTOR信号通路改善胃癌对顺铂的化疗敏感性。慢性炎症被认为是包括胃癌在内的许多上皮癌的关键促瘤因子[36]。IL-17是一种促炎细胞因子,参与多种疾病的发生发展,IL-17介导的LCN2可以通过靶向SLPI影响胃癌细胞的增殖、迁移、侵袭和细胞周期[37]。相关研究表明,IL-17是一把双刃剑,其不仅可以通过调节肿瘤血管生成[38]和增强肿瘤免疫逃逸在肿瘤发生中发挥致癌作用,还可以通过增强自然杀伤细胞(NK)和细胞毒性T淋巴细胞(CTL)的激活、向肿瘤组织中募集中性粒细胞、NK细胞、CD4+和CD8+T细胞等,发挥抗肿瘤作用[39]。TNF信号通路主要参与调控胃癌细胞的迁移、侵袭以及上皮-间充质转化(EMT)[40]等生物学行为。此外,有研究发现肿瘤相关的巨噬细胞可以通过IL-6和TNF-β信号传导诱导胃癌细胞中的PD-L1表达[41],肿瘤内肥大细胞增加可以通过TNF-α-PD-L1途径促进免疫抑制和胃癌进展[42]。由此可见,消岩汤治疗胃癌的作用机制以调控肿瘤细胞的功能及干预肿瘤相关信号通路为主[43]。
本研究亦存在一定的局限性:1)由于TCMSP数据库未收录牡蛎的活性成分信息,本研究借助TCMID数据库和BATMAN-TCM数据库对牡蛎的活性成分进行收集,但限于数据库条件限制,无法利用OB值以及DL值对牡蛎的活性成分进行筛选。2)网络药理学是一种计算与预测的学科,随着数据库的不断更新和新研究的出现,网络药理学的结果也会不断变化,需要及时更新[44]。3)本研究在检索成分时没有对相关文献进行整合筛选,需要日后研究进行补充完善[44]。
4 结语综上所述,本研究利用网络药理学手段对消岩汤治疗胃癌的靶点、生物学途径以及相关通路进行初步预测,同时也初步探讨本方发挥药效的主要活性成分,为本方治疗胃癌的作用机制提供了客观依据,也为今后临床的中医药应用以及本方的优化提供了一定的参考,但结果的准确性仍需进一步基础及临床研究验证。
| [1] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: a Cancer Journal for Clinicians, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
邬明歆, 李小江, 牟睿宇, 等. 消岩汤姑息治疗非小细胞肺癌疗效的回顾性研究[J]. 时珍国医国药, 2019, 30(6): 1424-1426. WU M X, LI X J, MOU R Y, et al. Retrospective study on the curative effect of Xiaoyan Decoction in palliative treatment of non-small cell lung cancer[J]. Lishizhen Medicine and Materia Medica Research, 2019, 30(6): 1424-1426. |
| [3] |
李小江, 邬明歆, 孔凡铭, 等. 消岩汤联合对症维持治疗晚期非小细胞肺癌的回顾性研究[J]. 中草药, 2020, 51(3): 697-701. LI X J, WU M X, KONG F M, et al. A retrospective study of Xiaoyan Decoction combined with symptomatic maintenance in treatment of advanced non-small cell lung cancer[J]. Chinese Traditional and Herbal Drugs, 2020, 51(3): 697-701. |
| [4] |
朱津丽, 贾英杰, 张硕, 等. 消岩汤联合大株红景天注射液改善恶性肿瘤患者血液高凝状态的临床研究[J]. 天津中医药, 2018, 35(11): 813-815. ZHU J L, JIA Y J, ZHANG S, et al. Clinical study on Xiaoyan Decoction combined with Sofren Injection in improving hypercoagulability of malignant tumor patients[J]. Tianjin Journal of Traditional Chinese Medicine, 2018, 35(11): 813-815. |
| [5] |
张丽丽, 李文涛, 李海鹏, 等. 消岩汤联合针灸疗法对化疗相关性疲乏影响的临床研究[J]. 天津中医药, 2018, 35(7): 498-502. ZHANG L L, LI W T, LI H P, et al. Clinical study of Xiaoyan Decoction combined with acupuncture and moxibustion therapy on fatigue related to chemotherapy[J]. Tianjin Journal of Traditional Chinese Medicine, 2018, 35(7): 498-502. |
| [6] |
张丽丽, 贺斌, 王园园, 等. 消岩汤调整黄芪剂量联合GP方案治疗非小细胞肺癌的临床观察[J]. 天津中医药, 2017, 34(9): 587-590. ZHANG L L, HE B, WANG Y Y, et al. Clinical observation of Xiaoyan Decoction adjusted dose of Astragalus combined with GP regimen in the treatment of non-small cell lung cancer[J]. Tianjin Journal of Traditional Chinese Medicine, 2017, 34(9): 587-590. |
| [7] |
李小江, 姜珊, 郭姗琦, 等. 阿帕替尼联合消岩汤治疗晚期非鳞非小细胞肺癌临床疗效观察[J]. 中国肿瘤临床, 2017, 44(14): 701-705. LI X J, JIANG S, GUO S Q, et al. Clinical research on apatinib combined with Xiaoyan Decoction for the treatment of non-squamous non-small cell lung cancer[J]. Chinese Journal of Clinical Oncology, 2017, 44(14): 701-705. |
| [8] |
诸葛晶哲, 易丹, 张莹. 消岩汤治疗晚期恶性肿瘤恶液质42例临床观察[J]. 天津中医药, 2017, 34(4): 236-238. ZHUGE J Z, YI D, ZHANG Y. Clinical observation of Xiaoyan Decoction in treatment of 42 patients with cachexia of the late malignant tumor[J]. Tianjin Journal of Traditional Chinese Medicine, 2017, 34(4): 236-238. |
| [9] |
曹吉, 贾英杰. 贾英杰教授运用扶正解毒祛瘀法治疗胃恶性肿瘤[J]. 医疗装备, 2016, 29(13): 120-121. CAO J, JIA Y J. Professor JIA Yingjie used the method of strengthening body resistance, detoxifying and removing blood stasis to treat gastric malignant tumor[J]. Medical Equipment, 2016, 29(13): 120-121. |
| [10] |
王晓群, 李小江, 孔凡铭, 等. 消岩汤对Lewis肺癌小鼠的抑瘤作用及对髓源性抑制细胞的影响[J]. 天津中医药, 2020, 37(9): 1057-1061. WANG X Q, LI X J, KONG F M, et al. Effect of Xiaoyan Decoction on tumor inhibition and myeloid-derived suppressor cells of mice with Lewis lung cancer[J]. Tianjin Journal of Traditional Chinese Medicine, 2020, 37(9): 1057-1061. |
| [11] |
吕艳, 张畅, 李小江, 等. 消岩汤对人乳腺癌细胞MCF-7增殖的影响及机制[J]. 山东医药, 2020, 60(19): 42-46. LYU Y, ZHANG C, LI X J, et al. Effects of Xiaoyan Decoction on proliferation of human breast cancer cells MCF-7[J]. Shandong Medical Journal, 2020, 60(19): 42-46. |
| [12] |
刘宏根, 杨佩颖, 赵林林, 等. 消岩汤逆转肺癌顺铂耐药的机制研究[J]. 中草药, 2020, 51(9): 2486-2491. LIU H G, YANG P Y, ZHAO L L, et al. Mechanism of reversing cisplatin resistance by Xiaoyan Decoction in lung cancer[J]. Chinese Traditional and Herbal Drugs, 2020, 51(9): 2486-2491. |
| [13] |
李小江, 张莹, 杨佩颖, 等. 消岩汤对肺癌干细胞TGF-β/Smad3/MMP-9信号通路的影响[J]. 中草药, 2018, 49(5): 1110-1114. LI X J, ZHANG Y, YANG P Y, et al. Effects of Xiaoyan Decoction on TGF-β/Smad3/MMP-9 signaling pathway in SP cells[J]. Chinese Traditional and Herbal Drugs, 2018, 49(5): 1110-1114. |
| [14] |
李小江, 张莹, 杨佩颖, 等. 消岩汤对肺癌A549细胞及肺癌干细胞迁移及侵袭的影响[J]. 中草药, 2018, 49(4): 870-873. LI X J, ZHANG Y, YANG P Y, et al. Effect of Xiaoyan Decoction on migration and invasion of A549 cells and SP cells in lung cancer[J]. Chinese Traditional and Herbal Drugs, 2018, 49(4): 870-873. |
| [15] |
张莹, 贾英杰, 李小江, 等. 消岩汤对耐顺铂人肺腺癌A549/DDP细胞多药耐药相关蛋白的调控作用[J]. 中草药, 2017, 48(13): 2717-2721. ZHANG Y, JIA Y J, LI X J, et al. Research of Xiaoyan Decoction on multidrug resistance of lung adenocarcinoma A549/DDP cell with cisplatin resistance in human gene[J]. Chinese Traditional and Herbal Drugs, 2017, 48(13): 2717-2721. |
| [16] |
杨佩颖, 许文婷, 刘宏根, 等. 消岩汤对A549/DDP细胞自噬及耐药蛋白的影响研究[J]. 天津中医药, 2016, 33(6): 358-362. YANG P Y, XU W T, LIU H G, et al. Study on the autophagy and resistance protein affected by Xiaoyan Decoction in A549/DDP cells[J]. Tianjin Journal of Traditional Chinese Medicine, 2016, 33(6): 358-362. |
| [17] |
董智平, 张静喆. 中医治疗胃癌研究进展[J]. 中国中西医结合外科杂志, 2019, 25(2): 206-209. DONG Z P, ZHANG J Z. Research progress on treatment of gastric cancer with traditional Chinese medicine[J]. Chinese Journal of Surgery of Integrated Traditional and Western Medicine, 2019, 25(2): 206-209. |
| [18] |
SHANG H S, LU H F, LEE C H, et al. Quercetin induced cell apoptosis and altered gene expression in AGS human gastric cancer cells[J]. Environmental Toxicology, 2018, 33(11): 1168-1181. |
| [19] |
LI H, CHEN C. Quercetin has antimetastatic effects on gastric cancer cells via the interruption of uPA/uPAR function by modulating NF-κb, PKC-δ, ERK1/2, and AMPKα[J]. Integrative Cancer Therapies, 2018, 17(2): 511-523. |
| [20] |
SONG H B, BAO J J, WEI Y Z, et al. Kaempferol inhibits gastric cancer tumor growth: an in vitro and in vivo study[J]. Oncology Reports, 2015, 33(2): 868-874. |
| [21] |
KIM T W, LEE S Y, KIM M, et al. Kaempferol induces autophagic cell death via IRE1-JNK-CHOP pathway and inhibition of G9a in gastric cancer cells[J]. Cell Death & Disease, 2018, 9(9): 875. |
| [22] |
ZANG M D, HU L, ZHANG B G, et al. Luteolin suppresses angiogenesis and vasculogenic mimicry formation through inhibiting Notch1-VEGF signaling in gastric cancer[J]. Biochemical and Biophysical Research Communications, 2017, 490(3): 913-919. |
| [23] |
ZANG M D, HU L, FAN Z Y, et al. Luteolin suppresses gastric cancer progression by reversing epithelial-mesenchymal transition via suppression of the Notch signaling pathway[J]. Journal of Translational Medicine, 2017, 15(1): 52. |
| [24] |
LU X Y, LI Y H, LI X B, et al. Luteolin induces apoptosis in vitro through suppressing the MAPK and PI3K signaling pathways in gastric cancer[J]. Oncology Letters, 2017, 14(2): 1993-2000. |
| [25] |
PU Y S, ZHANG T, WANG J H, et al. Luteolin exerts an anticancer effect on gastric cancer cells through multiple signaling pathways and regulating miRNAs[J]. Journal of Cancer, 2018, 9(20): 3669-3675. |
| [26] |
JIANG Z H, LIU Z X, LI M Y, et al. Immunogenomics analysis reveals that TP53 mutations inhibit tumor immunity in gastric cancer[J]. Translational Oncology, 2018, 11(5): 1171-1187. |
| [27] |
HAN Z Y, WU K C, SHEN H Q, et al. Akt1/protein kinase B alpha is involved in gastric cancer progression and cell proliferation[J]. Digestive Diseases and Sciences, 2008, 53(7): 1801-1810. |
| [28] |
ZHOU W, FU X Q, LIU J, et al. RNAi knockdown of the Akt1 gene increases the chemosensitivity of gastric cancer cells to cisplatin both in vitro and in vivo[J]. Regulatory Peptides, 2012, 176(1/2/3): 13-21. |
| [29] |
XU Y P, DONG M, WANG J H, et al. LINC01436 inhibited miR-585-3p expression and upregulated MAPK1 expression to promote gastric cancer progression[J]. Digestive Diseases and Sciences, 2021, 66(6): 1885-1894. |
| [30] |
LUO M, LIANG C B. LncRNA LINC00483 promotes gastric cancer development through regulating MAPK1 expression by sponging miR-490-3p[J]. Biological Research, 2020, 53(1): 14. |
| [31] |
DIAO L Y, WANG S Y, SUN Z G. Long noncoding RNA GAPLINC promotes gastric cancer cell proliferation by acting as a molecular sponge of miR-378 to modulate MAPK1 expression[J]. OncoTargets and Therapy, 2018, 11(2): 2797-2804. |
| [32] |
LIU X, XIAO M Y, ZHANG L, et al. The m6A methyltransferase METTL14 inhibits the proliferation, migration, and invasion of gastric cancer by regulating the PI3K/AKT/mTOR signaling pathway[J]. Journal of Clinical Laboratory Analysis, 2021, 35(3): e23655. |
| [33] |
CHEN H Y, SHENG H Q, ZHAO Y S, et al. Piperine inhibits cell proliferation and induces apoptosis of human gastric cancer cells by downregulating phosphatidylinositol 3-kinase (PI3K)/akt pathway[J]. Medical Science Monitor: International Medical Journal of Experimental and Clinical Research, 2020, 26(2): e928403. |
| [34] |
HU Y, ZHANG Y, DING M, et al. Long noncoding RNA TMPO-AS1/miR-126-5p/BRCC3 axis accelerates gastric cancer progression and angiogenesis via activating PI3K/Akt/mTOR pathway[J]. Journal of Gastroenterology and Hepatology, 2021, 36(7): 1877-1888. |
| [35] |
KOU Y Y, TONG B D, WU W Q, et al. Berberine improves chemo-sensitivity to cisplatin by enhancing cell apoptosis and repressing PI3K/AKT/mTOR signaling pathway in gastric cancer[J]. Frontiers in Pharmacology, 2020, 11(2): 616251. |
| [36] |
NGUYEN P M, PUTOCZKI T L. Could the inhibition of IL-17 or IL-18 be a potential therapeutic opportunity for gastric cancer?[J]. Cytokine, 2019, 118(12): 8-18. |
| [37] |
XU J, LV S X, MENG W, et al. LCN2 mediated by IL-17 affects the proliferation, migration, invasion and cell cycle of gastric cancer cells by targeting SLPI[J]. Cancer Management and Research, 2020, 12(3): 12841-12849. |
| [38] |
WU X Q, YANG T, LIU X, et al. IL-17 promotes tumor angiogenesis through Stat3 pathway mediated upregulation of VEGF in gastric cancer[J]. Tumour Biology: the Journal of the International Society for Oncodevelopmental Biology and Medicine, 2016, 37(4): 5493-5501. |
| [39] |
QIAN X, CHEN H K, WU X F, et al. Interleukin-17 acts as double-edged sword in anti-tumor immunity and tumorigenesis[J]. Cytokine, 2017, 89(10): 34-44. |
| [40] |
CUI X Y, ZHANG H, CAO A N, et al. Cytokine TNF-α promotes invasion and metastasis of gastric cancer by down-regulating Pentraxin3[J]. Journal of Cancer, 2020, 11(7): 1800-1807. |
| [41] |
JU X L, ZHANG H, ZHOU Z D, et al. Tumor-associated macrophages induce PD-L1 expression in gastric cancer cells through IL-6 and TNF-α signaling[J]. Experimental Cell Research, 2020, 396(2): 112315. |
| [42] |
LV Y P, ZHAO Y L, WANG X H, et al. Increased intratumoral mast cells foster immune suppression and gastric cancer progression through TNF-α-PD-L1 pathway[J]. Journal for Immunotherapy of Cancer, 2019, 7(1): 54. |
| [43] |
余莹, 胡玲, 劳绍贤. 基于网络药理学探讨漏芦治疗胃癌的作用机制[J]. 中华中医药学刊, 2020, 38(12): 65-68, 283. YU Y, HU L, LAO S X. Study on mechanism of loulu(rhapontici Radix) treating gastric cancer based on network pharmacology[J]. Chinese Archives of Traditional Chinese Medicine, 2020, 38(12): 65-68, 283. |
| [44] |
王倩, 何涛, 周佳丽, 等. Meta分析关联网络药理学的补肾活血汤治疗糖尿病肾病的临床评价及其潜在作用机制探析[J]. 中草药, 2021, 52(6): 1692-1705. WANG Q, HE T, ZHOU J L, et al. Integrated Meta analysis and network pharmacology to investigate clinical evaluation and potential mechanism of Bushen Huoxue Decoction in treatment of diabetic nephropathy[J]. Chinese Traditional and Herbal Drugs, 2021, 52(6): 1692-1705. |
 2023, Vol. 42
2023, Vol. 42







